自蔓延高温合成技术法合成La0.7Sr0.3MnO3过程的热力学分析
湖南大学材料科学与工程学院,中南大学材料科学与工程学院,湖南大学材料科学与工程学院,湖南大学材料科学与工程学院,湖南大学材料科学与工程学院 湖南长沙410082,湖南长沙410083,湖南长沙410082,湖南长沙410082,湖南长沙410082
摘 要:
通过热力学计算研究自蔓延高温合成技术合成La0.7Sr0.3MnO3反应机制。结果表明:对于Mn, La2O3, SrCO3, NaClO4组成的自蔓延高温合成La0.7Sr0.3MnO3反应体系, 理论上Mn粉优先与La2O3反应生成LaMnO3, 低温下Mn粉优先与O2反应生成少量MnOx, 大部分剩余的Mn粉高温 (>1417 K) 下优先与O2反应生成SrMnO3;同时, 少量低温 (<1417 K) 时形成的MnOx与SrCO3反应生成SrMnO3。高温下, SrMnO3与LaMnO3反应生成La0.7Sr0.3MnO3, 这是SHS法合成La0.7Sr0.3MnO3的主要途径。另外, 当温度大于1235 K时, 少量La2O3与SrCO3反应生成La2SrOx, La2SrOx再与LaMnO3反应生成La0.7Sr0.3MnO3。
关键词:
中图分类号: O614.331
收稿日期:2006-11-15
基金:国家自然科学基金项目资助 (50602051);湖南省博士后科学基金项目资助 (2006FJ4237);
Thermodynamics Analysis on SHS Process of La0.7Sr0.3MnO3
Abstract:
The reaction mechanism of the SHS system was explored through thermodynamic calculation method.It is found that in the reaction system consisted of Mn, La2O3, SrCO3, NaClO4, firstly, Mn prefers to react with La2O3 and O2 to produce LaMnO3.Then the remainder prefers to be reacted with O2 to produce MnOx.Howerer, SHS is a quick process and at high temperature (above 1417 K) , most residual Mn reacts with SrCO3 to produce SrMnO3.At the same time, MnOx produced at low temperature (bellow 1417 K) reacts with SrCO3 to produce SrMnO3.The high temperature way is predominant.Finally, LaxSr1-xMnO3 is prepared by SrMnO3 and LaMnO3.Nevertheless, when the temperature was above 1235 K, some La2O3 reacts with SrCO3 to produce La2SrOx, then the La2SrOx will react with LaMnO3 to produce La0.7Sr0.3MnO3, but it is much less than that produced by SrMnO3-LaMnO3 reaction.
Keyword:
SOFC;SHS;thermodynamic calculation;mechanism;
Received: 2006-11-15
固体氧化物燃料电池 (SOFC) 由于其利用效率高和无污染两大特点而具有广阔的市场前景和研究价值
韩敏芳等
1 SHS合成La0.7Sr0.3MnO3物相分析
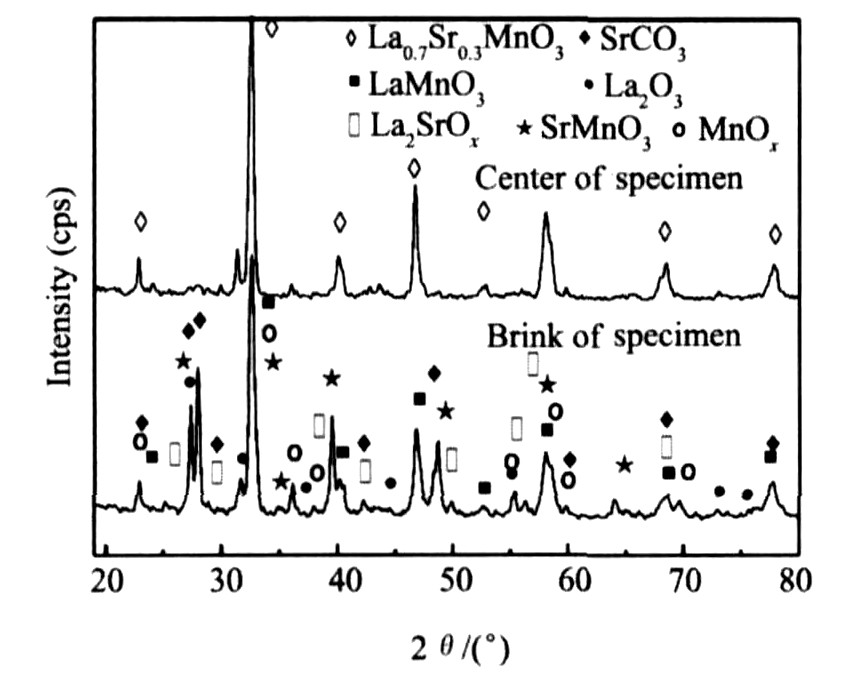
按一定配比称取Mn, La2O3, SrCO3, NaClO4等原料混合后压制成直径为10 mm的圆柱体, 点火后使其发生自蔓延高温合成反应制备La0.7Sr0.3MnO3。 SHS反应结束后, 分别取试样中心处和外层边角处样品作XRD分析, 其结果如图1所示。 由图1可见, 试样中心处主要产物是La0.7Sr0.3MnO3, 这是由于中心部分散热慢, 反应温度高, 反应进行完全, 杂质含量低; 外层边角试样中除了含有目的产物La0.7Sr0.3MnO3之外, 还含有La2O3, SrCO3, MnOx, LaMnO3, SrMnO3和La2SrOx等杂质相, 前两者是反应物, 说明反应进行得不完全, 后四者是新生成的中间产物。 这是由于试样外部散热快, 反应温度相对较低, 反应进行不彻底。 通过热力学计算, 探讨这些中间产物的形成过程, 最终可以推断出SHS合成LSM的反应机制。
2 反应历程的热力学分析
2.1 体系中可能发生的化学反应
由图1可见, SHS合成La0.7Sr0.3MnO3过程中发生了一系列化学反应, 导致MnOx, LaMnO3, SrMnO3和La2SrOx等中间产物的生成。 SHS过程中可能发生的化学反应如表1所示。
2.2 热力学计算方法
T温度下, 反应的标准摩尔反应自由能按下式计算:
ΔfG
G (AxByOαx+βy) =n (AxOαx) ·μ (AxOαx) +n (ByOβy) ·μ (ByOβy)
图1 SHS合成LSM坯体中心处和边角处XRD图谱
Fig.1 XRD spectrums of LSM specimens synthesised by SHS
表1 体系中可能发生的反应
Table 1 Possible reaction involved in system
Reaction No. |
Chemical equations |
(1) |
Mn+0.5O2→MnO |
(2) |
3Mn+2O2→Mn3O4 |
(3) |
2Mn+1.5O2→Mn2O3 |
(4) |
Mn+O2→MnO2 |
(5) |
2MnO2→Mn2O3+0.5O2 |
(6) |
1.5Mn2O3→Mn3O4+0.25O2 |
(7) |
0.33Mn3O4→MnO+0.176O2 |
(8) |
0.5Mn+0.5MnO2→MnO |
(9) |
0.33Mn2O3+0.33Mn→MnO |
(10) |
0.25Mn3O4+0.25Mn→MnO |
(11) |
NaClO4→NaCl+2O2 |
(12) |
NaClO4→NaCl (g) +2O2 |
(13) |
SrCO3+Mn+O2→SrMnO3+CO2 |
(14) |
SrCO3+MnO+0.5O2→SrMnO3+CO2 |
(15) |
SrCO3+0.5Mn2O3+0.25O2→SrMnO3+CO2 |
(16) |
SrCO3+0.33Mn3O4+0.33O2→SrMnO3+CO2 |
(17) |
SrCO3+MnO2→SrMnO3+CO2 |
(18) |
SrCO3+La2O3→La2SrO4+CO2 |
(19) |
SrCO3→SrO+CO2 |
(20) |
SrO+0.5O2→SrO2 |
(21) |
SrO+MnO2→SrMnO3 |
(22) |
La2SrO4→La2O3+SrO |
(23) |
La2SrO4+0.5O2→La2O3+SrO2 |
(24) |
La2O3+Mn+0.75O2→LaMnO3 |
(25) |
0.5La2O3+MnO+0.25O2→LaMnO3 |
(26) |
0.5La2O3+0.333Mn3O4+0.08lO2→LaMnO3 |
(27) |
0.5La2O3+0.5Mn2O3→LaMnO3 |
(28) |
0.5La2O3+MnO2→LaMnO3+0.25O2 |
(29) |
0.7LaMnO3+0.3SrMnO3→La0.7Sr0.3MnO3 |
(30) |
0.3La2SrO4+0.1LaMnO3+0.3Mn3O4+0.15O2→La0.7Sr0.3MnO3 |
(31) |
0.3La2SrO4+0.1LaMnO+0.9MnO+0.3O2→La0.7Sr0.3MnO3 |
(32) |
La2O3+SrCO3+Mn+NaClO4→La0.7Sr0.3MnO3+NaCl+CO2 |
μ (AxOαx) =ΔG (AxOαx) +RT·lnx (AxOαx)
μ (ByOβy) =ΔG (ByOβy) +RT·lnx (ByOβy)
其中G (AxByOαx+βy) 为物质AxByOαx+βy的自由能; μ (AxOαx) 为物质AxOαx的化学势; μ (ByOβy) 为物质ByOβy的化学势; x (AxOαx) 为物质AxOαx的摩尔浓度; x (ByOβy) 为物质ByOβy的摩尔浓度。 计算中用到的热力学数据来自文献
2.3 MnOx的生成
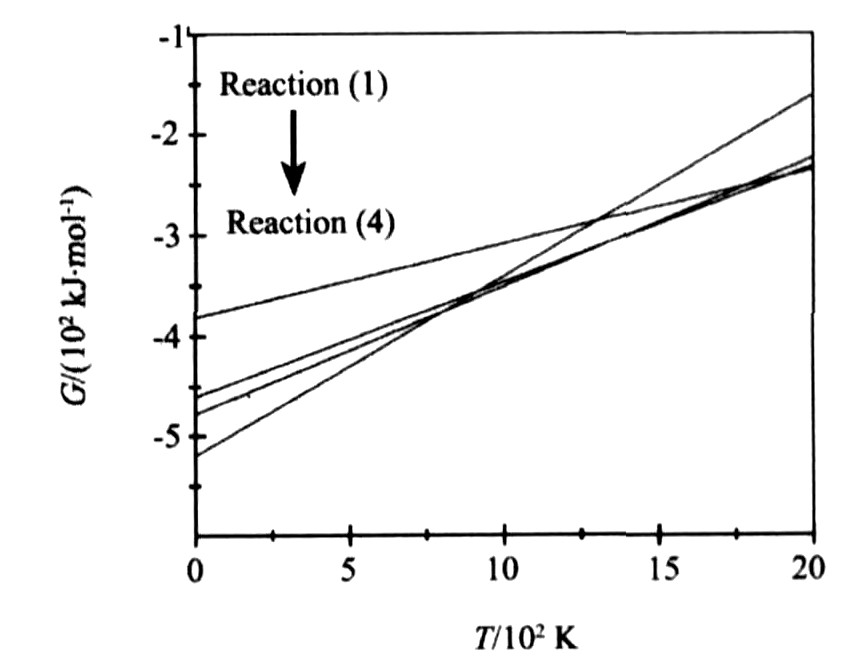
体系中Mn粉容易与O2反应生成一系列MnOx (反应 (1) ~ (4) ) , 图2是反应 (1) ~ (4) 的吉布斯自由能与温度的关系。 由图可知, 当温度小于804 K时, 热力学上反应 (4) 进行的趋势最大; 当温度介于804~1345 K时, 反应 (3) 优先进行; 当温度介于1345~1922 K时, 反应 (2) 优先进行; 当温度大于1922 K时, 反应 (1) 优先进行。 自蔓延过程中试样内的温度通常超过1400 K, 因此SHS过程中Mn与O2反应主要生成Mn3O4或MnO。
2.4 LaMnO3的生成
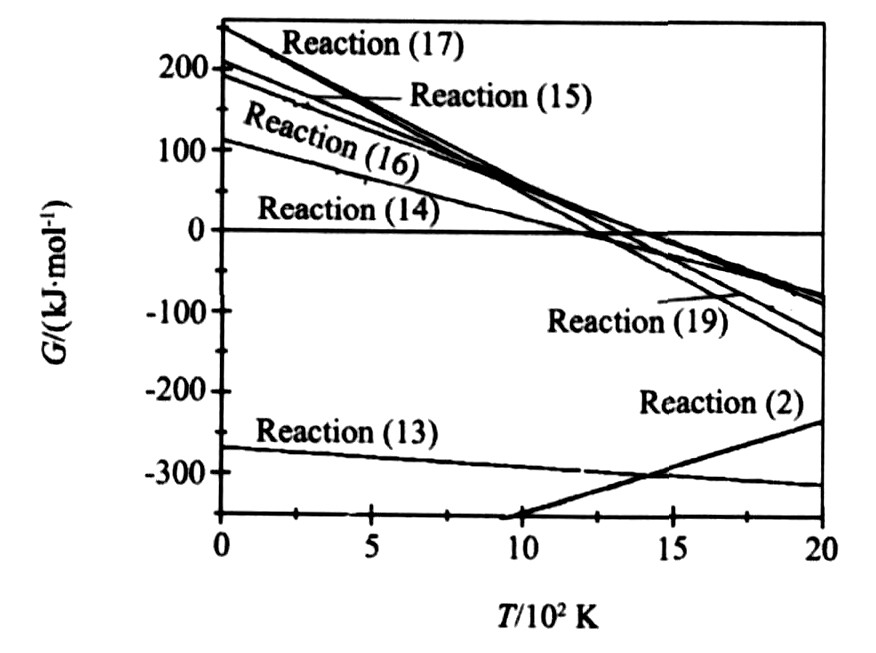
体系中可能生成LaMnO3的反应为反应 (24) ~ (28) , 其反应吉布斯自由能与温度的关系如图3所示。 由图可见, Mn粉与La2O3, O2反应生成LaMnO3 (反应 (24) ) 的吉布斯自由能最低。 在1400~2000 K左右, 反应 (24) 的吉布斯自由能约为-1700 kJ·mol-1, 而在同样温度下, 由Mn粉生成Mn3O4或MnO的吉布斯自由能约为-300 kJ·mol-1, 因而, 热力学上LaMnO3是Mn粉与La2O3, O2直接反应的产物。 实际SHS过程中, 由于动力学因素的影响, 不可避免的有少量MnOx与La2O3反应生成LaMnO3。
图2 反应 (1) ~ (4) 的吉布斯自由能与温度的关系
Fig.2 Relationship between Gibbs energy and temperature of Reactions (1) ~ (4)
2.5 SrMnO3的生成过程
体系中可能生成SrMnO3的反应为反应 (13) ~ (17) , 其反应吉布斯自由能与温度的关系如图4所示。 由图可知, 反应 (13) ~ (17) 中反应 (13) 的吉布斯自由能最低, 说明由Mn直接生成SrMnO3的可能性最大。 而由MnOx生成SrMnO3的最低温度依次为1197 K (MnO) , 1329 K (MnO2) , 1412 K (Mn2O3) 和1417 K (Mn3O4) 。 SrCO3分解成SrO的反应 (反应 (19) ) 只有当温度大于1253 K时才能进行, 当反应温度介于1253~1417 K时, Mn易于生成Mn3O4 (图2) 。 而由Mn3O4生成SrMnO3的最低温度为1417 K, 所以此阶段不可能发生由Mn3O4生成SrMnO3的反应。 当反应温度大于1417 K时, 一方面, Mn生成SrMnO3 (反应 (13) ) 的吉布斯自由能小于Mn生成Mn3O4 (反应 (2) ) 的吉布斯自由能,
图3 反应 (24) ~ (27) 吉布斯自由能与温度的关系
Fig.3 Relationship between Gibbs energy and temperature of Reactions (24) ~ (28)
图4 反应 (2) , (13) ~ (17) , (19) 吉布斯自由能与温度的关系
Fig.4 Relationship between Gibbs energy and temperature of Reactions (2) , (13) ~ (17) and (19)
因而此时Mn直接与SrCO3, O2反应生成SrMnO3, 而不是先生成Mn3O4, 再由Mn3O4生成SrMnO3; 另一方面, 少量低温 (<1417 K) 时形成的MnOx与SrCO3反应生成SrMnO3。 由于SHS反应过程速度快、 温度高 (>1417 K) , 因此, 大部分中间产物SrMnO3是Mn直接与SrCO3, O2反应的产物。
2.6 La2SrOx的生成
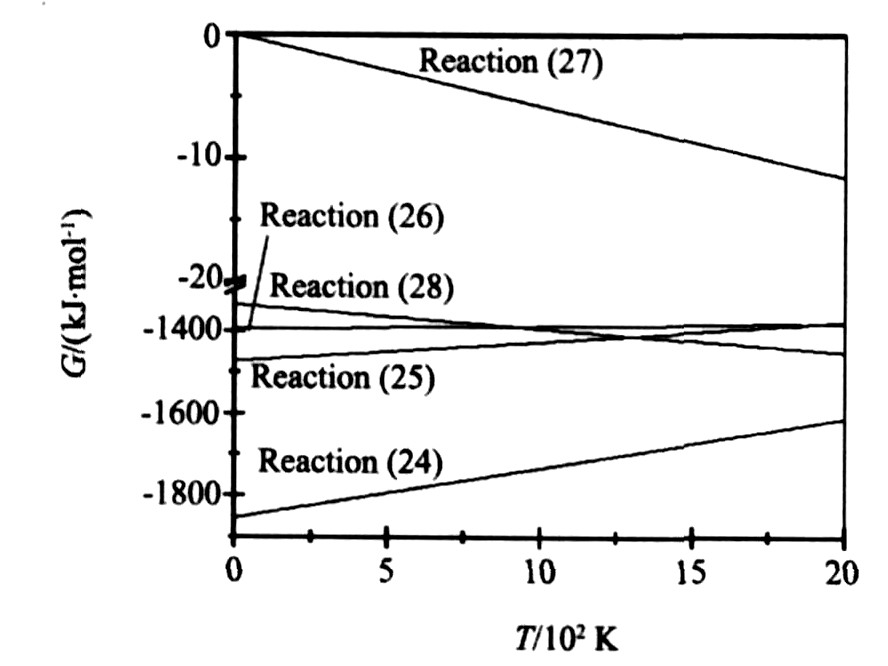
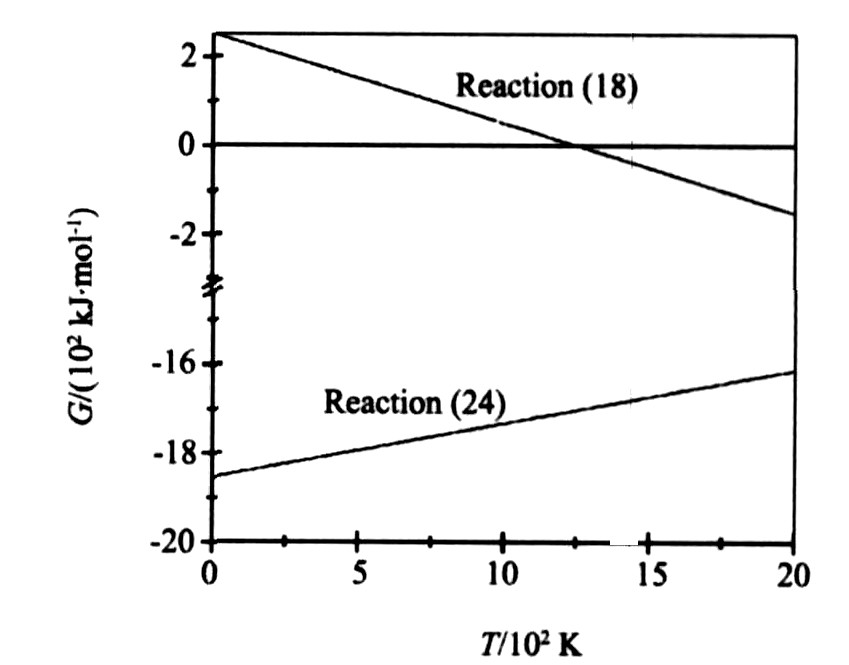
图5是反应 (18) , (24) 的生成吉布斯自由能与温度的关系。 由图可见, 当温度小于1253 K时, 反应 (18) 吉布斯自由能大于0, 反应不能进行。 对比反应 (24) 与反应 (18) 发现, 前者的吉布斯自由能远小于后者, 因此La2O3将优先生成LaMnO3, 在生成LaMnO3的过程中将放出大量的热, 使试样温度升高, 当温度大于1253 K时, 反应 (18) 可以进行, 但是其反应趋势小于反应 (24) 。 因此, 在SHS合成LSM过程中, La2O3与SrCO3通过反应 (18) 生成La2SrOx的反应不是主要的。 因此图1中试样边角部分的中间相不仅有LaMnO3, 还有La2SrOx相, 但LaMnO3相占主导。
2.7 La0.7Sr0.3MnO3的生成机制
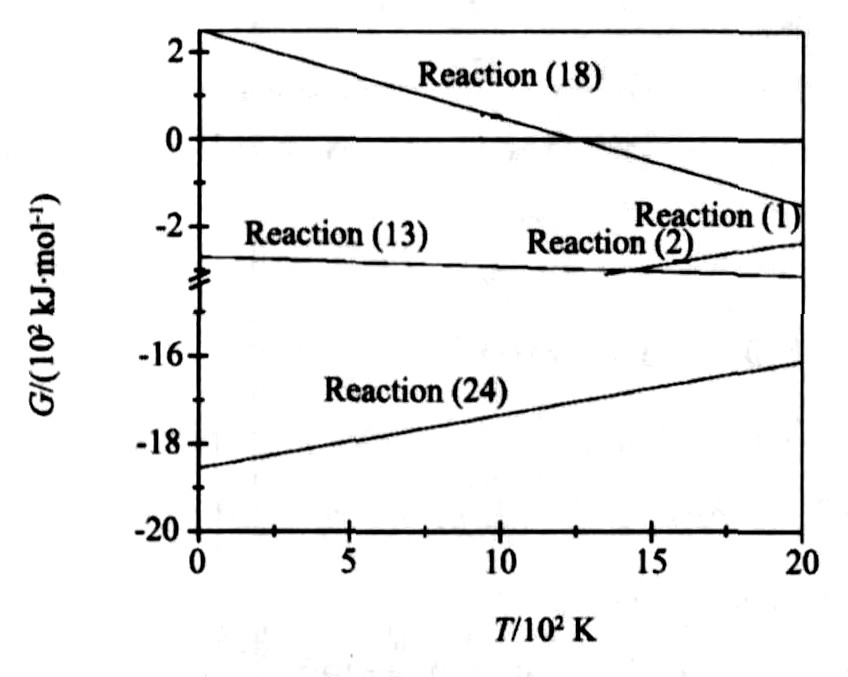
图1中MnOx, LaMnO3, SrMnO3和La2SrOx等中间产物的产生是由于发生了以下反应: 少量Mn氧化成Mn3O4和MnO; Mn与La2O3反应生成LaMnO3; Mn与SrCO3反应生成SrMnO3; MnOx与SrCO3反应生成SrMnO3; La2O3与SrCO3反应生成La2SrOx。 将其生成吉布斯自由能与温度关系绘于同一个图中, 如图6所示。
图5 反应 (18) , (24) 的生成吉布斯自由能与温度的关系
Fig.5 Relationship between Gibbs free energy and temperature of reaction (18) and (24)
图6 反应吉布斯自由能与温度的关系
Fig.6 Relationship between Gibbs free energy and temperature
Mn粉参与反应包括: Mn粉与La2O3反应生成LaMnO3 (反应 (24) ) ; Mn粉与SrCO3反应生成SrMnO3 (反应 (13) ) 和Mn粉与O2反应生成MnOx (反应 (1) ~ (4) ) 。 其中生成LaMnO3的反应吉布斯自由能最负; 当温度小于1417 K时, 生成MnOx的反应 (反应 (1) , (2) ) 的吉布斯自由能小于生成SrMnO3的反应 (反应 (13) ) , 此时Mn粉优先与O2反应生成MnOx, 但是由于温度低, MnOx不能与SrCO3反应生成SrMnO3。 当温度大于1417 K时, 生成SrMnO3的反应 (反应 (13) ) 吉布斯自由能小于生成MnOx的反应 (反应 (1) , (2) ) , 此时, 生成三者的难易程度分别为LaMnO3最易, SrMnO3居中, MnOx最难。
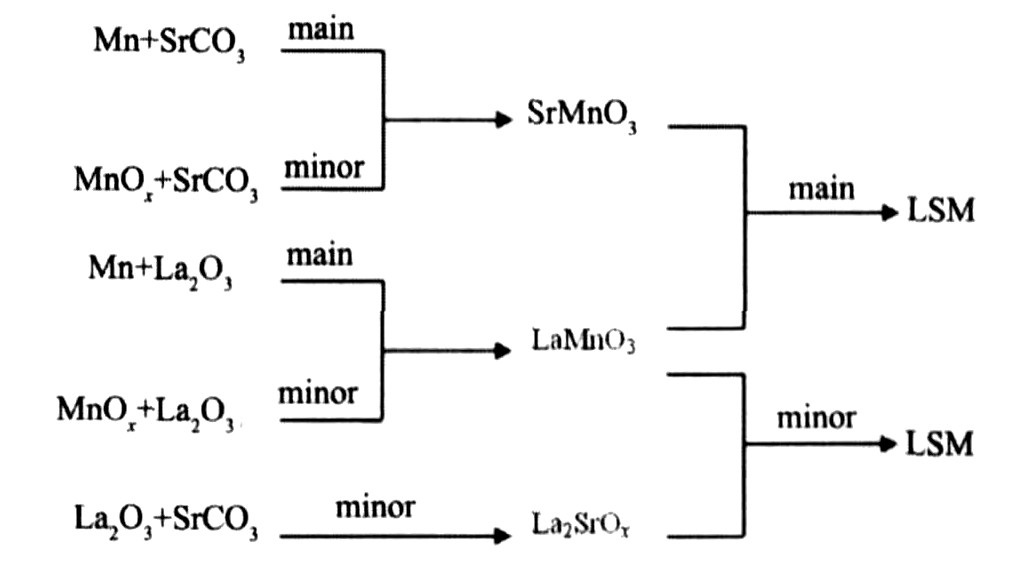
综上所述, 热力学计算得到SHS法合成LSM的反应历程如图7所示, 该自蔓延反应体系中, 理论上Mn粉优先与La2O3反应生成LaMnO3, 低温下Mn粉优先与O2反应生成MnOx, 但是由于SHS过程反应速度快, 反应温度高, 生成MnOx的量不会很多。 大部分剩余的Mn粉高温 (>1417 K) 下优先与O2反应生成SrMnO3; 同时, 少量低温 (<1417 K) 时形成的MnOx与SrCO3反应生成SrMnO3。 其中, Mn直接与SrCO3, O2反应是生成中间产物SrMnO3的主要途径。 高温下, SrMnO3可以与LaMnO3以任意比例反应生成LSM固溶体, 反应容易进行, 这是SHS法合成LaxSr1-xMnO3的主要途径。 另外, 当温度大于1235 K时, 少量La2O3与SrCO3通过反应 (18) 生成La2SrOx, La2SrOx再与LaMnO3反应生成LaxSr1-xMnO3。
图7 SHS法合成La0.7Sr0.3MnO3的反应历程
Fig.7 Mechanism of SHS process of La0.7Sr0.3MnO3
3 结 论
1. SHS过程中由于反应进行不完全可能产生La2O3, SrCO3, MnOx, LaMnO3, SrMnO3和La2SrOx等杂质相。
2. La0.7Sr0.3MnO3的生成主要是LaMnO3与SrMnO3高温反应的产物, 同时, La2SrOx与LaMnO3反应也会生成少量La0.7Sr0.3MnO3。
参考文献
[2] 祝宝军, 贡涛, 唐元洪.自蔓延高温合成SOFC阴极材料La0.7Sr0.3MnO3[J].湖南大学学报, 2005, 32 (2) :90.
[3] 赵苏阳.固体氧化物燃料电池 (SOFC) 制备方法的研究进展[J].材料导报, 2006, 20 (7) :27.
[5] 汪忠柱, 吴先良, 冯双久, 林玲.La1-xSrxMnO3氧化物磁导率和介电常数的频率特性研究[J].中国稀土学报, 24 (3) :310.
[8] 刘旭俐.固体氧化物燃料电池材料的研究进展[J].硅酸盐通报, 2001, (1) :24.
[9] 韩敏芳, 李伯涛, 彭苏萍, 等.固相反应合成La1-xSrxMnO3的机理[J].北京科技大学学报, 2002, 24 (6) :619.
[2] 祝宝军, 贡涛, 唐元洪.自蔓延高温合成SOFC阴极材料La0.7Sr0.3MnO3[J].湖南大学学报, 2005, 32 (2) :90.
[3] 赵苏阳.固体氧化物燃料电池 (SOFC) 制备方法的研究进展[J].材料导报, 2006, 20 (7) :27.
[5] 汪忠柱, 吴先良, 冯双久, 林玲.La1-xSrxMnO3氧化物磁导率和介电常数的频率特性研究[J].中国稀土学报, 24 (3) :310.
[8] 刘旭俐.固体氧化物燃料电池材料的研究进展[J].硅酸盐通报, 2001, (1) :24.
[9] 韩敏芳, 李伯涛, 彭苏萍, 等.固相反应合成La1-xSrxMnO3的机理[J].北京科技大学学报, 2002, 24 (6) :619.