文章编号:1004-0609(2010)09-1748-05
溶胶-凝胶法制备LiFePO4/C复合材料及其性能
尹雄鸽, 黄可龙, 刘素琴, 徐 洋
(中南大学 化学化工学院,长沙 410083)
摘 要:为了提高LiFePO4的电化学性能,以柠檬酸为络合剂和碳源,采用溶胶-凝胶法制备LiFePO4/C复合正极材料。采用FTIR和XRD等对前驱体及产物进行表征,并测试样品的电化学性能。结果表明:经700 ℃烧结10 h所得产物具有单一的橄榄石型晶体结构,碳含量为10.81%(质量分数)。 样品在0.1C下首次放电比容量为127.1 mA?h/g,在0.2C、0.5C、1C下首次放电比容量分别为106.1、83.3、70.6 mA?h/g。 该样品在0.1C下经过20次循环后,容量还保持为126.3 mA?h/g,衰减仅为0.035%。循环伏安和交流阻抗测试表明该材料具有较好的电化学性能。
关键词:
中图分类号:TM912.9 文献标志码:A
Synthesis of LiFePO4/C composite cathode materials by
sol-gel method and its performance
YIN Xiong-ge, HUANG Ke-long, LIU Su-qin, XU Yang
(School of Chemistry and Chemical Engineering, Central South University, Changsha 410083, China)
Abstract:To improve the performance of LiFePO4, LiFePO4/C composite cathode materials were synthesized by sol-gel method using citric acid as chelant and carbon source. The precursors and the products were characterized by FTIR and XRD, and the electrochemical performance of the samples was measured. The results show that the composite synthesized at 700 ℃ has a simple pure olive-type phase with 10.81%(mass fraction) carbon content. The sample can deliver a discharge capacity of 127.1 mA?h/g at 0.1C. The first special discharge capacities of LiFePO4 at 0.2C, 0.5C and 1C are 106.1, 83.3 and 70.6 mA?h/g, respectively. It retains discharge capacity of 126.3 mA?h/g at 0.1C after 20 cycles, with only 0.035% capacity decrment.The sample exhibits good electrochemical performance, proved by cyclic voltammetry (CV) and electrochemical impedance spectroscopy (EIS) tests.
Key words: Li ion battery; cathode material; LiFePO4; sol-gel method
橄榄石型LiFePO4作者一种新型的锂离子电池正极材料[1],它具有可逆比容量高(170 mA?h/g)、充放电电压适中(3.4 V)、无毒、廉价和结构稳定等优点,因此受到广泛关注。但是LiFePO4作为正极材料,存在一些固有的缺点,主要问题是它的电子电导率较低(约10-9 S·cm )[2],使得其大倍率放电性能较差,这主要通过引入电导性物质(如碳、Ag、Cu等)[3-4]或掺杂金属离子[5]来解决。LiFePO4除了电子导电率低以外,Li+在固相中的扩散系数也较低[6],导致了较慢的固相反应动力学,为了缩短Li+在固相中的扩散时间,可以采用合适的制备方法,优化合成工艺来得到粒径较小,分布均匀的颗粒。
目前,制备LiFePO4的方法很多,主要有高温固相法、水热法、溶胶-凝胶法、共沉淀法、微波法等[7-12]。与传统的固相法相比,溶胶-凝胶法可以在溶胶过程中将原料混合到分子级,从而降低固相煅烧所需要的温度,有机物在预处理阶段分解生成碳,均匀地分散于原料前驱体中,可以有效地抑制样品晶粒的过分长大,从而得到粒径小、电化学性能好的LiFePO4样品;而且有机酸分解所得碳作为还原剂,与纯H2相比具有价廉、危险性低等优点;残留在样品中的过量的碳还可以作为导电剂提高材料的电子导电率,从而提高材料的电化学性能。 HU等[13]用乙二酸作为金属离子螯合剂合成了LiFePO4材料。WANG等[14]用聚丙烯酸和柠檬酸作为螯合剂通过溶胶-凝胶法进行掺杂(Mg、Ti、Zr)和包覆碳,并比较了二者的差别。YANG和XU[15]在非水溶胶-凝胶体系中合成了颗粒细小、均匀的纳米LiFePO4材料,在低电流密度下(1/100C)放电得到165 mA?h/g的放电容量;在1/5C和2 C倍率下仍然保持150 mA?h/g的放电容量,显示出非常好的电化学性能。
本文作者采用溶胶-凝胶法,以柠檬酸为络合剂和碳源,制备LiFePO4 /C正极材料,研究LiFePO4的物相结构及其电化学性能。
1 实验
以物质的量比1?1?2称取Fe(NO3)3·9H2O、LiH2PO4和柠檬酸(均为分析纯),溶解于去离子水中形成 1 mol/L的溶液。在恒温水浴中磁力搅拌下,分别将Fe(NO3)3溶液和LiH2PO4溶液逐滴加入到柠檬酸溶液中,用氨水调节其pH值,85 ℃下加热除去水分形成凝胶,凝胶在真空干燥箱中120 ℃干燥12 h,研磨后在管式炉中氩气气氛下于700 ℃煅烧10 h,制得LiFePO4/C复合材料。
采用Nicolet560傅里叶变换红外光谱仪对前驱体和样品进行红外表征,扫描范围为4 000~500 cm-1。采用RigaKu D/max2550VB+18 kW转靶X射线衍射仪(CuKa)对样品进行物相分析,管电压为40 kV,管电流为300 mA,扫描范围为10?~ 70?,扫描速度为4(?)/min。
将制得的样品、乙炔黑、聚四氟乙烯按质量比80?10?10均匀混合,涂在约l cm2 的不锈钢网上,然后置于真空干燥箱120 ℃下干燥12 h,压片后得到正极片。以金属锂片为对电极,电解液采用1 mo1/L LiPF6/EC+DMC+EMC(体积比为1?1?1),在氩气保护的MBRAUN手套箱中组装成模拟电池,H2O和O2体积分数均小于10-12。采用武汉力兴公司制造的PCBT-32-D程控电池测试仪检测样品的电化学性能,充放电电压范围为2.5~4.2 V。采用上海辰华公司生产的CHI660A型电化学工作站进行循环伏安测试,扫描速率为0.1 mV/s,电压扫描范围为2.7~4.2 V。电化学阻抗测试采用德国生产的ZAHNER-IM6型电化学工作站,交流电压振幅为5 mV,频率范围为10-2~105 Hz。
2 结果与讨论
分别对制备的前驱体和煅烧后的样品进行红外光谱测试,结果如图1和2所示。
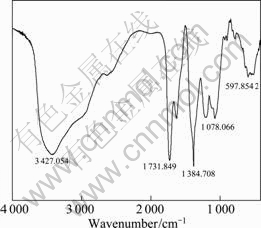
图1 前驱体的FTIR谱
Fig.1 FTIR spectrum of precursor
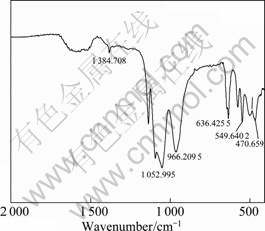
图2 LiFePO4样品的FTIR谱
Fig.2 FTIR spectrum of LiFePO4 sample
图1所示的前驱体的FTIR图谱在3 427.054 cm-1处有一个宽大的吸收峰,对应于O—H的伸缩振动,而1 632 cm-1为O—H的弯曲振动吸收峰,1 731.849 cm-1处吸收峰为酯基C=O的伸缩振动峰,1 217 cm-1为C—O的伸缩振动峰,表明前驱体中含有柠檬酸的羟基和羧基结构。FTIR图谱中在400~1 200 cm-1存在P—O的特征吸收峰,1 384.708 cm-1则为N—O的特征吸收峰,表明原料形成螯合物前驱体后,达到了原子级的混合。
前驱体经过热处理后, 有机物分解以CO和CO2形式释放出去, 酯、螯合物、羧酸盐及醇的特征峰完全消失, 只存在磷酸根的特征峰。图2中各吸收峰的位置与文献[16]报道的基本一致。LiFePO4的吸收峰主要位于1 200~400 cm-1,由两个谱带组成,一个是 1 200~900 cm-1的强吸收,另一个是700~400 cm-1的中强吸收。1 138.708 cm-1归属于PO2的伸缩振动模式;1 095 cm-1和1 052.995 cm-1均归结于P—O的反对称伸缩振动。LiFePO4中P—O键的对称伸缩振动出现于966.2095 cm-1、652 cm-1和636.4255 cm-1;PO2的反对称伸缩振动出现于577 cm-1;PO2的对称弯曲振动出现于469 cm-1和549.6402 cm-1。另外,507 cm-1处还有表示PO2摇摆振动的峰。同时,在红外光谱图中还出现了许多小峰,说明以柠檬酸为碳源制备的LiFePO4/C复合材料的红外光谱可能受到了包覆碳的影响,结构发生了较小的变化。
样品的X射线衍射谱如图3所示。由图3可看出,各衍射峰的位置与LiFePO4标准谱图基本吻合,没有发现杂质峰,说明通过溶胶-凝胶法在700 ℃合成的样品具有纯相的橄榄石结构。根据X射线衍射理论,在晶粒尺寸小于100 nm时,样品晶粒尺寸可以用Debye-Scherrer公式计算,算出相应LiFePO4/C样品的粒径为30 nm。

图3 在700 ℃合成的LiFePO4样品的XRD谱
Fig.3 XRD pattern of LiFePO4 sample sintered at 700 ℃
以0.1C对样品进行充放电性能测试,图4所示为样品的首次充放电曲线。由图4可知,样品在3.4 V左右具有稳定的充放电平台,首次充电比容量为134.4 mA?h/g,放电比容量为127.2 mA?h/g,充放电效率为94.6%。充放电容量并没有其他研究者所得结果的高,可能是由于样品的形貌不规则,样品中碳含量过高且分布不均匀所致。通过溶解法测得产物中的碳含量为10.81%。过高的碳含量虽然能使电导率得到提高,但降低了其振实密度,同时减少了活性物质的量而导致电池的总容量降低。最佳的制备工艺条件还有待进一步研究。
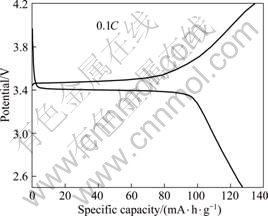
图4 LiFePO4以0.1C充放电的首次充放电曲线
Fig.4 First discharge curves of LiFePO4 sample at 0.1C
图5所示为样品在不同倍率下的循环性能。由图5可看出,在前20次循环内,当样品以0.1C电流充放电时,样品的放电容量先增大后减小,第3次循环时,达到最大值(147.5 mA?h/g),最后保持在126.3 mA?h/g,材料的比容量几乎没有下降,样品平均每次循环容量衰减为0.035%。从20到30次循环中,当样品以0.2C电流充放电时,样品的比容量从106.2 mA?h/g下降到105.7 mA?h/g,平均每次循环容量衰减0.041%。当充放电电流增大到0.5C时,首次放电比容量为83.3 mA?h/g,10次循环后,容量反而上升到84.5 mA?h/g。当充放电电流继续增大到1.0C时,首次放电比容量仅为70.6 mA?h/g,但循环性能较好。由此可见,该材料在小倍率充放电时,具有较好的放电比容量和循环性能,而大倍率充放电时其放电比容量较低。这是由于材料的离子导电率很低引起的,与文献报道的一致。
在常温下,采用三电极体系,工作电极为LiFePO4,以锂片为对电极和参比电极,扫描电压范围为2.7~4.2 V,扫速为0.1 mV/s,进行循环伏安测试。图6所示为新鲜电极的循环伏安曲线。由图6可知,电极的氧化峰和还原峰峰形对称,氧化峰与还原峰面积也近似相等,表明电极有较好的可逆性。氧化峰电位和还原峰电位分别为3.639 V和3.279 V,两者之差为0.36 V,说明电极反应过程动力学性能较好,极化较小。
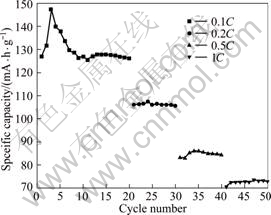
图5 LiFePO4在不同倍率下的循环曲线
Fig.5 Cycling curves of LiFePO4 sample at different discharge rates
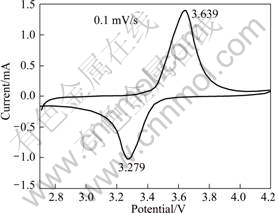
图6 LiFePO4/C的循环伏安曲线
Fig.6 CV curves of LiFePO4/C at scan rate of 0.1 mV/s
锂离子在电极体系中的运动不但要克服溶液中的电阻,而且还要在界面处发生电荷转移反应,进入LiFePO4的内部扩散。而电化学阻抗谱是电化学研究中常用的方法之一,以助于了解各个界面的性质与电极反应动力学以及反应机理。图7所示为模拟电池充电到开路电压3.4 V下测试的交流阻抗图。从图7可以看出,体系的交流阻抗谱图主要由3部分组成:高频区的半圆对应于Li+在正极表面膜中迁移的膜电阻Rf,中频区的半圆代表电荷转移电阻Rct,低频区的直线对应于Warburg阻抗。跟据以上分析,提出如图8所示的等效电路图,并采用ZView2软件对以上电化学阻抗图谱进行拟合(见表1)。根据拟合结果可得Rf=24.83 Ω,Rct=26.91 Ω,低于其他文献所报道的 值[17]。LiFePO4的电子导电性能不佳(约为10-9 S/cm,室温),采用碳包覆可以明显改善其导电能力,表现在Rct的降低,从而在电极表面的电荷传递更易发生。
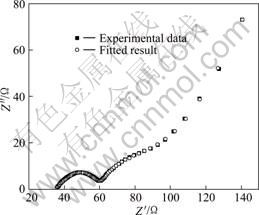
图7 LiFePO4/C的交流阻抗图及拟合结果
Fig.7 Nyquist plots and fitting result of LiFePO4/C at 3.4 V
![]()
图8 等效电路图
Fig.8 Equivalent circuits
表1 样品在开路电压3.4 V下的阻抗拟合结果
Table 1 Fitted results of impedance parameters of sample at open potential of 3.4 V
![]()
3 结论
1) 采用溶胶-凝胶法,以柠檬酸为络合剂和碳源,制备了碳包覆的LiFePO4正极材料。
2) 通过XRD、FIRT及相关电化学测试方法对合成的LiFePO4 /C进行表征,发现该材料具有单一的橄榄石型的晶体结构,颗粒粒径较小。
3) 样品具有较好的充放电比容量和循环性能,在0.1C倍率下的首次放电比容量为127.1 mA?h/g。
4) 循环伏安测试表明电极有较好的可逆性,极化较小。交流阻抗测试表明,正极表面SEI膜电阻Rf=24.83 Ω,电荷转移电阻Rct=26.91 Ω。
REFERENCES
[1] Padhi A K, Nanjundaswamy K S, Goodenough J B. Phospho-olivines as positive electrode materials for rechargeable lithium batteries[J]. Electrochem Soc, 1997, 144(4): 1188-1194.
[2] Chung S Y, Blocking J T, Chiang Y M. Electronically conductive phospho-olivines as lithium storage electrodes[J]. Nat Mater, 2002, 1: 123-128.
[3] BAUER E M, BELUTTO C, PASQUALI M, PROSINI P P, RIGHINi G. Versatile synthesis of carbon-rich LiFePO4 enhancing its electrochemical properties[J]. Electrochem Solid-State Lett, 2004, 7(4): A85-A87.
[4] MI C H, CAO Y X, ZHANG X G, ZHAO X B, LI H L. Synthesis and characterization of LiFePO4/(Ag+C) composite cathodes with nano-carbon webs[J]. Power Technol, 2008, 181: 301-306.
[5] Herle P S, Ellis B, Coombs N, Nazar L F. Nano-network electronic conduction in iron and nickel olivine phosphates[J]. Nat Mater, 2004, 3(3): 147-152.
[6] Dominko R, Gaberscek M, Drofenik J, Bele M, Pejovnik S, Jamnik J. The role of carbon black distribution in cathodes for Li ion batteries[J]. J Power Sources, 2003, 119/121: 770-773.
[7] Bauer E M, Bellitto C, Righini G, Pasquali M, Dell E A, Prosini P P. A versatile method of preparation of carbon-rich LiFePO4: A promising cathode material for Li-ion batteries[J]. J Power Sources, 2005, 146: 544-549.
[8] Dokko K, Koizumi S, Sharaishi K, Kanamura K. Electrochemical properties of LiFePO4 prepared via hydrothermal route[J]. J Power sources, 2007, 165(2): 656-659.
[9] 张 静, 刘素琴, 黄可龙, 赵裕鑫. LiFePO4: 水热合成及性能研究[J]. 无机化学学报, 2005, 21(5): 433-436.
Zhang Jin, Liu Su-qin, Huang Ke-long, Zhao Yu-xin. LiFePO4: Hydrothermal synthesis and properties[J]. Chinese Journal of Inorganic Chemistry, 21(5): 433-436.
[10] Dominko R, Bele M, Gaberscek M, Remskar M, Hanzel D, Goupil J M, Pejovnik S, Jamnik J. Porous olivine composites synthesized by sol-gel technique[J]. J Power Sources, 2006, 153(2): 274-280.
[11] Prosini P P, Carewska M, Scaccia S, Wisniewski P, Passerini S, Pasquali M. A new synthetic route for preparing LiFePO4 with enhanced electrochemical performance[J]. J Electrochem Soc, 2002, 149(7): 886-890.
[12] Masashi H, Kelichi K, Azuma Y, Yukawa M, Suhara M. Synthesis of LiFePO4 cathode material by microwave processing[J]. J Power Sources, 2003, 119/121: 258-261.
[13] Hu Y Q, Doeff M M, Kostecki R, Finones R. Electrochemical performance of sol-gel synthesized LiFePO4 in lithium batteries[J]. J Electrochem Soc, 2004, 151(8): 1279-1285.
[14] Wang G X, Bewlay S, Yao J, Ahn J H, Dou S X, Liu H K. Characterization of LiMxFe1-xPO4 (M = Mg, Zr, Ti) cathode materials prepared by the sol-gel method[J]. Electrochem Solid-State Lett, 2004, 7(12): 503-506.
[15] Yang J S, Xu J J. Nonaqueous sol-gel synthesis of high-performance LiFePO4[J]. Electrochem Solid-State Lett, 2004, 7(12): 515-518.
[16] Burba C M, Frech R. Raman and FTIR spectroscopic study of LixFePO4: 0
[17] Gao F, Tang Z Y. Kinetic behavior of LiFePO4/C cathode material for lithium-ion batteries[J]. Electrochim Acta, 2008, 53: 5071-5075.
基金项目:国家重点基础研究发展计划资助项目(2008AA031205)
收稿日期:2009-11-15;修订日期:2010-02-20
通信作者:黄可龙,教授,博士;电话:0731-88879850;E-mail: huangkelong@yahoo.com.cn


