LiODFB电解液的高低温性能
周宏明1, 2,刘芙蓉1,李荐1, 2,方珍奇1,李艳芬1
(1. 中南大学 材料科学与工程学院,湖南 长沙,410083;
2. 湖南省正源储能材料与器件研究所,湖南 长沙,410083)
摘 要:
化学工作站和电池测试系统研究LiODFB/(EC+DMC+EMC)和LiPF6/(EC+DMC+EMC)电解液的热稳定性、高低温下的电化学窗口及其对铝箔集流体的稳定性、LiFePO4/G(石墨,graphite,简称G)电池在60和-20 ℃的高循环性能,通过SEM分析循环后的正负极极片形貌,探索高低温下电解液与极片的相互作用机理。研究结果表明:LiODFB电解液在250 ℃才会分解,而LiPF6电解液的分解温度为120 ℃;在-20和60 ℃时,LiODFB电解液的电化学窗口及其对集流体铝箔的稳定性比LiPF6电解液的大;以LiFePO4/G为电极的LiODFB电池在-20和60 ℃循环100次后的容量保持率均比LiPF6电池的大,LiODFB电解液能够帮助石墨表面SEI膜的形成,而LiPF6电解液在高温下会产生HF破坏SEI膜,致使电池性能降低。
关键词:
中图分类号:TM911.3 文献标志码:A 文章编号:1672-7207(2013)06-2230-07
High and low temperature performance of LiODFB electrolyte
ZHOU Hongming1, 2, LIU Furong1, LI Jian1, 2, FANG Zhenqi1, LI Yanfen1
(1. School of Materials Science and Engineering, Central South University, Changsha 410083, China;
2. Hunan Zhengyuan Insititute for Energy Storage Materials and Devices, Changsha 410083, China)
Abstract: The thermal stability of LiODFB/(EC+DMC+EMC) electrolyte and LiPF6/(EC+DMC+EMC) electrolyte, electrochemical window and stability with the aluminum foil at high and low temperature, and the cycle performance of LiFePO4/G (graphite) battery at 60 and -20 ℃ were studied by DSC, electrochemical workstations and battery test system. SEM was used to analyse the anode morphology after cycle, and the interaction mechanism between the electrolyte and electrode at high and low temperature was also investigated. The results show that LIODFB electrolyte is decomposed at 250 ℃, while LiPF6 electrolyte has a decomposition temperature of 120 ℃. The electrochemical of LiODFB electrolyte and its stability with aluminum foil are superior to those of LiPF6 electrolyte at -20 and 60 ℃. LiODFB battery with LiFePO4/G for electrode has better capacity retention than the LiPF6 battery at -20 and 60 ℃. LiODFB electrolyte is benefitial to the formation of the SEI film on the G electrode. However, LiPF6 electrolyte would generate HF to destroy the SEI film at high temperature.
Key words: LiODFB; lithium battery; high and low temperature performance; thermal stability
科技进步和社会发展促进了锂离子电池的应用和推广,也对其提出了更高的要求,锂离子电池在极限温度下的性能是影响其应用的主要因素[1-4]。作为锂离子电池的关键材料之一,电解液是获得高比能、高电压的锂电池的重要保证[5-8]。电解液的高低温性能包括电解液的热分解性,在不同温度的电导率,其自身的稳定性及其对集流体的腐蚀性,还有电解液与电极材料制备电池的高低温性能等方面。付茂华等[9-11]测定了室温下LiODFB电解液的稳定性,并借助扣式电池和SEM等手段研究了LiODFB电解液与LiFePO4/石墨(G)电池的高温性能,LiODFB在室温下4.5 V开始出现氧化分解电流,略高于LiPF6电解液的4.4 V,60 ℃循环时LiODFB电池循环100次的容量保持率为86.7%,明显高于LiPF6电池的67.4%,石墨负极的SEM表明LiODFB电池的负极有形成致密光滑的SEI膜,而LiPF6电池负极的膜粗糙,且LiPF6产生HF破坏SEI膜,导致电池循环性能差。但是关于循环过程中电池正极与电解液的相互作用还尚未有研究。邓凌峰等[12]测试了室温时LiODFB电解液对铝丝的稳定性,LiODFB在室温下6.0 V开始出现氧化分解电流,高于LiPF6电解液的4.5 V。刘凡群[13]测定了LiODFB电解液在不同温度下的电导率,在-20~60 ℃之间,LiODFB电解液的电导率随着温度的升高逐渐增加,在-20~0 ℃,LiODFB电解液电导率高于LiPF6电解液电导率,而在0~60 ℃,LiODFB电解液电导率稍低于LiPF6电解液电导率。另外,关于LiODFB电解液在高低温条件下的电化学窗口、对集流体铝箔的腐蚀性以及电解液的热稳定性的研究鲜见报道,这些都严重限制了LiODFB电解液的进一步推广应用。为此,本文作者选用LiFePO4为正极,G为负极,LiODFB和LiPF6为电解质盐,EC+DMC+ EMC(质量比为1:1:1)为有机溶剂,借助电化学工作站测试了电解液在高低温下的稳定性及其对集流体的腐蚀性,采用DSC分析了电解液的热分解性能,同时运用实际生产中的全电池技术测定了LiFePO4/G电池的高低温性能,结合SEM技术对循环后的正负极极片进行分析,分析高低温循环过程中电解液与电解液之间的相互作用机理,系统地探索了电解液的高低温性能。
1 实验
1.1 电解液配置
以LiPF6(电池级)和自制的LiODFB(纯度>99.9%)为电解质盐,以EC(碳酸乙烯酯,电池级)、DMC(碳酸二甲酯,电池级)和EMC(碳酸甲乙酯,电池级)为溶剂,在手套箱(水、氧含量低于10 mg/L)中分别配置1mol/L LiODFB/(EC+DMC+EMC)(质量比为1:1:1)、LiPF6/(EC+DMC+EMC)(质量比为1:1:1)的电解液。
1.2 电池制作
将电池级的LiFePO4、导电剂炭黑(SP)、羧甲基纤维素钠(CMC)和丁苯橡胶(SBR),按比例先后加入,搅拌均匀后涂布,然后经压片切片;负极料为G,SP,CMC和SBR,制片方法同上;制备的极片与Celgard隔膜(美国Celgard公司)一起卷成柱式电池,真空干燥箱中脱气,手套箱中注液,然后取出封口,得到电池。
1.3 电化学性能测试
采用三电极体系在CHI660电化学工作站(上海辰华仪器有限公司)测试电解液的稳定性,对电极和参比电极用锂片(文中的电位值均相对于Li/Li+),工作电极用铂电极。测试条件为:2.5~6.5 V,扫速速度1 mV/s,测试温度为-20和60 ℃。
采用三电极体系在电化学工作站测试电解液对铝箔的腐蚀性,对电极和参比电极用锂片,工作电极用铝箔。测试条件均为:2.5~6.5 V,扫速速度1 mV/s,测试温度为-20和60 ℃。
采用拜特BTS0105C8电池测试系统(宁波拜特测控技术有限公司)测试柱式电池的首次充放曲线性能、倍率性能以及循环性能。电池充电的终止电压为3.6 V,放电的终止电压为2.5 V,测试温度为-20和60 ℃。
1.4 极片扫描
在手套箱中将60 ℃下循环100次的LiFePO4/G电池拆开,将正负极片泡入DMC中清洗极片表面残留的电解液,然后取出极片,真空干燥。取干燥好的极片做SEM(SIRION 200场发射扫描电子显微镜,荷兰FEI公司)检测,观察循环后极片的形貌,分析循环过程的变化。
1.5 热稳定性分析
采用美国SDT V8.0热分析仪来分析LiODFB电解液的热分解反应与特性,选用刚玉材质坩埚来放置样品,分析条件为:保护气体是99.999%高纯氮气,升温速率10 ℃/min,升温范围20~500 ℃。
2 结果讨论与分析
2.1 电解液的热稳定性
采用DSC对纯有机溶剂EC+DMC+EMC,1 mol/L LiODFB/(EC+DMC+EMC)和1 mol/L LiPF6/(EC+ DMC+EMC)的热稳定性进行了分析,结果如图1所示。
从图1可见:有机溶剂仅在150~170 ℃之间有1个很小的放热峰,此峰对高温下不稳定的EMC的分解反应,能完全满足电池对温度的要求[14]。LiPF6电解液一共有3个放热峰,第1个峰在120~135 ℃之间,对应的是LiPF6分解成LiF和PF5,且电解液中存在的痕量水会加速分解反应的发生;第2个峰为150~170 ℃之间的EMC的分解;第3个峰在190~220 ℃之间,主要是LiPF6的分解产物与有机溶剂发生反应,生成PF4OH,CO2,C2H5OC2H5和CH3F等[15]。
从图1可见:LiODFB电解液有2个峰,第1个峰为150~170 ℃之间的EMC的分解;第2个峰在254~270 ℃之间,在此温度下LiODFB/(EC+DMC+ EMC)电解液发生热分解反应,生成C2H5F,CO2,CH3F, BF2OH,LiF,C2H5BF4OH等。由上述分析结果可知:LiODFB电解液的热分解温度明显大于LiPF6电解液的热分解温度,具有更好的热稳定性。
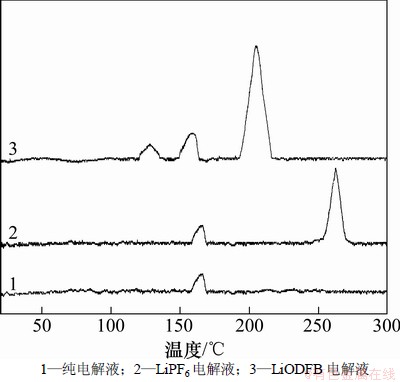
图1 不同电解液的DSC曲线
Fig. 1 DSC curves of different electrolytes
2.2 电解液的高低温电化学稳定性
图2所示为LiODFB和LiPF6电解液在不同温度下的氧化分解电位曲线。
从图2(a)可知:-20 ℃条件下,LiODFB和LiPF6电解液分别在6.01和4.69 V出现氧化电流,且LiPF6电解液在6.33 V达到电流峰值。可见:LiODFB电解液具有较LiPF6电解液更宽的电化学窗口,适合用作高电压电解液。
从图2(b)可知:60 ℃条件下,LiODFB和LiPF6电解液在4.20和3.98 V第1次出现氧化电流,且LiPF6电解液在4.98 V达到电流峰值,此时对应电解液中EMC的分解成DEC和DMC的反应,LiPF6会分解生成HF和LiF等。LiODFB和LiPF6电解液的第2次氧化电流增大出现在5.38和5.11 V,并很快在5.62和5.50 V分别达到电流峰值。可以很明显地看出:2次氧化电流出现均有LiODFB电解液分解电位比LiPF6电解液的大,且LiODFB不会发生分解,因此,LiODFB电解液较LiPF6电解液具有更好的高温稳定性。
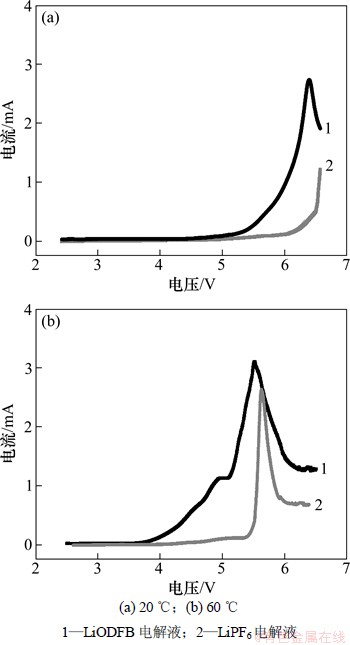
图2 电解液的电流-电位曲线
Fig. 2 I-E curves of electrolytes
另外,从图2还可看出:60 ℃时电解液开始出现氧化分解峰的电位低于-20 ℃的,且出现了2次阳极电流随着电位正移增大的情况,因此,-20 ℃时的电解液的稳定性优于60 ℃时的电解液的稳定性。
2.3 电解液对铝箔的腐蚀性研究
LiODFB和LiPF6电解液在不同温度下对集流体铝箔的电流-电位曲线如图3所示。
从图3(a)可知:-20 ℃条件下,LiODFB电解液和LiPF6电解液出现氧化电流分别是在6.15和4.55 V,且LiPF6电解液在6.06 V达到电流峰值。可以很明显的看出,LiODFB电解液较LiPF6电解液对铝箔具有更宽的电化学窗口,因此,-20 ℃时LiODFB电解液与铝箔、锂片的三电极体系较LiPF6电解液更加稳定。
从图3(b)可知:60 ℃下,LiODFB电解液对铝箔的电流-电位曲线在4.58~5.04 V之间出现了阳极电流缓慢增加的斜坡,对应高温下不稳定的溶剂EMC分解生成DEC和DMC;随后从5.31 V开始阳极电流再次随着电位的正移而迅速增加,在5.63 V出现电流峰,对应的是电解液与铝箔之间相互的反应,电解液会在铝箔表面生成钝化膜。LiPF6电解液与铝箔的电流-电位曲线出现了3个明显的电流峰,在4.63 V出现第1个峰值电流(1.49 mA),对应EMC的分解反应以及LiPF6分解反应;在5.01 V出现第2个峰值电流(2.57 mA),此时电解液中的有机溶剂等会结合游离Li+和LiF等在铝箔表面形成钝化膜;在5.45 V出现第3个峰值电流(1.46 mA),此时LiPF6分解产生的HF和LiPF6制备过程中无法分离的痕量HF对铝箔表面的钝化膜产生腐蚀。
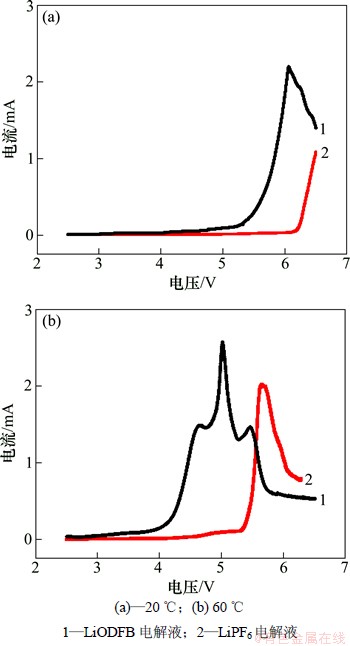
图3 电解液对集流体铝箔的电流-电位曲线
Fig. 3 I-E curves of aluminum foil in electrolytes
由上述分析可知:-20和60 ℃条件下,LiODFB电解液与铝箔、锂片的三电极体系较LiPF6电解液更加稳定。
2.4 LiFePO4/G电池的高温循环性能
分别以LiODFB和LiPF6为电解质的LiFePO4/G电池在60 ℃下的循环容量如图4所示。
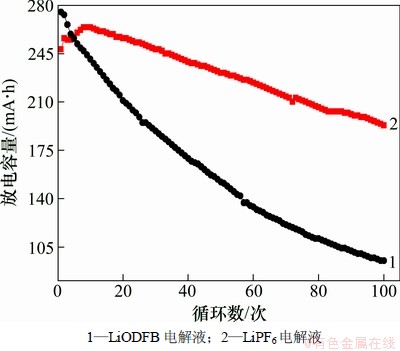
图4 LiFePO4/G电池的高温60 ℃的循环容量
Fig. 4 Cycle discharge capacity of LiFePO4/G batteries at 60 ℃
从图4可知:LiODFB基电池在60 ℃的循环性能明显比LiPF6基电池的优。随着循环次数的增加,LiODFB基电池的放电容量衰减速度明显比LiPF6基电池的低。循环100次后,LiODFB基电池放电容量为193 mA·h,容量保持率为78%,而LiPF6基电池衰减至93 mA·h,容量保持率仅为35%。LiPF6基电池的容量在60 ℃条件下衰减迅速的主要原因是:(1) LiPF6电解液在负极石墨表面形成的SEI膜易被高温下电解液分解产生的HF腐蚀,导致电解液与石墨材料直接接触,发生溶剂共嵌等现象[16],影响电池的性能;而且产生的HF极大地促进了电池正极材料磷酸铁锂在LiPF6电解液中的溶解,导致活性物质的减少,降低电池的容量。(2) 隔膜被产生的HF腐蚀后会使其孔隙变大,不仅Li+,其他离子也可以通过,严重的话可能导致电池短路,导致电池容量的降低。然而,LiODFB电解液热稳定性优异,在60 ℃电解质盐与有机溶剂均不会发生反应分解,也不会而且产生腐蚀隔膜的HF,而且LiODFB电解质盐具有很好的成膜性能,有效的帮助在电池负极表面形成均匀致密且阻抗小的SEI膜,从而能够有效地控制只允许Li+从负极的嵌入脱出,隔绝了电解液与石墨的接触,避免了短路的可能性。
2.5 LiFePO4/G电池的低温循环性能
分别以LiODFB和LiPF6为电解质的LiFePO4/G电池在-20 ℃下的循环容量如图5所示。
由图5可知:LiODFB基电池具有优于LiPF6电池的低温循环性能。在-20 ℃,LiODFB基电池首次放电容量为214 mA·h,循环100次后为222 mA·h,而LiPF6基电池首次放电容量为208 mA·h,循环100次后为192 mA·h。二者前10次循环的放电容量持上升趋势,达到最大放电容量后,LiODFB基电池的放电容量保持平稳趋势,而LiPF6电池则呈逐渐衰减的趋势。电池初始放电容量低主要是电解液中Li+及溶剂化Li+的溶剂分子、LiODFB的阴离子等在负极石墨表面结合形成阻止Li+外离子通过的膜,电极体系活性较低,因此需要循环多次才可以在石墨表面形成完整的SEI膜。LiODFB能够帮助形成均匀、致密且阻抗小的SEI膜,有效地提高了电池体系的循环性能[17],因此循环100次,容量保持率在95%以上。而LiPF6形成的SEI膜结构粗糙,稳定性差,容易被电解液中微量HF腐蚀,同时使电解液与石墨接触,破坏石墨结构,导致电池循环放电容量降低[18]。

图5 LiFePO4/G电池-20 ℃循环容量
Fig. 5 Cycle discharge capacity of LiFePO4/G batteries at -20 ℃
2.6 LiFePO4/G电池环前后的负极极片扫描分析
图6所示为以LiODFB和LiPF6为电解质的LiFePO4/G电池在-20和60 ℃下循环前后石墨极片扫描图。
从图6(a)可以看出:纯石墨极片颗粒圆润,颗粒大小不等,分布不均匀,表面有明显的孔隙。由图6(b) 可知:LiPF6电池低温循环后石墨极片表面疏松、粗糙,颗粒大小分布不均,部分颗粒粉化或者被剥离,表面有尖锐的微粒子存在,同时颗粒之间有很明显的大的间隙。部分粉化的颗粒会锂离子的脱嵌进入电解液中,造成了其在极片表面的缺失与间隙。被粉化及石墨层的层离剥落会致使电子导电性中断,增大极片表面的阻抗,直接降低了电池的容量保持率。从图 6(d)可知:-20 ℃循环后LiODFB电池的石墨极片表面颗粒较循环前更加均匀、致密,推测是极片上形成了一层表面膜,保护了电极,因此电池循环100次容量衰减小。这与图5的低温循环性能分析结果是一致的。
由图6(c)可以看出:LiPF6电池在60 ℃下循环100次后的石墨极片表面覆盖了一层膜,但表面膜不均匀,且有明显的裂纹[19]。这是由于LiPF6电解液高温时分解产生的HF会破坏形成的SEI膜,导致电解液与石墨直接接触,电解液中有机溶剂分子会与Li+发生共嵌入反应,导致在石墨层间生成锂盐沉淀,而产生的大量气体会导致石墨层结构之间的层离、剥落和粉化,产生的气体在逸出过程中会进一步破坏表面膜,使其产生裂纹。表面膜裂纹产生后,增加了HF与膜和石墨颗粒的接触面积,进一步促进了对极片的破坏,依此循环,极片迅速被破坏。因此,LiPF6电池的循环性能差,容量衰减很快。而从图6(e)可知:LiODFB电池在60 ℃循环100次之后的石墨极片表面形成的SEI膜表面均匀,致密,未见裂纹产生。这是由于LiODFB电解液中的ODFB-能够参与形膜反应,帮助在石墨表面形成致密均匀、阻抗小的SEI膜[20],反应式如图7所示。LiODFB电池表面膜的形成,隔绝了电解液与电极接触,电池循环容量衰减缓慢。

图6 LiFePO4/G电池在-20和60 ℃循环前后的石墨极片扫描图
Fig. 6 SEM images of graphite before and after cycle in LiFePO4/G batteries at -20 and 60 ℃
2.7 LiFePO4/G电池循环前后的正极极片扫描分析
图8所示为LiFePO4/G电池循环前后正极LiFePO4极片的扫描图。比较图8(a)和8(b)可见:60 ℃下由于LiODFB基电解液对LiFePO4的溶解性很低,同时不会产生对电极材料具有腐蚀性的HF[11],因此60 ℃循环100次后的极片扫描图谱基本无变化,LiODFB电池的高温循环容量衰减缓慢。而由图8(c)可知:LiPF6基电池循环100次后极片出现了颗粒裂开或者断裂等被破坏的现象,且具有较多裂纹。这是由于LiFePO4在LiPF6基电解液中具有一定的溶解性,温度升高能够促进溶解[11],而且LiPF6在高温下易分解产生HF,HF对LiFePO4的腐蚀性造成了裂纹的产生,促进了LiPF6电池容量的迅速衰减。
从图8(d)和8(e)可知:-20 ℃下,LiODFB电池循环100次后的LiFePO4极片基本无变化,而LiPF6电池循环100次后的LiFePO4极片有微量的裂纹,说明LiODFB在-20 ℃也具有较LiPF6更好的正极极片成膜性能。因此,-20 ℃时LiODFB电池较LiPF6电池容量保持率更高。
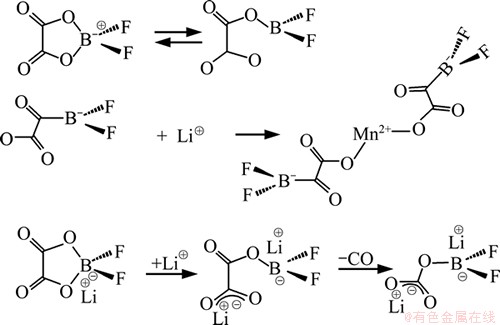
图7 电解质盐ODFB-参与SEI膜形成的反应式图
Fig.7 Reactive figure of electrolyte salt ODFB- participating in forming SEI film

图8 LiFePO4/G电池在-20和60 ℃循环前后的LiFePO4极片扫描图
Fig. 8 SEM images of LiFePO4 before and after cycle in LiFePO4/G batteries at -20 and 60 ℃
3 结论
(1) LiODFB电解液在250 ℃才会分解,而LiPF6电解液的分解温度为120 ℃;在-20和60 ℃时,LiODFB电解液的电化学窗口及其对集流体铝箔的稳定性比LiPF6电解液的大。
(2) 以LiFePO4/G为电极的LiODFB电池在-20和60 ℃循环100次后的容量保持率均比LiPF6电池的大,LiODFB电解液能够帮助石墨表面SEI膜的形成,而LiPF6电解液在高温下会产生HF破坏SEI膜,致使电池性能降低。
参考文献:
[1] Wang H, Shao D G, Xu L. Research on a new type of lithium battery string equalization and management system[J]. Advanced Materials Research, 2012, 383/390: 1470-1476.
[2] Lee S B, Jang I C, Lim H H, et al. Preparation and electrochemical characterization of LiFePO4 nanoparticles with high rate capability by a sol–gel method[J]. Journal of Alloys and Compounds, 2010, 491: 668-672.
[3] Fang S H, Tang Y F, Tai X Y, et al. One ether-functionalized guanidinium ionic liquid as new electrolyte for lithium battery[J]. Journal of Power Sources, 2011, 196(3): 1433-1441.
[4] Angenendt K, Johansson P. Ionic liquid based lithium battery electrolytes: Charge carriers and interactions derived by density functional theory calculations[J]. Journal of Physical Chemistry B, 2011, 115(24): 7808-7813.
[5] Yoshizawa H, Ikoma M. Thermal stabilities of lithium magnesium cobalt oxides for high safety lithium-ion batteries[J]. J Power sources, 2005, 146(6): 121-124.
[6] Andersson A M, Henningson A, Siegbahn H, et a1. Electrochemically lithiated graphite characterized by photoelectron spectroscopy[J]. Journal of Power Sources, 2003, 119/120/121: 522-527.
[7] Yokoyama K, Hiwar A, Fujita A, et al. Carbonate compounds non-aqueous electrolytic solutions and batteries comprising non-aqueous electrolytic solutions: US, 5847188[P]. 1998-12-08.
[8] Masashi I, Hideaki K, Masayuki M, et al. Li(CF3SO2)2N as a electrolytic salt for rechargeable lithium batteries with graphitized mesocarbon microbeads anodes[J]. Journal of Power Sources, 2000, 62(2): 229-232.
[9] 付茂华. 磷酸铁锂电池用高低温电解液的研究[D]. 长沙: 中南大学化学化工学院, 2010: 16-42.
FU Maohua. Study of LiFePO4 battery with high/low temperature electrolyte[D]. Changsha: Central South University. School of Materials Science and Engineering, 2010: 16-42.
[10] Fu M H, Huang K L, Liu S Q, et al. Lithium difluoro(oxalato)borate/ethylene carbonate+propylene carbonate +ethyl (methyl)carbonate electrolyte for LiMn2O4 cathode[J]. Journal of Power Sources, 2010, 195(11): 862-866.
[11] 付茂华, 黄可龙, 刘素琴, 等. 二氟草酸硼酸锂对LiFePO4/石墨电池高温性能的影响[J]. 物理化学学报, 2009, 25(10): 1985-1990.
FU Maohua, HUANG Kelong, LIU Suqin, et al. Effect of lithiumdifluoro(oxalato) borate on the high-temperature performance of LiFePO4/graphite batteries[J]. Acta Phys Chim Sin, 2009, 25(10): 1985-1990.
[12] 邓凌峰,陈洪. 锂离子电池电解质LiBC2O4F2 的合成与电化学性能[J]. 电源技术, 2010, 34(3): 237-240.
DENG Lingfeng, CHEN Hong. Electrochemical properties and synthesis of LiBC2O4F2 for lithium batteries[J]. Chinese Journal of Power Sources, 2010, 34(3): 237-240.
[13] 李凡群. LiODFB基电解液及其与LiFePO4-AC/AG-AC超级电容电池电极材料的相容性研究[D]. 长沙: 中南大学化学化工学院, 2009: 15-30.
LI Fanqun. Study of LiODFB electrolyte and its compatibility with super capacity material LiFePO4-AC/AG-AC[D]. Changsha: Central South University. School of Materials Science and Engineering, 2009: 15-30.
[14] 郑洪河. 锂离子电池电解质[M]. 北京: 化学工业出版社, 2007: 51-53.
ZHENG Honghe. Lithium battery electrolyte[M]. Beijing: Chemical Industry Press, 2007: 51-53.
[15] Mori S, Asahina H, Suzuki H, et al. Proceedings of the eighth international meeting on lithium batteries[C]//Energy Development. Nagoya, Japan: International Academic Publishers, 1996: 16-21.
[16] Sato K, Zhao L W, Okada S, et al. LiPF6/methyl difluoroacetate electrolyte with vinylene carbonate additive for Li-ion batteries[J]. Journal of Power Sources, 2011, 196(13): 5617-5622.
[17] Peled E, Golodnitsky D, Menachem C, et al. Advanced tool for the selection of electrolyte components for rechargeable lithium batteries[J]. Journal of the Electrochemical Society, 1998, 145(10): 3482-3486.
[18] Deng T S, Hsieh P H, Yang M H. Effect of mixed LiBOB and LiPF6 salts on electrochemical and thermal properties in LiMn2O4 batteries[J]. Journal of Power Sources, 2007, 174(25): 663-667.
[19] Zhang S S, Ding M S, Xu K, et al. Understanding solid electrolyte interface film formation on graphite electrodes[J]. Electrochemical and Solid-State Letters, 2001, 4(12): 206-208.
[20] Colclasure A M, Smith K A, Kee R J. Modeling detailed chemistry and transport for solid-electrolyte-interface (SEI) films in Li-ion batteries[J]. Electrochimica Acta, 2011, 58(1):33-43.
(编辑 杨幼平)
收稿日期:2012-06-09;修回日期:2012-09-01
基金项目:湖南省科技计划项目(2010FJ4061);长沙市科技计划项目(K1201039-11)
通信作者:李荐(1969-),男,湖南郴州人,副教授,从事新能源材料和器件研究;电话:13786145378;E-mail:ziliao2000@126.com
摘要:采用DSC、电化学工作站和电池测试系统研究LiODFB/(EC+DMC+EMC)和LiPF6/(EC+DMC+EMC)电解液的热稳定性、高低温下的电化学窗口及其对铝箔集流体的稳定性、LiFePO4/G(石墨,graphite,简称G)电池在60和-20 ℃的高循环性能,通过SEM分析循环后的正负极极片形貌,探索高低温下电解液与极片的相互作用机理。研究结果表明:LiODFB电解液在250 ℃才会分解,而LiPF6电解液的分解温度为120 ℃;在-20和60 ℃时,LiODFB电解液的电化学窗口及其对集流体铝箔的稳定性比LiPF6电解液的大;以LiFePO4/G为电极的LiODFB电池在-20和60 ℃循环100次后的容量保持率均比LiPF6电池的大,LiODFB电解液能够帮助石墨表面SEI膜的形成,而LiPF6电解液在高温下会产生HF破坏SEI膜,致使电池性能降低。
[9] 付茂华. 磷酸铁锂电池用高低温电解液的研究[D]. 长沙: 中南大学化学化工学院, 2010: 16-42.
[11] 付茂华, 黄可龙, 刘素琴, 等. 二氟草酸硼酸锂对LiFePO4/石墨电池高温性能的影响[J]. 物理化学学报, 2009, 25(10): 1985-1990.
[12] 邓凌峰,陈洪. 锂离子电池电解质LiBC2O4F2 的合成与电化学性能[J]. 电源技术, 2010, 34(3): 237-240.
[13] 李凡群. LiODFB基电解液及其与LiFePO4-AC/AG-AC超级电容电池电极材料的相容性研究[D]. 长沙: 中南大学化学化工学院, 2009: 15-30.


