DOI: 10.11817/j.ysxb.1004.0609.2021-39659
砷酸盐的溶解理论在含砷废水处理中的应用
徐 蕾1,郑雅杰1,彭映林2,龙 华1,何汉兵1
(1. 中南大学 冶金与环境学院,长沙 410083;
2. 湖南城市学院 材料与化学工程学院,益阳 413000)
摘 要:
根据热力学数据,通过计算绘制Ca-As(Ⅴ)-H2O、Cu-As(Ⅴ)-H2O、Zn-As(Ⅴ)-H2O、Fe-As(Ⅴ)-H2O系lg c-pH图,以此为理论指导,采用单一金属盐和复合盐处理含As(Ⅴ)废水,研究各金属盐对沉砷效果的影响。结果表明:采用钙、铁、铜和锌盐单独处理3.17 g/L含As(Ⅴ)废水,各金属盐沉砷适宜pH值与理论分析结果基本吻合。采用金属盐复合后处理3.17 g/L含As(Ⅴ)废水,适宜沉砷pH=9,在此条件下,处理初始浓度为1~10 g/L含As(Ⅴ)废水时,滤液中As残留浓度在《污水综合排放标准》(GB 8978—1996)范围内。通过改变金属盐种类处理含As(Ⅴ)废水,在pH=9时,钙盐对脱砷率影响最大。
关键词:
文章编号:1004-0609(2021)-03-0724-12 中图分类号:X756;X703 文献标志码:A
引文格式:徐 蕾, 郑雅杰, 彭映林, 等. 砷酸盐的溶解理论在含砷废水处理中的应用[J]. 中国有色金属学报, 2021, 31(3): 724-735. DOI: 10.11817/j.ysxb.1004.0609.2021-39659
XU Lei, ZHENG Ya-jie, PENG Ying-lin, et al. Application of dissolution theory of arsenate in treatment of arsenic-containing wastewater[J]. The Chinese Journal of Nonferrous Metals, 2021, 31(3): 724-735. DOI: 10.11817/j.ysxb.1004.0609.2021-39659
水体中的砷主要以As(Ⅴ)和As(Ⅲ)两种形式存在,有色冶金是产生含砷废水的主要行业,其废水pH一般小于2[1-2]。目前,处理工业含砷废水的方法主要有化学沉淀法、离子交换法、吸附法、生物法等,其中化学沉淀法是应用范围最广,它是利用(亚)砷酸根与多种阳离子形成(亚)砷酸盐沉淀而去除废水中砷[3-4],因此,研究不同砷酸盐的溶解度随pH的变化,有助于了解含砷废水沉淀机理。但由于目前较常采用钙盐及铁盐处理含砷废水,故人们对难溶砷酸盐的研究主要集中在砷酸钙盐、砷酸铁盐[5-6],实际上Cu2+、Zn2+等金属盐也能与As(Ⅴ)反应生成难溶的砷酸盐沉淀,且Ca2+、Fe3+、Cu2+、Zn2+盐的配合也能更有效地除去废水中砷。
本文通过热力学计算绘制Ca-As(Ⅴ)-H2O、Cu-As(Ⅴ)-H2O、Zn-As(Ⅴ)-H2O、Fe-As(Ⅴ)-H2O系的lg c-pH图,在理论分析所得适宜n(Ca)/n(As)、n(Cu)/n(As)、n(Fe)/n(As)、n(Zn)/n(As)沉砷条件下,利用氯化钙、氯化锌、硫酸铁和五水硫酸铜复合盐沉淀废水中As(Ⅴ)。结果表明,当pH=9、初始As(Ⅴ)浓度为3.17 g/L时,采用复合盐处理后,废水中砷浓度为0.33mg/L,符合污水综合排放标准,且所得含砷沉淀通过硫酸浸出、蒸发结晶后回收三氧化二砷,回收砷后母液可循环利用[7-8]。本文研究理论上对实际含砷废水处理具有重要的指导意义,而且利用复合盐沉淀砷能有效减少含砷危险固体废弃物量,并极大降低含砷废水处理成本。
1 实验
1.1 实验步骤
1.1.1 水中砷酸盐的溶解与pH的关系
1) 采用氯化钙、氯化锌、硫酸铁和五水硫酸铜(均为分析纯)单独处理3.17 g/L含As(Ⅴ)溶液(将五氧化二砷溶于蒸馏水中,并采用硫酸调节pH=1.0配制而成),控制搅拌速度250 r/min,采用34%氢氧化钠溶液调节pH,在pH=2、3、4、5、6、7、8、9、10条件下,反应搅拌后,取样过滤,滤液保存待测,分析沉砷后砷浓度与pH值的关系。
2) 采用氯化钙、氯化锌、硫酸铁和五水硫酸铜(均为分析纯)混合后,处理 3.17 g/L含As(Ⅴ)溶液,控制搅拌速度250 r/min,采用34%氢氧化钠溶液调节pH,在pH=4、5、6、7、8、9、10条件下,反应搅拌后,取样过滤,滤液保存待测,分析沉砷后砷浓度与pH值的关系。在适宜pH值下,按上述实验步骤,采用复合盐处理 500 mg/L、1 g/L及10 g/L含As(Ⅴ)溶液,反应搅拌后,取样过滤,滤液保存待测。
1.1.2 金属盐种类对沉砷率的影响
采用硫酸铁、氯化钙和五水硫酸铜(均为分析纯)混合后处理3.17 g/L含As(Ⅴ)溶液,并采用34%氢氧化钙溶液调节pH(实际工厂常采用钙盐调节pH),在适宜pH值下,反应搅拌后,取样过滤,滤液保存待测。
采用硫酸铁、氯化钙和五水硫酸铜(均为分析纯)混合后处理3.17 g/L含As(Ⅴ)溶液,并采用34%氢氧化钠溶液调节pH,在适宜pH值下,反应搅拌后,取样过滤,滤液保存待测。
采用硫酸铁和五水硫酸铜(均为分析纯)混合后处理3.17 g/L含As(Ⅴ)溶液,并采用34%氢氧化钠溶液调节pH,在适宜pH值下,反应搅拌后,取样过滤,滤液保存待测。
1.2 分析与检测
采用X线衍射仪(XRD,Rigaku D/max-TTR Ⅲ)分析样品物相(发光源为Cu Kα靶,管压为40 kV,管流为250 mA,λ=0.154056×10-10 m,2θ为10.0°~ 80.0°);采用电感耦合等离子体光谱仪(ICP-OES,IRIS Intrepid Ⅱ,Thermo Electron Corporation)分析溶液中的元素含量;在扫描电镜(SEM,FEIQuanta 200)下观察样品表面形貌;采用红外光谱仪(FT-IR,WQF-510A)对沉淀渣进行傅里叶变换红外光谱分析。
2 砷酸盐溶解的热力学分析及计算方法
在水溶液中砷酸有H3AsO4、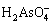 、
、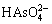 和
和 四种形态,使用复合盐沉砷过程中,砷与钙、铁、铜和锌盐可形成多种砷酸盐沉淀,Ca2+、Fe3+、Cu2+、Zn2+等离子在水溶液中的存在形态及其与As(Ⅴ)形成的各种砷酸盐沉淀的反应式及化学平衡常数如表1所示[9-16]。
四种形态,使用复合盐沉砷过程中,砷与钙、铁、铜和锌盐可形成多种砷酸盐沉淀,Ca2+、Fe3+、Cu2+、Zn2+等离子在水溶液中的存在形态及其与As(Ⅴ)形成的各种砷酸盐沉淀的反应式及化学平衡常数如表1所示[9-16]。
表1 溶液中可能发生的反应及平衡常数
Table 1 Possible reactions and equilibrium constants in solution

假设体系中各砷酸盐沉淀互不影响,以Cu3(AsO4)2 为例,Cu-As(Ⅴ)-H2O系可能发生(1)~(8)的反应式,根据元素质量守恒原理,平衡时溶液中游离的总砷[As]T、总铜[Cu]T分别满足式(31)和(32):
[Cu]T=[Cu2+]+[CuOH+]+[Cu(OH)2(aq)]+[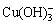 ]+[
]+[ ] (31)
] (31)
[As]T=[H3AsO4]+[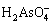 ]+[
]+[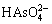 ]+[
]+[ ] (32)
] (32)
由平衡关系式(8)可得:
[ Cu2+ ]3[ ]2=10-35.11 (33)
]2=10-35.11 (33)
假设体系中仅有Cu3(AsO4)2,则有2[Cu]T= 3[As]T,以[Cu]T表示溶液中[Cu2+]、[As(Ⅴ)]T表示溶液中[ ]并代入式(33),可得溶液中[As]T与pH值的关系式,由此绘制Cu3(AsO4)2-H2O系的lg[As]T-pH图如图1(a)所示。
]并代入式(33),可得溶液中[As]T与pH值的关系式,由此绘制Cu3(AsO4)2-H2O系的lg[As]T-pH图如图1(a)所示。
按上述步骤,根据表1中热力学数据计算,即得到用lg[As]T表示的不同砷酸盐的溶解度与pH值的关系曲线如图1所示。
由图1(a)可以看出,在1.2<pH<10.5范围内,溶液中均有Cu3(AsO4)2、CuHAsO4、Cu5H2(AsO4)4沉淀析出,当pH=7左右时,溶液中三种砷酸铜盐的溶解度达到最小,沉砷率达到最大;由图1(b)可以看出,在4.5<pH<10.5范围内,在溶液中均有Ca3(AsO4)2、CaHAsO4·H2O、Ca5(AsO4)3OH沉淀析出,当pH=9.5左右时,溶液中Ca3(AsO4)2、Ca5(AsO4)3OH溶解度达到最小,沉砷率达到最大;由图1(c)可以看出,在0<pH<10范围内,在溶液中均有FeAsO4、FeAsO4·2H2O沉淀析出,当pH=3.9左右时,溶液中两种砷酸铁盐溶解度达到最小,沉砷率达到最大;由图1(d)可以看出,在2<pH<5范围内,在溶液中均有Zn3(AsO4)2、ZnHAsO4、Zn5H2(AsO4)4沉淀析出,当pH=3.6左右时,三种砷酸锌盐溶解度达到最小,沉砷率达到最大。
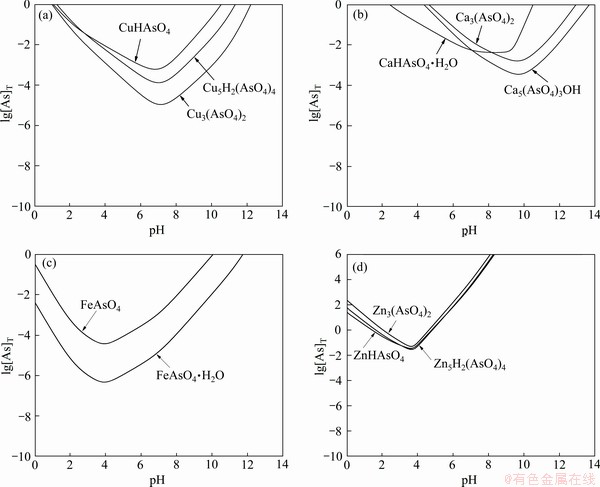
图1 298.15 K时Cu-As(Ⅴ)-H2O(a)、Ca-As(Ⅴ)-H2O(b)、Fe-As(Ⅴ)-H2O(c)、Zn-As(Ⅴ)-H2O(d)系的lg[As]T-pH图
Fig. 1 lg[As]T-pH diagrams of Cu-As(Ⅴ)-H2O(a), Ca-As(Ⅴ)-H2O(b), Fe-As(Ⅴ)-H2O(c), Zn-As(Ⅴ)-H2O(d) system at 298.15 K
由理论分析结果可知,当砷酸铜盐以Cu3(AsO4)2形式沉淀、砷酸钙盐以Ca5(AsO4)3OH形式沉淀、砷酸铁盐以FeAsO4·2H2O形式沉淀、砷酸锌盐以Zn5H2(AsO4)4形式沉淀时,溶液中[As]T可达到最小。对上述曲线叠加,可得到Cu3(AsO4)2-Ca5(AsO4)3OH- FeAsO4·2H2O-Zn5H2(AsO4)4-H2O系lg[As]T-pH图,如图2所示。
由图2可知,4.4<pH<4.7时,为各砷酸盐沉淀的公共区。当pH>5时,溶液中基本没有Zn5H2(AsO4)4沉淀;而在5<pH<11范围内,均存在Cu3(AsO4)2、Ca5(AsO4)3OH及FeAsO4·2H2O沉淀;且随着pH的增加,砷酸钙盐、砷酸铁盐和砷酸铜盐的稳定区逐渐增大,溶液中[As]T不断减小,当pH>11时,Cu3(AsO4)及FeAsO4·2H2O基本溶解,溶液中[As]T增加。
3 结果与讨论
根据上述砷酸盐溶解理论,在分析所得最佳沉砷物质量比的条件下(w(Ca):w(As)=5:3、w(Cu): w(As)=3:2、w(Zn):w(As)=5:4、w(Fe):w(As)=1:1),采用单一金属盐和复合盐处理含As(Ⅴ)废水,通过实验验证理论分析结果,为化学沉砷工艺提供可靠的理论依据。
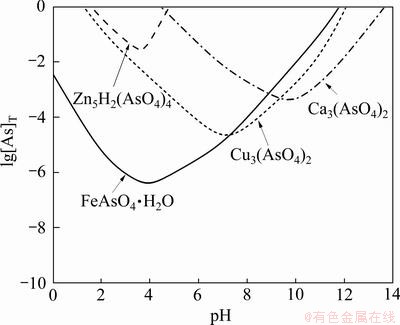
图2 Cu3(AsO4)2-Ca5(AsO4)3OH-FeAsO4·2H2O-Zn5H2·(AsO4)4-H2O系lg[As]T-pH图
Fig. 2 lg[As]T-pH diagrams of Cu3(AsO4)2-Ca5(AsO4)3OH- FeAsO4·2H2O-Zn5H2(AsO4)4-H2O system (298.15 K)
3.1 单一金属盐对含砷废水的处理
采用钙、铁、铜、锌盐分别处理3.17 g/L含As(Ⅴ)溶液,在2≤pH≤10取样分析,溶液中主要元素残留浓度随pH的变化趋势如图3所示。
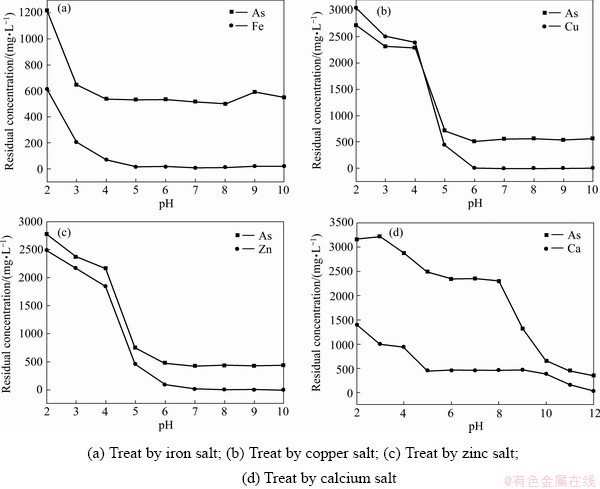
图3 主要元素残留浓度随pH的变化趋势
Fig. 3 Trend of residual element concentration with pH
由图3可知,随着pH的增大,采用铁、钙、锌及铜盐单独处理含砷废水时,废水中主要元素浓度均随pH的增大而减小,当溶液pH达到沉砷适宜pH值时,生成的砷酸盐类沉淀溶解度达到最小,使溶液中砷浓度急剧下降;随着pH的增加,溶液中As浓度变化不大,这是由于各砷酸盐沉淀具有一定的稳定性,在短时间内不易溶解,且溶液中钙、铁、铜、锌的氢氧化物或氧化物生成,并具有一定的吸附作用[17-18],沉砷后液中As浓度并未降至理论计算值,是由于砷沉淀过程中生成的砷酸盐化合物的组成、结构及砷去除率取决于溶液中各金属离子与As的摩尔比和pH值,反应时间对沉砷率也有一定的影响[11, 19-21]。
结合上述结果可知,实测沉砷反应最适宜pH值与理论计算较为吻合但仍有偏差,且随着pH升高,溶液中As浓度并没有大幅上升,这是因为实际反应情况要比理论分析复杂得多,且在热力学计算过程中并未能把各化学反应或吸附等作用对As(Ⅴ)浓度的影响考虑进去。将在适宜pH条件下所得沉淀渣烘干后进行SEM及XRD检测,测得SEM像如图4所示,XRD谱如图5所示。
由图4可以看出,采用铁、钙、锌、铜盐单独处理含砷废水所得沉淀物为不规则的多面体,表面粗糙,形成团聚体,用铁、铜盐处理所得沉淀物团聚现象较为严重,主要为絮团状,这是由于形成胶体物质吸附性能较大引起的,而采用钙、锌盐处理所得沉淀物形貌较为密实,但仍有许多小颗粒黏附在大颗粒上。
由图5可以看出,采用铁盐单独处理含砷废水所得沉淀物的衍射峰主要为无定型峰,未能识别出合适的组分物相;采用铜盐单独处理含砷废水所得沉淀物的衍射峰液为无定型峰,但沉淀物中能识别出Cu5(AsO4)2(OH)4;采用锌盐及钙盐单独处理时,所得沉淀物衍射峰峰强明显增强,但仅能检测出Zn(OH)2和Ca5(AsO4)3(OH)。由XRD谱可知,铁盐、铜盐处理废水所得沉淀物结晶性较差;钙盐、锌盐处理废水所得沉淀物结晶性较好。对所得沉淀渣进行红外光谱分析,其结果如图6所示。

图4 不同金属盐分别处理含As(Ⅴ)废水所得沉淀物的SEM像
Fig. 4 SEM images of precipitates obtained by treating As(Ⅴ)-containing wastewater with different metal salts
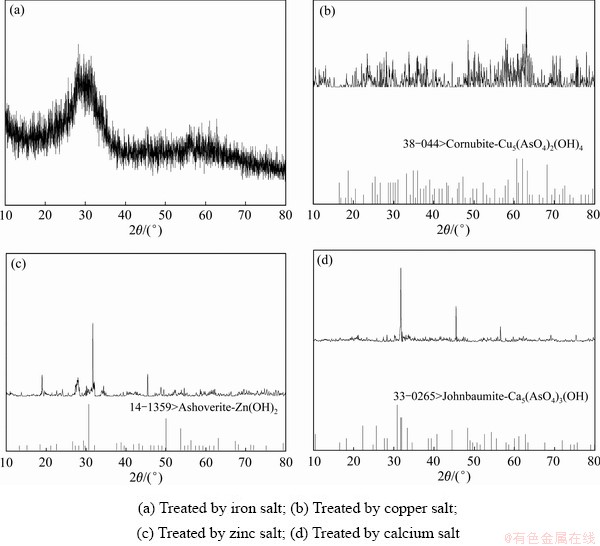
图5 不同金属盐分别处理含As(Ⅴ)废水所得沉淀物的XRD谱
Fig. 5 XRD pattern of precipitates obtained from treating As(Ⅴ)-containing wastewater with different metal salts
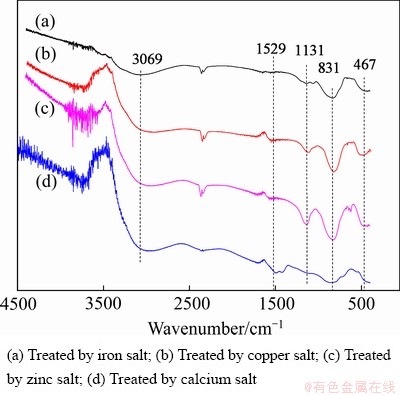
图6 不同金属盐分别处理含As(Ⅴ)废水所得沉淀物的红外光谱图
Fig. 6 FT-IR spectra of precipitate obtained by treating As(Ⅴ)-containing wastewater with different metal salts
从图6中可看到,3069 cm-1处的峰为水分子中羟基和氢氧化物中羟基的伸缩振动峰,在1529 cm-1处出现的峰为水分子中羟基和氢氧化物中羟基的弯曲振动峰[22],在1131 cm-1处的峰为金属水合氧化物中M—OH键的振动峰[17],在831 cm-1处的吸收峰为As—O键的伸缩振动峰[23-24],467 cm-1处的吸收峰为O—As—O键的弯曲振动吸收峰[24]。由红外光谱图可知,采用金属盐单独处理含As(Ⅴ)废水所得沉淀物中均含有金属氢氧化物及砷酸盐类沉淀,进一步说明金属盐沉砷是化学沉淀与吸附作用共同的结果。
3.2 复合盐对含砷废水的处理
3.2.1 适宜pH值的确定
采用钙、铁、铜、锌盐复合后处理3.17 g/L 含As(Ⅴ)溶液,在4≤pH≤10取样分析。溶液中主要元素残留浓度随pH的变化趋势如图7所示。
由图7可知,在4≤pH≤10范围内,随着pH的增大,溶液中各元素的浓度均下降,这是由于溶液中Zn2+、Cu2+、Ca2+、Fe3+与As(Ⅴ)均能生成砷酸盐沉淀,随着pH增加,溶液中铁离子开始生成氢氧化铁,其具有一定的吸附作用[19],能将其他砷酸盐类沉淀吸附共沉淀。溶液中As浓度随pH的增大而减小,当pH=9时,溶液中As残留浓度为0.39 mg/L,浓度在《污水综合排放标准》(GB 8978—1996)范围内,在碱性条件下,复合盐脱砷效果均比较好,砷脱除率都大于99%。对复合盐处理含砷废水所得沉淀渣进行SEM及XRD检测。沉淀渣SEM像如图8所示,沉淀渣的XRD谱如图9所示。
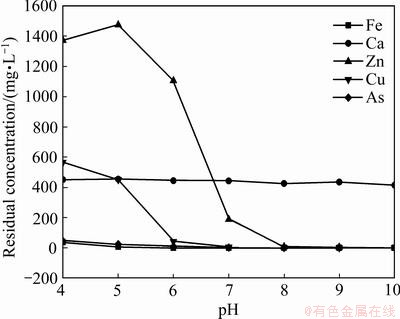
图7 滤液中主要元素残留浓度随pH的变化趋势
Fig. 7 Variation trend of residual concentration of main elements in filtrate with pH
由图8可以看出,金属盐复合处理后所得沉淀物与单独处理所得沉淀物相比粒径更大,大颗粒呈现不规则块状,且表面较为平滑,小颗粒大多为絮团状并黏附在大颗粒上。结合XRD谱可以看出,复合盐处理含砷废水时,所得沉淀物的衍射峰峰强较强,结晶度较好,沉淀物中能识别出Ca2Zn(AsO4)2·2H2O、Ca3Fe3(AsO4)4(OH)6·3H2O、Ca3(AsO4)2·2H2O。由此可知,复合盐沉砷是化学沉淀与吸附共同作用的结果。
3.2.2 初始As(Ⅴ)浓度对复合盐沉砷效果的影响
在理论分析所得最佳沉砷物质量比不变的条件下(w(Ca):w(As)=5:3、w(Cu):w(As)=3:2、w(Zn): w(As)=5:4、w(Fe):w(As)=1:1),处理不同初始As(Ⅴ)浓度废水,在pH=9时过滤,取样分析,滤液中主要元素残留浓度如表2所示。
由表2可以看出,当控制反应终点pH=9时,处理高浓度含As(Ⅴ)废水,溶液中残留As浓度可以降到0.5 mg/L以下,处理500 mg/L含As(Ⅴ)废水时,溶液中As残留浓度为5.42 mg/L,需进行二次沉砷处理,采用复合盐处理高浓度含As(Ⅴ)废水,可使处理后废水达标排放。

图8 复合盐处理含As(Ⅴ)废水所得沉淀物的SEM像
Fig. 8 SEM image of precipitates obtained by treating As(Ⅴ)-containing wastewater with compound salt
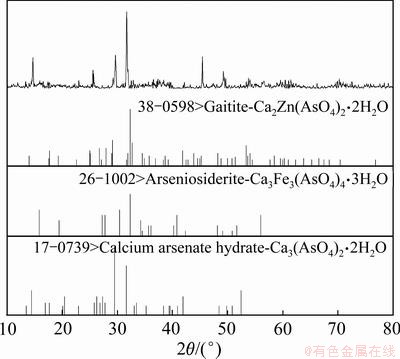
图9 复合盐处理含As(Ⅴ)废水所得沉淀物的XRD谱
Fig. 9 XRD pattern of precipitates obtained from As(Ⅴ)-containing wastewater with compound salt
3.3 不同金属盐种类对沉砷效果的影响
通过前期实验发现,在pH=9时,处理不同初始As(Ⅴ)浓度废水,处理效果均较好,故在此pH值下,通过改变加入废水中复合盐的种类,处理3.17 g/L含As(Ⅴ)废水,考察加入金属盐的种类对脱砷率的影响,滤液中各元素残留浓度如表3所示。
由表3可以看出,将铁盐、钙盐和铜盐复合后处理3.17 g/L含As废水,采用氢氧化钙调节pH=9,脱砷后液中As残留浓度为2.07 mg/L;将铁盐、钙盐及锌盐复合后处理,脱砷后液中As残留浓度为2.38 mg/L;将铁盐和铜盐复合后处理3.17 g/L含砷废水,脱砷后液中As残留浓度为192.96 mg/L,由此可知钙、铜、铁及锌盐均有一定的脱砷效果,但钙盐对脱砷的影响更大,结合图1可知,在pH=9时,砷酸钙盐溶解度基本达到最小,但其他砷酸盐类沉淀已经开始溶解,而且溶液中Ca2+对As(Ⅴ)的去除有明显的促进作用,生成的硫酸钙也具有固砷作用[26-27],故实际工业处理过程中,也常采用钙盐脱砷。采用四种盐复合后处理含砷废水,能使脱砷后废水中As残留浓度降至0.5 mg/L以下,这是由于金属盐种类的增加提高了溶液中As与各金属盐反应效率,从而使脱砷后液中As残留浓度降低。对所得沉淀渣进行XRD检测,测得的XRD谱如图10所示。
表2 脱砷后液中各组分残留浓度
Table 2 Residual concentration of each component in the solution after arsenic removal
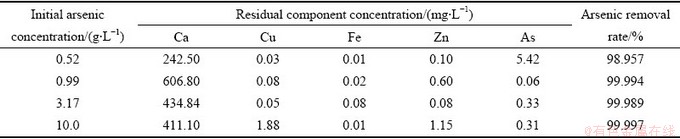
表3 脱砷后液中各组分残留浓度
Table 3 Residual concentration of each component in the solution after arsenic removal (mg/L)
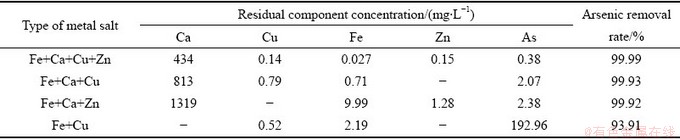
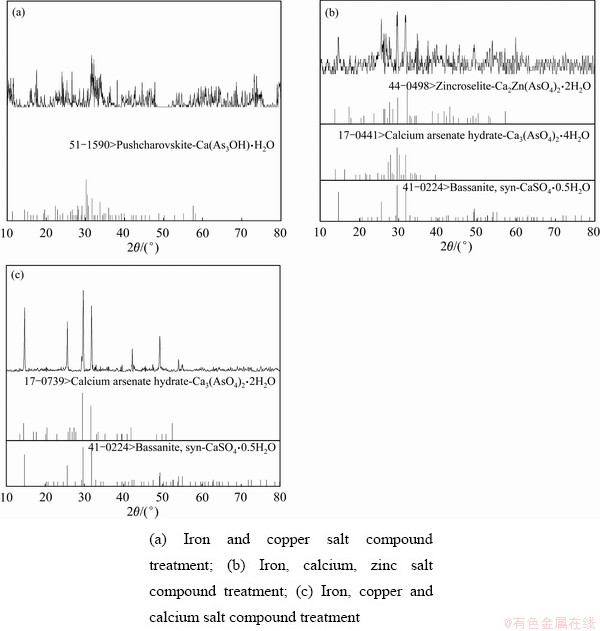
图10 不同金属盐种类处理含As(Ⅴ)废水所得沉淀渣的XRD谱
Fig. 10 XRD pattern of precipitates obtained from treating As(Ⅴ)-containing wastewater with different metal salt types
由图10可以看出,铁、铜盐复合处理含砷废水所得沉淀物的衍射峰为无定型峰,峰宽且杂,与铁盐、铜盐单独处理所得沉淀物的衍射峰类似,结晶性较差,仅能识别出Cu(AsO3OH)·H2O;铁、钙、锌复合处理后所得沉淀物的衍射峰杂峰较多,但峰强增强,能识别出CaSO4·0.5H2O、Ca3(AsO4)2·4H2O、Ca2Zn(AsO4)2·2H2O; 铁、铜、钙盐复合处理后所得沉淀物的衍射峰峰强明显增强且杂峰减少,能识别出Ca3(AsO4)2·2H2O、CaSO4·0.5H2O,由此可知,加入钙盐有助于改善砷酸盐类沉淀的结晶性。对所得沉淀渣进行红外光谱分析,其结果如图11所示。
在3326~3605 cm-1范围内的峰为水分子中羟基和氢氧化铁中羟基的伸缩振动峰,在1125、1131、1159 cm-1处的吸收峰是针铁矿(α-FeOOH)的吸收峰[22],图8(a)和(b)中828、843 cm-1处的峰为As—O键的伸缩振动峰[23],图8(c)与图8(a)相比,增加了669、603 cm-1两个吸收峰,这为石膏的振动吸收峰[28]。
4 结论
1) 通过热力学计算绘制Ca-As(Ⅴ)-H2O、Cu-As(Ⅴ)-H2O、Zn-As(Ⅴ)-H2O和Fe-(Ⅴ)-H2O的lg c-pH图,分析可知,pH=7.0为铜盐沉砷适宜pH值;pH=9.5为钙盐沉砷适宜pH值;pH=3.9为铁盐沉砷适宜pH值;pH=3.6为锌盐沉砷适宜pH值。
2) 在理论分析所得最佳沉砷条件下(n(Ca): n(As)=5:3、n(Cu):n(As)=3:2、n(Zn):n(As)=5:4、n(Fe): n(As)=1:1),采用单一金属盐处理3.17 g/L含As(Ⅴ)废水。结果表明:铜盐除砷适宜pH=6、钙盐除砷适宜pH=10、铁盐除砷适宜pH=4、锌盐除砷适宜pH=5,实验结果与理论分析吻合较好。
3) 将所得沉淀物通过XRD、SEM和红外光谱分析可知,采用金属盐沉砷是沉淀与吸附共同作用的结果,采用铁、铜盐沉砷吸附作用较强、结晶性较差,采用钙盐处理能明显改善沉淀物的结晶性。
4) 在含量比不变的条件下,采用钙、铜、铁、锌复合盐处理1~10 g/L含As(Ⅴ)废水,在pH=9时,沉砷效果最佳,脱砷后液中砷含量低于0.5 mg/L,在此pH值下,通过改变金属盐种类处理含As(Ⅴ)废水,发现钙盐对脱砷率的影响最大,从砷酸盐溶解理论角度说明了钙盐除砷的优势。
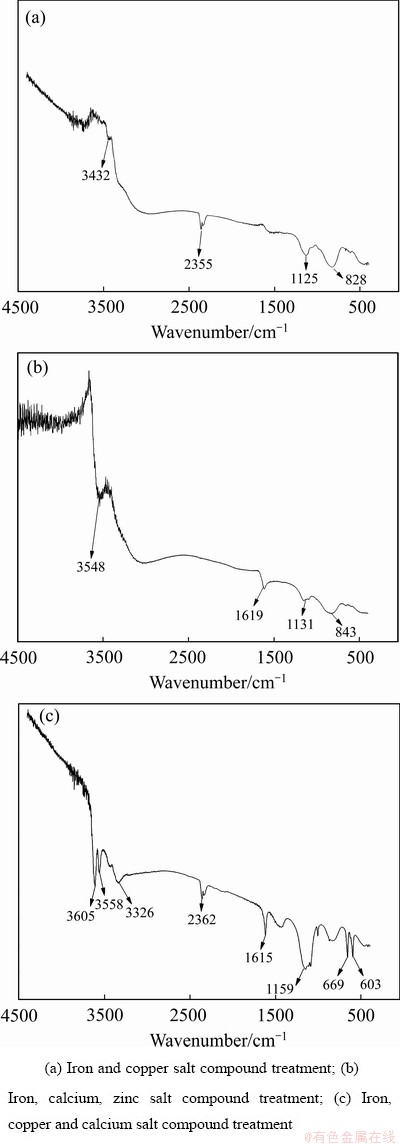
图11 不同复合盐种类处理含As(Ⅴ)废水所得沉淀渣的红外光谱
Fig. 11 FT-IR spectra of precipitates obtained from treating As(Ⅴ)-containing wastewater with different metal salt types
REFERENCES
[1] 王 颖, 吕斯丹, 李 辛, 等. 去除水体中砷的研究进展与展望[J]. 环境科学与技术, 2010, 33(9): 102-107.
WANG Ying, Lü Si-dan, LI Xin, et al. Research advances and prospects in arsenic removal from water[J]. Environmental Science & Technology, 2010, 33(9): 102-107.
[2] JIANG Q J. Removing arsenic from groundwater for the developing world—A review[J]. Water Science and Technology, 2001, 44(6): 89-98.
[3] 郑雅杰, 崔 涛, 彭映林. 二段脱铜液还原结晶法脱砷新工艺[J]. 中国有色金属学报, 2012, 22(7): 2103-2108.
ZHENG Ya-jie, CUI Tao, PENG Ying-lin. New process of arsenic removal from second stage decopperizing electrolyte by reduction and crystallization[J]. The Chinese Journal of Nonferrous Metals, 2012, 22(7): 2103-2108.
[4] NICOMEL N R, LEUS K, FOLENS K, et al. Technologies for arsenic removal from water: current status and future perspectives[J]. International Journal of Environmental Research and Public Health, 2015, 13(1): 62.
[5] 朱义年, 张学洪, 解庆林, 等. 砷酸盐的溶解度及其稳定性随pH值的变化[J]. 环境化学, 2003, 22(5): 478-484.
ZHU Yi-nian, ZHANG Xue-hong, XIE Qing-lin, et al. Dependence of arsenate solubility and stability on pH value[J]. Environmental Chemistry, 2003, 22(5): 478-484.
[6] LITYNSKA M, TOLSTOPALOVA N, ASTRELIN I. Neutralization of arsenic pollutants, contained in natural waters: The theoretical analysis of solubility of some arsenates and optimization of the processes[J]. Water Environ Nanotechnol, 2017, 2(1): 1-8.
[7] LONG H, ZHENG Y J, PENG Y L, et al. Recovery of alkali, selenium and arsenic from antimony smelting arsenic-alkali residue[J]. Journal of Cleaner Production, 2020, 251: 119673.
[8] 郑雅杰, 徐 蕾, 龙 华. 一种利用可回收的复合盐沉淀剂处理含砷废水的方法: 中国, 201911069055.7[P]. 2019-11-05.
ZHENG Ya-jie, XU Lei, LONG Hua. A method for treating arsenic-containing wastewater by using recyclable compound salt precipitant: China, 201911069055.7[P]. 2019-11-05.
[9] YANG J Q, CHAI L Y, LI Q Z, et al. Redox behavior and chemical species of arsenic in acidic aqueous system[J]. Transactions of Nonferrous Metals Society of China, 2017, 27(9): 2063-2072.
[10] 陈小凤, 周新涛, 罗中秋, 等. 化学沉淀法固化/稳定化除砷研究进展[J]. 硅酸盐通报, 2015, 34(12): 3510-3516.
CHEN Xiao-feng, ZHOU Xin-tao, LUO Zhong-qiu, et al. Progress on arsenic immobilization/stabilization with chemical precipitation method[J]. Bulletin of the Chinese Ceramic Society, 2015, 34(12): 3510-3516.
[11] 朱义年, 张 华, 梁延鹏, 等. 砷酸钙化合物的溶解度及其稳定性随pH值的变化[J]. 环境科学学报, 2005, 25(12): 1652-1660.
ZHANG Hua, LIANG Yan-peng, LIU Hui-li, et al. Dependence of solubility and stability of calciun arsenates on pH value[J]. Acta Scientiae Circumstantiae, 2005, 25(12): 1652-1660.
[12] ROBINS R G. The solubility of metal arsenates[J]. Metallurgical and Materials Transactions B, 1981, 12(1): 103-109.
[13] ZHU Y N, ZHANG X H, XIE Q L, et al. Solubility and stability of calcium arsenates at 25 ℃[J]. Water Air and Soil Pollution, 2006, 169(1/4): 221-238.
[14] 杨显万, 邱定蕃. 湿法冶金[M]. 北京: 冶金工业出版社, 1988: 139-145.
YANG Xian-wan, QIU Ding-pan. Hydrometallurgy[M]. Beijing: Metallurgical Industry Press, 1988: 139-145.
[15] 郑雅杰, 张胜华, 龚 昶. 含砷污酸资源化回收铜和砷的新工艺[J]. 中国有色金属学报, 2013, 24(10): 2985-2992.
ZHENG Ya-jie, ZHANG Sheng-hua, GONG Chang. Novel technique for recovery of copper and arsenic from arsenic-containing waste acid[J]. The Chinese Journal of Nonferrous Metals, 2013, 24(10): 2985-2992.
[16] 刘海浪. 白烟尘脱砷及铅、铜、锌回收基础研究[D]. 云南: 昆明理工大学, 2018: 36-47.
LIU Hai-lang. Basic research on arsenic removal from white dust and recovery of lead, copper and zinc[D]. Yunnan: Kunming University of Science and Technology, 2018: 36-47.
[17] 张 昱, 豆小敏, 杨 敏, 等. 砷在金属氧化物/水界面上的吸附机制Ⅰ. 金属表面羟基的表征和作用[J]. 环境科学学报, 2006, 26(10): 1586-1591.
ZHANG Yu, DOU Xiao-min, YANG Min, et al. Adsorption mechanism of arsenic on metal oxide adsorbent 1. Characterization and the role of metal surface hydroxyl groups[J]. Acta Scientiae Circumstantiae, 2006, 26(10): 1586-1591.
[18] 徐 昕, 吕 鑫, 王南钦, 等. 金属氧化物表面化学吸附和反应的量子化学簇模型方法研究[J]. 物理化学学报, 2004, 20(z1): 1045-1054.
XU Xin, Lü Xin, WANG Nan-qin, et al. Cluster modeling of chemisorption and reactions on metal oxide surfaces[J]. Acta Physico-Chemica Sinica, 2004, 20(z1): 1045-1054.
[19] 夏薪怡. 石灰-铜盐-氧化法处理高浓度含砷废水的实验研究[J]. 环保科技, 2018, 24(3): 12-15.
XIA Xin-yi, Experimental research of treatment of high concentration of trivalent As-containing wastewater by the catalytic oxidation-cupric salt[J]. Environmental Protection Technology, 2018, 24(3): 12-15.
[20] 郑雅杰, 罗 园, 王 勇. 采用含砷废水沉淀还原法制备三氧化二砷[J]. 中南大学学报(自然科学版), 2009, 40(1): 52-58.
ZHENG Ya-jie, LUO Yuan, WANG Yong. Arsenic trioxide made by precipitation-reduction method from As-containing wastewater[J]. Journal of Central University (Natural Science Edition), 2009, 40(1): 52-58.
[21] 叶恒朋, 杜亚光, 严立爽. 三氯化铁除砷的工艺研究[J]. 化学与生物工程, 2012, 29(9): 72-74.
YE Heng-peng, DU Ya-guang, YAN Li-shuan. Study on process of removing arsenic with ferric chloride[J]. Chemistry & Bioengineering, 2012, 29(9): 72-74.
[22] 李 娜, 孙竹梅, 阮福辉, 等. 三氯化铁除砷(Ⅲ)机理[J]. 化工学报, 2012, 63(7): 2224-2228.
LI Na, SUN Zhu-mei, RUAN Fu-hui, et al. Mechanism of removing arsenic(Ⅲ) with ferric chloride[J]. CIESC Journal, 2012, 63(7): 2224-2228.
[23] MYNENI S C B, TRAINA S J, WAYCHUNAS G A, et al. Experimental and theoretical vibrational spectroscopic evaluation of arsenate coordination in aqueous solutions, solids, and at mineral-water interfaces—Reevaluation of EXAFS results and topological factors in predicting geometry and evidence for m[J]. Geochimica Et Cosmochimica Acta, 1998, 62(19/20): 3285-3300.
[24] 刘 璟, 黄 晰, 谌 书, 等. 人工合成图水羟砷铁矾的矿物学研究[J]. 岩石矿物学杂志, 2012, 31(6): 901-906.
LIU Jing, HUANG Xi, CHEN Shu, et al. Mineralogical research on synthesized tooeleite[J]. Acta Petrologica et Mineralogica, 2012, 31(6): 901-906.
[25] 刘辉利, 梁美娜, 朱义年, 等. 氢氧化铁对砷的吸附与沉淀机理[J]. 环境科学学报, 2009, 29(5): 1011-1020.
LIU Hui-li, LIANG Meina, ZHU Yi-nian, et al. The adsorption of arsenic by ferric hydroxide and its precipitation mechanism[J]. Acta Scientiae Circumstantiae, 2009, 29(5): 1011-1020.
[26] 李小亮, 张丹妮, 王少锋, 等. 铁砷共沉淀中的硫酸钙对砷固定作用[J]. 生态学杂志, 2014, 33(10): 2803-2809.
LI Xiao-liang, ZHANG Dan-ni, WANG Shao-feng, et al. Arsenic immobilization by gypsum during iron-arsenic coprecipitation process[J]. Chinese Journal of Ecology, 2014, 33(10): 2803-2809.
[27] 陈晓娟, 杨柳春, 陈曲仙, 等. 脱硫石膏重结晶法制备硫酸钙晶须及其除砷性能初探[J]. 人工晶体学报, 2013, 42(9): 1889-1895.
CHEN Xiao-juan, YANG Liu-chun, CHEN Qu-xian, et al. Preparation of calcium sulfate whisker through recrystallization of flue gas desulfurization gypsum and exploration of its arsenic removal performance[J]. Journal of Synthetic Crystals, 2013, 42(9): 1889-1895.
[28] 肖 愉. 硫化砷渣的无害化处理研究[J]. 环境科技, 2015, 28(5): 12-15.
XIAO Yu. Study on innocent treatment of arsenic sulfide sludge[J]. Environmental Science and Technology, 2015, 28(5): 12-15.
Application of dissolution theory of arsenate in treatment of arsenic-containing wastewater
XU Lei1, ZHENG Ya-jie1, PENG Ying-lin2, LONG Hua1, HE Han-bing1
(1. School of Metallurgy and Environment, Central South University, Changsha 410083, China;
2. School of Chemistry and Environmental Engineering, Hunan City University, Yiyang 413000, China)
Abstract: According to the thermodynamic data, lg c-pH diagrams of Ca-As(Ⅴ)-H2O, Cu-As(Ⅴ)-H2O, Zn-As(Ⅴ)-H2O, Fe-As(Ⅴ)-H2O system were established. Using these as theoretical guide, the single metal salt and compound salt were used to treat As(Ⅴ)-containing wastewater. The results show that the optimum pH value for arsenic precipitation of each metal salt is basically consistent with the theoretical analysis results when the salts of calcium, iron, copper and zinc were separately used to treat 3.17 g/L of As(Ⅴ)-containing wastewater. Using compound salts to treat arsenic-containing wastewater, the suitable pH=9 for arsenic precipitation, under this conditions, when treating As(Ⅴ)-containing wastewater with an initial concentration of 1-10 g/L, As residual concentration in filtrate is within the scope of “Integrated Wastewater Discharge Standard” (GB 8978—1996). Changing the types of metal salts to treat As(Ⅴ)-containing wastewater, calcium salt has the greatest influence on arsenic removal rate at pH=9.
Key words: arsenic-containing wastewater; arsenate; solubility product; solution; pH value
Foundation item: Project(2017SK2254) supported by Key Research and Development Project of Hunan Province, China
Received date: 2020-01-17; Accepted date: 2020-11-20
Corresponding author: ZHENG Ya-jie; Tel: +86-731-88836285; E-mail: zyj@csu.edu.cn
(编辑 龙怀中)
基金项目:湖南省重点研发计划项目(2017SK2254)
收稿日期:2020-01-17;修订日期:2020-11-20
通信作者:郑雅杰,教授,博士;电话:0731-88836285;E-mail: zyj@csu.edu.cn
摘 要:根据热力学数据,通过计算绘制Ca-As(Ⅴ)-H2O、Cu-As(Ⅴ)-H2O、Zn-As(Ⅴ)-H2O、Fe-As(Ⅴ)-H2O系lg c-pH图,以此为理论指导,采用单一金属盐和复合盐处理含As(Ⅴ)废水,研究各金属盐对沉砷效果的影响。结果表明:采用钙、铁、铜和锌盐单独处理3.17 g/L含As(Ⅴ)废水,各金属盐沉砷适宜pH值与理论分析结果基本吻合。采用金属盐复合后处理3.17 g/L含As(Ⅴ)废水,适宜沉砷pH=9,在此条件下,处理初始浓度为1~10 g/L含As(Ⅴ)废水时,滤液中As残留浓度在《污水综合排放标准》(GB 8978—1996)范围内。通过改变金属盐种类处理含As(Ⅴ)废水,在pH=9时,钙盐对脱砷率影响最大。
[1] 王 颖, 吕斯丹, 李 辛, 等. 去除水体中砷的研究进展与展望[J]. 环境科学与技术, 2010, 33(9): 102-107.
[3] 郑雅杰, 崔 涛, 彭映林. 二段脱铜液还原结晶法脱砷新工艺[J]. 中国有色金属学报, 2012, 22(7): 2103-2108.
[5] 朱义年, 张学洪, 解庆林, 等. 砷酸盐的溶解度及其稳定性随pH值的变化[J]. 环境化学, 2003, 22(5): 478-484.
[8] 郑雅杰, 徐 蕾, 龙 华. 一种利用可回收的复合盐沉淀剂处理含砷废水的方法: 中国, 201911069055.7[P]. 2019-11-05.
[10] 陈小凤, 周新涛, 罗中秋, 等. 化学沉淀法固化/稳定化除砷研究进展[J]. 硅酸盐通报, 2015, 34(12): 3510-3516.
[11] 朱义年, 张 华, 梁延鹏, 等. 砷酸钙化合物的溶解度及其稳定性随pH值的变化[J]. 环境科学学报, 2005, 25(12): 1652-1660.
[14] 杨显万, 邱定蕃. 湿法冶金[M]. 北京: 冶金工业出版社, 1988: 139-145.
[15] 郑雅杰, 张胜华, 龚 昶. 含砷污酸资源化回收铜和砷的新工艺[J]. 中国有色金属学报, 2013, 24(10): 2985-2992.
[16] 刘海浪. 白烟尘脱砷及铅、铜、锌回收基础研究[D]. 云南: 昆明理工大学, 2018: 36-47.
[17] 张 昱, 豆小敏, 杨 敏, 等. 砷在金属氧化物/水界面上的吸附机制Ⅰ. 金属表面羟基的表征和作用[J]. 环境科学学报, 2006, 26(10): 1586-1591.
[18] 徐 昕, 吕 鑫, 王南钦, 等. 金属氧化物表面化学吸附和反应的量子化学簇模型方法研究[J]. 物理化学学报, 2004, 20(z1): 1045-1054.
[19] 夏薪怡. 石灰-铜盐-氧化法处理高浓度含砷废水的实验研究[J]. 环保科技, 2018, 24(3): 12-15.
[20] 郑雅杰, 罗 园, 王 勇. 采用含砷废水沉淀还原法制备三氧化二砷[J]. 中南大学学报(自然科学版), 2009, 40(1): 52-58.
[21] 叶恒朋, 杜亚光, 严立爽. 三氯化铁除砷的工艺研究[J]. 化学与生物工程, 2012, 29(9): 72-74.
[22] 李 娜, 孙竹梅, 阮福辉, 等. 三氯化铁除砷(Ⅲ)机理[J]. 化工学报, 2012, 63(7): 2224-2228.
[24] 刘 璟, 黄 晰, 谌 书, 等. 人工合成图水羟砷铁矾的矿物学研究[J]. 岩石矿物学杂志, 2012, 31(6): 901-906.
[25] 刘辉利, 梁美娜, 朱义年, 等. 氢氧化铁对砷的吸附与沉淀机理[J]. 环境科学学报, 2009, 29(5): 1011-1020.
[26] 李小亮, 张丹妮, 王少锋, 等. 铁砷共沉淀中的硫酸钙对砷固定作用[J]. 生态学杂志, 2014, 33(10): 2803-2809.
[27] 陈晓娟, 杨柳春, 陈曲仙, 等. 脱硫石膏重结晶法制备硫酸钙晶须及其除砷性能初探[J]. 人工晶体学报, 2013, 42(9): 1889-1895.


