文章编号:1004-0609(2016)-10-2230-08
几种酸在废弃脱硝催化剂中提钒效果的比较
李力成1,王 磊1,赵学娟2,钱 祺1,宋珊珊1,李小保1
(1. 南京林业大学 化学工程学院,南京 210037;
2. 南京工程学院 材料工程学院,南京 211167)
摘 要:
对比盐酸、硫酸、硝酸和草酸等几种常规酸对废弃脱硝催化剂活性组分五氧化二钒(V2O5)的提取效果,并考察酸的种类、浓度以及提钒温度对提钒效果的影响。结果表明:盐酸的提钒效果最佳,可将V2O5含量降至0.191%(质量分数),几种酸的提钒效果由大到小的顺序依次为盐酸、草酸、硫酸、硝酸。其次,硫酸的浓度对其提钒量影响最大,浓硫酸的效果是稀硫酸的2.8倍;而处理温度则对草酸的提钒效果影响最为显著,室温下草酸较高温少提取58.4%的V2O5。Uv-vis结果显示:V2O5经盐酸、硫酸以及草酸提取后,在浸渍液中出现(VO)2+的低价钒离子,这有利于提升酸的提钒效果。此外,酸处理对样品的比表面积影响较为显著,经浓草酸处理比表面积可恢复至60.8 m2/g,相比原有废弃催化剂的提升39.6%。
关键词:
中图分类号:TQ09 文献标志码:A
截止到2015年,全国火电装机容量已达到13.6亿kW·h。而目前火电机组广泛使用的脱硝技术为选择性催化还原技术(Selective catalytic reduction,SCR),SCR系统中最关键的部件为催化剂,成本通常占脱硝装置总投资的30%~50%,一般电厂运行3年左右即需要更换新鲜脱硝催化剂[1]。按照蜂窝式SCR催化剂“2+1”的安装使用模式,从2014年开始将产生1.2×104 t/a SCR废催化剂,至2018年预计将达到3.8×104 t/a,其中包含约91%的TiO2、1% V2O5、8% WO3或MoO3。2014年8月环境保护部印发的《废烟气脱硝催化剂危险废物经营许可证审查指南》[2]明确将废烟气SCR催化剂列为危险废物,必须进行无害化处理。由于催化剂中活性组分V2O5是一类剧毒金属氧化物,故降低V2O5的含量成为SCR催化剂无害化处理的关键[3]。
目前,国内各大科研院所已开展大量关于废弃脱硝催化剂中V2O5回收的研究工作。大部分工作选择 向催化剂体系中引入碱土金属,通过高温焙烧使碱土金属与氧化钒生成可溶性盐,再进一步溶解实现提钒。常用的碱土金属有Na2CO3、NaOH和CaCO3等[4-6],也有研究者选用KOH亚熔盐来提钒[7]。然而SCR反应是典型的酸催化反应,引入碱土金属易使SCR催化剂中毒失活[8],且通过碱法回收后的氧化钛也难以重新作为催化剂的载体。相比之下,用酸液浸渍催化剂提钒的工艺无需考虑上述问题,但目前针对酸法处理废弃SCR催化剂的研究报道较少。
因此,本文作者对比了盐酸、硫酸、硝酸和草酸(H2C2O4)等几种常用酸对废弃脱硝催化剂中V2O5的提取效果,初步考察了这几种酸的浓度、处理温度对提钒的影响,通过XRD、BET、FESEM等结构表征手段考察酸处理对样品晶相结构和孔结构的影响,借助XRF、Uv-vis和FT-IR等仪器对比分析几种酸的钒提取效果。
1 实验
1.1 实验原料
实验主要原料为某电厂废弃V2O5-WO3/TiO2脱硝催化剂(比表面积约为43.6 m2/g,锐钛矿),盐酸(南京化学试剂有限公司生产,38%,分析纯),硫酸(南京化学试剂有限公司生产,98%,分析纯),硝酸(永华化学科技有限公司生产,68%,分析纯),草酸(上海凌峰化学试剂有限公司生产,99.5%,分析纯)。
1.2 钒回收过程
采用盐酸、硫酸、草酸和硝酸对催化剂进行浸渍处理。首先将废弃脱硝催化剂破碎处理,得到废弃催化剂粉末样品(250~425 μm)。取2 g样品在室温下与50 mL酸液混合,其中草酸按室温下饱和浓度配制。搅拌12 h后通过离心除去酸液,洗至中性后烘干得提钒后样品。
将上述浓酸按体积比1:20进行稀释,稀释后的酸液同样用来浸渍粉末样品,反应12 h后离心除去酸液,洗涤干燥得稀酸处理的样品。
对于在高温下的V2O5提取实验,将待测试样和不同浓度的酸液混合,80 ℃时在均相反应器中高温溶解12 h,后冷却得到提钒回收液。再经一系列洗涤干燥得高温提钒后的样品。
1.3 样品表征
催化剂样品的表征方式如下:采用德国Bruker公司生产的D8 Adavance型X射线衍射仪(XRD)检测催化剂的晶体结构,检测电流为30 mA,电压40 kV,扫描范围5°~60°,扫描步长0.05 (°)/step,扫描速率0.2 s/step;样品的比表面积、孔分布和孔容采用美国Micromertics公司生产的TristarII 3020M比表面孔隙吸附测定仪分析,温度77 K,通过BET方程和BJH模型计算得到样品的比表面积、孔容和孔径等数据;采用美国Thermo Electron公司生产的Nicolet-360型FTIR光谱仪测试催化剂的傅立叶变换红外光谱(FT-IR),KBr压片,分辨率0.9 cm-1;利用日本株式会社JSM-7600F型场发射扫描电子显微镜对催化剂的微观形貌进行观察,分析催化剂酸处理前后表面物理性质的差异;利用瑞士ARL公司生产的ADVANTXP 型X射线荧光光谱仪(XRF)分析测定催化剂样品中钒的含量;紫外-可见光谱分析则使用UNICO公司生产的UV-28型紫外可见分光光度计,扫描范围200~1100 nm,扫描精度1 nm。
2 结果与讨论
2.1 酸处理对样品结构的影响
通过XRD考察酸处理对样品晶相结构的影响,分析结果如图1所示。经过不同酸处理的样品和废弃脱硝催化剂原样均在2θ=25.26°附近出现一个强衍射峰,该峰对应于TiO2的(101)晶面;同时,在较高角度37.94°、48.14°、53.98°和55.06°处均产生衍射峰,峰位与标准PDF卡(JCPDS 21-1272)一致,皆归因于锐钛矿型TiO2的特征衍射峰[9]。另外,从谱图上未观察到V2O5和WO3两种物质的特征峰,表明V2O5和WO3在催化剂上分散性良好,酸处理对二者的分散度影响不大[10]。所有样品的XRD谱也未出现金红石型TiO2的特征衍射峰,表明样品中的TiO2在提钒过程中未发生从锐钛矿晶型向金红石晶型的转变,经不同酸液处理后,仍然能够保持良好的锐钛矿晶型。
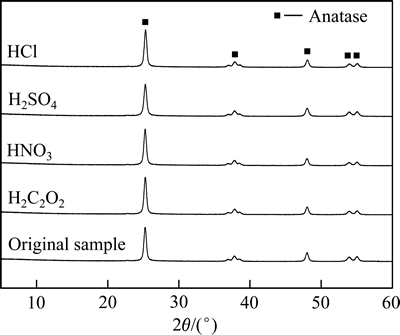
图1 废弃脱硝催化剂及经过不同酸处理后样品的XRD谱
Fig. 1 X-ray diffraction patterns of different samples
通过Scherrer公式进一步分析各样品的晶粒尺 寸[11],结果如表1所列。废弃脱硝催化剂的晶粒尺寸为19.9 nm,经盐酸、草酸和硝酸处理后,样品的TiO2晶粒尺寸均维持在(19.0±0.2) nm左右。而在高温条件下经浓硫酸处理的催化剂,TiO2晶粒尺寸略有减小,为17.4 nm,这可能与部分TiO2被浓硫酸溶解有关[12]。所以,比较样品的晶型以及晶粒尺寸等参数也不难发现酸处理对废弃脱硝催化剂的晶相结构影响较小。
比表面积、孔容以及孔径也是影响SCR催化剂活性的重要指标[13],图2和3所示分别为提钒后样品的氮气吸附-脱附等温曲线和孔径分布图。从图中可以看出,5组样品的吸脱附曲线均为V型,滞后环的起始压力p/p0在0.8~0.9之间,此外在孔径分布图中最可几孔径为19.8 nm,故推测样品中大部分孔道为介孔,且分布较为均一;滞后环为H4型,可推断无论是废弃催化剂还是酸浸渍后的样品均包含因层状结构而产生的狭缝孔[14]。孔道结构方面,样品经不同酸液处理后的吸脱附曲线基本一致,证明几组样品的孔结构比较类似,也可说明酸处理过程不会改变样品孔道的整体结构。
此外,由孔径分布图可以发现,酸处理后样品中10 nm以上孔道的比例不会改变,2 nm以下微孔数量会部分增加,其中硫酸浸渍后样品的微孔恢复程度最为显著。从孔径分布还可看出,5组样品的孔道总数较为接近,由吸脱附曲线也可得出类似结论。
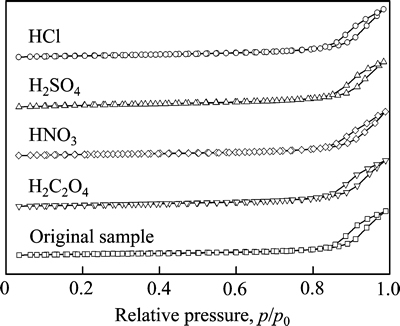
图2 不同样品酸处理后的氮气吸附-脱附等温曲线
Fig. 2 Nitrogen adsorption-desorption isotherms of different samples

图3 废弃催化剂与酸处理后的样品孔径分布曲线
Fig. 3 Pore size distribution of different samples
由表1进一步定量分析不同酸以及不同处理条件对样品结构的影响。发现与废弃脱硝催化剂相比,酸处理后样品的比表面积均明显提升:其中经盐酸、硫酸和草酸3种酸处理后其表面积均达到50 m2/g以上,高于原来废弃SCR催化剂的43.6 m2/g[15]。并且,在高温条件下经浓草酸浸渍后的样品比表面积可达 60.8 m2/g,相比废弃催化剂提升39.5%,比表面积的增加也有利于其后续的再次回收利用[16]。此外,酸处理对样品的孔容和孔径也均有改善,样品的孔容经盐酸浸渍后由0.23 m3/g扩大至0.25 m3/g。所有样品比表面积的提升除了因为活性物质—V2O5等发生溶解外,也可能与孔道中沉积的化合物发生溶解有关,包括易使SCR催化剂中毒的NH4HSO4[17]。有研究发现[18],脱硝过程中产生的NH4HSO4固体使催化剂失活的同时也会引起催化剂堵孔。而酸液尤其是高浓度的盐酸和硫酸,则可以使堵孔的铵盐发生溶解;同时,样品内部微孔中较难溶解的铵盐经高温浓酸处理后可能会加速溶解,样品的比表面积也会随之增加。此外,脱硝催化剂在运行过程中还会受到CaSO4、Ca3Mg(SiO4)2、CaCO3以及飞灰等影响,而这些物质在酸中发生溶解也可能是比表面积增加的原因[19-20]。
表1 废弃脱硝催化剂和经不同酸处理的脱硝催化剂样品的结构信息
Table 1 Structure data of waste deNOx catalyst and samples with different acid treatments
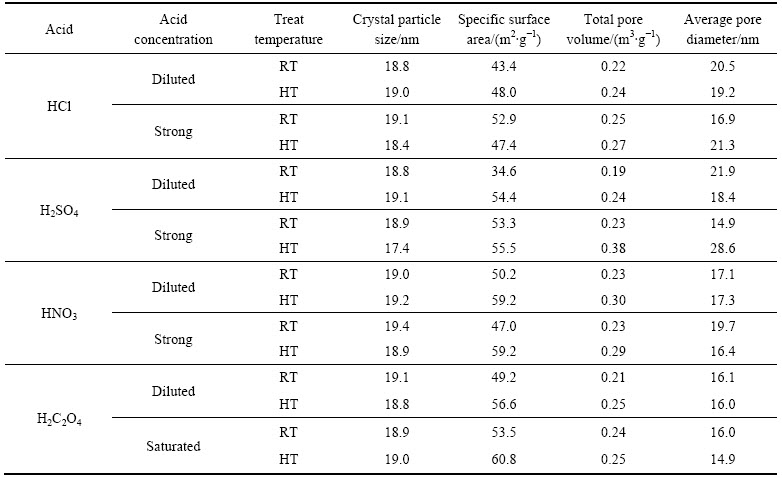

图4 样品处理前后的微观形貌
Fig. 4 SEM images of different samples
进一步比较样品的微观形貌,如图4(a)所示,废弃催化剂的表面粒子结合较为紧密,难以观察到颗粒间的缝隙。可能是由于催化剂在使用过程中,熔融的NH4HSO4等物质附着在催化剂表面,造成催化剂大部分孔道堵塞,因而钒氧化物无法发挥其催化活性。而经酸处理后的样品颗粒分散性增加(见图4(b)~(e)),与BET结果类似,说明酸处理可去除样品中大部分的可溶性盐,使样品的孔道恢复。
2.2 酸种类对提钒效果的影响
提钒的关键是提高钒化合物在酸液中的溶解度,故对酸的种类、酸的浓度以及浸渍温度这三种因素对提钒效果的影响进行分析讨论。
废弃催化剂在高温下经浓酸浸渍后其V2O5含量显著降低,结果如图5所示。对比发现经盐酸处理的样品中V2O5含量最低,仅为0.191%(质量分数),浓盐酸可除去样品中约72.9%的V2O5。盐酸提钒的方程式如下:
V2O5+6HCl+7H2O=2[VO(H2O)5]Cl2+Cl2↑ (1)
硫酸的提钒量与盐酸相比略为降低,约为64.4%。草酸具有一定的还原性,样品中近67.3%的V2O5被提取。草酸提钒的方程式可以表示为
2VO2++H2C2O4+2H+→2VO2++2CO2↑ +2H2O (2)
而硝酸的提钒量仅为34.9%,钒提取效果最差。
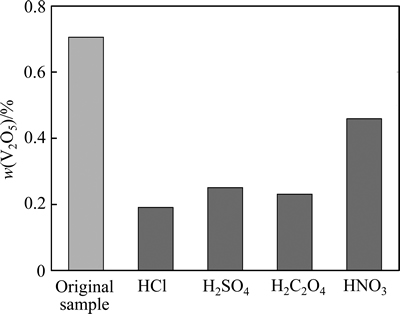
图5 不同酸种类提钒效果的比较
Fig. 5 Comparison in vanadium extraction performance of different acids
2.3 酸浓度对提钒效果的影响
上述结果为高温浓酸条件下获得的实验结果,继续考察低浓度酸的钒提取情况,各种酸稀释后的提钒效果如图6所示。稀释后的盐酸提钒量较浓盐酸显著下降,稀盐酸的提钒量为19.3%,提钒效率仅为浓盐酸的33.3%。而稀硫酸的提钒量较稀盐酸更低,仅为13.7%,提取效率为浓硫酸的26%。有研究指出,在稀硫酸的浸渍下,V2O5可能部分生成难溶的(VO2)2SO4,因而提钒量下降明显[21]。稀、浓硫酸的反应式如下:
V2O5+H2SO4(稀)=(VO2)2SO4+H2O (3)
2V2O5+4H2SO4(浓)=4(VO)SO4+4H2O+O2↑ (4)
相比之下,浓度对草酸的提钒效果影响不大。草酸稀释后拥有最佳的提钒效果,可提取样品中57.2%的V2O5,提钒量为浓草酸的82%,显著优于其他几种稀酸的提钒效果。此外,经稀释后的稀硝酸的提钒量仅次于草酸,可提取19.7%的钒氧化物。硝酸的浓度对其沉钒效果影响同样较小,但无论是浓硝酸或稀硝酸,其对V2O5的提取量均低于草酸的。
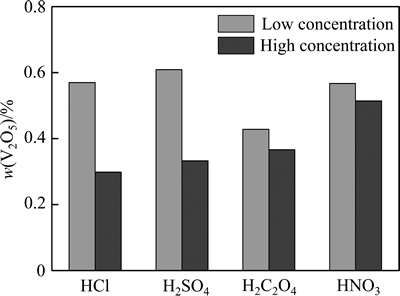
图6 酸浓度对钒提取效果的影响
Fig. 6 Effect of acid concentration on vanadium extraction performance
2.4 回收温度对提钒效果的影响
最后,考察回收温度对V2O5的提取量的影响,发现温度降低后钒组分的溶解度也随之降低[22]。图7所示为不同温度下V2O5的提取情况,由图7可知,室温下盐酸的提钒效果仍为最佳,样品酸溶后仅包含0.298%的V2O5。温度对硫酸的提钒效果影响不大,室温下可回收52.8%的V2O5,提钒量较高温降低32.7%。相比之下,温度对V2O5在草酸中的溶解度的影响最为显著,较高温少回收58.4%的V2O5。这可能是室温条件下被还原的V5+减少,溶解度便大幅降低。温度对硝酸提钒效果的影响较小,室温条件下仅比高温少回收15.6%的V2O5。
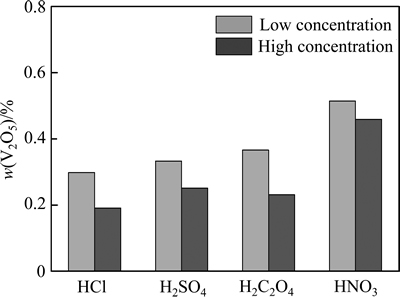
图7 温度对钒提取效果的影响
Fig. 7 Effect of temperature on vanadium extraction performance
2.5 酸法提钒机理分析
图8所示为催化剂酸处理前后的红外光谱。由图8可知,所有催化剂样品均在1020 cm-1附近出现特征峰,推测为V5+=O的特征峰[23];废弃催化剂的峰强度较高,酸洗后的样品的特征峰很弱,说明样品中活性组分V2O5的含量在减少,钒化合物经酸洗可能会向易溶的(VO)2+转变[24]。
浓盐酸较高的提钒率可能与其强配位能力有关。强配位能力使钒的价态降低,生成微溶的[VO(H2O)5]Cl2,在酸液中以(VO)2+的形式存在。此时可观察到提取液变为浅绿色,如图9所示,在分光光度计上722 nm处产生强烈的吸收[25]。对于硫酸同样较好的提钒效果,KHODAYARI等[26]认为V2O5酸浸后形成可溶的VOSO4为主要原因。从式(2)可知,草酸的还原性使得大部分V2O5被还原为(VO)2+,溶解性因而增加。浸渍液转变为蓝色也可证明这一结论,此时可见光吸收波长为795 nm[27]。草酸良好的溶钒效果也可能由于当其与过渡金属钒结合时,形成可溶性的络合物。与其他酸相比,硝酸的强氧化性使钒保持难溶的高价态,高温浸渍也很难改善硝酸的钒提取效果[28]。所以,在提钒过程中,V2O5与某些强酸溶液反应易形成可溶的(VO)2+,难溶的V5+被还原为V4+,钒化合物的溶解度相应提高[29]。同时,浸渍体系的颜色会发生改变,也可进一步验证V2O5与不同的酸反应生成价态不同的化合物[30]。
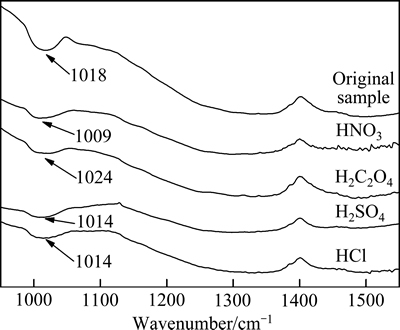
图8 处理前后样品的红外光谱
Fig. 8 FT-IR spectra of different catalyst samples
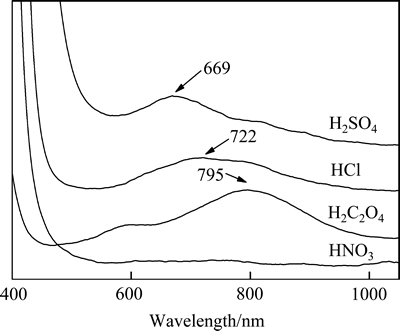
图9 浸渍液的紫外可见吸收光谱
Fig. 9 Uv-vis spectra of extraction solution in corresponding acid
3 结论
1) 几种酸对废弃脱硝催化剂的晶型结构影响较小,即使在高温下经浓酸处理后的样品依旧保持原有的锐钛矿型TiO2,晶粒尺寸也未发生任何改变。酸处理后催化剂的比表面积显著提升,其中草酸浸渍后催化剂的比表面积恢复最为显著,水热条件下可恢复至60.8 m2/g,相比废弃催化剂提升39.5%。
2) 不同种类的酸液提钒量也有所差别,浓盐酸在高温下可除去样品中约72.9%的V2O5,提钒效果最佳,其次为草酸、硫酸和硝酸。酸处理浓度对硫酸的提钒影响最大,较稀硫酸可使提钒效果提升2.8倍;温度下降各种酸的提钒量均显著降低,尤其是对草酸而言,室温浸渍时较高温少回收58.4%的V2O5。
3) Uv-vis结果显示,提钒过程中,V2O5在强酸溶液中易形成可溶的(VO)2+,难溶的V5+被还原为V4+,此为钒化合物溶解度增加的主要原因。
REFERENCES
[1] KRISHNAN A T, BOEHMAN A L. Selective catalytic reduction of nitric oxide with ammonia at low temperatures[J]. Applied Catalysis B (Environmental), 1998, 18(3): 189-198.
[2] 中华人民共和国环境保护部. 关于发布《废烟气脱硝催化剂危险废物经营许可证审查指南》的公告[EB/OL]. http://www.zhb.gov.cn/gkml/hbb/bgg/201408/t20140825_288180.htm. [2014-08-19].
Ministry of Environmental Protection of the People’s Republic of China. Announcement on release “Review guide about hazardous waste operating license on waste flue gas deNOx catalyst”[EB/OL]. http://www.zhb.gov.cn/gkml/hbb/bgg/201408/ t20140825_288180.htm. [2014-08-19].
[3] 曾 瑞. 有关我国 SCR 废催化剂回收产业的思考[J]. 中国环保产业, 2013(4): 55-61.
ZENG Rui. Consideration on reclaiming industry of SCR waste catalyzer in China[J]. China Environmental Protection Industry, 2013(4): 55-61.
[4] 朱 跃, 何 胜, 张 扬. 从废烟气脱硝催化剂中回收金属氧化物的方法: 中国, 101921916A[P]. 2010-12-22.
ZHU Yue, HE Sheng, ZHANG Yang. A method to recycle oxide metal from waste flue gas denitration catalyst: CN, 101921916A[P]. 2010-12-22.
[5] 路光杰, 汪德志, 肖雨亭, 杨建辉, 梅 雪, 欧阳丽华, 张 弘. 一种利用废弃SCR催化剂回收液再生脱硝催化剂的方法: 中国, 103846112A[P]. 2014-06-11.
LU Guang-jie, WANG De-zhi, XIAO Yu-ting, YANG Jian-hui, MEI Xue, OUYANG Li-hua, ZHANG Hong. A method to regenerate denitration catalyst by using waste SCR catalyst regeneration liquid: CN, 103846112A[P]. 2014-06-11.
[6] 霍怡廷, 常志东, 董 彬, 李文军. 一种SCR废烟气脱硝催化剂的回收方法: 中国, 103526031A [P]. 2014-01-22.
HUO Yi-ting, CHANG Zhi-dong, DONG Bin, LI Wen-jun. A method to recycle waste flue gas denitration catalyst: CN, 103526031A[P]. 2014-01-22.
[7] 刘挥彬, 杜 浩, 刘 彪, 王少娜, 郑诗礼, 张 懿. KOH 亚熔盐中钒渣的溶出行为[J]. 中国有色金属学报, 2013, 23(4): 1129-1139.
LIU Hui-bin, DU Hao, LIU Biao, WANG Shao-na, ZHENG Shi-li, ZHANG Yi. Dissolution behavior of vanadium slag in KOH sub-molten salt[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(4): 1129-1139.
[8] SVACHULA J, FERLAZZO N, FORZATTI P, TRONCONI E, BREGANI F. Selective reduction of nitrogen oxides (NOx) by ammonia over honeycomb selective catalytic reduction catalysts[J]. Industrial & Engineering Chemistry Research, 1993, 32(6): 1053-60.
[9] 商雪松, 陈进生, 赵金平, 张福旺, 徐 亚, 徐 琪. SCR 脱硝催化剂失活及其原因研究[J]. 燃料化学学报, 2011, 39(06): 465-370.
SHANG Xue-song, CHEN Jin-sheng, ZHAO Jin-ping, ZHANG Fu-wang, XU Ya, XU Qi. Discussion on the deactivation of SCR denitrification catalyst and its reasons[J]. Journal of Fuel Chemistry and Technology, 2011, 39(6): 465-370.
[10] OZKAN U S, CAI Y, KUMTHEKAR M W. Mechanistic studies of selective catalytic reduction of nitric oxide with ammonia over V2O5/TiO2 (anatase) catalysts through transient isotopic labeling at steady state[J]. The Journal of Physical Chemistry, 1995, 99(8): 2363-2371.
[11] SPURR R A, MYERS H. Quantitative analysis of anatase-rutile mixtures with an X-ray diffractometer[J]. Analytical Chemistry, 1957, 29(5): 760-762.
[12]  , MOJUMDAR S. Thermal stability of Li2O-SiO2-TiO2 gels evaluated by the induction period of crystallization[J]. Journal of Thermal Analysis and Calorimetry, 2010, 100(3): 817-820.
, MOJUMDAR S. Thermal stability of Li2O-SiO2-TiO2 gels evaluated by the induction period of crystallization[J]. Journal of Thermal Analysis and Calorimetry, 2010, 100(3): 817-820.
[13] KIM Y J, KWON H J, NAM I S, CHOUNG J W, KIL J K, KIM H J, CHA M S, YEO G K. High deNOx performance of Mn/TiO2 catalyst by NH3[J]. Catalysis Today, 2010, 151(3): 244-250.
[14] ROUQUEROL J, AVNIR D, FAIRBRIDGE C, EVERETT D, HAYNES J, PERNICONE N, RAMSAY J, SING K, UNGER K. Recommendations for the characterization of porous solids (Technical Report)[J]. Pure and Applied Chemistry, 1994, 66(8): 1739-1758.
[15] CHOO S T, LEE Y G, NAM I S, HAM S W, LEE J B. Characteristics of V2O5 supported on sulfated TiO2 for selective catalytic reduction of NO by NH3[J]. Applied Catalysis A (General), 2000, 200(1): 177-188.
[16] XU H D, QIU C T, ZHANG Q L, LIN T, GONG M C, CHEN Y Q. Influence of Tungsten Oxide on selective catalytic reduction of NOx with NH3 over MnOx-CeO2/ZrO2-TiO2 monolith catalyst[J]. Acta Physico-Chimica Sinica, 2010, 26(9): 2449-2454.
[17] PRITCHARD S, DIFRANCESCO C, KANEKO S, KOBAYASHI N, SUYAMA K, LIDA K. Optimizing SCR catalyst design and performance for coal-fired boilers[C]// EPA/EPRI Joint Symposium on Stationary Combustion NOx Control, 1995.
[18] LI P, LIU Q, LIU Z. Behaviors of NH4HSO4 in SCR of NO by NH3 over different cokes[J]. Chemical Engineering Journal, 2012, 181: 169-173.
[19] SMOOT L D. Fundamentals of coal combustion for clean and efficient use[J]. Coal Science and Technology, 1993, 20: 191.
[20] YONGYANG D, YING C. Study on Mid-temperature SCR deNOx catalyst under high SO2 and CaO[M]//Electrostatic Precipitation. Berlin Heidelberg: Electrostatic Precipitation, 2009: 606-610.
[21] LEE J B, KIM S K, KIM D W, KIM K H, CHUN S N, HUR K B, JEONG S M. Effect of H2SO4 concentration in washing solution on regeneration of commercial selective catalytic reduction catalyst[J]. Korean Journal of Chemical Engineering, 2012, 29(2): 270-276.
[22] LI Q, LIU Z, LIU Q. Kinetics of vanadium leaching from a spent industrial V2O5/TiO2 catalyst by sulfuric acid[J]. Industrial & Engineering Chemistry Research, 2014, 53(8): 2956-2962.
[23] FREDERICKSON L D Jr, HAUSEN D. Infrared Spectra-Structure correlation study of vanadium oxygen compounds[J]. Analytical Chemistry, 1963, 35(7): 818-827.
[24] 张家靓, 赵中伟. W(Ⅵ)-V(Ⅴ)-H2O体系钨钒分离的热力学分析[J]. 中国有色金属学报, 2014, 24(6): 1656-1662.
ZHANG Jia-liang, ZHAO Zhong-wei. Thermodynamic analysis for separation of tungsten and vanadium in W(Ⅵ)-V(Ⅴ)-H2O system[J]. The Chinese Journal of Nonferrous Metals, 2014, 24(6): 1656-1662.
[25] ECONOMIDIS N V,  , SMIRNIOTIS P G. Comparison of TiO2-based oxide catalysts for the selective catalytic reduction of NO: Effect of aging the vanadium precursor solution[J]. Applied Catalysis B (Environmental), 1999, 23(2): 123-134.
, SMIRNIOTIS P G. Comparison of TiO2-based oxide catalysts for the selective catalytic reduction of NO: Effect of aging the vanadium precursor solution[J]. Applied Catalysis B (Environmental), 1999, 23(2): 123-134.
[26] KHODAYARI R, ODENBRAND C I. Regeneration of commercial TiO2-V2O5-WO3 SCR catalysts used in bio fuel plants[J]. Applied Catalysis B (Environmental), 2001, 30(1): 87-99.
[27] MAZUREK K. Recovery of vanadium, potassium and iron from a spent vanadium catalyst by oxalic acid solution leaching, precipitation and ion exchange processes[J]. Hydrometallurgy, 2013, 134: 26-31.
[28] HSU L Y, TENG H. Influence of thermal treatment on the catalytic activity of Cu-loaded carbons in NO reduction with NH3 and regeneration of the thermally deactivated catalysts[J]. Applied Catalysis B (Environmental), 2003, 42(1): 69-76.
[29] SELBIN J. The chemistry of oxovanadium (Ⅳ)[J]. Chemical Reviews, 1965, 65(2): 153-75.
[30] KOLTHOFF I M, MGHTINGALE E R. Voltammetric behavior of the iron (Ⅱ)-(Ⅲ) and cerium (Ⅲ)-(Ⅳ) couples in potentiometric titrations at constant current and amperometric titrations with two indicator electrodes[J]. Analytical Chimica Acta, 1957, 17: 329-338.
Comparison of effect of different acid treatments on vanadium extraction of waste deNOx catalyst
LI Li-cheng1, WANG Lei1, ZHAO Xue-juan2, QIAN Qi1, SONG Shan-shan1, LI Xiao-bao1
(1. College of Chemical Engineering, Nanjing Forestry University, Nanjing 210037, China;
2. College of Material Engineering, Nanjing Institute of Technology, Nanjing 211167, China)
Abstract: The effects of HCl, H2SO4, HNO3 and oxalic acid (H2C2O4) on the V2O5 extraction of waste deNOx catalyst were studied. The type of acid, acid concentration and treat temperature also have remarkable impacts on the effect reduce from high to low of reactant. The results show that V2O5 content can be reduced to 0.191% (mass fraction) with HCl treated. The order is HCl, H2C2O4, H2SO4 and HNO3. In addition, the V2O5 extraction performance of catalyst is susceptible to the concentration and temperature changes. The concentrated H2SO4 has 2.8 times V2O5 extraction performance than diluted one. Furthermore, the V2O5 extraction capability of H2C2O4 is decreased by 58.4% as temperature drops. Uv-vis results show that, V2O5 can be transformed into (VO)2+ ions by impregnating samples with HCl, H2SO4 and H2C2O4. The specific surface area can also be recovered to 60.8 m2/g after H2C2O4 extraction, with 39.6% increase compared with waste deNOx catalyst.
Key words: waste deNOx catalyst; acid; vanadium extraction; (VO)2+
Foundation item: Projects(21406118, 21136004, 91334202) supported by the National Natural Science Foundation of China; Project(YKJ201310) supported by the Startup Fund of Nanjing Institute of Technology China; Project(QKJA201401) supported by the Youth Key Funding of Nanjing Institute of Technology, China; Projects supported by the Priority Academic Program Development of Jiangsu Higher Education Institutions, China
Received date: 2015-12-04; Accepted date: 2016-04-05
Corresponding author: LI Li-cheng; Tel: +86-13655160109; E-mail: llc0024@yahoo.com
(编辑 龙怀中)
基金项目:国家自然科学基金资助项目(21406118,91434109,91334202);南京工程学院引进人才科研启动基金项目(YKJ201310);青年基金重点项目(OKJA201401);江苏高校优势学科建设工程资助项目
收稿日期:2015-12-04;修订日期:2016-04-05
通信作者:李力成,讲师,博士;电话:13655160109;E-mail: llc0024@yahoo.com
摘 要:对比盐酸、硫酸、硝酸和草酸等几种常规酸对废弃脱硝催化剂活性组分五氧化二钒(V2O5)的提取效果,并考察酸的种类、浓度以及提钒温度对提钒效果的影响。结果表明:盐酸的提钒效果最佳,可将V2O5含量降至0.191%(质量分数),几种酸的提钒效果由大到小的顺序依次为盐酸、草酸、硫酸、硝酸。其次,硫酸的浓度对其提钒量影响最大,浓硫酸的效果是稀硫酸的2.8倍;而处理温度则对草酸的提钒效果影响最为显著,室温下草酸较高温少提取58.4%的V2O5。Uv-vis结果显示:V2O5经盐酸、硫酸以及草酸提取后,在浸渍液中出现(VO)2+的低价钒离子,这有利于提升酸的提钒效果。此外,酸处理对样品的比表面积影响较为显著,经浓草酸处理比表面积可恢复至60.8 m2/g,相比原有废弃催化剂的提升39.6%。
[3] 曾 瑞. 有关我国 SCR 废催化剂回收产业的思考[J]. 中国环保产业, 2013(4): 55-61.
[4] 朱 跃, 何 胜, 张 扬. 从废烟气脱硝催化剂中回收金属氧化物的方法: 中国, 101921916A[P]. 2010-12-22.
[5] 路光杰, 汪德志, 肖雨亭, 杨建辉, 梅 雪, 欧阳丽华, 张 弘. 一种利用废弃SCR催化剂回收液再生脱硝催化剂的方法: 中国, 103846112A[P]. 2014-06-11.
[6] 霍怡廷, 常志东, 董 彬, 李文军. 一种SCR废烟气脱硝催化剂的回收方法: 中国, 103526031A [P]. 2014-01-22.
[7] 刘挥彬, 杜 浩, 刘 彪, 王少娜, 郑诗礼, 张 懿. KOH 亚熔盐中钒渣的溶出行为[J]. 中国有色金属学报, 2013, 23(4): 1129-1139.
[9] 商雪松, 陈进生, 赵金平, 张福旺, 徐 亚, 徐 琪. SCR 脱硝催化剂失活及其原因研究[J]. 燃料化学学报, 2011, 39(06): 465-370.
[24] 张家靓, 赵中伟. W(Ⅵ)-V(Ⅴ)-H2O体系钨钒分离的热力学分析[J]. 中国有色金属学报, 2014, 24(6): 1656-1662.
[29] SELBIN J. The chemistry of oxovanadium (Ⅳ)[J]. Chemical Reviews, 1965, 65(2): 153-75.


