DOI: 10.11817/j.issn.1672-7207.2016.02.009
稳定性二氧化氯对水华微囊藻叶绿素a及酶活性的影响
陈淑芳1, 2,郭沛涌1, 3,阮滨1, 3
(1. 华侨大学 化工学院,环境科学与工程系,福建 厦门,361021;
2. 厦门市安兜自来水有限公司,福建 厦门,361021;
3. 华侨大学 环境与资源技术研究所,福建 厦门,361021)
摘 要:
化氯对水华微囊藻叶绿素a及酶活性的影响。研究结果表明:水华微囊藻叶绿素a的抑制率与稳定性二氧化氯的投加质量浓度成正相关性,当稳定性二氧化氯投加质量浓度为1.08 mg/L时对水华微囊藻叶绿素a抑制率超过51%。CAT酶活性随着稳定性二氧化氯投加质量浓度的增大而增加,当投加质量浓度为1.08 mg/L时,CAT酶活性是对照组的8.6倍,但SOD酶活性反而降低,同时膜脂过氧化产物和氧化胁迫的增加导致水华微囊藻丙二醛(MDA)值出现异常,表明稳定性二氧化氯对水华微囊藻具有很好的抑制效应。
关键词:
中图分类号:TQ085+.4 文献标志码:A 文章编号:1672-7207(2016)02-0414-06
Effects of stable chlorine dioxide on chlorophyll a and antioxiant enzymes of Microcystis flos-aquae.
Chen Shufang1, 2, Guo Peiyong1, 3, Ruan Bin1, 3
(1. Department of Environmental Science and Engineering,
College of Chemical Engineering, Huaqio University, Xiamen 361002, China;
2. Andou Water Limited, Xiamen 361021, China;
3. Institute of Environment and Resource technology, Huaqiao University, Xiamen 361021, China)
Abstract: The effects of stable chlorine dioxide (ClO2) on Cyanobacteria Microcystis flos-aquae were investigated by determining the chlorophyll a content and the activity of antioxidant enzymes. The results show that there is positive correlation between the inhibition rate of chlorophyll a content and the concentration of ClO2. The inhibition rate of chlorophyll a surpasses 51% at 1.08 mg/L. The catalase (CAT) activity increases with the increase of ClO2 concentrations, and is 8.6 times of the control at the concentration of 1.08 mg/L. However, the SOD activity decreases at 1.08 mg/L. At the same time, the increase of lipid peroxidation products and oxidative stress causes the malondialdehyde (MDA) content to become abnormal. The ClO2 has adverse effect on the growth of Microcystis flos-aquae.
Key words: stable chlorine dioxide (ClO2); Cyanobacteria Microcystis flos-aquae; chlorophyll a; activity of antioxidant enzymes
随着人们健康条件的改善,对生活饮用水水质的要求也越来越高,让人们喝上安全、放心的生活饮用水已成为社会关注的焦点之一。但由于大量的生活污水和工业废水直接排入水体,使我国的生活饮用水源地的21个湖库都存在着不同程度的富营养化[1]。研究表明,水体富营养化引起的藻类水华及其产生的藻毒素已对生活饮用水安全构成严重威胁[2],而且水中藻类也严重影响给水处理效果,如何去除藻类并防止藻类在各构筑物滋生已成为水厂亟待解决的问题[3]。目前,关于去除藻类方法的研究较多,其中一些具有较好去除效果的工艺复杂、成本高、操作困难,如:反渗透膜法、纳米光催化氧化法、活性污泥法、生物膜法等[4]。常用的化学消毒剂液氯由于氯化消毒后产生的副产物三卤甲烷(THMs)的含量显著升高对人体健康的影响也引起人们的关注[5],稳定性二氧化氯作为一种新型的消毒剂,由于二氧化氯消毒工艺具有操作简单、运行安全可靠、具有强氧化性和广谱性等特点,是世界卫生组织(WHO)和世界粮农组织(FAO)向全世界推荐的A1级安全、广谱和高效的食品级消毒剂[6]。目前,国内有一些供水企业也开始初探性的使用二氧化氯来预防与控制含藻类的水源水[7],但对二氧化氯抑藻机理中酶活性的研究较少。本文作者选取稳定性二氧化氯作为抑藻剂,分析稳定性二氧化氯对水华微囊藻叶绿素a含量、抗氧化酶活性、丙二醛(MDA)含量的影响,揭示其抑藻机制,以期对饮用水源中的水华微囊藻治理提供科学依据,同时也为供水企业除藻工艺优化提供参考。
1 材料与方法
1.1 实验材料
1) 稳定性二氧化氯杀菌剂:河北科技大学化工学院研制的速溶型二氧化氯泡腾片(质量分数为12%),每片质量为(1±0.1) g。
2) 水华微囊藻(Microcystis flos-aquae)购自中国科学院武汉水生生物研究所淡水藻种库(FACHB- 1028),采用培养基BG11培养。
1.2 实验方法
1.2.1 水华微囊藻培养
实验前,在1 L的锥形瓶中培养500 mL水华微囊藻,每100 mL培养基中加入藻液1 mL,置于气候箱中静置培养。培养约4 d后,待藻液颜色发绿,将藻分别接种于装有100 mL BG11 培养基的250 mL锥形瓶(已灭菌)中,进行扩大培养,培养条件为:温度25 ℃,光照强度3 000~4 000 lx,光暗比12 h:12 h。用8层的无菌纱布封口静置培养,每天定时摇瓶1次防止藻种沉淀。同时为减小各瓶的光通量差异,缩小实验误差,培养期间应随机调换各瓶位置,自第5天开始,每天同一时间进行镜检计数。
1.2.2 藻细胞密度的测定
采用血球计数板显微技术法测定藻细胞密度,并于680 nm波长下测定其吸光度,连续测定7 d,得到水华微囊藻的细胞密度(X=104 个/mL)与藻液光密度D680(Y)的关系曲线。关系曲线公式为Y=0.001 5X+ 0.027 7,线性相关系数R?=0.990 6,两者相关性较好,所以,每天定时定点测定藻液的光密度(D680)来反映藻的生长情况,如图1所示。
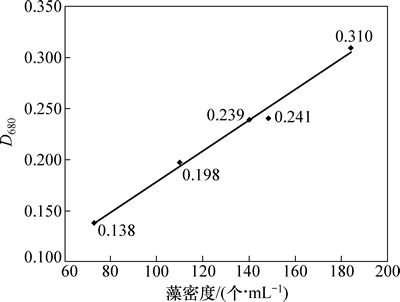
图1 水华微囊藻藻密度与吸光度关系曲线
Fig. 1 Blooms microcystin algae density and absorbance curve
1.2.3 叶绿素a质量浓度的测定
设定5组质量浓度梯度为:0.60,0.72,0.84,0.96和1.08 mg/L,并设空白对照一组,每组设定3个平行样。分别把不同质量浓度梯度稳定性二氧化氯直接投加到100 mL处于对数期第3天的藻液中(叶绿素a质量浓度为2 300 mg/L左右),立刻摇匀,并置于气候箱中培养,次日开始测定吸光度。实验开始后,每隔24 h,即在24,48,72和96 h时,从瓶中取样进行测定。持续观测4 d内抑制率的变化,确定稳定性二氧化氯长效抑藻的有效浓度。叶绿素a质量浓度采用浮游植物分析仪(Phyto-PAM)进行测定,测定方法参考文献[8]。抑制率为对照组叶绿素质量浓度减去处理组叶绿素质量浓度之差与对照组叶绿素质量浓度之比。
1.2.4 酶液的提取
ClO2处理4 d后,离心收集藻细胞,并迅速放入冰浴中,加入50 mmol/L磷酸缓冲液(pH=7.8),用超声细胞破碎仪破碎(功率500 W,温度设定为4 ℃),处理20 min后,在4 ℃下12 000 r/min离心15 min,上清液即为粗酶提取液,低温保存待用。取5 mL试管8支,6支为测定管,2支为对照管。
1.2.5 生理生化参数的测定
1) 超氧化物歧化酶(SOD)的测定。超氧化物歧化酶(SOD)活性的测定采用氮蓝四唑(NBT)染色法[9],略有修改。
2) 过氧化氢酶(CAT)的测定。过氧化氢酶(CAT)采用高锰酸钾滴定法测定[10]。
3) 脂质过氧化物丙二醛(MDA)量的测定。采用硫代巴比妥酸法(TBA)测定藻细胞中MDA含量[9],略有修改。
1.3 数据处理
数据采用SPSS18.0软件包进行统计分析,利用Origin8.0进行作图。抗氧化酶活性、丙二醛对照组与处理组采用单因素方差分析,叶绿素质量浓度采用重复测量方差分析。P<0.05表示有显著性差异,P<0.01表示有极显著性差异。
2 结果与分析
2.1 稳定性二氧化氯对水华微囊藻叶绿素a的影响
稳定性二氧化氯对水华微囊藻叶绿素a的影响如图2所示。由图2可见:不同质量浓度梯度的稳定性二氧化氯对水华微囊藻都有明显抑制作用,且其抑制率都保持在25%以上。随着稳定性二氧化氯投加质量浓度的增大,其对叶绿素a的抑制效率越高。当稳定性二氧化氯投加质量浓度为1.08 mg/L时,抑制率超过51%,但在48 h(第5 d)后其抑制率迅速下降,72 h后几乎没有抑制效果。说明稳定二氧化氯在24 h以内的抑制效果最佳,而且随着投加浓度的增大而增高,但由于稳定性二氧化氯见光极易分解,所以,48 h后其抑制率迅速降低。
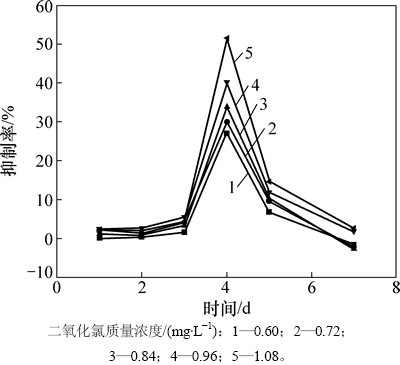
图2 稳定性二氧化氯对水华微囊藻叶绿素a的抑制情况
Fig. 2 Inhibition effect of stable chlorine dioxide on chlorophyll a of Microcystis flos-aquae
2.2 稳定性二氧化氯对水华微囊藻CAT活性的影响
稳定性二氧化氯投加质量浓度不同对水华微囊藻细胞CAT酶活性的影响如图 3所示。由图3可见:与空白对照组相比,随着稳定性二氧化氯投加质量浓度的增加,CAT酶活性也明显增加。当稳定性二氧化氯投加质量浓度为1.08 mg/L时,CAT酶活性是对照组的8.6倍,极显著上升(P<0.01),表明水华微囊藻细胞受到稳定性二氧化氯胁迫作用时,藻细胞内大量的活性氧自由基发生歧化反应后产生大量的过氧化氢(H2O2),藻细胞为了防止活性氧自由基产生的H2O2在细胞表面大量堆积,藻细胞内产生大量的过氧化氢酶(CAT)将H2O2分解成水和分子氧,清除H2O2对藻细胞的损害。说明过氧化氢酶(CAT)能够更稳定对外界环境的氧化胁迫做出反应。
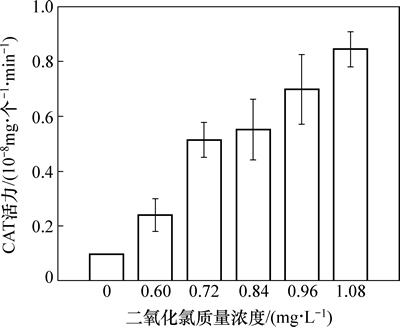
图3 稳定性二氧化氯对水华微囊藻CAT活性的影响
Fig. 3 Effects of stable chlorine dioxide on CAT activity of Microcystis flos-aquae
2.3 稳定性二氧化氯对水华微囊藻SOD活性的影响
稳定性二氧化氯对水华微囊藻超氧化物歧化酶(SOD)的影响如图4所示。由图4可见:当稳定性二氧化氯投加质量浓度为0.96 mg/L时,SOD活性最高,SOD酶活性是对照组的4.81倍,显著上升(P<0.05)。其他投加质量浓度(如0.60,0.72和0.84 mg/L)与对照组相比,其SOD酶活性也有增加。说明随着稳定性二氧化氯投加质量浓度的增大,藻细胞受到稳定性二氧化氯氧化胁迫作用后,细胞内部产生的活性氧超氧物阴离子自由基(O2—)迅速增加,藻细胞为了清除超氧物阴离子自由基对其氧化破坏,自身产生的超氧化物歧化酶(SOD)活性也增加了。但是当稳定性二氧化氯投加质量浓度增加到1.08 mg/L时,SOD酶活性反而降低了,表明SOD酶活性并不是可以无限增加,而是SOD酶的活性存在1个有限的阈值,即SOD酶对膜系统的保护作用是有一定限度的。稳定性二氧化氯投加质量浓度越高对超氧化物歧化酶(SOD)的影响越大,但高浓度稳定性二氧化氯影响细胞内活性氧超氧物阴离子自由基(O2—)浓度超出一定的阈值时,细胞不能及时将其清除,导致细胞损伤不能及时被修复,引起SOD酶活性降低[11]。说明了藻细胞内过量产生的活性氧自由基(O2—)导致整个抗氧化防御系统遭到破坏(表现为SOD活性的降低),进一步降低藻细胞活力。
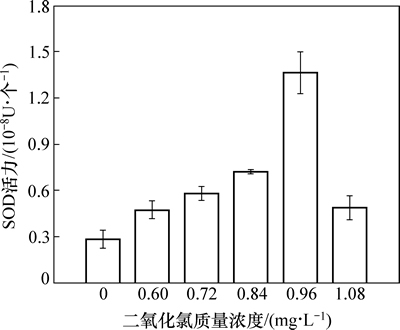
图4 稳定性二氧化氯对水华微囊藻SOD活性的影响
Fig. 4 Effects of stable chlorine dioxide on SOD activity of Microcystis flos-aquae
2.4 稳定性二氧化氯对水华微囊藻MDA的影响
稳定性二氧化氯对丙二醛(MDA)的影响如图5所示。由图5可见:MDA含量出现异常,且与稳定性二氧化氯投加质量浓度没有成正相关性。说明在稳定性二氧化氯的氧化胁迫作用下,水华微囊藻细胞内的活性氧自由基产生与清除的动态平衡失去了,导致藻细胞内的H2O2过度积累,引发藻细胞膜脂的过氧化作用,造成藻细胞膜系统和功能受到损伤,藻细胞膜通透性增加,干扰水华微囊藻细胞的呼吸、光合及生理代谢过程,导致细胞死亡[12],所以不同质量浓度梯度的稳定性二氧化氯与对照组相比变化并不显著(P>0.05)。当稳定性二氧化氯投加质量浓度增加到0.96 mg/L时,藻细胞内丙二醛(MDA)与对照相比反而减低了,说明藻细胞系统已经严重损伤,细胞膜功能已经破坏,导致影响和破坏藻细胞正常的生理功能,引起丙二醛(MDA)含量出现异常,而丙二醛(MDA)含量异常又进一步影响藻细胞体外的线粒体呼吸链复合和线粒体内关键酶活性,最后导致细胞死亡。另一方面,由于稳定性二氧化氯活化后自身能产生较多羟自由基、氧自由基等,这些自由基对藻细胞膜的破坏作用可能是引起藻细胞死亡的主要原因之一[13]。
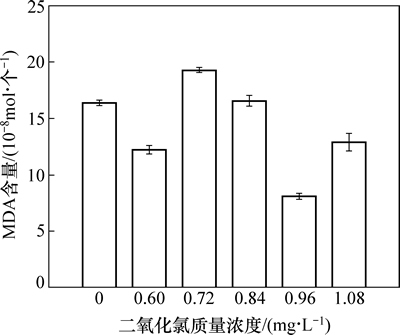
图5 稳定性二氧化氯对水华微囊藻MDA含量的影响
Fig. 5 Effects of stable chlorine dioxide on MDA content of Microcystis flos-aquae
3 讨论
3.1 稳定性二氧化氯对水华微囊藻叶绿素a的影响
叶绿素是植物进行光合作用的主要脂溶性色素,且叶绿素含量减少会导致光合作用受阻。由图2可见:随着稳定性二氧化氯投加质量浓度的增加,当稳定性二氧化氯投加质量浓度达到1.08 mg/L时,水华微囊藻中的叶绿素 a 含量显著下降(P<0.05),相应的其抑制率也达到最高值51%,而且所有投加质量浓度的稳定性二氧化氯均在24 h内的抑制率最佳,随后的48 h就迅速下降。这个结果与LIU等[14]实验中所用1.0 mg/L二氧化氯对叶绿素a作用在24 h内的杀灭率达到40%,24 h后叶绿素a含量开始上升的研究结果一致。稳定性二氧化氯投加质量浓度越高,对水华微囊藻细胞的氧化胁迫强度越大,造成叶绿素a的分解速度也就越快,导致叶绿素a含量下降也越明显,它的破坏与降解都会直接引起光合作用效率的下降[15]。另一方面,ClO2分子具有强氧化性,在水体中的电子结构呈不饱和状态,不以二聚或多聚状态存在,而是以自由基单体形式存在,有利于它在水中的扩散,且能透过藻细胞膜,氧化破坏叶绿素a,造成藻类色素脱色[16]。原因是水华微囊藻中叶绿素的基本骨架是卟吩,卟吩是由4个吡咯环的α-碳原子通过次甲基(—CH=)相连而成的共轭体系,吡咯环对氧化剂很敏感,而且强氧化剂ClO2对苯环具有一定的亲和性,叶绿素中的吡咯环与苯环类似,ClO2也同样能作用于吡咯环,ClO2把藻类中叶绿素的吡咯环氧化,使叶绿素的新陈代谢终止,造成蛋白质合成中断,导致藻类死亡[17]。由于二氧化氯见光极易分解,故48 h后其抑制率下降。
3.2 稳定性二氧化氯对水华微囊藻SOD和CAT的影响
在本实验中,水华微囊藻细胞受到稳定性二氧化氯强氧化性的胁迫时,藻细胞机体内为了避免大量的活性氧自由基发生歧化反应后产生大量的过氧化氢(H2O2)对机体的氧化损伤,为了清除过多的H2O2和活性氧自由基O2—,SOD作为一种抗氧化关键酶,其酶活性首先发生变化,SOD活性会应相应的升高,增强水华微囊藻细胞对活性氧自由基的清除能力,防止藻细胞免受活性氧自由基的氧化损伤[18]。SOD酶活性能将O2—歧化生产H2O2和O2,防止细胞膜系统过氧化作用的发生,其藻细胞体内的活性氧产生与清除是维持一个相对稳定的动态平衡。而且SOD随着稳定性二氧化氯投加质量浓度的增加而升高,当稳定性二氧化氯投加质量浓度达到0.96 mg/L时,SOD达到最高值。但当稳定性二氧化氯的投加质量浓度为1.08 mg/L时,藻细胞抗氧化系统的这种动态平衡遭到破坏,SOD活性会受到抑制,藻细胞体内的活性氧自由基过量积累,这些非常活跃活性氧自由基,会对水华微囊藻细胞膜系统产生很大的危害作用,最终会抑制其生长[19],最终导致藻细胞机体损伤或死亡,所以导致SOD活性下降了,因此,SOD活性是反映生物体对环境氧化胁迫适应程度的重要指标[20]。当藻细胞受到稳定性二氧化氯强氧化性的胁迫时,CAT(过氧化氢酶)活性也在不断升高,而且随着稳定性二氧化氯投加质量浓度的增加而增大。由于CAT是一种血红素蛋白,存在于所有的生物机体中,它能够催化H2O2分解为H2O和O2[21],使水华微囊藻细胞免受氧化损伤。当稳定性二氧化氯质量浓度为1.08 mg/L时,CAT酶活性是对照组的8.6倍,说明在抵御氧化胁迫方面,CAT 酶活性的作用更加重要和持久,而SOD对外界的胁迫响应更为敏感,其兴奋效应范围较CAT的窄。
3.3 稳定性二氧化氯对水华微囊藻MDA的影响
许多研究表明[22]:外界的氧化胁迫可以引起生物体内活性氧自由基的过度产生,对细胞膜产生氧化损伤。MDA(丙二醛)是细胞膜脂过氧化分解的最终产物之一,其含量能够反映细胞脂质过氧化强度和损伤程度[23]。藻细胞在稳定性二氧化氯的氧化胁迫下,活性氧自由基H2O2的毒害导致藻细胞发生膜脂过氧化作用,其产物丙二醛会严重损伤细胞膜系统,因此,丙二醛含量反映了膜脂过氧化的程度;另一方面活性氧自由基H2O2可能产生对DNA直接氧化损伤,导致细胞程序性死亡[24-25]。细胞膜是ClO2对藻细胞作用的初始位点,造成细胞膜系统和功能受到损伤,破坏细胞膜结构,使细胞膜渗透性增强,干扰细胞的生理代谢功能,导致细胞死亡[26]。在本实验中,MDA含量出现异常,且与稳定性二氧化氯投加质量浓度没有成正相关性,说明藻细胞受到氧化胁迫后,细胞结构和功能遭受伤害时机体作出的一种防护反应,由于活性氧自由基在体内大量积累,抗氧化体系酶不能及时清除过量的氧自由基时,导致抗氧化体系酶活性降低,造成了膜脂过氧化作用,导致MDA的含量异常,最终影响藻细胞正常的生理功能,导致藻细胞死亡。
4 结论
1) 稳定性二氧化氯具有强氧化性,当它作用于水华微囊藻时,叶绿素a的被抑制率与稳定性二氧化氯的投加质量浓度成正相关,而且在24 h内其抑制效果最佳。当稳定性二氧化氯投加质量浓度为1.08 mg/L时,对水华微囊藻抑制率超过51%。
2) CAT酶的活性随稳定性二氧化氯投加质量浓度的增大而增加,稳定性二氧化氯质量浓度为1.08 mg/L时,CAT酶活性是对照组的8.6倍。但SOD酶活性反而降低了,是说明SOD酶的活性存在一个阈值,对ClO2分子氧化胁迫更敏感,其兴奋效应范围较CAT的窄,而CAT酶对机体的防御更重要而且持久。
3) 由于氧化胁迫的增加导致细胞膜功能破坏,影响和破坏藻细胞正常的生理功能,导致丙二醛(MDA)含量出现异常。
参考文献:
[1] 中国环境监测总站.全国地表水水质月报[R]. 北京: 中国环境监测总站, 2009: 2-31.
China National Environmental Monitoring Centre. The National Surface Water Quality Monthly Report[R]. Beijing: China National Environmental Monitoring Centre, 2009: 2-31.
[2] 黄祖亚. 福建省饮用水源藻类危害态势及其对策研究[J]. 水利科技, 2011(1): 1-5.
HUANG Zuya. Drinking water algae hazard situation and countermeasures in fujian[J]. Water Conservancy Science and Technology, 2011(1): 1-5.
[3] 张勇, 陈文娟, 李雷. 二氧化氯预氧化对净水工艺的强化试验研究[J]. 山东建筑大学学报, 2009, 24(5): 407-410.
ZHANG Yong, CHEN Wenjuan, LI Lei. Experimental study on strengthening of chlorine dioxide preoxidation for conventional water purification process[J]. Journal of Shandong Jianzhu University, 2009, 24(5): 407-410.
[4] LEE D K, KIM S C, KIM S J, et al. Photocatalytic oxidation of Microcystin LR with TiO2-coated activated carbon[J]. Chen Eng J, 2004, 102(1): 93-98.
[5] 钟格梅, 唐振柱. 二氧化氯消毒饮用水的研究进展[J]. 环境与健康杂志, 2010, 27(8): 742-744.
ZHONG Gemei, TANG Zhenzhu. Progress on disinfection of drinking water with chlorine dioxide[J]. Journal of Environment and Health, 2010, 27(8): 742-744.
[6] 黄君礼. 水消毒剂和处理剂: 二氧化氯[M]. 北京: 化工出版社, 2010: 1-21.
HUANG Junli. Disinfectants and water treatment agent, chlorine dioxide[M]. Beijing: Chemical Industry Press, 2010: 1-21.
[7] 代园园, 员建, 苑宏英, 吴丽杰, 孙力平. 二氧化氯作为消毒剂在饮用水处理中的应用[J]. 净水技术, 2011, 30(1): 4-7.
DAI Yuanyuan, YUAN Jian, YUAN Hongying, et al. Application of chlorine dioxide disinfectant in drinking water treatment[J]. Water Purification Technology, 2011, 30(1): 4-7.
[8] HEINZ W G. Phytoplankton analyzer phyto-PAM and phyto-win software V1.45[M]. Effeltrich Germany: Heinz Walz GmbH, 2003: 1-123.
[9] 李合生, 孙群, 赵世杰, 等. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 167-261.
LI Hesheng, SUN Qun, ZHAO Shijie, et al. Plant physiological and biochemical principles and experimental techniques[M]. Beijing: Higher Education Press, 2000: 167-261.
[10] RAO M, PALIVATH G, ORMORD D. Influence of salicylic acid on H2O2 production, oxidative stress, and H2O2 -metabolizing enzymes[J]. Plant Physiol, 1997, 115: 137-149.
[11] HEJL A M, KOSTER K L. Juglone disrupts root plasma membrane H+-ATPase activity and impairs water uptake, root respiration, and growth in soybean (Glycine max) and corn (Zea mays)[J]. Journal of Chemical Ecology, 2004, 30(2): 453-471.
[12] ALAIZ M, HIDALGO F, ZAMORA R. Effect of pH and temperature on comparative antioxidant activity of nonenzymatically broened proteins produced by reaction with oxidized lipids and carbohydrates[J]. Journal of Agricultural and Food Chemistry, 1999, 47(2): 748-752.
[13] 陈春田, 李东力, 刘希真, 刘国平. 二氧化氯杀菌效果影响因素的研究[J]. 中国消毒学杂志, 2002, 19(4): 208-211.
CHEN Chuntian, LI Dongli, LIU Xizhen, et al. Study on factors influencing germicidal efficacy of chlorine dioxide[J]. Chinese Journal of Disinfection, 2002, 19(4): 208-211.
[14] 刘洁生, 杨维东, 张珩, 吴彦. 二氧化氯对球形棕囊藻叶绿素a、蛋白质、DNA含量的影响[J]. 热带亚热带植物学报, 2006, 14(5): 427-432.
LIU Jieshen, YANG Weidong, ZHENG Heng, et al. Effects of chlorine dioxide on contents of chlorophyll a, proteins and DNA in Phaeocystis Globosa[J]. Journal of Tropical and Subtropical Plants, 2006, 14(5): 427-432.
[15] 侯东颖, 冯佳, 谢树莲. 纳米二氧化钛胁迫对普生轮藻的毒性效应[J]. 环境科学学报, 2012, 32(6): 1481-1486.
HOU Dongying, FENG Jia, XIE Shulian. Nano titanium dioxide stress on relieving the toxicity effect of chara Vulgaris L[J]. Journal of Environmental Sciences, 2012, 32(6): 1481-1486.
[16] 王宁, 白敏冬, 黄桂兵, 高敏, 白希尧. 羟基对海洋微藻细胞叶绿素a的影响[J]. 大连海事大学学报, 2003, 29(4): 59-61.
WANG Ning, BAI Mindong, HUANG Guibing, et al. Effect of hydroxyl on Chl-a in algae cells[J]. Journal of Dalian Maritime University, 2003, 29(4): 59-61.
[17] 裴海燕, 胡文容, 丁国际, 刘培启. 二氧化氯杀藻特性研究[J]. 山东大学学报(工学版), 2004, 34(5): 107-108.
PEI Haiyan, HU Wenrong, DING Guoji, et al. The characters of algae-killing with chlorine dioxide[J]. Journal of Shandong University (Engineering Science), 2004, 34(5): 107-108.
[18] QIAN H F, XU X Y, CHEN W, et al. Allelochemical stress causes oxidative damage and inhibition of photosynthesis in chlorella vulgaris[J]. Chemosphere, 2009, 75(3): 368-375.
[19] 唐学玺, 李永祺. 抗氧化剂对扁藻久效磷毒害的抑制效应[J]. 环境科学, 2000, 21(1): 87-89.
TANG Xuexi, LI Yongqi. Inhibition of antioxidants on monocrotophos damage to Platymonassp sp.[J]. Chinese Journal of Environmental Science, 2000, 21(1): 87-89.
[20] 唐学玺, 张培玉. 蒽对黑鱼君超氧化物歧化酶活性的影响[J]. 水产学报, 2000, 24(3): 217-220.
TANG Xuexi, ZHANG Peiyu. Effects of anthracene on activity of superoxide dismutase in Sebastodes Fuscescens[J]. Journal of Fisheries of China, 2000, 24(3): 217-220.
[21] BO?OV? B, HUTTOV? J, LIPT?KOV? L', et al. Impact of short-term cadmium treatment on catalase and ascorbate peroxidase activities in barley root tips[J]. Biologia Plantarum, 2012, 56(4): 724-728.
[22] ELBAZ A, WEI Y, MENG Q, et al. Mercury-induced oxidative stress and impact on antioxidant enzymes in chlamydomonas reinhardtii[J]. Ecotoxicology, 2010, 19(7): 1285-1293.
[23] 秦洪伟, 陈柳芳, 鲁楠, 等. 氧氟沙星对斜生栅藻的毒性效应[J]. 环境化学, 2011, 30(4): 885-886.
QIN Hongwei, CHEN Liufang, LU Nan, et al. Ofloxacin on inclined scenedesmus toxicity effect[J]. Environmental Chemistry, 2011, 30(4): 885-886.
[24] DZIGA D, SUDA M, BIALCZYK J, et al. The alteration of Microcystis Aeruginasa biomass and dissolved microcystin-LR concertration following exposure to plant-producing phenols[J]. Environmental Toxicology, 2007, 22(4): 341-346.
[25] HALLIWELL B. Reactive species and antioxidants: redox biology is a fundamental theme of aerobic life[J]. Plant Physiology, 2006, 141(2): 312-322.
[26] BAXTER C J, REDESTIG H, SCHAUER N, et al. The metabolic response of heterotrophic arabidopsis cells to oxidative stress[J]. Plant Physiology, 2007, 143(1): 312-325.
(编辑 杨幼平)
收稿日期:2015-02-01;修回日期:2015-04-09
基金项目(Foundation item):国家自然科学基金资助项目(20777021);教育部科学技术研究重点项目(210253);福建省自然科学基金资助项目(2010J01043,D0610012,2014J01049);泉州市重点科技项目(2012Z85,2014Z110);晋江市重点科技项目(2013S002) (Project (20777021) supported by the National Natural Science Foundation of China; Project (210253) supported by the Key Research Project of Science and Technology of Ministry of Education; Projects (2010J01043, D0610012, 2014J01049) supported by the Natural Science Foundation of Fujian Province of China;Projects (2012Z85, 2014Z110) supported by the Science and Technology of Quanzhou City of China; Project (2013S002) supported by the Key Project of Science and Technology of Jinjiang City of China)
通信作者:郭沛涌,博士,教授,从事水污染防治研究;E-mail:guopeiyong@sina.com
摘要:研究稳定性二氧化氯对水华微囊藻叶绿素a及酶活性的影响。研究结果表明:水华微囊藻叶绿素a的抑制率与稳定性二氧化氯的投加质量浓度成正相关性,当稳定性二氧化氯投加质量浓度为1.08 mg/L时对水华微囊藻叶绿素a抑制率超过51%。CAT酶活性随着稳定性二氧化氯投加质量浓度的增大而增加,当投加质量浓度为1.08 mg/L时,CAT酶活性是对照组的8.6倍,但SOD酶活性反而降低,同时膜脂过氧化产物和氧化胁迫的增加导致水华微囊藻丙二醛(MDA)值出现异常,表明稳定性二氧化氯对水华微囊藻具有很好的抑制效应。
[1] 中国环境监测总站.全国地表水水质月报[R]. 北京: 中国环境监测总站, 2009: 2-31.
[2] 黄祖亚. 福建省饮用水源藻类危害态势及其对策研究[J]. 水利科技, 2011(1): 1-5.
[3] 张勇, 陈文娟, 李雷. 二氧化氯预氧化对净水工艺的强化试验研究[J]. 山东建筑大学学报, 2009, 24(5): 407-410.
[5] 钟格梅, 唐振柱. 二氧化氯消毒饮用水的研究进展[J]. 环境与健康杂志, 2010, 27(8): 742-744.
[6] 黄君礼. 水消毒剂和处理剂: 二氧化氯[M]. 北京: 化工出版社, 2010: 1-21.
[7] 代园园, 员建, 苑宏英, 吴丽杰, 孙力平. 二氧化氯作为消毒剂在饮用水处理中的应用[J]. 净水技术, 2011, 30(1): 4-7.
[9] 李合生, 孙群, 赵世杰, 等. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 167-261.
[13] 陈春田, 李东力, 刘希真, 刘国平. 二氧化氯杀菌效果影响因素的研究[J]. 中国消毒学杂志, 2002, 19(4): 208-211.
[14] 刘洁生, 杨维东, 张珩, 吴彦. 二氧化氯对球形棕囊藻叶绿素a、蛋白质、DNA含量的影响[J]. 热带亚热带植物学报, 2006, 14(5): 427-432.
[15] 侯东颖, 冯佳, 谢树莲. 纳米二氧化钛胁迫对普生轮藻的毒性效应[J]. 环境科学学报, 2012, 32(6): 1481-1486.
[16] 王宁, 白敏冬, 黄桂兵, 高敏, 白希尧. 羟基对海洋微藻细胞叶绿素a的影响[J]. 大连海事大学学报, 2003, 29(4): 59-61.
[17] 裴海燕, 胡文容, 丁国际, 刘培启. 二氧化氯杀藻特性研究[J]. 山东大学学报(工学版), 2004, 34(5): 107-108.
[19] 唐学玺, 李永祺. 抗氧化剂对扁藻久效磷毒害的抑制效应[J]. 环境科学, 2000, 21(1): 87-89.
[20] 唐学玺, 张培玉. 蒽对黑鱼君超氧化物歧化酶活性的影响[J]. 水产学报, 2000, 24(3): 217-220.
[23] 秦洪伟, 陈柳芳, 鲁楠, 等. 氧氟沙星对斜生栅藻的毒性效应[J]. 环境化学, 2011, 30(4): 885-886.


