DOI: 10.11817/j.issn.1672-7207.2019.08.005
小球藻生长及协同净化畜禽养殖废水研究
朱中强1, 2,何雪1, 2,薛梦婷1, 2,余冉1, 2
(1. 东南大学 能源与环境学院,江苏 南京,210096;
2. 东南大学 能源热转换及其过程测控教育部重点实验室,江苏 南京,210096)
摘 要:
在模拟畜禽养殖废水中的生长特性及其对高质量浓度有机物废水的协同净化效果,分析小球藻在自养/异养混合代谢生长模式下对有机与无机碳源的竞争利用策略以及外加无机碳源对小球藻生长与废水净化能力的影响规律。研究结果表明:在高质量浓度有机碳(化学需氧量质量浓度ρCOD为(1 172±22.5) mg/L)存在条件下,一定浓度的无机碳(0.1~1 μmoL/L)可以促进小球藻的生长及其对有机物的吸收,COD去除率可提高12.9% ~ 40.4%,同时小球藻合成积累油脂和叶绿素能力也得到提高,藻细胞内总叶绿素质量浓度高达(8.6±0.06) mg/L,单个藻细胞中油脂质量达(0.26±0.004) ng。但当无机碳源的浓度继续提高到2.1 mmoL/L时,小球藻的生长和废水有机碳利用速率明显受到抑制,小球藻的比生长速率下降(6.5±2.1)%,COD去除率只有(68.8±5.6)%,但对氮磷去除率影响不大,总氮、总磷、氨氮的去除率分别为(97.0±0.6)%,(86.8±3.8)%和100%。
关键词:高质量浓度有机物废水;小球藻;无机碳源;微藻生长;废水净化
中图分类号:X172 文献标志码:A 文章编号:1672-7207(2019)08-1795-07
Study of Chlorella vulgaris growth coupled with purification of livestock and poultry aquaculture wastewater
ZHU Zhongqiang1, 2, HE Xue1, 2, XUE Mengting1, 2, YU Ran1, 2
(1. School of Energy and Environment, Southeast University, Nanjing 210096, China;
2. Key Laboratory of Energy Thermal Conversion and Control of Ministry of Education,Southeast University, Nanjing 210096, China)
Abstract: To study the growth of Chlorella vulgaris and its role in purification of synthetic livestock wastewater whose high mass concentration of organic matter, the competition strategy of organic and inorganic carbon sources and the influence of inorganic carbon sources on the growth of C. vulgaris and wastewater treatment were analyzed. The results show that in condition of high mass concentration of organic matter (chemical oxygen demand mass concentration ρCOD is (1 172±22.5) mg/L), the growth of C. vulgaris and the removal efficiencies of nitrogen and phosphorus are promoted by the addition of 0.1-1.0 μmoL/L inorganic carbon. The COD removal efficiency increases by 12.9%~40.4%. Meanwhile, the mass concentration of lipid in C. vulgaris cell increases to (8.6±0.06) mg/L and the mass of oil in a single algal cell is (0.26±0.004) ng. However, when the inorganic source carbon concentration further increases to 2.1 mmol/L, the cell growth rate and the utilization efficiency of organic carbon are limited. The growth rate of C. vulgaris decreases by (6.5±2.1) %, and the COD removal efficiency is merely (68.8±5.6) %. In contrast, total nitrogen, total phosphorus and ammonia nitrogen removal efficiencies are significantly affected, which are (97.0±0.6)%,(86.8±3.8)% and 100%, respectively.
Key words: wastewater with high mass concentration of organic matter; Chlorella vulgaris; inorganic carbon; microalgae growth; wastewater purification
微藻是一种极其细小、肉眼不可见的自养植物,因其具有比一般植物更高的光合作用效率及更高的生物质产量,并且生长周期短、可适应复杂的生态条件(如盐碱地、沙漠等)[1-3],故在营养保健食品行业、医学领域、环境治理等方面应用广泛。微藻具有多种代谢途径,既可光合自养,也可化能异养,可混合代谢生长,并能在不同的培养条件下,通过改变其合成蛋白质、多糖、脂质的途径实现其自身增殖[4]。而微藻的混合代谢模式可帮助其利用废水中的有机物并减少其自养生长对光的依赖[5-6],从而同步实现废水净化与资源的有效利用。目前,微藻养殖种类主要包括小球藻、螺旋藻、栅藻,其中,小球藻生长速率快,固碳效率高,pH适应性广,因而,成为应用与研究的热点。人们对小球藻的废水养殖技术已有一定研究,在光照条件下,二氧化碳和废水中的有机物可协同促进小球藻的生长[7]。LU等[8]利用小球藻处理肉类加工废水,发现生长在混合废水中的小球藻的生物量比分别生长在单一废水和培养基中的高,达到0.68~1.54 g/L,此外,氨氮去除率(68.75%~80.3%)和总氮去除率(30.06%~50.94%)也有不同程度地提高。GE等[9]利用厌氧消化液分别自养、异养、混合培养小球藻,发现相比于其他2种培养模式,在混合模式下的小球藻具有更高的生长量((0.72±0.01) g/L)和更高质量浓度的叶绿素((14.2±0.1) g/L)及类胡罗素((12.9±0.4) g/L),并且氮磷污染物几乎全部去除。我国畜禽养殖业发展迅速,随之产生的畜禽养殖废水的有效处理问题受到广泛关注。目前,该类废水的典型处理工艺有水解-序批式活性污泥工艺(SBR)、氧化沟工艺等,但这些工艺都存在操作复杂、成本较高的缺点。然而,畜禽养殖废水具有氨氮浓度高、有机物浓度高的特点,其中部分有机物可用于回收再利用。虽然已有研究表明,利用畜禽养殖废水进行微藻养殖具有可行性,但该模式下微藻固碳机理的研究仍然较少,为此,本文作者研究小球藻对畜禽养殖废水的净化能力以及废水与小球藻代谢生长的协同作用关系与机理,重点探讨小球藻对有机与无机碳源的竞争利用策略,小球藻细胞增殖速率与合成代谢产物(色素、油脂)含量的关系,并解析有机碳利用的影响因素与小球藻固碳机理,以期为畜禽养殖废水的小球藻净化工艺提供参考。
1 材料与方法
1.1 藻种及培养基
实验所用的小球藻(Chlorella vulgaris) (FACHB-8)购于中国科学院水生生物研究所(中国,武汉)。采用高温灭菌(121 ℃,30 min)后的BG11培养基进行扩增培养。
1.2 反应器设计及运行
本次废水处理装置示意图如图1所示,具体包括藻培养系统及pH控制系统(控制pH为7.5±0.5)。反应器容积为1 L,有效容积为400 mL。反应器试验全程置于光照培养箱(温度为28 ℃,光暗时间比为12 h:12 h,光照强度为56.67 W/m2)。
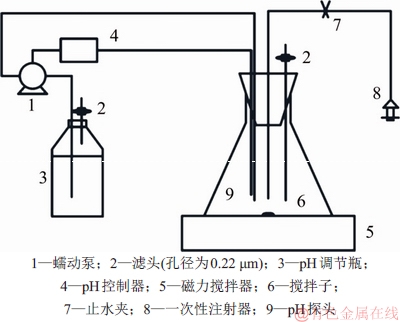
图1 废水处理装置示意图
Fig. 1 Diagram of wastewater treatment device
1.3 畜禽养殖废水组成
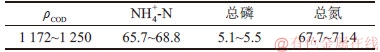
试验用废水参考南京市某养殖中心的废水成分进行人工配制,模拟废水以C6H12O6为碳源,以NH4Cl为氮源、以K2HPO4为磷源,添加必需金属元素。模拟废水组分如下: 1.000 g/L C6H12O6;0.200 g/L NH4Cl;0.040 g/L K2HPO4;0.075 g/L MgSO4·7H2O;0.036 g/L CaCl2·2H2O;0.003 g/L FeCl3·6H2O;1 mL/L A5(痕量金属溶液)。其中,A5组分如下:2.86 g/L H3BO3;1.86 g/L MnCl2·4H2O;0.22 g/L ZnSO4·7H2O;0.39 g/L Na2MoO4·2H2O;0.08 g/L CuSO4·5H2O;0.05 g/L Co(NO3)2·6H2O。模拟废水(接种后)成分如表1所示。
表1 模拟废水成分(质量浓度)
Table 1 Composition of simulated wastewater mg/L
考虑到pH对藻类生长及固碳机理的影响,为研究小球藻对无机碳(HCO
表2 实验设计方案
Table 2 Experimental design schemes

1.4 实验方法
将小球藻先于BG11培养基中进行培养,待生长至稳定期(10 d)后,按照1:50体积比分别接种进4个(分别编号为A,B,C和D组)装有400 mL高温灭菌(121 ℃, 30 min)废水的反应器中进行序批式培养,监测小球藻的生长及水质变化情况。同时,监测藻细胞内色素、油脂的含量变化,每批实验重复2次。
1.5 测定指标及分析方法
1.5.1 藻生长情况及比生长速率计算
在波长为680 nm条件下,利用紫外-可见分光光度计测定的吸光度表征藻的生长情况。比生长速率计算公式如下:
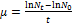
式中:μ为比生长速率,d-1;t为小球藻的培养时间,d;Nt和N0分别为第t天和初始时测定的藻密度。实验发现,在藻培养过程中,前3 d为对数增长期,因此,在计算比生长速率时,统一取第3天藻密度和初始藻密度进行计算,即t=3,Nt为N3。
1.5.2 废水中成分测定
取适量的小球藻液,以8 000 r/min离心5 min后取上清过滤(滤膜孔径为0.45 μm)。采用纳氏试剂光度法测定NH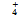
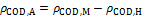
式中: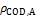
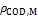
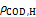
1.5.3 色素及油脂测定
采取分光光度法测定色素的含量(叶绿素a、叶绿素b、类胡萝卜素)[12];采用氯仿-甲醇法测定油脂质量[13]。
1.6 统计学分析
本文实验测得的藻生物量以及COD,TN,TP,NH4-N和叶绿素的质量浓度、脂质质量等采用Excel进行分析,并表示为T±ΔT,其中T为各指标的平均值,ΔT为各指标的平均偏差,并对数据进行t检验。当概率p<0.05时说明结果具有统计学意义。
2 结果与讨论
2.1 无机碳对藻类生长及水质净化的影响
2.1.1 小球藻的生长
小球藻在模拟畜禽养殖废水中的生长情况对比如图2所示。其中,“*”表示该组实验结果与C组实验结果相比具有显著性差异(p<0.05);“&”表示该组实验结果与D实验结果相比具有显著性差异(p<0.05)。由图2可知:无机碳的添加不影响小球藻的生长周期,4个实验组的小球藻在经过1 d的适应期后,均快速进入对数增长期,在第3天时小球藻的生物量达到最大,并逐渐进入生长稳定期(见图2(a))。其中,B实验组(以HEPPS为初始缓冲液,用NaHCO3调节pH)中的小球藻经过7 d培养后,生物量达到最大。由于初始无机碳的存在,小球藻的生长速率以及达到稳定期时的生物量明显降低(见图2(b))。当pH为7.0~8.0时,CO2在液相的主要存在形式为可被藻类吸收利用的HCO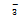
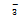
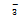
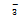
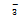
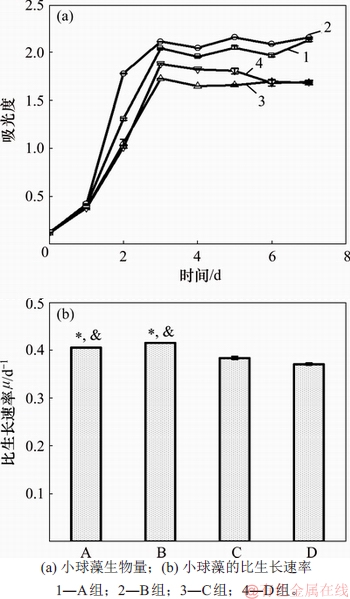
图2 小球藻在模拟畜禽养殖废水中的生长情况对比
Fig. 2 Comparison of growth of Chlorella vulgaris in simulated livestock and poultry aquaculture wastewater
2.1.2 无机碳对水质净化的影响
模拟畜禽养殖废水培养小球藻过程中COD质量浓度变化如图3所示。由图3可知:利用模拟畜禽养殖废水培养小球藻过程中,所有实验组中废水的ρCOD均随着小球藻的生长而明显降低。A~D实验组ρCOD去除率在7 d培养期结束时分别为(91.0±1.3)%,(77.8±14.4)%,(68.8±5.6)%和(64.8±12.1)%,但除A组外,ρCOD均呈现出先减少后缓慢增加的趋势;同时,C实验组中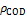
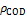
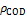
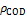
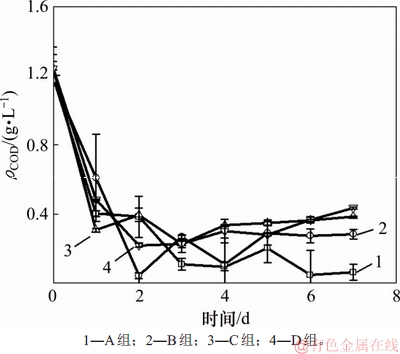
图3 模拟畜禽养殖废水培养小球藻过程中ρCOD变化
Fig. 3 Change of ρCOD during cultivation of Chlorella vulgaris in simulated livestock and poultry aquaculture wastewater
氮是藻类细胞的重要组成成分,对藻的结构蛋白、酶、核酸及叶绿素等合成至关重要[19]。模拟废水培养小球藻过程中氨氮和总氮的质量浓度变化如图4所示。由图4可知:随着小球藻的生长,氨氮和总氮的质量浓度都呈现下降趋势;A~D实验组中小球藻对氨氮去除率均达到100%,总氮的去除率分别为(96.5±2.7)%,(97.0±0.6)%,(96.9±1.1)%和(96.8±0.5)%,但是,各个实验组出水总氮质量浓度并无显著性差异,且均达到城镇污水厂一级A的排放标准(总氮质量浓度<15 mg/L)。由此可见,添加无机碳对氨氮和总氮的去除影响不显著。
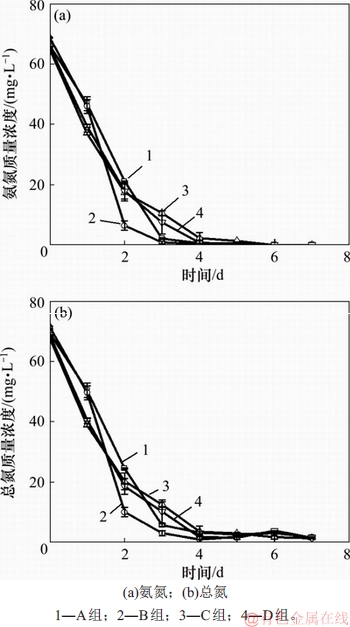
图4 模拟畜禽养殖废水培养小球藻过程中氨氮与总氮质量浓度变化
Fig. 4 Changes of ammonia nitrogen and total nitrogen mass concentrations during the cultivation of Chlorella vulgaris in simulated livestock and poultry aquaculture wastewater
磷是藻类生长必需的营养元素之一,它可以影响藻类磷脂、蛋白质和核酸的合成,并且对能量循环具有重要作用[20-21]。模拟畜禽养殖废水培养小球藻过程中总磷质量浓度的变化如图5所示。由图5可知:随着小球藻培养时间的延长,A~D组废水中总磷质量浓度都呈现下降趋势,最终总磷去除率均大于80%。A和B实验组的总磷去除率分别为(86.8±3.9)%和(86.8±2.8)%),比C和D实验组的总磷去除率(分别为(83.4±1.7)%和(83.3±5.7)%)略高,但C和D实验组中的最终出水总磷质量浓度与A和B实验组中的总磷质量浓度并没有显著性差异(p>0.05)。因此,当利用畜禽养殖废水培养小球藻时,是否添加无机碳对废水中总磷的去除无影响。
2.1.3 小球藻胞内色素、油脂质量变化
在小球藻培养过程中,无机碳浓度对油脂在藻细胞中积累量的影响如图6所示。由图6可知:经过7 d培养,B实验组中单个小球藻细胞内的油脂质量为(0.26±0.004) ng,显著高于其他实验组中藻细胞的油脂质量(p<0.05)。这是因为,适量无机碳源的添加可能促进了细胞对有机物的吸收与油脂的转化积累;另一方面, B实验组藻的生长速率较快,加快了其对氮的消耗,导致生长过程中提前形成了“氮饥饿”,从而更利于油脂的积累[22-24]。但无机碳的过量添加明显抑制藻细胞对油脂的转化积累,从而导致A和B组的藻细胞油脂质量均显著高于C和D组的藻细胞油脂质量。
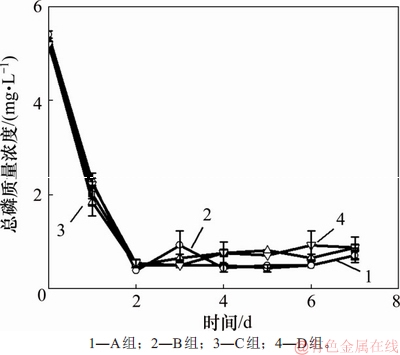
图5 模拟畜禽养殖废水培养小球藻过程中总磷质量浓度的变化
Fig. 5 Change of total phosphorus mass concentration during the cultivation of C hlorella vulgaris in simulated livestock and poultry aquaculture wastewater
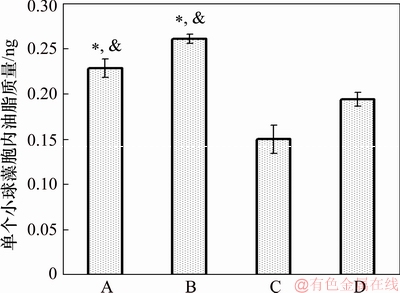
图6 模拟畜禽养殖废水培养的小球藻油脂积累情况
Fig. 6 Accumulation of oil of Chlorella vulgaris in simulated livestock and poultry aquaculture wastewater
叶绿素是小球藻进行光合作用的重要色素,其质量浓度直接影响小球藻光合效率和自养生长速率[25]。类胡萝卜素在捕集光能、维持光合作用和消除多余能量等方面具有重要作用[26]。模拟废水培养小球藻过程中叶绿素a、叶绿素b、总叶绿素与类胡萝卜素质量浓度的变化如图7所示。由图7可见:小球藻中测得的各叶绿素质量浓度均呈先增加后减小趋势,其中,B实验组中各类叶绿素的质量浓度在对数增长期末期(第4天)均明显高于其他实验组中各类叶绿素的质量浓度;在第3和第4天(即小球藻生长对数增长末期与平台期)时,实验组A和实验组B中的叶绿素a和叶绿素b的质量浓度与第5天时的并无显著性差异(p>0.05),表明这2个实验组藻细胞中叶绿素a和叶绿素b的质量浓度达到最大并稳定一段时间后逐渐减少,而实验组C和实验组D的变化规律类似,在第3天时达到最大后迅速下降后并逐渐趋于稳定。其中,B组叶绿素a质量浓度最高达(8.43±0.17) mg/L,比同时期的A,C和D组中叶绿素a质量浓度高34.1%,133.7%和56.4%。但是经过7 d培养,B组中叶绿素a质量浓度却显著低于A组叶绿素a质量浓度(p<0.05),说明经过7 d培养,B实验组的光合效率明显下降。这是因为,第6天时B组的小球藻生长情况显著优于A组的小球藻生长情况(p<0.05)(见图2),B组小球藻对模拟废水中Mg2+的吸收增加,导致第7天时B组中的小球藻在缺镁条件下生长,严重影响B组叶绿素的合成[27],故7 d后B组的叶绿素质量浓度显著低于A组的叶绿素质量浓度。另外,叶绿素b、总叶绿素、类胡萝卜素质量浓度的变化趋势与叶绿素a的均一致。A和B组的总叶绿素和类胡萝卜素水平明显比同期的C和D组的高,说明适量的无机碳可促进藻的光合作用,从而可释放更多的能量用于藻对有机碳的吸收(见图3)。
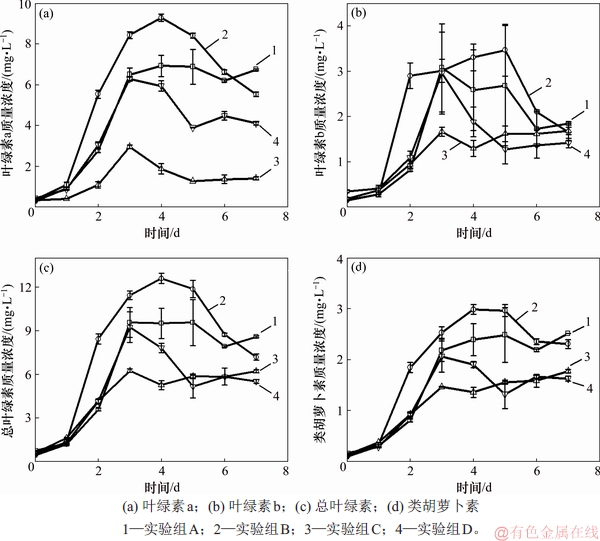
图7 模拟废水培养小球藻过程中叶绿素a、叶绿素b、总叶绿素与类胡萝卜素质量浓度的变化
Fig. 7 Changes of chlorophyll a, chlorophyll b, total chlorophyll and carotenoid mass concentrations in process of cultivating Chlorella vulgaris in simulated wastewater
3 结论
1) 小球藻可在有效净化高质量浓度有机畜禽废水的同时完成自身增殖,有机物、总氮、总磷和NH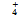
2) 一定浓度的无机碳(0.1~1 μmoL/L)可以促进小球藻的生长及其对有机物的吸收,COD去除率可提高12.9 %~40.4%,同时,油脂和叶绿素转化积累能力也有一定程度提高。
参考文献:
[1] CHISTI Y. Biodiesel from microalgae[J]. Biotechnology Advances, 2007, 25(3): 294-306.
[2] LUCIA B, RAGHU C, FEDERICO C, et al. The challenge of eco-physiological biodiversity for biotechnological applications of marine microalgae[J]. Marine Drugs, 2014, 12(3):1641-1675.
[3] CHISTI Y. Biodiesel from microalgae beats bioethanol[J]. Trends in Biotechnology, 2008, 26(3): 126-131.
[4] DISMUKES G C, CARRIERI D, BENNETTE N, et al. Aquatic phototrophs: efficient alternatives to land-based crops for biofuels[J]. Current Opinion in Biotechnology, 2008, 19(3): 235-240.
[5] CER N-GARC
N-GARC A M C, S
A M C, S NCHEZ-MIR
NCHEZ-MIR N A, FERN
N A, FERN NDEZ-SEVILLA J M, et al. Mixotrophic growth of the microalga Phaeodactylum tricornutum: influence of different nitrogen and organic carbon sources on productivity and biomass composition[J]. Process Biochemistry, 2005, 40(1): 297-305.
NDEZ-SEVILLA J M, et al. Mixotrophic growth of the microalga Phaeodactylum tricornutum: influence of different nitrogen and organic carbon sources on productivity and biomass composition[J]. Process Biochemistry, 2005, 40(1): 297-305.
[6] BHATNAGAR A, CHINNASAMY S, SINGH M, et al. Renewable biomass production by mixotrophic algae in the presence of various carbon sources and wastewaters[J]. Applied Energy, 2011, 88(10): 3425-3431.
[7] SFORZA E, CIPRIANI R, MOROSINOTTO T, et al. Excess CO2 supply inhibits mixotrophic growth of Chlorella protothecoides and Nannochloropsis salina[J]. Bioresource Technology, 2012, 104: 523-529.
[8] LU Qian, ZHOU Wenguang, MIN Min, et al. Growing Chlorella sp. on meat processing wastewater for nutrient removal and biomass production[J]. Bioresource Technology, 2015, 198: 189-197.
[9] GE Shijian, QIU Shuang, TREMBLAY D, et al. Centrate wastewater treatment with Chlorella vulgaris: simultaneous enhancement of nutrient removal, biomass and lipid production[J]. Chemical Engineering Journal, 2018, 342: 310-320.
[10] 国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法[M]. 第四版.北京.中国环境科学出版社, 2002: 255-281.
Editorial Board of the State Environmental Protection Administration "Water and Wastewater Monitoring and Analysis Methods". Water and wastewater monitoring and analysis methods [M]. 4th ed.Beijing: China Environmental Science Press, 2002: 255-281.
[11] 谭丽敏, 王雅昌, 张林爱. HACH公司COD试剂的替代品开发[J]. 中国给水排水, 2001, 17(6): 55-56.
TAN Limin, WANG Yachang, ZHANG Lin’ai. Development of alternatives to COD reagents in HACH [J]. China Water & Wastewater, 2001, 17(6): 55-56.
[12] FERN NDEZ-LINARES L C, GUERRERO BARAJAS C, DUR
NDEZ-LINARES L C, GUERRERO BARAJAS C, DUR N P
N P RAMO E, et al. Assessment of Chlorella vulgaris and indigenous microalgae biomass with treated wastewater as growth culture medium[J]. Bioresource Technology, 2017, 244: 400-406.
RAMO E, et al. Assessment of Chlorella vulgaris and indigenous microalgae biomass with treated wastewater as growth culture medium[J]. Bioresource Technology, 2017, 244: 400-406.
[13] 贺乐. 油藻培养液中抑制物的鉴定及去除工艺[D].天津:天津科技大学食品工程与生物技术学院, 2016: 15-16.
HE Le. Identification and removal of inhibitor in oleaginous microalgae medium[D]. Tianjin: Tianjin University of Science and Technology. College of Food Engineering and Biotechnology, 2016: 15-16.
[14] MATTOS E R, SINGH M, CABRERA M L, et al. Effects of inoculum physiological stage on the growth characteristics of Chlorella sorokiniana cultivated under different CO2 concentrations[J]. Applied Biochemistry and Biotechnology, 2012, 168(3): 519-530.
[15] MARKOU G, VANDAMME D, MUYLAERT K. Microalgal and cyanobacterial cultivation: the supply of nutrients[J]. Water Research, 2014, 65: 186-202.
[16] MARTIN C L, TORTELL P D. Bicarbonate transport and extracellular carbonic anhydrase in marine diatoms[J]. Physiologia Plantarum, 2008, 133(1): 106-116.
[17] VAN DEN HENDE S , VERVAEREN H, BOON N. Flue gas compounds and microalgae: (bio-)chemical interactions leading to biotechnological opportunities[J]. Biotechnology Advances, 2012, 30(6): 1405-1424.
[18] GIORDANO M, BEARDALL J, RAVEN J A. CO2 concentrating mechanisms in algae: mechanisms, environmental modulation, and evolution[J]. Annual Review of Plant Biology, 2005, 56(1):99-131.
[19] KUBE M, JEFFERSON B, FAN Linhua, et al. The impact of wastewater characteristics, algal species selection and immobilisation on simultaneous nitrogen and phosphorus removal[J]. Algal Research, 2018, 31: 478-488.
[20] KESAANO M, SIMS R C. Algal biofilm based technology for wastewater treatment[J]. Algal Research, 2014, 5: 231-240.
[21] PROCH ZKOV
ZKOV G, BR
G, BR NYIKOV
NYIKOV I, ZACHLEDER V, et al. Effect of nutrient supply status on biomass composition of eukaryotic green microalgae[J]. Journal of Applied Phycology, 2014, 26(3): 1359-1377.
I, ZACHLEDER V, et al. Effect of nutrient supply status on biomass composition of eukaryotic green microalgae[J]. Journal of Applied Phycology, 2014, 26(3): 1359-1377.
[22] ILLMAN A M, SCRAGG A H, SHALES S W. Increase in Chlorella strains calorific values when grown in low nitrogen medium[J]. Enzyme and Microbial Technology, 2000, 27(8): 631-635.
[23] KHOZINGOLDBERG I, COHEN Z. The effect of phosphate starvation on the lipid and fatty acid composition of the fresh water eustigmatophyte Monodus subterraneus[J]. Phytochemistry, 2006, 67(7): 696-701.
[24] LYNN S G, KILHAM S S, KREEGER D A, et al. Effect of nutrient availability on the biochemical and elemental stoichiometry in the freshwater diatom stephanodiscus minutulus (bacillariophyceae)[J]. Journal of Phycology, 2000, 36(3): 510-522.
[25] 刘志媛, 王广策. 铁促进海水小球藻油脂积累的动态过程[J]. 海洋科学, 2008, 32(11): 56-59, 73.
LIU Zhiyuan, WANG Guangce. Dynamics of lipid accumulation in marine microalga Chlorella vulgaris promoted by iron[J]. Marine Sciences, 2008, 32(11): 56-59, 73.
[26] DEMMIG-ADAMS B. Antioxidants in photosynthesis and human nutrition[J]. Science, 2002, 298(5601): 2149-2153.
[27] 王珊, 赵树欣, 魏长龙, 等. 缺镁胁迫对普通小球藻光合生理及油脂积累的影响[J]. 环境科学, 2014, 35(4): 1462-1467.
WANG Shan, ZHAO Shuxin, WEI Changlong, et al. Effect of magnesium deficiency on photosynthetic physiology and Triacylglyceride(TAG) accumulation of Chlorella vulgaris[J]. Environmental Science, 2014, 35(4): 1462-1467.
(编辑 伍锦花)
收稿日期: 2018 -10 -11; 修回日期: 2018 -12 -11
基金项目(Foundation item):国家重点研发项目(2016YFB0601003) (Project(2016YFB0601003)supported by the National Key Research and Development Program of China)
通信作者:余冉,博士,教授,从事环境生物技术在水污染控制、固体废弃物(污泥)处理和处置以及在环境生态修复中的应用研究;E-mail: yuran@seu.edu. com
摘要:为了研究小球藻在模拟畜禽养殖废水中的生长特性及其对高质量浓度有机物废水的协同净化效果,分析小球藻在自养/异养混合代谢生长模式下对有机与无机碳源的竞争利用策略以及外加无机碳源对小球藻生长与废水净化能力的影响规律。研究结果表明:在高质量浓度有机碳(化学需氧量质量浓度ρCOD为(1 172±22.5) mg/L)存在条件下,一定浓度的无机碳(0.1~1 μmoL/L)可以促进小球藻的生长及其对有机物的吸收,COD去除率可提高12.9% ~ 40.4%,同时小球藻合成积累油脂和叶绿素能力也得到提高,藻细胞内总叶绿素质量浓度高达(8.6±0.06) mg/L,单个藻细胞中油脂质量达(0.26±0.004) ng。但当无机碳源的浓度继续提高到2.1 mmoL/L时,小球藻的生长和废水有机碳利用速率明显受到抑制,小球藻的比生长速率下降(6.5±2.1)%,COD去除率只有(68.8±5.6)%,但对氮磷去除率影响不大,总氮、总磷、氨氮的去除率分别为(97.0±0.6)%,(86.8±3.8)%和100%。
[1] CHISTI Y. Biodiesel from microalgae[J]. Biotechnology Advances, 2007, 25(3): 294-306.
[10] 国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法[M]. 第四版.北京.中国环境科学出版社, 2002: 255-281.
[11] 谭丽敏, 王雅昌, 张林爱. HACH公司COD试剂的替代品开发[J]. 中国给水排水, 2001, 17(6): 55-56.
[13] 贺乐. 油藻培养液中抑制物的鉴定及去除工艺[D].天津:天津科技大学食品工程与生物技术学院, 2016: 15-16.
[25] 刘志媛, 王广策. 铁促进海水小球藻油脂积累的动态过程[J]. 海洋科学, 2008, 32(11): 56-59, 73.
[27] 王珊, 赵树欣, 魏长龙, 等. 缺镁胁迫对普通小球藻光合生理及油脂积累的影响[J]. 环境科学, 2014, 35(4): 1462-1467.


