新型过渡金属草酸盐储锂机制和性能改进研究进展
张克宇1, 2,崔丁方1, 3,高 耕1, 2,张利波1,杨 斌1, 2,戴永年1, 2,姚耀春1, 2
(1. 昆明理工大学 冶金与能源工程学院,昆明 650093;
2. 昆明理工大学 锂离子电池与材料制备技术国家地方联合工程实验室,昆明 650093;
3. 云南驰宏国际锗业有限公司,曲靖 655011)
摘 要:
过渡金属草酸盐基于其高比容量、优异的倍率性能、简单的制备工艺和丰富的资源等优势,在高能量锂离子电池储能领域拥有巨大的应用潜力。然而由于其较低的电子电导率和Li+迁移速率,在循环过程中会形成大量电化学反应活性较低的金属纳米粒子和聚合物,引起更高的不可逆容量,并且不稳定的层状结构会造成颗粒的破裂,导致电池的循环寿命较差。此外,过渡金属草酸盐特殊的热力学特性,导致获得100%失结晶水材料更加困难。本文综述了过渡金属草酸盐材料的晶体结构特征,基于对储锂过程中材料转换过程的理解和界面特性等机理研究并结合材料面临的主要挑战,深入分析了近年来在形貌微纳结构调控和增强产物反应活性等方面的改性策略及其作用机理,为推动高能量密度过渡金属草酸盐基负极材料在锂离子电池方面的基础科学研究和商业化应用提供借鉴参考。
关键词:
过渡金属草酸盐;储能机制;转换反应;微纳结构调控;锂离子电池;研究进展;
文章编号:1004-0609(2021)-11-3254-18 中图分类号:TH3 文献标志码:A
引文格式:张克宇, 崔丁方, 高 耕, 等. 新型过渡金属草酸盐储锂机制和性能改进研究进展[J]. 中国有色金属学报, 2021, 31(11): 3254-3271. DOI: 10.11817/j.ysxb.1004.0609.2021-42269
ZHANG Ke-yu, CUI Ding-fang, GAO Geng, et al. Recent progress in lithium storage mechanism and performance regulation strategies for transition metal oxalates[J]. The Chinese Journal of Nonferrous Metals, 2021, 31(11): 3254-3271. DOI: 10.11817/j.ysxb.1004.0609.2021-42269
锂离子电池作为一种新型高能绿色电能存储解决方案,具有能量密度高、循环寿命长、安全性能好、自放电低等优点,在便携电子设备如手机、笔记本电脑、仪器仪表以及大型设备如电动汽车、混合动力汽车、储能电站等均得到了广泛的应用[1]。自20世纪90年代,索尼公司以LiCoO2与石墨作为正负极材料,首次研制出新一代锂离子电池以来,储能技术得到了长足发展,电池安全性和能量密度不断得到提升[2]。但用于电动汽车的高功率、大容量锂离子动力电池受体积密度、价格、安全性问题的困扰,仍面临很大挑战。能源材料是能源开发的基础,但也是能源利用中的瓶颈,所以解决能源问题的关键是能源材料的突破。对于锂离子电池而言,负极材料作为其重要的组成部分,不仅决定着锂离子电池的性能,还对其工作时间、价格成本起着重要的作用。然而,目前商业化的负极材料仍以石墨为主,其较低的理论比容量(约372 mA·h/g)严重限制了锂离子动力电池的发展。因此,开发能量密度高、循环性能好、安全稳定的储能材料是当前锂离子电池发展的新方向。
根据负极材料储锂机理的差异,可分为三类:嵌入型、合金化型和转换反应型。其中,以尖晶石钛酸锂(Li4Ti5O12)和二氧化钛(TiO2)为代表的嵌入式材料,在储锂过程中体积变化小、循环寿命好,但其能量密度低、成本高、倍率性能差也限制了其发展[3]。以硅碳为代表的合金化电极材料(M+xLi LixM,M为Si、Sn等,如图1(b)所示),因其价格低廉、嵌锂容量高(4200 mA·h/g)、安全性好,被誉为最具应用潜力的锂离子动力电池负极材料[4-5]。但其显著的体积效应(>300%)、不稳定的固相电解质层(SEI)和较低的首次库伦效率,导致了材料较差的循环稳定性[6-7]。2000年,POIZOT小组首次报道了具有高比容量和倍率性能的锂离子电池过渡金属氧化物负极材料,其电化学反应机理为MOx+2xLi++e
LixM,M为Si、Sn等,如图1(b)所示),因其价格低廉、嵌锂容量高(4200 mA·h/g)、安全性好,被誉为最具应用潜力的锂离子动力电池负极材料[4-5]。但其显著的体积效应(>300%)、不稳定的固相电解质层(SEI)和较低的首次库伦效率,导致了材料较差的循环稳定性[6-7]。2000年,POIZOT小组首次报道了具有高比容量和倍率性能的锂离子电池过渡金属氧化物负极材料,其电化学反应机理为MOx+2xLi++e xLi2O+M(M为过渡金属Fe、Co、Ni、Mn、Cu和Sn),如图1(c)所示[8]。相比于碳材料,过渡金属氧化物虽然表现出较高的理论放电比容量,但也存在首次充放电不可逆容量高和循环稳定性差等缺点[9]。
xLi2O+M(M为过渡金属Fe、Co、Ni、Mn、Cu和Sn),如图1(c)所示[8]。相比于碳材料,过渡金属氧化物虽然表现出较高的理论放电比容量,但也存在首次充放电不可逆容量高和循环稳定性差等缺点[9]。
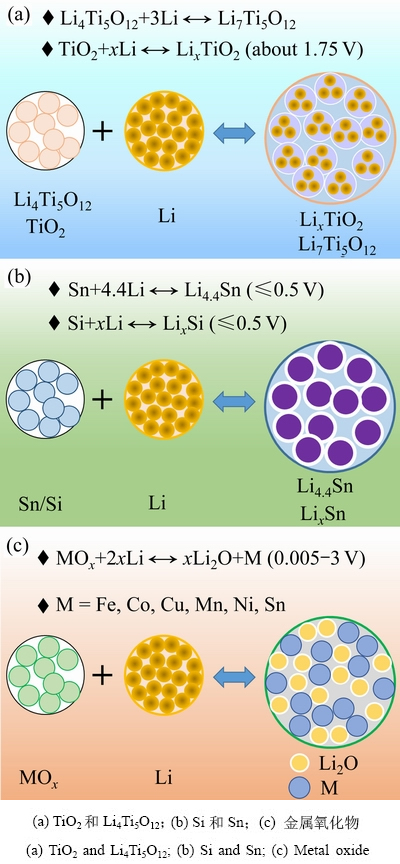
图1 各类型负极材料的储锂机制
Fig. 1 Lithium storage mechanism for various anode materials
近年来,在过渡金属氧化物负极材料研究的基础上,较易制备的过渡金属草酸盐(TMOxs)在储能领域的应用也逐渐吸引了人们的注意[10]。2008年,西班牙科尔多瓦大学TIRADO课题组首次合成并报道一种具有优良电化学性能的锂离子电池草酸亚铁负极材料,具有转换反应储锂和插层多孔结构嵌入式储锂的双重特性,产生的实际放电比容量高达1600 mA·h/g,远远高于相应金属氧化物负极材料[11]。此外,从储能材料可持续性的角度考虑,过渡金属草酸盐无疑成为最具应用潜力的储能材料之一[12-14]:1) 优异的循环稳定性;2) 较低的放电电压(0.8 V);3) 较小的体积效应(<10%),对电池设计要求低;4) 丰富的铁资源储备,原料成本更低廉;5) 通过人工合成将二氧化碳转化为草酸,既可以解决草酸的来源,又有助于缓解全球碳排放量的问题。因此,具有良好电化学特性的过渡金属草酸盐材料,在金属离子(锂、钠、钾等)电池等储能领域有着广泛应用[15-16]。本文系统评述了过渡金属草酸盐材料的基本结构和在储能中的反应机制,对过渡金属草酸盐在锂离子电池体系中的应用情况进行了论述,分析了其作为负极材料存在的问题并提出相应的改进策略,并对材料的发展趋势进行了预测。
1 结构特征
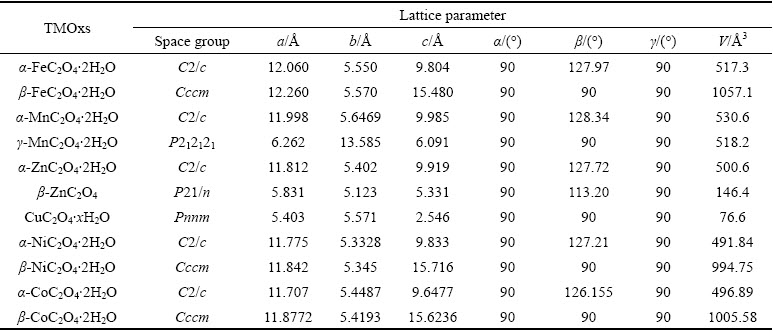
过渡金属草酸盐材料是由过渡金属阳离子和草酸根离子组成的化合物。与其他类似的金属含氧酸盐一样广泛存在于自然界中,如矿物、植物、真菌、地衣和动物组织[17-18]。常见的过渡金属草酸盐主要存在于元素周期表过渡金属第一排元素中。根据原子间排列形式的不同,其晶体结构可以分为以下几种[19-21]:1) 单斜晶系α-MC2O4·2H2O(属于C2/c空间群),M=Mn、Fe、Co、Ni、Zn;2) 正交晶系β-MC2O4·2H2O(属于Cccm空间群),M=Fe、Co、Ni;3) 正交晶系γ-MC2O4·2H2O(属于P212121空间群),M=Mn。
α-和β-草酸盐材料的晶体结构是以金属原子为中心连接草酸根离子(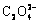 )而形成的3D插层结构。如图2(a)~(e)所示,在晶胞中金属M原子与周围四个氧原子通过M—O金属单键相连形成八面体结构,而后与两个碳原子组成五元环鳌合物,并依次沿b轴方向延伸排列,形成一维链状结构[26-28]。而对于含结晶水材料,水分子分别位于MO6八面体a轴方向上的两个位点,但对整体链状结构并未有较大的影响。这些一维链沿a和c轴方向竖直排列,从而形成横向和纵向的插层结构(见图2(b)~(c))。由于层间水分子形成的氢键排列的差异以及层间堆叠缺陷,两种晶体结构呈现出明显的三维层状结构差异[29-30]。而γ-MnC2O4·2H2O晶体中扭曲的MnO6八面体是由两个水分子和四个草酸盐中氧原子组成(见图2(d))。这导致沿c轴方向的扭曲八面体单元中上下两个顶角氧原子与相邻链间形成共享配位体[24]。此外,如图2(f)~(h)所示,α-CuC2O4·2H2O和β-ZnC2O4的晶体结构也表现出与γ-MnC2O4·2H2O相类似的结构特征,这可能是由金属原子与氧原子成键结合能以及与草酸根结合形式的差异所导致的。表1所示为不同过渡金属草酸盐材料的晶体结构参数,差异化的原子排布和空间体积也会导致材料储锂能力的不同[23, 31]。本文作者课题组详细对比了α-FeC2O4·2H2O和β-FeC2O4·2H2O晶体结构间的差异,通过Rietveld精修和DFT理论计算,发现α-FeC2O4·2H2O表现出更宽和更稳定的层间锂离子扩散通道(D3=5.158
)而形成的3D插层结构。如图2(a)~(e)所示,在晶胞中金属M原子与周围四个氧原子通过M—O金属单键相连形成八面体结构,而后与两个碳原子组成五元环鳌合物,并依次沿b轴方向延伸排列,形成一维链状结构[26-28]。而对于含结晶水材料,水分子分别位于MO6八面体a轴方向上的两个位点,但对整体链状结构并未有较大的影响。这些一维链沿a和c轴方向竖直排列,从而形成横向和纵向的插层结构(见图2(b)~(c))。由于层间水分子形成的氢键排列的差异以及层间堆叠缺陷,两种晶体结构呈现出明显的三维层状结构差异[29-30]。而γ-MnC2O4·2H2O晶体中扭曲的MnO6八面体是由两个水分子和四个草酸盐中氧原子组成(见图2(d))。这导致沿c轴方向的扭曲八面体单元中上下两个顶角氧原子与相邻链间形成共享配位体[24]。此外,如图2(f)~(h)所示,α-CuC2O4·2H2O和β-ZnC2O4的晶体结构也表现出与γ-MnC2O4·2H2O相类似的结构特征,这可能是由金属原子与氧原子成键结合能以及与草酸根结合形式的差异所导致的。表1所示为不同过渡金属草酸盐材料的晶体结构参数,差异化的原子排布和空间体积也会导致材料储锂能力的不同[23, 31]。本文作者课题组详细对比了α-FeC2O4·2H2O和β-FeC2O4·2H2O晶体结构间的差异,通过Rietveld精修和DFT理论计算,发现α-FeC2O4·2H2O表现出更宽和更稳定的层间锂离子扩散通道(D3=5.158 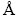 )。并基于此特性,材料在0.5和5 A/g电流密度下,循环100次后,其放电比容量仍高达1073.17和841.24 mA·h/g。
)。并基于此特性,材料在0.5和5 A/g电流密度下,循环100次后,其放电比容量仍高达1073.17和841.24 mA·h/g。

图2 草酸亚铁一维链状结构[14](a);α-FeC2O4·2H2O的三维晶体结构[22](b);β-FeC2O4·2H2O的三维晶体结构[23](c);γ-MnC2O4·2H2O的链状结构[24](d);MO6八面体结构(e);CuC2O4、α-ZnC2O4·2H2O和β-ZnC2O4三维晶体结构[25]((f)~(h))
Fig. 2 One-dimensional (1D) chain of FeC2O4·2H2O composed by octahedral FeO6 and oxalate along b-axis[14](a); three-dimensional (3D) interlayered structure of α-FeC2O4·2H2O[22](b); three-dimensional (3D) interlayered structure of β-FeC2O4·2H2O[24](c); chain arrangement in γ-MnC2O4·2H2O[23](d); octahedral MO6(e); Metal coordination and ribbonlike motif present in the structure of CuC2O4(f), α-ZnC2O4·2H2O(g), and β-ZnC2O4[25](h)
2 储锂机制
作为锂离子电池新型负极材料,过渡金属草酸盐和其等效氧化物(TMO)一样,具有类似的转换反应储锂机制,即在放电过程中Li+与MC2O4反应,生成Li2C2O4和高度分散且具有电化学反应活性的纳米金属M颗粒,即MC2O4+2Li++2e M+Li2C2O4 (M=Mn、Fe、Co、Ni、Zn等)[32]。通过计算发现,基于转换反应储锂机制,材料理论比容量约为370 mA·h/g,与主流石墨负极材料的储锂能力相似。而在实际测试过程中其首次放电比容量却高达1500 mA·h/g,且循环稳定后比容量也能保持在800 mA·h/g左右[33-34]。这一现象说明材料在充放电过程中仍存在其它可逆的储锂反应。因此,研究人员对材料的电化学反应过程进行了大量研究。
M+Li2C2O4 (M=Mn、Fe、Co、Ni、Zn等)[32]。通过计算发现,基于转换反应储锂机制,材料理论比容量约为370 mA·h/g,与主流石墨负极材料的储锂能力相似。而在实际测试过程中其首次放电比容量却高达1500 mA·h/g,且循环稳定后比容量也能保持在800 mA·h/g左右[33-34]。这一现象说明材料在充放电过程中仍存在其它可逆的储锂反应。因此,研究人员对材料的电化学反应过程进行了大量研究。
首先,为了明确过渡金属草酸盐与其金属氧化物在转换反应产物间的差异,ARAGON等[11]首次对草酸亚铁材料充放电过程进行了红外光谱测试,并证明材料转换反应的产物为草酸锂而非金属氧化物材料的氧化锂。SUN课题组利用飞行时间二次离子质谱(TOF-SIMS)、原位XRD和TEM测试,进一步明确了草酸镍和草酸锡的电化学可逆性,并证实了草酸锡体系中转换反应和合金化储锂反应的相互协同效应,如图3(a)~(b)所示[35-36]。由于充放电过程中过渡金属氧化物颗粒表面发生电解液分解,导致有机固体电解质膜(SEI膜)的产生,这一过程消耗了大量Li+并导致较高不可逆容量的产生。为了分析草酸盐材料在充放电过程中表面SEI膜的形成规律,WU等[37]以Mn0.33Co0.67C2O4材料为研究对象,对其充放电过程中的物相组成和形貌变化进行了表征,如图3(c)~(e)所示。发现材料经过三次循环后,颗粒表面的SEI膜逐渐稳定,其主要成分为烷基碳酸锂和草酸锂的催化产物。ALCANTARA等[38]在对草酸锡的电化学行为进行研究时,也指出其颗粒表面以碳酸锂为主的有机SEI膜会导致材料在首次循环中产生大量不可逆容量,并推测转换反应产生的少量草酸锂会继续与Li+发生不可逆反应生成氧化锂和一氧化碳气体。此外,ARAGON等人[39]也指出金属草酸盐在热处理过程中由于结晶水的失去,导致大量纳米孔洞结构的产生,也会引起材料电容效应的储锂机制。ZHUKOVSKII等[40]针对过渡金属碳酸盐和其氧化物的转换反应过程提出了界面储锂的概念。他们认为材料发生转换反应后会生成金属纳米颗粒和锂盐界面。而此界面仍具有一定的储锂能力,即Li+储存于锂盐表层或界面核中,基于金属颗粒的电负性,电子存储于金属原子中以平衡电荷。为进一步证明草酸盐材料多元化的储锂能力,本文作者课题组利用差速dQ/dV分析对草酸亚铁电极在100次循环过程中的电化学反应过程进行分析,如图3(f)所示,发现电极在前几次循环中,0.75 V附近的转换反应产物呈现出短暂电化学失活,后被重新激活的现象,并证实了过渡金属草酸盐转换反应的可逆性和稳定性[34]。此外,也发现放电至0.35 V后材料仍表现出较强的储锂能力。如图3(g)~(h)所示,通过对不同扫描速率下草酸亚铁电极的电容贡献和离子扩散贡献分析,量化了法拉第容量和非法拉第容量的组成,并发现金属草酸盐的主体容量为电容贡献。
表1 不同过渡金属草酸盐晶体结构参数对比[29, 31]
Table 1 Comparison of crystal structure parameters for TMOxs[29, 31]
目前,对过渡金属草酸盐储锂机制的研究仍停滞于对其转换反应的验证和其他可能存在的电化学反应的猜测上。因此,对材料储锂过程进行系统化研究仍然是今后材料电化学反应机理研究的重点,这不仅可以有效分析材料较高容量组成,探究不可逆容量来源,也可以为材料后续性能的改善提供更详细的理论指导。
3 材料性能提升策略
虽然过渡金属草酸盐具有诸多优点,但材料自身电子电导率低、锂离子扩散速率慢、不可逆容量高等问题也严重限制了它的实际应用。近年来,为了改善过渡金属草酸盐负极材料上述缺陷,提高材料整体电化学活性和结构稳定性,国内外研究者也做了许多研究。根据性能提升机制的不同,大概可以分为以下两类:1) 微纳结构及其维度设计:通过控制材料颗粒形态的多样性(茧状、棒状、纳米线、三维球状等)和结构组成,可以显著缩短Li+的嵌入/脱出距离,并增加稳定的扩散通道[41-43];2) 掺杂-复合改性:一方面,在草酸盐晶格中的阳离子位掺杂金属离子(Co、Mn、Cu等)来提高材料电子电导率和Li+扩散速率[44-45];另一方面,在草酸盐材料中添加石墨烯等碳材料,制备得到草酸盐-碳(MC2O4/G,M=Fe、Mn、Cu、Co、Zn等)复合材料,这不仅可提高电极整体的电子电导率,而且也为电解质渗透提供了足够的空隙[46-47]。
3.1 微纳结构及其维度设计
从材料微纳结构设计的角度考虑,差异化的形貌结构导致了材料独特的物理和化学特性,对其电化学性能有如下影响:1) 不同的锂离子扩散距离直接影响材料的倍率性能;2) 结构的稳定性对材料循环稳定性起着至关重要的作用,可塑性和蠕变性可以减轻体积效应带来的结构不稳定;3) 较高的比表面积使材料活性位点增多,提供更多的锂离子扩散通道,并增强电化学反应能力。由此可见,对材料微纳结构的优化可以筛选出锂离子扩散距离短、内部迁移通道多、结构稳定的颗粒形貌,以获得材料较高的可逆容量、优异的倍率和循环性能。
不同的制备方法能有效地获得材料差异化的形貌结构。目前,过渡金属草酸盐材料常见的制备方法包括微乳液法、液相法、溶胶凝胶法、微波辅助法、离子液相辅助法和一步固相法等[48-49]。LUO等[50]在1-丁基-3-甲基二甲苯氯化[BMIM]Cl离子液体的辅助下,通过传统的沉淀反应得到了不同形貌的过渡金属草酸盐,并指出离子液体作为介质和模板对不同过渡金属草酸盐的形貌结构起着速率对材料纳至关重要的作用。如图4(a)~(b)所示,KIM等[51]通过简单的化学阳极氧化法,使用草酸在Sn箔表面腐蚀得到分布均匀的SnC2O4纳米线,并发现界面处草酸浓度梯度、有机溶液介电常数和草酸根传递米线长度和堆积密度均有较大的影响。BIAN等[52]采用同样的方法在乙二醇和NH4F电极质中制备得到片层矩阵状的SnC2O4材料,并指出片层结构的自组装现象归因于阳极电位和含水 量。此外,WU等[53]利用K3[Fe(C2O4)3]·3H2O的分解反应(2K3[Fe(C2O4)3]·3H2O=3K2C2O4+2FeC2O4+ 2CO2↑+6H2O),通过原料在球形二氧化碳气泡表面富集并形成中空微米球形的草酸亚铁,如图4(c)和(e)所示。AHMAD等[54]采用反向胶束技术,在油水两相界面处利用微乳液颗粒得到了纳米棒状草酸镍和草酸铜,并指出油包水界面和溶剂为颗粒沿横向生长提供了积极的作用,如图4(d)和(f)所示。VAIDYA等[56]也指出表面活性剂和溶剂类型对草酸镍的形貌和结构有较大的影响,并制备得到了纳米球状、棒状和块状的颗粒。
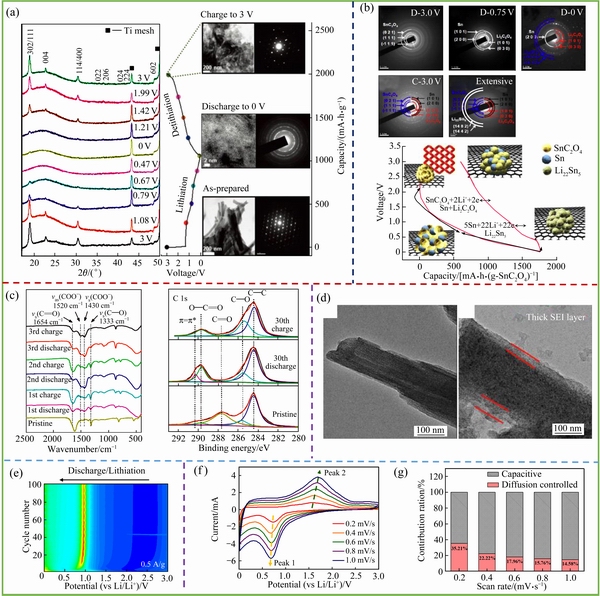
图3 NiC2O4·2H2O/rGO材料充放电过程中材料物相和颗粒形貌的变化[35](a);SnC2O4/rGO充放电过程中的物相变化及电化学反应机理图[36](b);Mn0.33Co0.67C2O4电极材料在首次充放电过程中的红外光谱和XPS分析[37](c);Mn0.33Co0.67C2O4电极材料(左图)和充放电循环后(右图)的TEM图像[37](d);FeC2O4电极100次循环过程中的差速容量图[37](e);FeC2O4电极在不同扫描速率下的CV图[34](f);不同扫描速率下电极的电容贡献和离子扩散贡献分布图[34](g)
Fig. 3 Phase evolution and TEM bright-field image (right) of NiC2O4·2H2O/rGO composite electrode upon lithiation (reduction) and delithiation (oxidation)[35](a); TEM images and SAD patterns of SnC2O4/rGO during discharge, charge, and after extensive cycles and schematic electrochemical reaction of SnC2O4/rGO composite during cycles[36](b); FTIR spectra and XPS spectra (right) of Mn0.33Co0.67C2O4 electrodes measured at a pristine state[37](c); TEM images of Mn0.33Co0.67C2O4 electrodes under pristine state (left) and cycled for 30th (right)[37](d); differential capacity maps of FeC2O4 electrode galvanostatically cycled 100 times at 0.5 A/g[37](e); CV curves of common-FeC2O4 at different sweep rates[34](f); normalized contribution ratio of capacitive (white region) and diffusion-controlled (pink region) capacities at different scan rates[34](g)
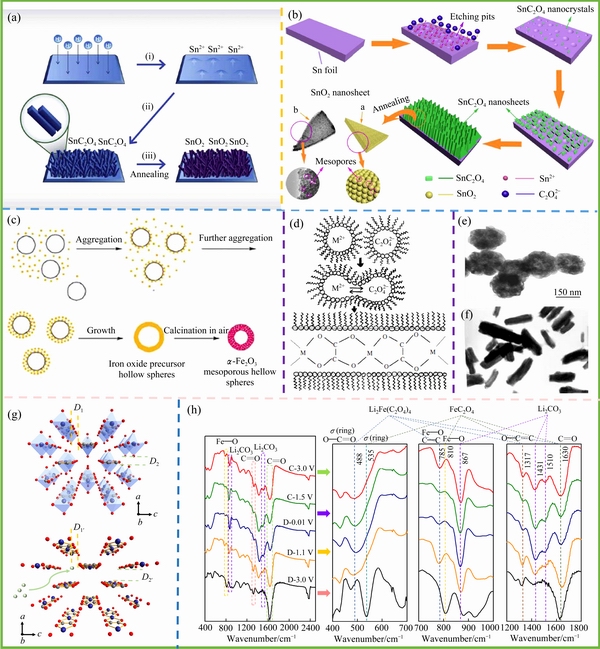
图4 模板法制备一维SnC2O4和SnO2材料[51](a);阳极氧化自组装工艺在Ti板生长SnC2O4纳米片[52](b);γ-Fe2O3中空球形的制备过程及其形貌表征[53]((c),(e));棒状金属(Cu, Ni)草酸盐生长机理及其TEM分析[54]((d),(f));由氢键保持的三维层状结构[55](g);失结晶水后的FeC2O4多层框架结构[34](h)
Fig. 4 Schematic illustration of one-dimensional SnC2O4 and SnO2 formation[51](a); Self-assemble process of SnC2O4 nanosheets grown on tin substrate by anodization[52](b); Evolution of γ-Fe2O3 mesoporous hollow spheres[53](c); Proposed mechanism for formation of metal (Cu, Ni) oxalate nanorods[54](d); TEM images with different morphologies[53-54]((e)-(f)); three-dimensional (3D) interlayered structure which is maintained by hydrogen bonding[55](g); Multilayer framework of FeC2O4 after losing crystal water[34](h)
通过上述分析发现,通过改变制备方法可以有效控制过渡金属草酸盐材料形貌结构。但这些方法也由于制备流程复杂、原料有毒或污染环境等原因而限制了材料未来的工业化生产和应用。而表面活性剂、模板、催化剂和自组装过程等因素条件是材料各向异性生长的关键。正如相关报道指出,表面活性剂对颗粒形态、大小和分布提供了有效的控制[57-58]。但也有研究表明,使用有机溶剂作为介质而无需额外添加剂的溶剂热或水热方法也可以达到控制材料颗粒特性的目的[59]。由于这种传统水热或溶剂热法制备流程更加简单、条件可控,研究人员对渡金属草酸盐材料颗粒形貌和结构的控制作用也做了大量研究。根据我们课题组对草酸亚铁在常温条件下颗粒生长过程的研究,发现乙醇作为溶剂可以控制草酸亚铁一次颗粒片层之间的疏水性,并促进颗粒之间的层层自组装[60]。此外,不同浓度溶剂对材料颗粒的团聚也呈现出差异化的效果,导致最终不同的颗粒尺寸。PANG等[61]通过对材料生长过程中反应时间和溶剂浓度的细化研究,发现在较低溶剂浓度下随着反应时间的延长,少量草酸亚铁棒状颗粒会重新溶解生成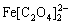 络合物(FeC2O4·2H2O+
络合物(FeC2O4·2H2O+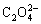 ==
==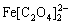 +2H2O),进而导致颗粒腐蚀和坍塌。SHEN等[62]分别采用水热和溶剂热的方法成功制备得到了球形和杆状的草酸铜材料,并指出溶剂对材料疏水性的作用抑制了颗粒的生长,从而表现出纳米化尺寸。但由于均一化和特殊的颗粒结构,微米级的球形颗粒却表现出优于纳米杆状颗粒的出色倍率和循环性能,在0.2和0.5 A/g电流密度下循环100次后,仍有高达970和809.5 mA·h/g。XU等[63]也通过控制反应过程中水含量得到了微米块状和一维纳米杆状草酸钴材料,并发现纳米杆状颗粒表现出稳定的小倍率循环性能。ARAGON等[33]通过对商业化和实验制备的纳米带状草酸钴电化学性能测试对比发现,由于商业化材料颗粒的不规则和结构缺陷导致其较差的倍率和循环性能。
+2H2O),进而导致颗粒腐蚀和坍塌。SHEN等[62]分别采用水热和溶剂热的方法成功制备得到了球形和杆状的草酸铜材料,并指出溶剂对材料疏水性的作用抑制了颗粒的生长,从而表现出纳米化尺寸。但由于均一化和特殊的颗粒结构,微米级的球形颗粒却表现出优于纳米杆状颗粒的出色倍率和循环性能,在0.2和0.5 A/g电流密度下循环100次后,仍有高达970和809.5 mA·h/g。XU等[63]也通过控制反应过程中水含量得到了微米块状和一维纳米杆状草酸钴材料,并发现纳米杆状颗粒表现出稳定的小倍率循环性能。ARAGON等[33]通过对商业化和实验制备的纳米带状草酸钴电化学性能测试对比发现,由于商业化材料颗粒的不规则和结构缺陷导致其较差的倍率和循环性能。
此外,MADHAVI等[64-65]针对溶剂热反应过程中溶剂种类的影响和不同形貌的演化机理进行了详细的探究。晶体结构的各向异性生长是晶体晶面间表面能差异化的结果。通过不同的溶剂体系可以控制离子交换反应,进而得到不同的形貌结构。他们发现在不同的溶剂体系下,草酸根离子呈现不同的电离程度并直接影响材料生长过程中反应物离子扩散动力学和中间产物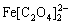 的浓度,进而导致一次颗粒不同的成核和生长速率。因此,利用这一特征,分别在N,N-二乙基乙酰胺(DEAc)和N-甲基-2-吡咯烷酮(NMP)两种溶剂条件下制备得到了蚕茧状和杆状的草酸亚铁颗粒。由于材料形貌、比表面积和封装密度的差异,两种结构的草酸亚铁表现出不同的电化学性能。而杆状结构草酸亚铁具有较高的比表面积和较大的电解液接触界面,也表现出较高的内部储锂性能。因此,较高的比表面积和较小的颗粒尺寸可以显著增强材料充放电过程中Li+的迁移过程,而稳定的形貌结构可以提高材料循环稳定性和容量保留。
的浓度,进而导致一次颗粒不同的成核和生长速率。因此,利用这一特征,分别在N,N-二乙基乙酰胺(DEAc)和N-甲基-2-吡咯烷酮(NMP)两种溶剂条件下制备得到了蚕茧状和杆状的草酸亚铁颗粒。由于材料形貌、比表面积和封装密度的差异,两种结构的草酸亚铁表现出不同的电化学性能。而杆状结构草酸亚铁具有较高的比表面积和较大的电解液接触界面,也表现出较高的内部储锂性能。因此,较高的比表面积和较小的颗粒尺寸可以显著增强材料充放电过程中Li+的迁移过程,而稳定的形貌结构可以提高材料循环稳定性和容量保留。
为了进一步分析材料晶体结构对微纳结构和储锂能力的影响,我们课题组对草酸亚铁层间结晶水和氢键作用进行了详细的讨论[55]。在三维层状结构中,一维链在b轴和c轴方向上均匀有序排布,且相邻链间通过水分子中氢键相连以保证层状框架的稳定性(见图4(g))。从理论上看,FeC2O4·2H2O失结晶水后,一维链沿b轴方向的层间间距(D2)较失结晶水前会有较大提升,这可以为Li+的扩散提供更为通畅的路径。然而,由于FeC2O4·2H2O三维框架结构非常脆弱,随着水分子的缺失,层间氢键支撑的减少,会导致层状结构沿b轴方向的收缩或塌陷。TOMINAKA等[29]就证明了结晶水和氢键网络的缺失容易导致八面体FeO6与草酸根基团沿a轴方向的堆叠障碍,并缩短了横向通道的层间间距(D2)。因此,从晶体结构角度考虑,层间结晶水可以稳定层间结构,为锂离子反复的嵌入/脱出提供弹性缓冲空间并能减缓结构破坏的程度。但通过对不同结晶水含量草酸亚铁材料电化学性能分析发现,结晶水会抑制锂离子的转换,从而表现出较差的储锂能力。在对草酸亚铁电极首次循环中物相组成进行研究时,发现中间产物Li2Fe(C2O4)2的形成,并在充电完成后仍有大量残存[34](见图4(h))。这可能是由于部分电化学反应产物,如金属纳米颗粒(Li、Fe)、复合产物(Li2Fe(C2O4)2、Li2C2O4)等,催化活性或反应活性较低,在初期循环过程中未能全部被激活,从而造成反应不完全和部分不可逆容量。因此,通过过渡金属草酸盐微纳结构和维度设计是实现材料稳定储锂,解决不可逆容量问题的关键。
3.2 掺杂-复合改性
目前,针对提升材料电导率和电化学活性的方法,应用最多的是多种材料间的掺杂和复合,包括金属元素间掺杂和高导电碳材料复合[66-67]。LOPEZ等[32]在对比各过渡金属草酸盐材料的电化学性能时发现:1) 草酸钴拥有更高的放电比容量,但是后期循环过程中容量衰减较大;2) 草酸锰和草酸亚铁材料拥有更加稳定的循环性能,但与草酸钴相比放电比容量较小;3) 草酸镍和草酸锌相较其他过渡金属草酸盐表现出较差的容量保持率和较低的放电比容量。如表2所示,分别列举了不同过渡金属草酸盐材料间差异化的储锂能力。因此,采用过渡金属材料相间掺杂,一方面可以充分优化不同草酸盐材料间特殊的储锂性能,提升元素间的相互协同效应;另一方面晶体间的掺杂可以提高材料电导率,也会诱导晶格畸变和结构缺陷,从而提高Li+在材料晶格中的扩散速率[68]。HE等[69]采用简单的电沉积技术和自腐蚀工艺,在金属铜箔上沉积形成纳米棒状Co/CoO,并以此为模板在其表面吸附纳米针状CoC2O4得到独特分层分支阵列架构的CoC2O4@ CoO/Co材料(见图5(a),(c),(d))。基于特殊的微纳结构、矩阵排列形式和内茎(CoO/Co)与分支(CoC2O4)之间的相互作用,复合电极表现出优异的循环稳定性和较高的储锂能力,在0.2 A/g电流密度下循环200次后,其放电比容量仍能稳定在800 mA·h/g(见图6(g))。PANG等[70]通过简单地化学沉淀法得到了CuC2O4/TiO2异构结构,在反应过程中主要利用TiO2与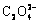 形成的配位体,使得Cu2+在加入反应溶液后会依靠TiO2颗粒生长,这不但可以减少添加剂的加入也可以得到结合程度优异的复合材料(见图5(b))。如图5(e)和(f)所示,WU等[37]采用无模板剂的共沉淀法成功制备得到海胆状Mn0.33Co0.67C2O4,虽然其具有较低的电导率,但由于特殊的结构组成和过渡金属元素间的协同效应,材料仍表现出出色的循环性能,在0.5A/g电流密度下,第二周期放电比容量高达924 mA·h/g,经过300次循环后仍有83%的容量保持。
形成的配位体,使得Cu2+在加入反应溶液后会依靠TiO2颗粒生长,这不但可以减少添加剂的加入也可以得到结合程度优异的复合材料(见图5(b))。如图5(e)和(f)所示,WU等[37]采用无模板剂的共沉淀法成功制备得到海胆状Mn0.33Co0.67C2O4,虽然其具有较低的电导率,但由于特殊的结构组成和过渡金属元素间的协同效应,材料仍表现出出色的循环性能,在0.5A/g电流密度下,第二周期放电比容量高达924 mA·h/g,经过300次循环后仍有83%的容量保持。
此外,金属元素的掺杂也会增强材料法拉第容量组成,提高Li+扩散控制容量,增强材料后期循环的能力。如图5 h,TIRADO课题组通过对Fe0.5Co0.5C2O4材料可逆容量的组成分析发现,掺杂后材料的法拉第容量远高于单一草酸盐材料,其在0.5 mV/s的扫描速率下,法拉第容量占比高达84%,在10 mV/s时也有64%[71]。此外,在对MxM′1-xC2O4·2H2O材料(MM′为FeMn和CoMn)的电化学性能进行考察时发现,Co0.7Mn0.3C2O4具有较高的放电比容量但循环稳定性较差,而Fe0.8Mn0.2C2O4表现出较低的储锂能力但拥有更加稳定的循环性能,如图5(i)所示[68]。这也充分说明在进行金属离子掺杂过程中需考虑过渡金属草酸盐各自的结构和储锂特性,使复合材料得到较好的电化学性能。
同时,新型碳材料(石墨烯、碳纳米管、碳纳米点、碳纳米角)较高的电子电导率和稳固的结构特征,在过渡金属草酸盐的改性研究中也逐渐引起人们的注意并开展了大量深入的实验研究。OH等[35]利用静电自组装技术,将纳米杆状草酸镍颗粒在静电作用下与氧化还原石墨烯吸附制备得到NiC2O4·2H2O/rGO复合材料,如图6(a)和(b)所示。由于氧化还原石墨烯较高的电子电导率和对材料的支撑作用,复合材料表现出优异的循环稳定性,在0.5 A/g电流密度下循环100次后仍有800 mA·h/g的放电比容量,且容量保持率高达85%。PARK等[36]采用同样的方法制备得到了SnC2O4/ rGO复合材料,在电化学性能测试时也发现,其首次放电比容量和充电可逆比容量均得到了大幅提升,分别为1763和1166 mA·h/g。ZHANG等[46]利用微波辅助的手段在低温条件下得到了CuC2O4·xH2O/ GO复合材料,在0.5、1.0和2.0 A/g的电流密度下,其放电比容量分别高达952、719和535 mA·h/g。此外,FENG等[72]通过共沉淀法和水热处理,结合金属离子掺杂和石墨烯复合,成功得到了Cu1/3Co2/3C2O4·xH2O/FGO复合材料,并发现金属元素之间的相互作用与石墨烯的高电导率共同维持了材料稳定的储锂能力,在1A/g的电流密度下经过200次循环后其放电比容量依然稳定在1134.9 mA·h/g。JO等[73]通过简单的球磨将纳米棒状CoC2O4与乙炔黑复合得到C-CoC2O4复合材料,并成功用于钠离子电池负极材料(见图6(c))。通过电化学性能测试发现,基于乙炔黑较高的导电能力,在0.2C(60 mA/g)电流密度下,材料表现出330 mA·h/g的放电比容量,循环200次后其容量保持仍稳定在75%。WANG等[75]也采用简单的液相沉淀法和超声技术成功制备得到CoC2O4/GO复合材料,并将其应用于钾离子电池也表现出一定的储钾特性,并为今后过渡金属草酸盐材料在其他离子电池的研究提供了参考。
表2 不同过渡金属草酸盐负极材料电化学性能对比
Table 2 Comparison of electrochemical performance for TMOxs anode materials
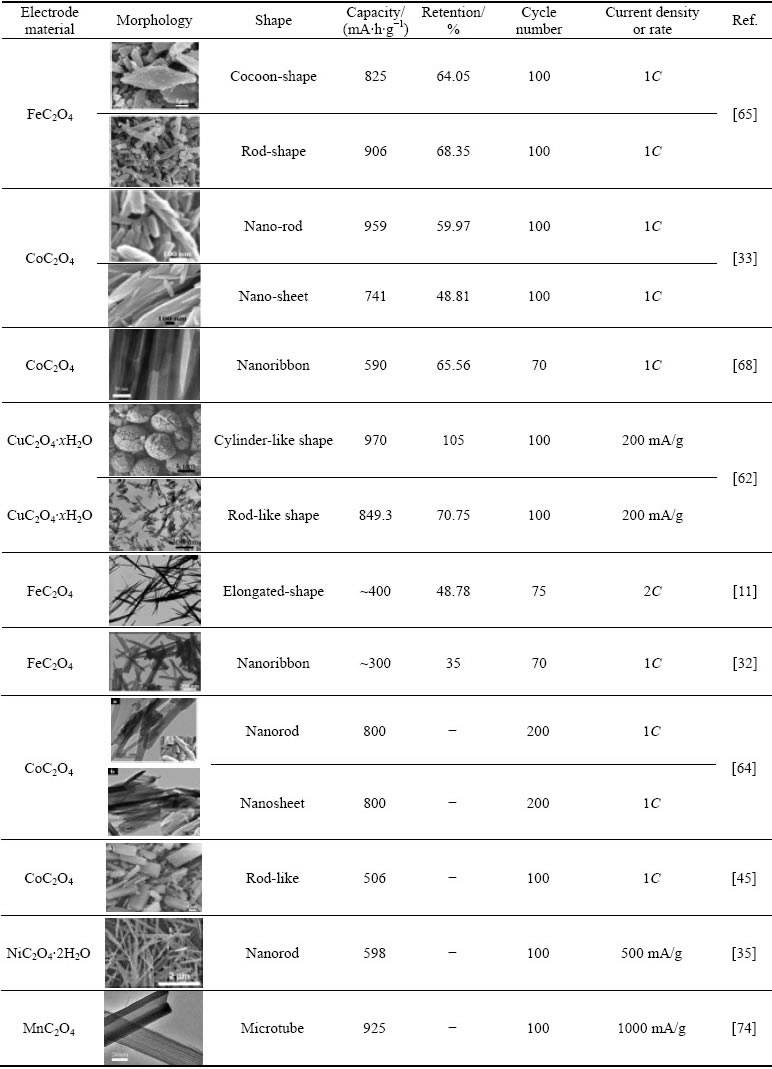
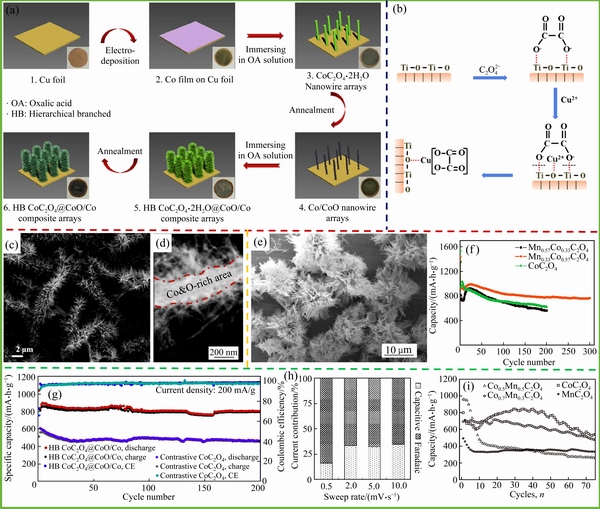
图5 原位制备CoC2O4@CoO/Co复合材料矩阵[69](a);CuC2O4/TiO2制备过程作用机理[70](b);CoC2O4@CoO/Co复合材料的SEM图像(c)和TEM图像[69](d);海胆状Mn0.33Co0.67C2O4的SEM图像[37](e);不同Mn、Co掺杂量材料的循环性能图[37](f);CoC2O4@CoO/Co复合材料的循环性能[69](g);Fe0.5Co0.5C2O4材料在不同扫描速率下的容量组成[71](h);FexMnyC2O4材料的循环性能[68](i)
Fig. 5 Schematic illustration for fabrication of in-situ formed hierarchically branched CoC2O4@CoO/Co composite arrays[69](a); Schematic illustration of interaction of 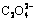 and CuC2O4 with TiO2 during synthesis process of CuC2O4/TiO2[70](b); SEM(c) and TEM(d) images of CoC2O4@CoO/Co composite arrays[69]; SEM images of as-prepared Mn0.33Co0.67C2O4[37](e); Long-term cycling performances of CoC2O4, Mn0.33Co0.67C2O4, and Mn0.67Co0.33C2O4 electrodes at current density of 500 mA/g[37](f); Cycling performances of CoC2O4@CoO/Co at 200 mA/g[69](g); Percentage of capacitive and faradaic contributions to total capacity of Fe0.5Co0.5C2O4 at different rates[71](h); Cycling performances of manganese-iron oxalates electrode materials[68](i)
and CuC2O4 with TiO2 during synthesis process of CuC2O4/TiO2[70](b); SEM(c) and TEM(d) images of CoC2O4@CoO/Co composite arrays[69]; SEM images of as-prepared Mn0.33Co0.67C2O4[37](e); Long-term cycling performances of CoC2O4, Mn0.33Co0.67C2O4, and Mn0.67Co0.33C2O4 electrodes at current density of 500 mA/g[37](f); Cycling performances of CoC2O4@CoO/Co at 200 mA/g[69](g); Percentage of capacitive and faradaic contributions to total capacity of Fe0.5Co0.5C2O4 at different rates[71](h); Cycling performances of manganese-iron oxalates electrode materials[68](i)
虽然近年来对过渡金属草酸盐材料形貌结构和掺杂改性研究不断深入,材料性能也得到了大幅度的提升,但研究重点仍停留在材料二次颗粒形貌和粒径优化上,对于颗粒构成、微观结构组成、晶体结构变化等研究仍然较少。因此,从材料颗粒的微观结构设计入手,改善材料离子和电子转移,进而提升其电化学性能是今后材料改性研究的一个重要的方向。
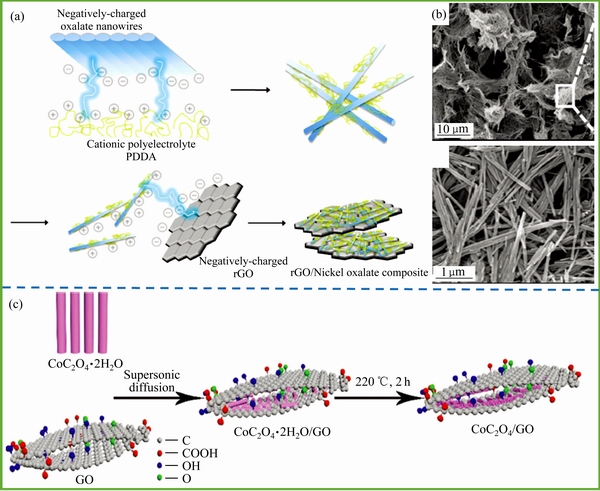
图6 静电自组装制备NiC2O4·2H2O/rGO材料示意图(a)和SEM图像[35](b)及CoC2O4/GO制备示意图[73](c)
Fig. 6 Schematic diagram of formation process for NiC2O4·2H2O/rGO composite[35](a); SEM images of as-synthesized NiC2O4·2H2O/rGO composite[35](b); Schematic diagram demonstrating synthesis of hybrid CoC2O4/GO[73](c)
4 面临挑战
通过对过渡金属草酸盐负极材料的储锂能力研究发现,其具有制备方法简单、比容量高、倍率性能好等优点,但其也存在首次充放电不可逆容量较大、循环稳定性差和材料完全失结晶水过程不易控制等缺点,如7所示。
1) 首次不可逆容量损失较高。如图7(a)所示,造成过渡金属草酸盐负极材料首次库伦效率低的主要原因有以下三点:① 在首次充放电过程中,材料与电解液在颗粒表面发生不可逆的分解,形成沉积SEI膜,并不断消耗Li+[23];② 由于首次放电结束后生成的金属纳米颗粒和草酸锂等电化学产物活性较差,在充电过程中并不能完全转化成过渡金属草酸盐,还会存在少量未反应的金属纳米颗粒和草酸基团Li2C2O4[71];③ 其他不明确的不可逆电化学反应过程,如少量Li2C2O4的分解等。
2) 循环稳定性差。过渡金属草酸盐负极材料循环稳定性差可归因于以下原因:① 材料本身较差的电子电导率和Li+迁移速率,直接影响了材料的电化学活性和电极反应的可逆性,导致充放电循环过程中容量波动较大,如图7(b)所示[34, 60, 71];② 材料颗粒结构应变能力差。Li+在材料内脱出/嵌入过程会导致一定程度的体积变化,而柔韧性较差的材料颗粒更容易发生粉化、破裂等现象,致使活性颗粒之间、活性颗粒与集流体之间失去电接触。这些失去电接触的颗粒不仅容易发生脱落影响电池安全,还会导致电极材料失活和容量衰减;③ 经过多次循环后,纳米金属颗粒和其他电化学反应产物会产生严重的团聚,影响Li+在材料内部的扩散,降低电极反应能力。
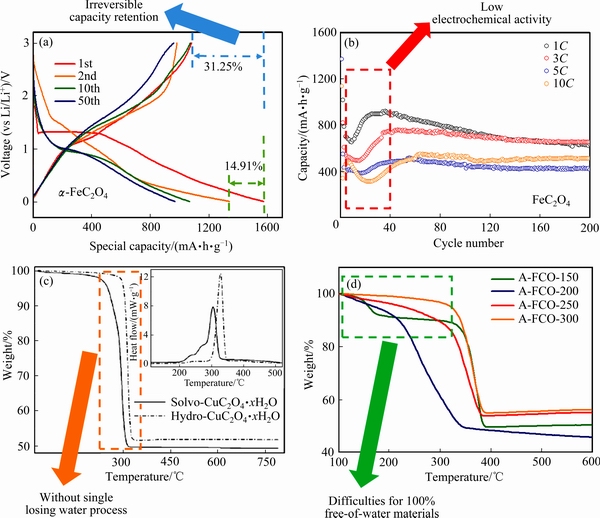
图7 FeC2O4材料充放电曲线[23](a);FeC2O4材料在不同电流密度下的循环曲线[60](b);CuC2O4·xH2O材料的热重曲线[62](c);不同温度处理后FeC2O4材料的热重曲线[55](d)
Fig. 7 Galvanostatic discharge/charge curves for FeC2O4[29](a); Galvanostatic cycling performance of FeC2O4[59](b); TGA patterns of CuC2O4·xH2O[62](c); TGA curves of FeC2O4·xH2O heated under various temperatures[55](d)
3) 材料热稳定性差。由于草酸盐材料特殊的热力学特性,导致材料失结晶水过程和草酸根分解过程并不明显,制备100%失结晶水材料更加困难[55]。如图7(c)和(d)所示,与其他过渡金属草酸盐材料相比,CuC2O4·xH2O材料并未表现出明显的失结晶水温度区间。在不同温度条件下处理的含结晶水草酸亚铁也表现出不同程度的结晶水剩余的情况。此外,结晶水的损失也会破坏材料颗粒的形貌结构,严重影响后期充放电循环的稳定性[76]。这些问题对含结晶水材料的后期烧结过程增加了制备难度。目前对于含结晶水草酸盐的热力学研究依旧以草酸盐分解及其热解产物为主,对失水过程和结构稳定性的研究较少。此外,含结晶水草酸盐材料的储锂能力依然集中于草酸铜的电化学能力研究,而在其他草酸盐材料中,结晶水的具体作用仍未见相关的报道。
5 结语
过渡金属草酸盐基于其高比容量、优异的倍率性能、简单的制备工艺和丰富的资源,不仅在碱金属(Li、Na、K等)离子电池负极材料方面具有广阔的应用前景,而且在超级电容器电极材料、燃料电池和金属空气电池催化剂等领域也有很大的应用潜力。然而,过渡金属草酸盐自身较差的电子电导率和Li+迁移速率容易导致产物较差的电化学反应活性,进而引起较高的不可逆容量,同时不稳定的层状结构也会造成颗粒的破裂和差的循环稳定性。因此,需要开发具有稳定微纳结构和电化学反应活性的过渡金属草酸盐材料。目前的研究主要集中于材料形貌控制、碳材料复合、金属元素掺杂等策略来调控电子和Li+传输以及材料的反应活性。其中,材料形貌调控在一定程度上能够改善Li+扩散,提升结构稳定性,然而此策略却未能解决材料电化学反应活性低的问题。此外,Li+扩散通道的优化仍需结合理论计算来理性设计材料微纳结构,进而调节材料快充-快放特性。基于金属掺杂和碳复合改善电子电导率的方法虽能有效提升反应产物电化学活性,但并未解决材料结构稳定性差的问题。因此,与商业化负极材料相比,过渡金属草酸盐不可逆容量高、循环寿命短等问题仍需要从以下几个方面解决:
1) 过渡金属草酸盐电化学储锂机制:电极材料的实际放电比容量远高于其理论值,说明在充放电过程中,Li+传输和电化学反应过程更为复杂。虽然很多研究人员也对其电化学反应过程进行了解释,但研究仍主要集中于材料转换反应的验证和草酸锂的存在形式上。对于其它副反应和储锂方式的研究依然较少,首次充放电过程中不可逆容量的产生原因仍不明晰。因此,深入、系统的研究材料电化学反应机制,揭示不可逆容量的主要来源可以为材料性能改善研究提供理论基础。
2) 材料微纳结构优化和多种复合材料协同调控:充分利用不同电极材料间的协同效应和材料微纳结构设计优化等手段,结合理论计算设计兼具稳定性结构和优异电化学反应活性的复合材料,进而实现高容量、长寿命和快充-快放特性。
3) 结晶水对材料储锂性能的影响:过渡金属草酸盐特殊的热力学特性导致材料失结晶水过程和草酸盐分解过程差异并不明显,获得100%失结晶水材料更加困难。需要结合理论计算来解析结晶水在材料层状结构和储锂过程中争议性作用,建立含结晶水材料微纳结构调控与电化学反应动力学的构效关系。
目前过渡金属草酸盐基负极材料在锂离子电池储能体系中的应用仍面临着许多基础性问题,有待进一步探索。总之,通过对过渡金属草酸盐基负极材料微纳结构优化与理论计算相结合,探索电化学反应机理和不可逆容量的主要来源对于推动材料的基础科学研究和商业化均具有重要的意义。
REFERENCES
[1] Armand M, Tarascon J M. Building better batteries[J]. Nature. 2008, 451: 652-657.
[2] Nagaura T. Lithium ion rechargeable battery[J]. Progress in Batteries & Solar Cells, 1990, 9: 209-217.
[3] Mo Run-wei, Lei Zheng-yu, Sun Ke-ning, et al. Facile synthesis of anatase TiO2 quantum-dot/graphene-nanosheet composites with enhanced electrochemical performance for lithium-ion batteries[J]. Advanced Materials, 2014, 26(13): 2084-2088.
[4] Chan C K, Peng H, Liu Gao, et al. High-performance lithium battery anodes using silicon nanowires[J]. Nature Nanotechnology, 2008, 3(1): 31-35.
[5] Xu Ru-hui, Wei Run-hong, Hu Xue-jun, et al. A strategy and detailed explanations to the composites of Si/MWCNTs for lithium storage[J]. Carbon, 2021, 171: 265-275.
[6] SU Xin, Wu Qing-liu, Li Ju-chuan, et al. Silicon-based nanomaterials for lithium-ion batteries: A review[J]. Advanced Energy Materials, 2014, 4(1): 1300882.
[7] JIN Yan, ZHU Jia, ZHU Bin, et al. Challenges and recent progress in the development of Si anodes for lithium-ion battery[J]. Advanced Energy Materials, 2017, 7(23): 1700715.
[8] Poizot P L S G, Laruelle S, Grugeon S, et al. Nano-sized transition-metal oxides as negative-electrode materials for lithium-ion batteries[J]. Nature, 2000, 407(6803): 496-499.
[9] Zhang Wei-ming, Wu Xing-long, Hu Jin-song, et al. Carbon coated Fe3O4 nanospindles as a superior anode material for lithium-ion batteries[J]. Advanced Functional Materials, 2008, 18(24): 3941-3946.
[10] Aoki Y, Hiroi M. Cupric oxalate, a new cathode material for reserve batteries[J]. Electrochimica Acta, 1968, 13(7): 1563-1568.
[11] Aragón M J, León B, Perez V C, et al. Synthesis and electrochemical reaction with lithium of mesoporous iron oxalate nanoribbons[J]. Inorganic Chemistry, 2008, 47(22): 10366-10371.
[12] Zhang Ying-ying, Wang Can-pei, Dong Yu-tao, et al. Understanding the high-performance anode material of CoC2O4·2H2O microrods wrapped by reduced graphene oxide for lithium-ion and sodium-ion batteries[J]. Chemistry-A European Journal, 2021, 27(3): 993-1001.
[13] Service R F. Catalyst offers new hope for capturing CO2 on the cheap[J]. Science, 2010, 327: 257.
[14] Yeoh J S, Armer C F, Lowe A. Transition metal oxalates as energy storage materials. A review[J]. Materials Today Energy, 2018, 9: 198-222.
[15] Jo C H, Jo J H, Choi J U, et al. Oxalate- based high-capacity conversion anode for potassium storage[J]. ACS Sustainable Chemistry & Engineering, 2020, 8(9): 3743-3750.
[16] Sahu K K, Sahoo R K, Beshra L D, et al. Facile synthesis of nickel oxalate@ carbon as electrical double layer and its derived nickel oxide as pseudo-type supercapacitor electrodes[J]. Ionics, 2021, 27(2): 819-832.
[17] Baran E J. Natural iron oxalates and their analogous synthetic counterparts: A review[J]. Geochemistry, 2016, 76(3): 449-460.
[18] Anwani S, Methekar R, Ramadesigan V. Life cycle assessment and economic analysis of acidic leaching and baking routes for the production of cobalt oxalate from spent lithium-ion batteries[J]. Journal of Material Cycles and Waste Management, 2020, 22(6): 2092-2106.
[19] Baran E J. Natural oxalates and their analogous synthetic complexes[J]. Journal of Coordination Chemistry, 2014, 67(23/24): 3734-3768.
[20] Müller H, Bourcet L, Hanfland M. Iron (Ⅱ) oxalate dihydrate-humboldtine: Synthesis, spectroscopic and structural properties of a versatile precursor for high pressure research[J]. Minerals, 2021, 11(2): 113.
[21] Simizu S, Friedberg S. A. Quasi one and two- dimensional antiferromagnetism in α-FeC2O4·2H2O and α-MnC2O4·2H2O[J]. Journal of Applied Physics, 1988, 63(8): 3557-3559.
[22] amada T, Sadakiyo M, Kitagawa H. High proton conductivity of one-dimensional ferrous oxalate dihydrate[J]. Journal of the American Chemical Society, 2009, 131(9): 3144-3145.
[23] Zhang Ke-yu, Li Yin, Wang Yun-ke, et al. Enhanced electrochemical properties of iron oxalate with more stable Li+ ions diffusion channels by controlling polymorphic structure[J]. Chemical Engineering Journal, 2020, 384: 123281.
[24] Lethbridge Z A D, Congreve A F, Esslemont E, et al. Synthesis and structure of three manganese oxalates: MnC2O4·2H2O, [C4H8(NH2)2][Mn2(C2O4)3] and Mn2(C2O4)(OH)2[J]. Journal of Solid State Chemistry, 2003, 172(1): 212-218.
[25] Zwiener L, Girgsdies F, Schlogl R, et al. Investigations of Cu/Zn oxalates from aqueous solution: Single-phase precursors and beyond[J]. Chemistry-A European Journal, 2018, 24(56): 15080-15088.
[26] Kondrashev Y D, Bogdanov V S, Golubev S N. Crystal structure of the ordered phase of zinc oxalate and the structure of anhydrous Fe2+, Co2+, Ni2+, Cu2+, and Zn2+ oxalates[J]. Journal of Structural Chemistry, 1985, 26(1): 74-77.
[27] D'Antonio M C, Wladimirsky A, Palacios D, et al. Spectroscopic investigations of iron (Ⅱ) and iron (Ⅲ) oxalates[J]. Journal of the Brazilian Chemical Society, 2009, 20: 445-450.
[28] Cai Jing-hua, Lan Yuan-qi, He Hai-yan, et al. Synthesis, structure, and electrochemical properties of some cobalt oxalates[J]. Inorganic Chemistry, 2020, 59(23): 16936-16943.
[29] Tominaka S, Cheetham A K. Intrinsic and extrinsic proton conductivity in metal-organic frameworks[J]. RSC Advances, 2014, 4: 54382-54387.
[30] Angermann A, Topfer J. Synthesis of magnetite nanoparticles by thermal decomposition of ferrous oxalate dihydrate[J]. Journal of Materials Science, 2008, 43(15): 5123-5130.
[31] Puzan A N, Baumer V N, Lisovytskiy D V, et al. Structure transformations in nickel oxalate dihydrate NiC2O4·2H2O and nickel formate dihydrate Ni(HCO2)2·2H2O during thermal decomposition[J]. Journal of Solid State Chemistry, 2018, 266: 133-142.
[32] López M C, Tirado J L, Vicente C P. Structural and comparative electrochemical study of M(Ⅱ) oxalates, M=Mn, Fe, Co, Ni, Cu, Zn[J]. Journal of Power Sources, 2013, 227: 65-71.
[33] Aragoon M J, Leon B, Perez V C, et al. Cobalt oxalate nanoribbons as negative-electrode material for lithium-ion batteries[J]. Chemistry of Materials, 2009, 21(9): 1834-1840.
[34] ZHANG Ke-yu, CUI Ding-fang, HUANG Xiao-peng, et al. Insights into the interfacial chemistry and conversion mechanism of iron oxalate toward the reduction by lithium[J]. Chemical Engineering Journal, 2021, 426: 131446.
[35] Oh H J, Jo C H, Yoon C S, et al. Nickel oxalate dihydrate nanorods attached to reduced graphene oxide sheets as a high-capacity anode for rechargeable lithium batteries[J]. NPG Asia Materials, 2016, 8(5): e270.
[36] Park J S, Jo J H, Yashiro H, et al. Synthesis and electrochemical reaction of tin oxalate-reduced graphene oxide composite anode for rechargeable lithium batteries[J]. ACS Applied Materials & Interfaces, 2017, 9(31): 25941-25951.
[37] Wu Xue-hang, Guo Jiang-huai, McDonald M J, et al. Synthesis and characterization of urchin-like Mn0.33Co0.67C2O4 for Li-ion batteries: Role of SEI layers for enhanced electrochemical properties[J]. Electrochimica Acta, 2015, 163: 93-101.
[38] Alcantara R, Madrigal F F, Lavela P, et al. Tin oxalate as a precursor of tin dioxide and electrode materials for lithium-ion batteries[J]. Journal of Solid State Electrochemistry, 2001, 6(1): 55-62.
[39] Aragón M J, León B, Vicente C P, et al. On the use of transition metal oxysalts as conversion electrodes in lithium-ion batteries[J]. Journal of Power Sources, 2009, 189(1): 823-827.
[40] Zhukovskii Y F, Kotomin E A, Balaya P, et al. Enhanced interfacial lithium storage in nanocomposites of transition metals with LiF and Li2O: Comparison of DFT calculations and experimental studies[J]. Solid State Sciences, 2008, 10(4): 491-495.
[41] Du Meng, Li Qing, Pang Huan. Oxalate-derived porous prismatic nickel/nickel oxide nanocomposites toward lithium-ion battery[J]. Journal of Colloid and Interface Science, 2020, 580: 614-622.
[42] Zhang Ke-yu, Yang Xiao-yan, Wu Jian, et al. Optimization of the process parameters for the synthesis process of battery-grade ferrous oxalate by response surface method[J]. Nano, 2016, 11(11): 1650123.
[43] Vu A, Qian Yu-qiang, Stein A. Porous electrode materials for lithium-ion batteries-how to prepare them and what makes them special[J]. Advanced Energy Materials, 2012, 2(9): 1056-1085.
[44] Li Nan, Li Qin, Yuan Mei-juan, et al. Synthesis of Co0.5Mn0.1Ni0.4C2O4·nH2O micropolyhedrons: Multimetal synergy for high-performance glucose oxidation catalysis[J]. Chemistry-An Asian Journal, 2019, 14(13): 2259-2265.
[45] Ang Wei An Elijah, Cheah Yan-ling, Wong Chui-ling, et al. One-pot solvothermal synthesis of Co1-xMnxC2O4 and their application as anode materials for lithium-ion batteries[J].Journal of Alloys and Compounds, 2015, 638: 324-333.
[46] Zhang Chi, Zheng Bin-feng, Song Zhi, et al. Microwave-assisted synthesis of a novel CuC2O4·xH2O/ Graphene composite as anode material for lithium ion batteries[J]. Ceramics International, 2020, 46(1): 1018-1025.
[47] Zhang Da, Zhang Ke-yu, Yao Yao-chun, et al. Intercalation and exfoliation syntheses of high specific surface area graphene and FeC2O4/graphene composite for anode material of lithium ion battery[J]. Fullerenes, Nanotubes and Carbon Nanostructures, 2019, 27(9): 746-754.
[48] Zhao Cheng-lan, Jiang Yu-qian, Liang Shun-fei, et al. Two-dimensional porous nickel oxalate thin sheets constructed by ultrathin nanosheets as electrode materials for high- performance aqueous supercapacitors[J]. CrystEngComm, 2020, 22(17): 2953-2963.
[49] Wei Xin, Zhang Shi-chao, Du Zhi-jia, et al. Electrochemical performance of high-capacity nanostructured Li[Li0.2Mn0.54Ni0.13Co0.13]O2 cathode material for lithium ion battery by hydrothermal method[J]. Electrochimica Acta, 2013, 107: 549-554.
[50] Luo Hao, Zou Ding-bing, Zhou Lin-gang, et al. Ionic liquid-assisted synthesis of transition metal oxalates via one-step solid-state reaction[J]. Journal of Alloys and Compounds, 2009, 481(1/2): L12-L14.
[51] Kim Jin-Won, Lee Jae-Kwang, Choi Jinsub, et al. Facile preparation of SnC2O4 nanowires for anode materials of a Li ion battery[J]. Current Applied Physics, 2014, 14(6): 892-896.
[52] Bian Hai-dong, Tian Ya-yuan, Lee Chris, et al. Mesoporous SnO2 nanostructures of ultrahigh surface areas by novel anodization[J]. ACS Applied Materials & Interfaces, 2016, 8(42): 28862-28871.
[53] Wu Zheng-cui, Yu Kuai, Zhang Shu-dong, et al. Hematite hollow spheres with a mesoporous shell: Controlled synthesis and applications in gas sensor and lithium ion batteries[J]. The Journal of Physical Chemistry C, 2008, 112(30): 11307-11313.
[54] Ahmad T, Chopra R, Ramanujachary K V, et al. Nanorods of copper and nickel oxalates synthesized by the reverse micellar route[J]. Journal of Nanoscience and Nanotechnology, 2005, 5(11): 1840-1845.
[55] Zhang Ke-yu, Li Yin, Hu Xue-jun, et al. Inhibitive role of crystal water on lithium storage for multilayer FeC2O4·xH2O anode materials[J]. Chemical Engineering Journal, 2021, 404: 126464.
[56] Vaidya S, Rastogi P, Agarwal S, et al. Nanospheres, nanocubes, and nanorods of nickel oxalate: control of shape and size by surfactant and solvent[J]. The Journal of Physical Chemistry C, 2008, 112(33): 12610-12615.
[57] de Mello Donegá C, Liljeroth P, Vanmaekelbergh D. Physicochemical evaluation of the hot-injection method, a synthesis route for monodisperse nanocrystals[J]. Small, 2005, 1(12): 1152-1162.
[58] Zhang Ke-yu, Xu Ru-hui, Wei Run-hong, et al. Tunable polymorph and morphology synthesis of iron oxalate nanoparticles as anode materials for lithium ion batteries[J]. Materials Chemistry and Physics, 2020, 243: 122676.
[59] Garnweitner G, Niederberger M. Nonaqueous and surfactant-free synthesis routes to metal oxide nanoparticles[J]. Journal of the American Ceramic Society, 2006, 89(6): 1801-1808.
[60] Zhang Ke-yu, Liang Feng, Wang Yun-ke, et al. Multilayer iron oxalate with a mesoporous nanostructure as a high-performance anode material for lithium-ion batteries[J]. Journal of Alloys and Compounds, 2019, 779: 91-99.
[61] Pang Huan, Wang Li, Zhao Zhang, et al. Controlled fabrication of iron oxalate hydrate microstructures and study of their electrochemical properties[J]. International Journal of Electrochemical Science, 2013, 8(3): 4174-4182.
[62] Kang Wen-pei, Shen Qiang. The shape-controlled synthesis and novel lithium storage mechanism of as-prepared CuC2O4·xH2O nanostructures[J]. Journal of Power Sources, 2013, 238: 203-209.
[63] Xu Jun-min, He Lei, Liu Hui, et al. Controlled synthesis of porous anhydrous cobalt oxalate nanorods with high reversible capacity and excellent cycling stability[J]. Electrochimica Acta, 2015, 170: 85-91.
[64] Ang Wei-an, Cheah Yan-ling, Wong Chui-ling, et al. Mesoporous cobalt oxalate nanostructures as high- performance anode materials for lithium-ion batteries: Ex situ electrochemical mechanistic study[J]. The Journal of Physical Chemistry C, 2013, 117(32): 16316-16325.
[65] Ang Wei-an, Gupta N, Prasanth R, et al. High- performing mesoporous iron oxalate anodes for lithium-ion batteries[J]. ACS Applied Materials & Interfaces, 2012, 4(12): 7011-7019.
[66] Zhang Ke-yu, Zhang Da, Li Yin, et al. FeC2O4@ Fe2O3/rGO composites with a novel interfacial characteristic and enhanced ultrastable lithium storage performance[J]. Applied Surface Science, 2020, 507: 145051.
[67] Zhang Ke-yu, Li Yin, Wang Yun-ke, et al. Study on the morphologies and electrochemical properties of the iron oxalate/graphene sheet composite with different polymorphs[J]. Materials Letters, 2019, 238: 187-190.
[68] León B, Vicente C P, Tirado J L. New mixed transition metal oxysalts as negative electrode materials for lithium-ion batteries[J]. Solid State Ionics, 2012, 225: 518-521.
[69] He Zhi-shun, Huang Liang-Ai, Guo Jian-feng, et al. Novel hierarchically branched CoC2O4@CoO/Co composite arrays with superior lithium storage performance[J]. Energy Storage Materials, 2020, 24: 362-372.
[70] Pang Yu-hua, Zhang Jun-ke, Feng Cai-xia, et al. Highly efficient visible light photocatalysis of CuC2O4/TiO2 nanocomposite based on photoinduced interfacial charge transfer[J]. Applied Surface Science, 2018, 457: 764-772.
[71] Aragón M J, León B, Serrano T, et al. Synergistic effects of transition metal substitution in conversion electrodes for lithium-ion batteries[J]. Journal of Materials Chemistry, 2011, 21(27): 10102-10107.
[72] Feng Fan, Kang Wen-pei, Yu Fa-qi, et al. High-rate lithium storage capability of cupric-cobaltous oxalate induced by unavoidable crystal water and functionalized graphene oxide[J]. Journal of Power Sources, 2015, 282: 109-117.
[73] Jo Chang-Heum, Yashiro Hitoshi, Yuan Shuai, et al. Conversion chemistry of cobalt oxalate for sodium storage[J]. ACS Applied Materials & Interfaces, 2018, 10: 40523-40530.
[74] Yang Y, He L, Lu J, et al. Rapid assemble of MnC2O4 microtubes using a microchannel reactor and their use as an anode material for lithium-ion batteries[J]. Electrochimica Acta, 2019, 321: 134673.
[75] Wang Li-feng, Wei Kai-yuan, Zhang Peng-jun, et al. Porous CoC2O4/graphene oxide nanocomposite for advanced potassium-ion storage[J]. Journal of Nanoscience and Nanotechnology, 2019, 19(6): 3610-3615.
[76] Zhang Ke-yu, Gao Geng, Li Yin, et al. Ferrous-cupric oxalate hydrate combined with multiwalled carbon nanotubes composite anodes for lithium-ion batteries[J]. Materials Letters, 2020, 266: 127476.
Recent progress in lithium storage mechanism and performance regulation strategies for transition metal oxalates
ZHANG Ke-yu1, 2, CUI Ding-fang1, 3, GAO Geng1, 2, ZHANG Li-bo1, YANG Bin1, 2, DAI Yong-nian1, 2, YAO Yao-chun1, 2
(1. Faculty of Metallurgy and Energy Engineering, Kunming University of Science and Technology, Kunming 650093, China;
2. National Local Joint Engineering Laboratory of Lithium Ion Battery and Material Preparation Technology, Kunming University of Science and Technology, Kunming 650093, China;
3. Yunnan Chihong International Germanium Industry Co., Ltd., Qujing 655011, China)
Abstract: Transition metal oxalates (TMOxs) exhibit great application potential as anode materials for high-energy density in lithium ion batteries, because of their higher electrochemical capacity, more excellent rate performance, and environmental friendliness. However, the lower electronic conductivity and slower migration of Li+ cause the formation of plenty of electrochemical production (metal nanoparticles and oxalate matrix) with reaction activity during the initial cycles, which creates larger irreversible capacity. In addition, a certain degree of disorder for their three-dimensional (3D) multi-layered structure can result in the collapse and crack around the edge of layer in micro- or nano-particles and shorten the cycling life of electrode materials. Furthermore, because of the similar temperatures for decomposition and losing crystalline water, the complete utilization of TMOxs is also challenged by the difficulty to obtain 100% free water material through dehydration. This paper detailedly reviews various crystal structures of TMOxs. Based on the understanding of confronting challenges and energy storage mechanism for TMOxs, such as the conversion reaction and interface characteristics during cycling, the modified strategies, especially in controlling of morphologies and micro-nano structure and elevating the electrochemical reactive activation for outcoming, are deeply analyzed. This paper also provides wide reference for promoting the fundamental researching and commercial application of high-energy TMOxs as anode materials in lithium-ion batteries.
Key words: transition metal oxalate; energy storage mechanism; conversion reaction; micro-nano structure regulation; lithium ion batteries; research progress
Foundation item: Projects(52064031, 52104302) supported by National Natural Science Foundation of China; Project(2018HB012) supported by Natural Science Foundation of Yunnan Province, China
Received date: 2021-09-01; Accepted date: 2021-10-27
Corresponding authors: YAO Yao-chun, Tel: +86-15887858024; E-mail: yaochun9796@163.com
ZHANG Ke-yu; Tel: +86-15512233572; E-mail: lkdzky@163.com, zhangkeyu@kust.edu.cn
(编辑 龙怀中)
基金项目:国家自然科学基金资助项目(52064031,52104302);云南省自然科学基金资助项目(2018HB012)
收稿日期:2021-09-01;修订日期:2021-10-27
通信作者:姚耀春,教授,博士;电话:15887858024;E-mail:yaochun9796@163.com
张克宇,讲师,博士;电话:15512233572;E-mail:lkdzky@163.com, zhangkeyu@kust.edu.cn
摘 要:过渡金属草酸盐基于其高比容量、优异的倍率性能、简单的制备工艺和丰富的资源等优势,在高能量锂离子电池储能领域拥有巨大的应用潜力。然而由于其较低的电子电导率和Li+迁移速率,在循环过程中会形成大量电化学反应活性较低的金属纳米粒子和聚合物,引起更高的不可逆容量,并且不稳定的层状结构会造成颗粒的破裂,导致电池的循环寿命较差。此外,过渡金属草酸盐特殊的热力学特性,导致获得100%失结晶水材料更加困难。本文综述了过渡金属草酸盐材料的晶体结构特征,基于对储锂过程中材料转换过程的理解和界面特性等机理研究并结合材料面临的主要挑战,深入分析了近年来在形貌微纳结构调控和增强产物反应活性等方面的改性策略及其作用机理,为推动高能量密度过渡金属草酸盐基负极材料在锂离子电池方面的基础科学研究和商业化应用提供借鉴参考。

 LixM,M为Si、Sn等,如图1(b)所示),因其价格低廉、嵌锂容量高(4200 mA·h/g)、安全性好,被誉为最具应用潜力的锂离子动力电池负极材料[4-5]。但其显著的体积效应(>300%)、不稳定的固相电解质层(SEI)和较低的首次库伦效率,导致了材料较差的循环稳定性[6-7]。2000年,POIZOT小组首次报道了具有高比容量和倍率性能的锂离子电池过渡金属氧化物负极材料,其电化学反应机理为MOx+2xLi++e
LixM,M为Si、Sn等,如图1(b)所示),因其价格低廉、嵌锂容量高(4200 mA·h/g)、安全性好,被誉为最具应用潜力的锂离子动力电池负极材料[4-5]。但其显著的体积效应(>300%)、不稳定的固相电解质层(SEI)和较低的首次库伦效率,导致了材料较差的循环稳定性[6-7]。2000年,POIZOT小组首次报道了具有高比容量和倍率性能的锂离子电池过渡金属氧化物负极材料,其电化学反应机理为MOx+2xLi++e
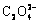 )而形成的3D插层结构。如图2(a)~(e)所示,在晶胞中金属M原子与周围四个氧原子通过M—O金属单键相连形成八面体结构,而后与两个碳原子组成五元环鳌合物,并依次沿b轴方向延伸排列,形成一维链状结构[26-28]。而对于含结晶水材料,水分子分别位于MO6八面体a轴方向上的两个位点,但对整体链状结构并未有较大的影响。这些一维链沿a和c轴方向竖直排列,从而形成横向和纵向的插层结构(见图2(b)~(c))。由于层间水分子形成的氢键排列的差异以及层间堆叠缺陷,两种晶体结构呈现出明显的三维层状结构差异[29-30]。而γ-MnC2O4·2H2O晶体中扭曲的MnO6八面体是由两个水分子和四个草酸盐中氧原子组成(见图2(d))。这导致沿c轴方向的扭曲八面体单元中上下两个顶角氧原子与相邻链间形成共享配位体[24]。此外,如图2(f)~(h)所示,α-CuC2O4·2H2O和β-ZnC2O4的晶体结构也表现出与γ-MnC2O4·2H2O相类似的结构特征,这可能是由金属原子与氧原子成键结合能以及与草酸根结合形式的差异所导致的。表1所示为不同过渡金属草酸盐材料的晶体结构参数,差异化的原子排布和空间体积也会导致材料储锂能力的不同[23, 31]。本文作者课题组详细对比了α-FeC2O4·2H2O和β-FeC2O4·2H2O晶体结构间的差异,通过Rietveld精修和DFT理论计算,发现α-FeC2O4·2H2O表现出更宽和更稳定的层间锂离子扩散通道(D3=5.158
)而形成的3D插层结构。如图2(a)~(e)所示,在晶胞中金属M原子与周围四个氧原子通过M—O金属单键相连形成八面体结构,而后与两个碳原子组成五元环鳌合物,并依次沿b轴方向延伸排列,形成一维链状结构[26-28]。而对于含结晶水材料,水分子分别位于MO6八面体a轴方向上的两个位点,但对整体链状结构并未有较大的影响。这些一维链沿a和c轴方向竖直排列,从而形成横向和纵向的插层结构(见图2(b)~(c))。由于层间水分子形成的氢键排列的差异以及层间堆叠缺陷,两种晶体结构呈现出明显的三维层状结构差异[29-30]。而γ-MnC2O4·2H2O晶体中扭曲的MnO6八面体是由两个水分子和四个草酸盐中氧原子组成(见图2(d))。这导致沿c轴方向的扭曲八面体单元中上下两个顶角氧原子与相邻链间形成共享配位体[24]。此外,如图2(f)~(h)所示,α-CuC2O4·2H2O和β-ZnC2O4的晶体结构也表现出与γ-MnC2O4·2H2O相类似的结构特征,这可能是由金属原子与氧原子成键结合能以及与草酸根结合形式的差异所导致的。表1所示为不同过渡金属草酸盐材料的晶体结构参数,差异化的原子排布和空间体积也会导致材料储锂能力的不同[23, 31]。本文作者课题组详细对比了α-FeC2O4·2H2O和β-FeC2O4·2H2O晶体结构间的差异,通过Rietveld精修和DFT理论计算,发现α-FeC2O4·2H2O表现出更宽和更稳定的层间锂离子扩散通道(D3=5.158 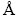 )。并基于此特性,材料在0.5和5 A/g电流密度下,循环100次后,其放电比容量仍高达1073.17和841.24 mA·h/g。
)。并基于此特性,材料在0.5和5 A/g电流密度下,循环100次后,其放电比容量仍高达1073.17和841.24 mA·h/g。



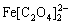 络合物(FeC2O4·2H2O+
络合物(FeC2O4·2H2O+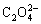 ==
==

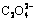 and CuC2O4 with TiO2 during synthesis process of CuC2O4/TiO2[70](b); SEM(c) and TEM(d) images of CoC2O4@CoO/Co composite arrays[69]; SEM images of as-prepared Mn0.33Co0.67C2O4[37](e); Long-term cycling performances of CoC2O4, Mn0.33Co0.67C2O4, and Mn0.67Co0.33C2O4 electrodes at current density of 500 mA/g[37](f); Cycling performances of CoC2O4@CoO/Co at 200 mA/g[69](g); Percentage of capacitive and faradaic contributions to total capacity of Fe0.5Co0.5C2O4 at different rates[71](h); Cycling performances of manganese-iron oxalates electrode materials[68](i)
and CuC2O4 with TiO2 during synthesis process of CuC2O4/TiO2[70](b); SEM(c) and TEM(d) images of CoC2O4@CoO/Co composite arrays[69]; SEM images of as-prepared Mn0.33Co0.67C2O4[37](e); Long-term cycling performances of CoC2O4, Mn0.33Co0.67C2O4, and Mn0.67Co0.33C2O4 electrodes at current density of 500 mA/g[37](f); Cycling performances of CoC2O4@CoO/Co at 200 mA/g[69](g); Percentage of capacitive and faradaic contributions to total capacity of Fe0.5Co0.5C2O4 at different rates[71](h); Cycling performances of manganese-iron oxalates electrode materials[68](i)

