文章编号:1004-0609(2016)02-0337-10
阳极氧化制备TiO2纳米管阵列的生长特性
邹俭鹏1,唐宁馨1,李红超1,杨洪志1,肖 平2,潘一峰2
(1. 中南大学 粉末冶金国家重点实验室,长沙 410083;
2. 中南大学 湘雅医院,长沙 410008)
摘 要:基于TiO2纳米管薄膜的广泛应用前景,采用阳极氧化的方法制备高度规则排列的TiO2纳米管阵列,研究外加电压、阳极氧化时间、电解液(NH4F+乙二醇)浓度、电解液体系对纳米管阵列生长特性的影响。结果表明:随着外加电压从10 V增大到30 V,纳米管的管径和管壁逐渐由22 nm和4.5 nm分别增至82 nm和10 nm,而纳米管密度由2240 μm-2降至200 μm-2。纳米管阵列出现的临界阳极氧化时间为5 min,且随着氧化时间延长,纳米管的长度随之增加,当氧化时间增至2 h时,纳米管长度增至4 μm,此后,纳米管长度不再增长。在含F-的有机电解液体系中可制备规则的纳米管阵列,当电解液(NH4F+乙二醇)浓度增加到0.2 mol/L后,出现清晰的纳米管管状结构,这是由于F-和乙二醇的存在对于TiO2纳米管阵列的形成具有至关重要的作用,F-与Ti4+形成的[TiF6]2-能延缓钛箔阳极的氧化进程,促使钛箔表面形成微孔;而乙二醇则有助于提高电解液的黏度,降低F-的扩散速率,保证TiO2纳米管阵列的稳定生长。
关键词:TiO2;阳极氧化法;纳米管阵列;生长特性
中图分类号:O643 文献标志码:A
二氧化钛是一种重要的无机功能材料,由于其具有无毒、气敏、湿敏、介电效应、光电转换、光致变色及催化活性高、稳定性好等优点[1-3]而被广泛应用于自洁材料、介电材料、催化剂载体、传感器、光催化太阳能电池、光裂解水制氢以及光催化降解大气和水中污染物等领域[4-5]。TiO2纳米管具有较大的比表面积,因此,其光电性、吸附性、光催化性以及与其他纳米物质的复合等方面的性能都比一般的TiO2粉优越。例如TiO2纳米管对染料活性艳红X-3B的光催化脱色活性比原料TiO2的提高2.1倍(以半衰期作比较,TiO2纳米管的半衰期为20 min,原料TiO2的半衰期为62 min),这与比表面积的增大倍数相当[10]。如果能在管中填充更小的无机、有机、金属或磁性纳米颗粒形成一维复合纳米材料,将会大大改善TiO2的光电、电磁、催化及抗菌等性能。
目前,对TiO2纳米管薄膜及掺杂改性的纳米TiO2复合材料的制备、结构相变及其应用已进行了较多研究。其中,二氧化钛纳米管的制备方法主要有3种:水热法、模板法、阳极氧化法[11-12]。其中,阳极氧化法由于能制备性能良好、排列整齐的TiO2纳米管阵列而受到广泛关注[13-15],其管壁、管径适宜,具有半导体特性,通常为无定形态,由于TiO2纳米管生长在Ti基体上,易制备为器件,有利于回收。
TiO2纳米管的形貌可通过制备参数来控制,其晶型与退火温度密切相关,阳极氧化法制备的TiO2纳米管经热处理后为纳米晶结构,平均晶粒尺寸随着退火温度升高而增大,氮气气氛下退火可拓宽TiO2由锐钛矿型向金红石型结构转变的热处理温度范围,在纯Ti表面一步制得原位生长的自组织TiO2纳米管阵列[16-17]。通过研究TiO2纳米管的结构特性和阳极氧化参数之间的关系,获得了大直径纳米管的制备工艺,且其可见光催化降解染料的去除率大幅提高[18-19]。采用简单快速的方法制备长度为23 μm、直径为29 nm、不含表面纳米纤维层的高度规则排列的TiO2纳米管,这种新型形貌的关键控制因素是搅拌速率和电解液温度[20]。这些研究结果表明:阳极氧化电压、电解液种类、电解液浓度、生长时间、退火温度会影响纳米管的管径、管壁厚度、密度、管长、晶型等生长特性,从而影响纳米管薄膜的性能。本文作者在这些研究的基础上,对TiO2纳米管的生长特性进行系统研究,通过设置不同的阳极氧化参数值,获得TiO2纳米管不同的微观结构和物理特征和各种参数对二氧化钛纳米管薄膜生长特性的影响规律,为TiO2纳米管的实际应用提供理论指导。
1 实验
1.1 实验材料
钛箔(购自Good Fellows Co.,USA,纯度99.99%(质量分数))表面光滑平整,不需要另外进行打磨抛光等机械加工,以免受到机械加工的损伤而影响实验结果。在每次实验之前,钛片需要依次用丙酮、无水乙醇、去离子水在超声浴下分别清洗10 min。阳极氧化过程采用双电极体系,处理好的钛片为阳极,铂片作为阴极。由于NH4F在乙二醇中的溶解度不高,所以所配制的电解液需要在每次实验前静置24 h以促进溶解。
1.2 实验方法
分别从电压(5、10、15、20、25、30 V)、氧化时间(5 s、30 s、5 min、10 min、 30 min、1 h、2 h和4 h)、NH4F浓度(0、0.1、0.2、0.3、0.4、0.5和1 mol/L)、电解质种类(NH4F+H2O、NH4F+乙二醇、NH4NO3+乙二醇)等4个参数进行对照试验(见表1)。制备得到的样品用去离子水清洗,然后在无水乙醇中超声5 min,用吸水纸吸干。采用场发射扫描电镜(FESEM)和能谱仪(EDAX)对试样进行表征。
2 结果与分析
2.1 电解液为NH4F+乙二醇时外加电压对TiO2纳米管阵列的影响
不同电压下阳极氧化制备的TiO2纳米管阵列放大10万倍的照片如图1示,所用电解液为0.27 mol/L的NH4F+乙二醇溶液(其中加入2%(体积分数)的去离子水)。在电压为5 V时(见图1(a)),TiO2薄膜层已经形成,但仅观察到垂直生长的无序纳米纤维结构,不能观察到清晰的管状结构,即TiO2纳米管阵列还未形成。在含F-的电解液中TiO2纳米管的形成过程大致分为3个阶段:第一阶段,初始氧化膜的形成。当施加电压的瞬间,阳极电流增大,阳极钛快速溶解,迅速反应在阳极表面形成致密的高阻值初始氧化膜(阻挡层)[21-23]。第二阶段,多孔氧化膜的形成。在阻挡层形成后,膜层承受的电场强度急剧增大,电场的极化作用削弱了氧化膜中Ti—O键的结合力,由于膜层的成分、膜层中的应力与结晶等因素的影响,使得膜层的表面能量分布不均,引起溶液中的F-在高能部位聚集并强烈溶解该处氧化物,氧化膜表面变得凹凸不平,氧化膜溶解形成孔核,孔核又因持续进行的场致和化学溶解过程而扩展为微孔,从而形成多孔氧化膜结构[23-24];第三阶段,以微孔为核,规则排列TiO2纳米管阵列稳定匀速生长。因此,5 V电压下不能形成TiO2纳米管阵列的可能是由于5 V电压所能提供的能量过小,只能在第二阶段形成孔径非常小的微孔,从而使TiO2纳米管以此微孔为核生长时,纳米管间连成比较模糊的一片,没有清晰的界面,无法辨识管径、壁厚等。
当外加电压增加到10 V时(见图1(b)),TiO2纳米管阵列的管状结构逐渐变得清晰,纳米管直径很小,外径约为22 nm,管壁约为4.5 nm,单位面积的纳米管密度约为2240 μm-2。外加电压为15 V时(见图1(c)),薄膜管状结构较10 V时更加清晰,外径约为32 nm,管壁约为6 nm,密度约为1030 μm-2。当外加电压增至20 V时(见图1(d)),TiO2纳米管生长成排列规整、分布均匀、界面清楚可测的阵列,此时,外径约为55 nm,管壁约为7 nm,密度约为370 μm-2。当电压为25 V时(见图1(e)),管状结构则更加规整,外径更大,约为64 nm,管壁约为8 nm,密度更小,约为250 μm-2。当电压为30 V时(见图1(f)),外径约为82 nm,管壁约为10 nm,密度约为200 μm-2。
电解液为NH4F+乙二醇时外加电压对TiO2纳米管阵列生长特性的影响如图2所示。由图2可知,阳极氧化电压对TiO2纳米管的管径、壁厚、密度均有影响,随着电压增加,纳米管的管径随之增加,壁厚增大,密度减小。TiO2纳米管制备时阳极氧化电压一般控制在25~30 V。这是由于太小的电压不易形成TiO2纳米管结构,而过大的电压又容易形成海绵多孔结构[19, 21]。
2.2 电解液为NH4F+乙二醇时氧化时间对TiO2纳米管薄膜的影响
不同阳极氧化时间制备的TiO2纳米管阵列薄膜FESEM形貌如图3所示(氧化电压均为30 V),所用电解液仍为0.27 mol/L的NH4F的乙二醇溶液(其中加入2%(质量分数)的去离子水)。由图3(a)和(b)可知,阳极氧化5 s和30 s时,尚未得到纳米管阵列,而是疏松多孔状的薄膜。在图3(b)中的插图中,观察到在疏松孔状结构下面有一层很薄的类管状结构的薄膜,厚度大约是120 nm。阳极氧化5 min和10 min后(见图3(c)和(d)),规则排列管状结构TiO2纳米管阵列已基本形成,但疏松多孔层结构仍然存在。阳极氧化30 min后(见图3(e)),纳米管上方生长出一层与疏松多孔状结构不一样的纳米纤维,呈纵横交错网络状结构。阳极氧化1 h后(见图3(f)),网络结构纳米纤维层出现。阳极氧化2 h后(见图3(g)),纳米纤维继续生长,纤维网络特征显著。阳极氧化4 h后(见图3(h)),纤维网络结构变化不大,基本稳定。

图1 电解液为NH4F+乙二醇时不同电压下阳极氧化4 h制备的TiO2纳米管阵列的FESEM像
Fig. 1 FESEM images of TiO2 nanotube samples anodized at different voltages for 4 h in electrolyte of NH4F+ethylene glycol

图2 电解液为NH4F+乙二醇时外加电压对TiO2纳米管阵列生长特性的影响
Fig. 2 Influence of voltage on growing characteristics of TiO2 nanotube array in electrolyte of NH4F+ethylene glycol
电解液为NH4F+乙二醇时阳极氧化不同时间所得TiO2纳米管长度如图4所示,阳极氧化时间5 s、30 s、5 min、10 min、30 min、1 h、2 h、4 h相应的纳米管长度分别为84 nm、105 nm、300 nm、500 nm、1.5 μm、2.5 μm、4 μm、4 μm。随着氧化时间的延长,纳米管的长度(薄膜的厚度)不断增加[21],但在制备时间2 h后,纳米管的长度基本稳定在4 μm。由于随着氧化进程的推进,由于电解液中F-浓度不断降低,纳米管中物质的传质过程不断减慢,因此纳米管的生长速度不断减小。当纳米管的生长速度与TiO2的腐蚀速度相等时,纳米管的溶解速度与生长速度达到平衡,此时纳米管的长度达到极限值[20]。

图3 电解液为NH4F+乙二醇时不同氧化时间制备的TiO2纳米管薄膜FESEM像
Fig. 3 FESEM images of TiO2 nanotube samples anodized for different time in electrolyte of NH4F+ethylene glycol
阳极氧化法制备的TiO2纳米管薄膜随着纳米管长度不断增加,在纳米管顶部生成一层网络结构纳米纤维层[21-24]。纳米纤维层产生的原因是由于当TiO2纳米管生长到一定长度时,要保持高度规则阵列的能量很大,体系逐渐变得不稳定,纳米管以竹子撕裂的方式裂开形成纳米纤维,并最终形成一层网络结构纳米纤维层以释放能量,使整个体系的能量降低,维持薄膜体系能量的稳定[25-26]。

图4 电解液为NH4F+乙二醇时阳极氧化时间对TiO2纳米管长度的影响
Fig. 4 Influence of anodization time on TiO2 nanotube length in electrolyte of NH4F+ethylene glycol
2.3 电解液为NH4F+乙二醇时电解液浓度对TiO2纳米管薄膜的影响
电解液为NH4F+乙二醇时不同NH4F浓度下所制备的纳米管阵列的形貌如图5所示(阳极氧化电压30 V、氧化时间2 h)。当NH4F浓度为0 mol/L时,即电解液仅为98%乙二醇+2%H2O(质量分数)的混合液,不能制备TiO2纳米管结构(见图5(a)),由此说明F-在TiO2纳米管生长过程中具有重要作用,主要通过将TiO2部分溶解于含F-的电解质及与大部分在电场力作用下溅射到电解液中的Ti4+(大于85%)反应来发挥作用,见式(1)、(2)和(3)。
TiO2+6F-+4H+→[TiF6]2++2H2O (1)
Ti4++6F-→[TiF6]2- (2)
Ti4++4F-→[TiF4] (3)
当NH4F浓度为0.1 mol/L时(见图5(b)),制备TiO2纳米管的管状结构已经形成,但形貌规整度不高,不能清晰的辩识TiO2纳米管管径与壁厚。当NH4F浓度达到0.2、0.3、0.4、0.5、1 mol/L时,均可制备高度规则排列的纳米管阵列,其管状结构与界面均清晰(见图5(c)~(g)),各浓度下制备的纳米管管径和壁厚相差不大。根据图5的测量结果可绘制NH4F浓度对TiO2纳米管生长特性的影响曲线,其结果如图6所示,图中0.1 mol/L为TiO2纳米管生长关键点,这是由于0.1 mol/L的F-浓度生成的[TiF6]2-的浓度偏低,导致因生成[TiF6]2-所得微孔的直径偏小,以此微孔为核生长的TiO2纳米管管径和壁厚偏小,纳米管之间粘连现象也较为严重,但此时,纳米管结构已初步形成。此后,随着F-浓度的逐渐增大,可以获得纳米管管状结构和生长特性都较为稳定的TiO2纳米管。
2.4 不同电解液体系对TiO2纳米管薄膜的影响
为了考察NH4F中的NH4+还是F-在阳极氧化中起主要作用,选择NH4NO3为电解质配制电解液作为对比,研究能否在NH4NO3体系中顺利制备TiO2纳米管阵列。同时,为了考察NH4F的乙二醇溶液中乙二醇溶剂的作用,选择去离子水位溶剂配制电解液作为对比,研究能否在NH4F的去离子水溶液中顺利制备TiO2纳米管阵列。不同电解液体系进行阳极氧化制备的TiO2纳米管阵列形貌如图7所示。NH4F+去离子水(无乙二醇)的电解液氧化钛片后,表面为棉絮状(见图7(a));该棉絮状结构层从基体剥离后,该层底部形成突起的圆形结构,且大小不一,高低起伏不平,排列不整齐(见图7(b))。NH4F+乙二醇电解液(见图7(c)和(d))获得了规则排列的TiO2纳米管阵列薄膜,其管径约82 nm,管长约4.5 μm,该薄膜从基体剥离后,在基体上留下蜂窝状的凹坑,凹坑为正六边形(如图7(d)右上方插入小图所示),对边长度约88 nm,分布均匀。NH4NO3+乙二醇(无去离子水)的电解液氧化钛片后,表面为疏松的珊瑚片状结构,未见规则排列的TiO2纳米管阵列形成(见图7(e)和(f))。
图7的3组对照试验(分别为图7(a)和(b)、图7(c)和(d)、图7(e)和(f))结果表明,在阳极氧化法中在含F-电解液和有机溶剂中时,能够制备出理想的TiO2纳米管。在电解液中加入F-离子是因为Ti4+与F-结合成TiF62-络合物,这可以减缓溶解速率,有利于纳米管的生长。对于溶剂而言,在水溶剂的溶液中,反应开始时,TiO2薄膜生长很快,但无法形成稳定生长的TiO2纳米管阵列。为了得到稳定生长的TiO2纳米管阵列,可以引入有机溶剂电解液,这是由于有机电解液的酸性较之水溶性电解液弱,且乙二醇有机溶剂能提高溶液的黏度,降低了氟离子的扩散速率,以减缓TiO2溶解速率,保证在较长一段时间内阳极氧化速率大于化学刻蚀速率,从而可以得到稳定生长的TiO2纳米管阵列[14,19-20]。

图5 电解液为NH4F+乙二醇时不同NH4F浓度制备出的TiO2纳米管阵列的FESEM像
Fig. 5 FESEM images of TiO2 nanotube samples with different NH4F concentrations in electrolyte of NH4F+ethylene glycol

图6 电解液为NH4F+乙二醇时NH4F浓度对TiO2纳米管阵列生长特性的影响
Fig. 6 Influence of NH4F concentration on growing characteristics of TiO2 nanotube array in electrolyte of NH4F+ ethylene glycol
2.5 TiO2纳米管的EDAX分析
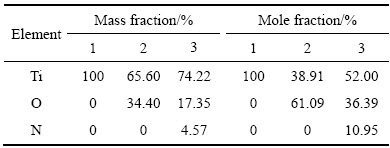
对在不同电解液条件下制备的TiO2纳米管阵列薄膜进行EDAX分析,其结果如图8所示,3个点的EDAX元素分析结果如表1所示。

图7 不同电解液体系阳极氧化制备TiO2纳米管的FESEM像
Fig. 7 FESEM images of TiO2 nanotube samples anodized in different electrolyte systems

图8 不同电解液体系TiO2纳米管阵列薄膜的SEM像和EDAX谱
Fig. 8 SEM images((a)-(c)) and EDAX patterns((a′)-(c′)) of TiO2 nanotube array film in different electrolyte systems
由图8和表1可看出,第二组样品的元素分析结果证实其基体部分(见图8(a))是100%(质量分数)的纯钛,对样品的纳米管薄膜层(见图8(b))的元素分析表明,薄膜中只有Ti和O两种元素,其摩尔分数分别为38.91%和61.09%,其可能原因是采用阳极氧化法制备的TiO2为非化学计量比的TiOx。另外,第3组(见图8(c))的分析结果表明:N元素的质量分数为4.57%,O元素的质量分数为17.35%,Ti元素的质量分数为74.22%,同时检测到少量Au是由于喷金所致。此样品中棉絮状结构的成分含N、O、Ti 3种元素,N、O、Ti来源为反应产物,结果表明:N为该物质中的一种组成元素,所以NH4NO3不仅仅是一种介质,还作为原料参与了反应。通过N和O元素的摩尔分数看出,样品中N和O的摩尔分数比约为1:3,由此推测NH4NO3中的NO3-离子参与了反应。
表1 图8中区域EDAX元素分析结果
Table 1 EDAX analysis results of zone shown in Fig. 8
3 结论
1) 外加电压影响TiO2纳米管的管径、壁厚和纳米管密度等生长特性。在电压达到10 V时,开始出现界面清晰的纳米管结构,随着电压增加,纳米管的管径增加,壁厚增大,纳米管密度减小。
2) 氧化时间主要影响TiO2纳米管的长度,阳极氧化5 min后,出现清晰的纳米管管状结构;随着氧化时间增加,纳米管长度逐渐增加;当氧化时间延长至2 h后,纳米管长度基本保持不变。
3) 电解质体系和浓度对TiO2纳米管的生长有很大影响,含F-的有机溶剂体系中可生长出理想的纳米管阵列,而缺少F-或者是在水溶剂中都不能获得规则排列的纳米管结构。NH4F+乙二醇电解液在NH4F浓度达到0.2 mol/L后即可长出界面清晰的规则排列的纳米管阵列。因此,可认为TiO2纳米管高效制备最佳工艺为氧化电压30 V、氧化时间2 h、电解液为0.2 mol/L的NH4F的乙二醇溶液。
REFERENCES
[1] JAYANTHI S, KULASEKARAPANDIAN K, ARULSANKAR A, SANKARANARAYANAN K, SUNDARESAN B. Influence of nano-sized TiO2 on the structural, electrical, and morphological properties of polymer-blend electrolytes PEO-PVC-LiClO4[J]. Journal of Composite Materials, 2015, 49(9): 1035-1045.
[2] KANRANNEJAD M M, HASANZADEH A, NOSOUDI N, MAI L, BABALUO A A. Photocatalytic degradation of polypropylene/TiO2 nano-composites[J]. Materials Research, 2014, 17(4): 1039-1046.
[3] WEI Y L, CHEN K W, WANG H P. Study of chromium modified TiO2 nano catalyst under visible light irradiation[J]. Journal of Nanoscience and Nanotechnology, 2010, 10(8): 5456-5460.
[4] 刘 月, 余 林, 魏志钢, 潘湛昌, 邹燕娣, 谢英豪. 稀土金属掺杂对锐钛矿型TiO2光催化活性影响的理论和实验研究[J]. 高等学校化学学报, 2013, 34(2): 434-440.
LIU Yue, YU Lin, WEI Zhi-gang, PAN Zhan-chang, ZOU Yan-di, XIE Ying-hao. Theoretical and experimental studies on photocatalytic potential of rare earth doped anatase TiO2[J]. Chemical Journal of Chinese Universities, 2013, 34(2): 434-440.
[5] LI Y K, YU H M, ZHANG CK, SONG W, LI G F, SHAO Z G, YI B L. Effect of water and annealing temperature of anodized TiO2 nanotubes on hydrogen production in photoelectrochemical cell[J]. Electrochimica Acta, 2013, 107: 313-319.
[6] DAS K, BANDYOPADHYAY A, BOSE S. Biocompatibility and in situ growth of TiO2 nanotubes on Ti using different electrolyte chemistry[J]. Journal of American Ceramic Society, 2008, 91(9): 2808-2814.
[7] MOR G K, VARGHESE K O, PAULOSE M, SHANKAR K, GRIMES C A. A review on highly ordered, vertically oriented TiO2 nanotube arrays: Fabrication, material properties, and solar energy applications[J]. Solar Energy Materials and Solar Cells, 2006, 90(14): 2011-2075.
[8] MOHAMED A E, ROHANI S. Modified TiO2 nanotube arrays (TNTAs): Progressive strategies towards visible light responsive photoanode, a review[J]. Energy and Environmental Science, 2011, 4(4): 1065-1086.
[9] TSUBOTA T, ONO A, MURAKAMI N, OHNO T. Characterization and photocatalytic performance of carbon nanotubematerial-modifiedTiO2synthesized by using the hot CVD process[J]. Applied Catalysis B-Environmental, 2009, 91(1/2): 533-538.
[10] GRIMES C A, ONG K G,VARGHESE O K, MOR G K,SHANKAR K. Application of finite-difference time domain to dye-sensitized solar cells: The effect of nanotube-array negative electrode dimensions on light absorption[J]. Solar Energy Materials and Solar Cells,2007, 91(4): 250-257.
[11] HSU M C, LEU I C, SUN Y M, HON M H. Fabrication of CdS@TiO2 coaxial composite nanocables arrays by liquid- phasedeposition[J]. Journal of Crystal Growth, 2005, 285(4): 642-648.
[12] BAVYKIN D V, PARMON V N, LAPKIN A A, WALSH F C. The effect ofhydrothermalconditions on the mesoporous structure ofTiO2nanotubes[J]. Journal of Materials Chemistry, 2004, 14(22): 3370-3377.
[13] YU J G, YU H G, CHENG B, ZHAO X J, YU J C, HO W K. The effect of calcination temperature on the surface microstructure and photocatalytic activity of TiO2 thin films prepared by liquid phase deposition[J]. Journal of Physical Chemistry B, 2003, 107(50): 13871-13879.
[14] JAROENWORALUCK A,REGONINI D,BOWEN C R,STEVENS R, ALLSOPP D. Macro, micro and nanostructure of TiO2 anodised films prepared in a fluorine-containing electrolyte[J]. Journal of Materials Science, 2007, 42(16): 6729-6734.
[15] MACAK J M, TSUCHIYA H, GHICOV A, YASUDA K, HAHN R, BAUER S, SCHMUKI P. TiO2 nanotubes: Self- organized electrochemical formation, properties and applications [J]. Current Opinion in Solid State and Materials Science, 2007, 11(1/2): 13-18.
[16] 金 冲, 张卫国, 姚素薇, 王宏智. 热处理工艺对TiO2纳米管阵列结构及其光电性能的影响[J]. 无机材料学报, 2012, 27(1): 54-58.
JIN Chong, ZHANG Wei-guo, YAO Su-wei, WANG Hong-zhi. Effect of heat-treatment process on the structure and photoelectric performance of TiO2 nanotube arrays[J]. Journal of Inorganic Materials, 2012, 27(1): 54-58.
[17] ZHANG Yu-lian, YU Dong-liang, GAO Ming-qi, LI Dong-dong, SONG Ye, JIN Rong. MA Wen-hua, ZHU Xu-fei. Growth of anodic TiO2 nanotubes in mixed electrolytes and novel method to extend nanotube diameter[J]. Electrochimica Acta, 2015, 160: 33-42.
[18] LI Yin-chang, MA Qun, HAN Jun, JI Li-li, WANG Jun-xia, CHEN Jie-yu, WANG Yong-qian. Controllable preparation, growth mechanism and the properties research of TiO2 nanotube arrays[J]. Applied Surface Science, 2014, 297: 103-108.
[19] 陈秀琴, 张兴旺, 雷乐成. 自组织TiO2纳米管阵列的制备及形成机理[J]. 中国有色金属学报, 2010, 20(9): 1724-1731.
CHEN Xiu-qin, ZHANG Xing-wang, LEI Le-cheng. Fabrication and formation mechanism of self-organized TiO2 nanotube arrays[J]. The Chinese Journal of Nonferrous Metals, 2010, 20(9): 1924-1931.
[20] MOHAMMADPOUR F, BEHZADI F, MORADI M. Fast anodically growth of long, small diameter TiO2 nanotubes by electropolishing of Ti foils in an ethanol-containing solution[J]. Materials Letters, 2015, 150(1): 81-83.
[21] 陶海军, 秦 亮, 王 玲, 陶 杰. TiO2 纳米管阵列的制备、热处理及光催化性能[J]. 中国有色金属学报, 2007, 17(5): 693-698.
TAO Hai-jun, QIN Liang, WANG Ling, TAO Jie. Fabrication, anneal and photocatalysis applications of self-organized TiO2 nanotubes[J]. The Chinese Journal of Nonferrous Metals, 2007, 17(5): 693-698.
[22] SUN Y, YAN K P. Effect of anodization voltage on performance of TiO2 nanotube arrays for hydrogen generation in a two-compartment photoelectrochemical cell[J]. International Journal of Hydrogen Energy, 2014, 2(39): 368-375.
[23] XIONG B T, ZHU Z Y, WANG C R, CHEN B X, LUO J Y. Supersonic anodization preparation of thin titanium oxide nanotube arrays films[J]. Acta Chimica Sinica, 2013, 71(3): 443-450.
[24] PAKES A, THOMPSON G E, SKELDON P, MORGAN P C. Development of porous anodic films on 2014-T4 aluminium alloy in tetraborate electrolyte[J]. Corrosion Science, 2003, 45(6): 1275-1287.
[25] JI Y J, LIN K C, ZHENG H G, ZHU J J, SAMIA A C S. Fabrication of double-walled TiO2 nanotubes with bamboo morphology via one-step alternating voltage anodization[J]. Electrochemistry Communications, 2011, 13(9): 1013-1015.
[26] ZHU J H, YANG D, GENG J Q, CHEN D M, JIANG Z Y. Synthesis and characterization ofbamboo-likeCdS/TiO2 nanotubes composites with enhanced visible-light photocatalytic activity[J]. Journal of Nanoparticle Research, 2008, 10(5): 729-736.
Growing characteristics of TiO2 nanotube array prepared by anodization method
ZOU Jian-peng1, TANG Ning-xin1, LI Hong-chao1, YANG Hong-zhi1, XIAO Ping2, PAN Yi-feng2
(1. State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China;
2. Xiangya Hospital, Changsha 410083, China)
Abstract: Based on the wide promising application of TiO2 nanotube films, highly ordered TiO2 nanotube arrays were prepared by anodization method. The effects of applied voltages, anodization time, electrolyte (NH4F+ethylene glycol) concentration, electrolyte system on the growing characteristics of TiO2 nanotube arrays were studied. The results show that the nanotube diameter and wall thickness increase from 22 nm and 4.5 nm to 82 nm and 10 nm, respectively, and the nanotube density decreases from 2240 to 200 μm-2 as the applied voltage increasing from 10 V to 30 V. The critical oxidation time of appearance of nanotube array is 5 min. The length of nanotubes increases with the oxidation time, and when the oxidation time is 2 h, the length of nanotubes increases to 4 μm and no more longer. The clear nanotube interface appears when the electrolyte (NH4F+ethylene glycol) concentration increases to 0.2 mol/L. The reason is that the existence of F- and ethylene glycol is very important for the formation of TiO2 nanotube. The formation of [TiF6]2- by the reaction of F- and Ti4+ can retard the oxidization process of Ti foil and help Ti foil produce micropores on its surface. The ethylene glycol is beneficial to increase the electrolyte viscosity and decrease the F- diffusion rate. Therefore, the uniform growth of TiO2 nanotube array can be guaranteed.
Key words: TiO2; anodization; nanotube array; growing characteristics
Foundation item: Project(50604017) supported by the National Natural Science Foundation of China; Project (2013DFA31440) supported by the International Scientific and Technological Cooperation Projects of China
Received date: 2015-05-06; Accepted date: 2015-10-09
Corresponding author: XIAO Ping; Tel: +86-731-84327300; E-mail: xiaoping.x@163.com
(编辑 李艳红)
基金项目:国家自然科学基金资助项目(51274248);国家国际科技合作专项项目(2013DFA31440)
收稿日期:2015-05-06;修订日期:2015-10-09
通信作者:肖 平,教授,博士;电话:0731-84327300;E-mail: xiaoping.x@163.com