网络首发时间: 2015-11-16 10:35
稀有金属 2016,40(05),478-484 DOI:10.13373/j.cnki.cjrm.2016.05.012
阳离子对嗜酸氧化亚铁硫杆菌氧化活性的影响
许晓芳 林海 董颖博 周闪闪
北京科技大学土木与环境工程学院金属矿山高效开采与安全教育部重点实验室
摘 要:
以嗜酸氧化亚铁硫杆菌(Acidthiobacillus ferrooxidans,At.f,FN811931)为研究对象,研究了脉石矿物溶出阳离子(K~+,Mg~(2+),Ca~(2+)和Al~(3+))对At.f菌氧化活性的影响。研究结果表明:不同阳离子对At.f菌氧化活性的影响效应不同,其影响由大到小的顺序依次为Mg~(2+),Al~(3+),K+,Ca~(2+),当Mg~(2+),Al~(3+),K~+浓度分别超过1,5,10 g·L~(-1)时显著降低了At.f菌的氧化活性,而Ca~(2+)在所研究0~2 g·L~(-1)浓度范围内对At.f菌氧化活性影响不大。培养25 h时,低浓度条件下(0.5 g·L~(-1)),K+,Ca~(2+),Al~(3+),Mg~(2+)作用下的Fe~(2+)的氧化率分别为67.78%,68.76%,65.27%,61.28%,均高于不添加任何离子作用下的Fe~(2+)的氧化率(60.74%);高浓度条件下(15 g·L~(-1)),K+,Al~(3+),Mg~(2+)作用下的Fe~(2+)的氧化率分别为35.82%,25.25%,21.47%,均低于不添加任何离子作用下的Fe~(2+)的氧化率。阳离子Mg~(2+),Al~(3+),K~+随离子浓度的增加,Fe~(2+)的氧化率均呈现逐渐降低的趋势。
关键词:
阳离子;嗜酸氧化亚铁硫杆菌;菌种活性;影响规律;
中图分类号: TD925.5
作者简介:许晓芳(1988-),女,山东潍坊人,博士研究生,研究方向:微生物浸矿;E-mail:xiaofangxu1988@163.com;;董颖博,副教授;电话:010-62333603;E-mail:ybdong@ustb.edu.cn;
收稿日期:2015-06-04
基金:国家自然科学基金青年基金项目(51204011);中国博士后科学基金第六批特别资助项目(2013T60063);北京市优秀博士学位论文指导教师科技项目(20121000803)资助;
Oxidation Activity of Acidthiobacillus Ferrooxidans with Cation Additives
Xu Xiaofang Lin Hai Dong Yingbo Zhou Shanshan
Key Laboratory of High-Efficient Mining and Safety of Metal Mines ( Ministry of Education) ,School of Civil and Environmental Engineering,University of Science and Technology Beijing
Abstract:
The effects of gangue minerals dissolved cations( K~+,Mg~(2+),Ca~(2+) and Al~(3+)) on the oxidation activity of Acidthiobacillus ferrooxidans( At. f) were studied. The results showed that,the cations exhibited different effects on the oxidation activity of At. f,and the effect sequence from great to little was Mg~(2+),Al~(3+),K~+,Ca~(2+). The oxidation activity of At. f bacteria was significantly reduced when the concentrations of Mg~(2+),Al~(3+)and K+were more than 1,5 and 10 g·L~(-1), respectively. However,the impact on the oxidation activity of bacteria of Ca~(2+)in the range of 0 ~ 2 g·L~(- 1)was not big. After cultured for 25 h,at low concentration( 0. 5 g·L~(- 1)),the oxidation rate of Fe~(2+)was 67. 78%,68. 76%,65. 27% and 61. 28%,respectively,under the action of K+,Ca~(2+),Al~(3+)and Mg~(2+),which were all higher than the Fe~(2+)oxidation rate( 60. 74%) without adding any ion; at high concentration( 15 g·L~(- 1)),the oxidation rate of Fe~(2+)was 35. 82%,25. 25% and 21. 47%,respectively,under the action of K+,Al~(3+)and Mg~(2+),which were all lower than the Fe~(2+)oxidation rate without adding any ion. With the increase of ion concentration of K~+,Mg~(2+)and Al~(3+),the oxidation rate of Fe~(2+)decreased.
Keyword:
cation; Acidthiobacillus ferrooxidans; bacterial activity; influence rules;
Received: 2015-06-04
氧化亚铁硫杆菌是以氧化亚铁离子、元素硫或还原态硫化合物获取能量生长的嗜酸硫氧化菌,是常见的硫化矿浸出功能菌[1,2]。黄铜矿是自然界中最主要的铜矿物,也是最难浸出的矿物之一[3]。绢云母、白云石、磷灰石以及萤石等是黄铜矿中常见的共伴生脉石矿物,细菌氧化浸出时其溶出的K+,Mg2+,Ca2+和Al3+等阳离子在体系中不断积累,不但可以影响铜的浸出效率[4],而且对于浸矿微生物的生长活性也有显著影响[5,6]。另外从生物学角度来说,K+,Mg2+和Ca2+均为氧化亚铁硫杆菌培养基的组成部分,是细菌生长所必需的营养离子,Al3+是细菌生长发育过程中所需的微量元素,因此存在这几种阳离子如何影响微生物的活性,以及在多少水平对微生物活性产生影响的问题。目前针对Mg2+,Al3+对细菌生长活性的影响已有文献报道[7,8,9],但针对这几种阳离子系统研究其对嗜酸氧化亚铁硫杆菌(At.f菌)氧化活性的影响较少,考察相同浓度条件下,不同阳离子对At.f菌活性的影响差异研究更为鲜见。
本文以嗜酸氧化亚铁硫杆菌(At.f菌)为研究对象,以细菌生长过程中体系的p H值、氧化还原电位、Fe2+氧化率等实时参数的变化来反映培养体系中K+,Mg2+,Ca2+和Al3+等阳离子浓度的变化对At.f菌氧化活性的影响规律,为获得浸矿细菌的最优生长和氧化活性条件提供理论依据。
1 实验
1.1 菌种及培养基
试验所需菌种经鉴定为嗜酸性氧化亚铁硫杆菌(Acidthiobacillus ferrooxidans,简称At.f菌),同源度为99.99%,其16S r DNA gene基因库登录序列号为FN811931。菌种最佳培养条件如下:初始p H值2.0,摇床温度30℃,转速160 r·min-1,采用9 K培养基[10]。
1.2 试验方法
阳离子对At.f菌氧化活性的影响试验均在250 ml锥形瓶中进行,在90 ml经灭菌后的9 K培养基中加入不同浓度梯度的(K+,Mg2+,Ca2+和Al3+)硫酸盐,调节酸平衡至p H=2.0后,接入10%的At.f菌,细菌浓度为1.0×108cell·ml-1,并设置重复3组。定期测定体系中的p H值、氧化还原电位和Fe2+浓度。蒸发掉的水分用蒸馏水补足,取样消耗的液量用相同体积p H=2.0的稀硫酸补充保证溶液总体积不变。
1.3 分析方法
采用Mettler型p H计测量溶液p H值的变化;采用BPP-922型台式ORP计检测溶液中氧化还原电位值的变化;浸出液中Fe2+浓度采用重铬酸钾法滴定;菌种的氧化活性用细菌氧化亚铁的能力来表示。n小时后Fe2+氧化率的计算公式为:

式中,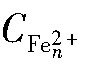 为菌液培养n小时后培养体系中Fe2+浓度(g·L-1);
为菌液培养n小时后培养体系中Fe2+浓度(g·L-1);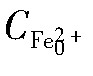 为培养体系初始Fe2+浓度(g·L-1)。
为培养体系初始Fe2+浓度(g·L-1)。
2 结果与讨论
2.1 不同浓度K+对At.f菌活性的影响
本试验考察了不同浓度K+对At.f菌活性的影响。图1为不同K+浓度下At.f菌培养过程中p H,氧化还原电势(Eh)随时间的变化情况。
从图1中可以看出,整个培养过程中体系p H值均呈先升高后逐渐下降的趋势,这是因为在培养初期,Fe2+氧化为Fe3+消耗H+,导致体系p H值升高;随着培养过程的进行,Fe3+发生水解使培养体系酸度增加,导致体系p H值下降[11]。钾离子的存在,使得体系p H随时间的变化趋势发生了较大变化。当K+浓度≤1 g·L-1时,p H值下降速度较快,在45 h时K+浓度为0,0.5,1.0 g·L-1的p H分别下降到1.66,1.63,1.62;而当K+浓度≥5 g·L-1时,p H值下降较慢,在45 h时K+浓度为20 g·L-1的p H仅下降到2.26。

图1 不同K+浓度下菌种培养过程p H,Eh随时间变化曲线Fig.1 Changing curves of p H and Ehin solution with different concentrations of K+
体系的氧化还原电位随培养时间的延长呈先逐渐升高后趋于稳定的趋势。在细菌生长过程中,Fe2+的氧化为细菌的生长提供必需的能量,使溶液中Fe3+浓度增加,溶液的混合电位逐渐升高;当Fe2+氧化完全时,氧化还原电位达到最高值,且维持在相对稳定的范围内[12]。钾离子对体系Eh值影响较大,当K+浓度≥10 g·L-1时,体系中电位上升较慢,K+浓度为20 g·L-1体系的Eh值在整个45 h的培养过程中都处于较低水平,最高仅可达409 m V;而当K+浓度≤5 g·L-1时,体系的Eh在35 h均已达到600 m V以上。
不同浓度K+对At.f菌氧化活性的影响见图2。结果表明,在K+浓度≤5 g·L-1时,对亚铁氧化活性影响不大,均在35 h时Fe2+氧化率接近100%;随着K+浓度的继续增大,Fe2+氧化速率逐渐降低,K+浓度为10,15 g·L-1时分别在40,45 h时Fe2+才逐渐氧化完全,而在K+浓度为20 g·L-1的体系中45 h内Fe2+氧化率仅为39.60%,表明K+浓度超过10 g·L-1时降低了At.f菌的活性。
2.2 不同浓度Mg2+对At.f菌活性的影响
镁离子是At.f菌培养基中必需的元素,其主要作用为:构成某些酶的活性成分,对微生物细胞核糖体、细胞膜等的稳定性起着重要作用[13]。若微生物生长得不到足够的镁,便会导致核糖体与细胞膜的稳定性降低,从而影响机体的正常生长;但当镁离子含量过高,则会抑制细菌的生长[7]。不同浓度Mg2+下At.f菌培养过程中p H,Eh随时间的变化情况如图3所示。图4为不同浓度的Mg2+对At.f菌氧化活性的影响。
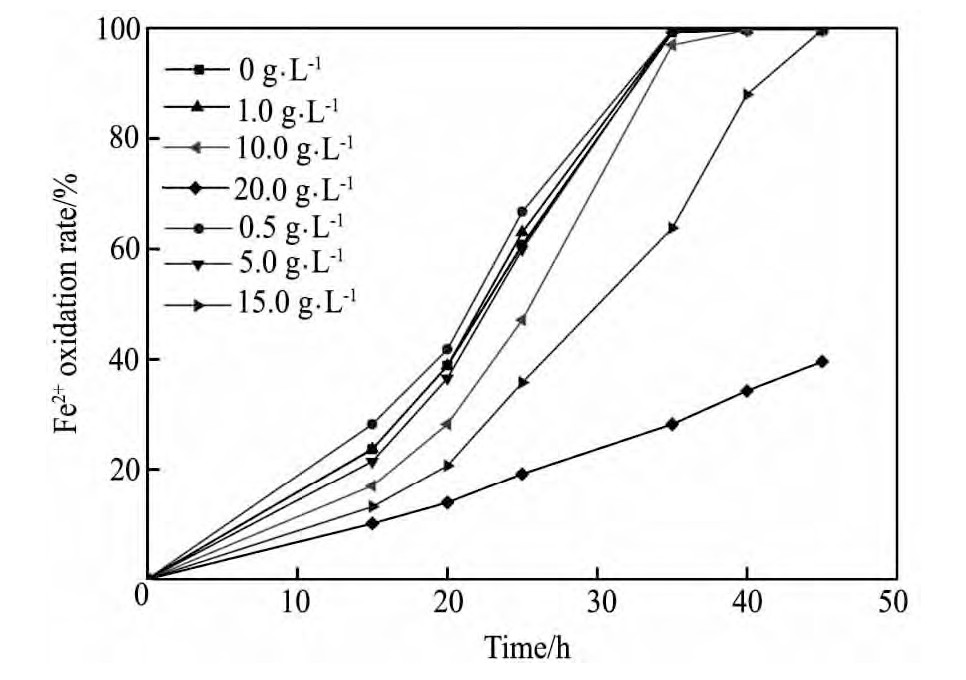
图2 不同K+浓度下菌种的氧化活性随时间变化曲线Fig.2 Changing curves of Fe2+oxidation rate in solution with different concentrations of K+
图3,4结果表明:不同浓度Mg2+对培养液中p H,Eh及Fe2+氧化率随时间的变化趋势影响不同。在Mg2+浓度小于5 g·L-1的体系中,培养35 h时,p H值均下降到1.70左右,氧化还原电位均上升到600 m V以上,Fe2+氧化率均接近100%;且Mg2+浓度越高,细菌氧化活性越好,培养45 h时,浓度为1 g·L-1的Mg2+体系中Eh值可达666 m V,而不添加Mg2+时体系Eh值为654 m V。表明适当的Mg2+能够促进细菌的生长,提高细菌的氧化活性。
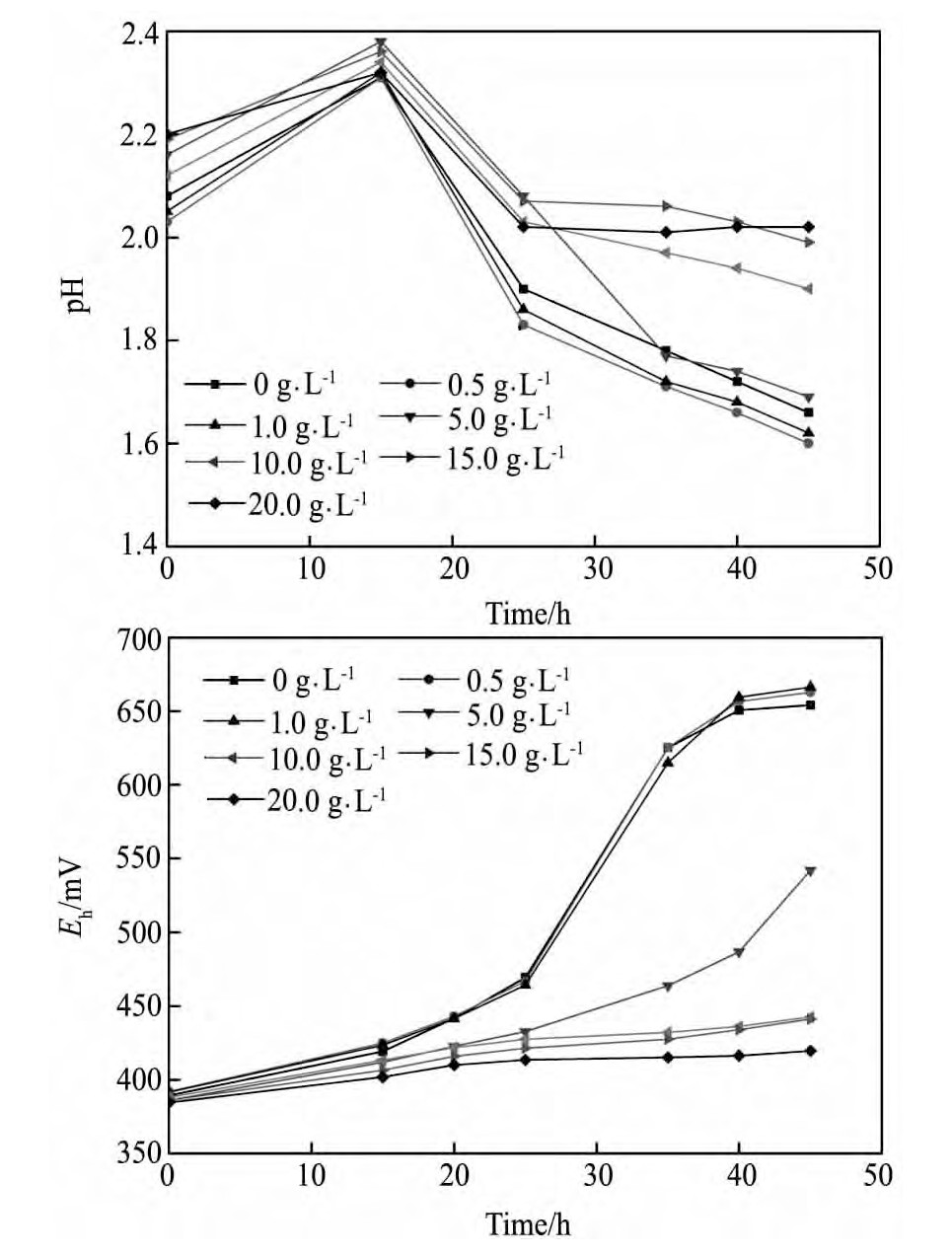
图3 不同Mg2+浓度下菌种培养过程p H,Eh随时间变化曲线Fig.3 Changing curves of p H and Ehin solution with different concentrations of Mg2+
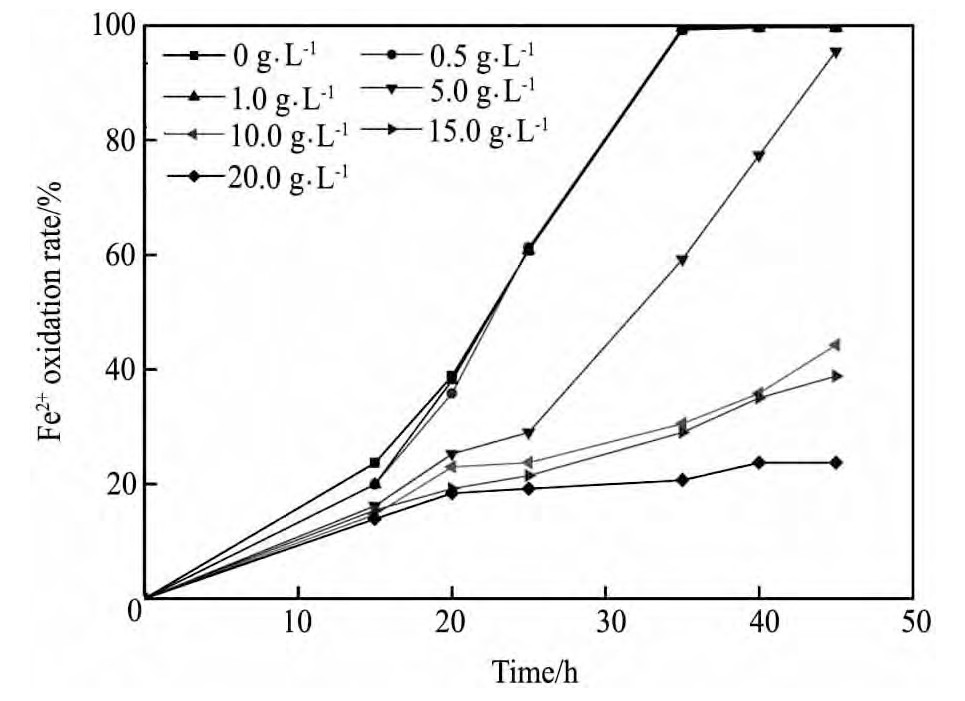
图4 不同Mg2+浓度下菌种的氧化活性随时间变化曲线Fig.4 Changing curves of Fe2+oxidation rate in solution with different concentrations of Mg2+
当Mg2+浓度≥10 g·L-1时,体系p H值下降缓慢、Eh值上升缓慢,Fe2+氧化速率减慢,且离子浓度越大,影响效果越明显。培养45 h后,体系p H值均仅下降到2.00左右,Eh值均仅可上升为440 m V左右,Fe2+氧化率分别仅为44.31%,38.84%,23.74%。表明Mg2+浓度超过10 g·L-1时,可能导致细菌体内与溶液之间的渗透压增加,从而影响其正常的生理功能;或影响其他物质代谢过程的进行,主要包括阻碍其它物质进入细胞、影响其他酶的代谢功能等,从而导致细菌的正常生长受到抑制,其氧化活性降低[14]。
2.3 不同浓度Ca2+对At.f菌活性的影响
Ca2+以辅酶形式参与微生物的各种生命活动,是At.f菌生长所必需的营养元素,适量存在对At.f菌生长代谢有促进作用。由于Ca2+在SO42-存在条件下,容易生成Ca SO4沉淀,根据硫酸钙在p H=2的条件下的溶解度,试验考察Ca2+浓度范围为0~2 g·L-1。不同浓度Ca2+下At.f菌培养过程中p H,Eh值随时间的变化情况如图5所示。图6为不同浓度的Ca2+对At.f菌氧化活性的影响。从图5,6中可以看出,在所研究浓度范围内,Ca2+的添加均可促进细菌的生长,提高细菌的氧化活性,且Ca2+浓度的变化对体系p H,Eh值以及Fe2+氧化率的影响不大。
2.4 不同浓度Al3+对At.f菌活性的影响
图7为不同Al3+浓度下At.f菌培养过程中p H,Eh随时间的变化情况。图8为不同浓度的Al3+对At.f菌氧化活性的影响。
由图7和8可知,Al3+浓度≤5 g·L-1时,能够提高细菌的氧化活性,培养45 h时,细菌的氧化还原电位均可达到660 m V以上,Fe2+氧化率均接近100%。这是因为,微生物具有一定的调节代谢的能力,当环境中金属离子或代谢产物的浓度升高时,微生物可以通过体外和体内两种方式来维持细菌生命活动的正常进行[15]。
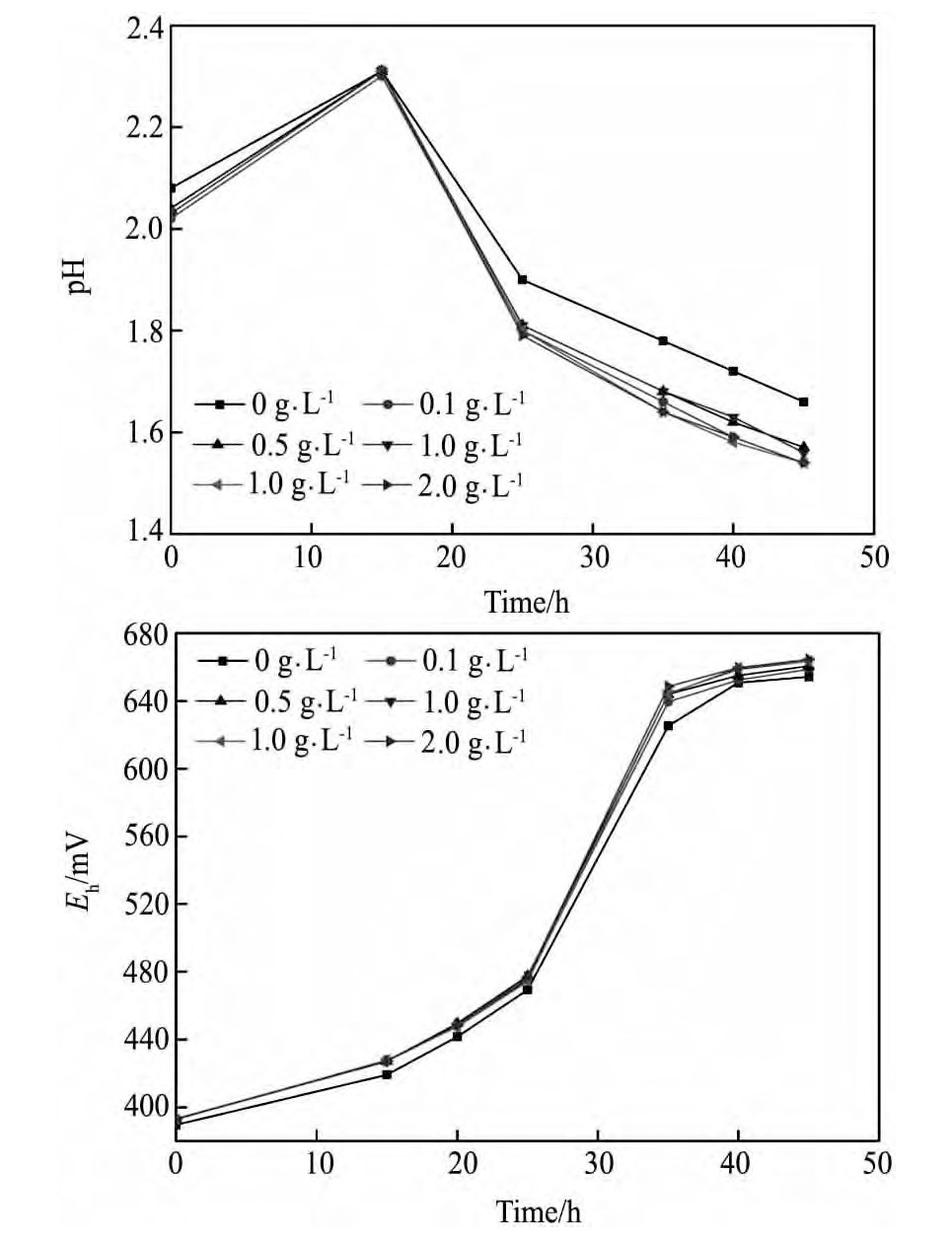
图5 不同Ca2+浓度下菌种培养过程p H,Eh值随时间变化曲线Fig.5 Changing curves of p H and Ehin solution with different concentrations of Ca2+

图6 不同Ca2+浓度下菌种的氧化活性随时间变化曲线Fig.6 Changing curves of Fe2+oxidation rate in solution with different concentrations of Ca2+
但当Al3+浓度增加至10 g·L-1时,则延缓细菌生长,降低细菌的氧化活性,Al3+浓度为10,15及20 g·L-1体系在培养45 h时,Eh值分别仅为537,455,429 m V,Fe2+氧化率分别为93.20%,45.64%,26.00%。可能的原因是,Al3+浓度过高,会与细胞膜表面的H+,Ca2+,Mg2+,K+等阳离子发生交换,使得细胞膜表面的蛋白质发生凝固,也可能与细胞中的许多成分起反应,甚至直接沉淀蛋白质,若进入细胞内部,与某些酶结合,将影响酶的活性[8]。
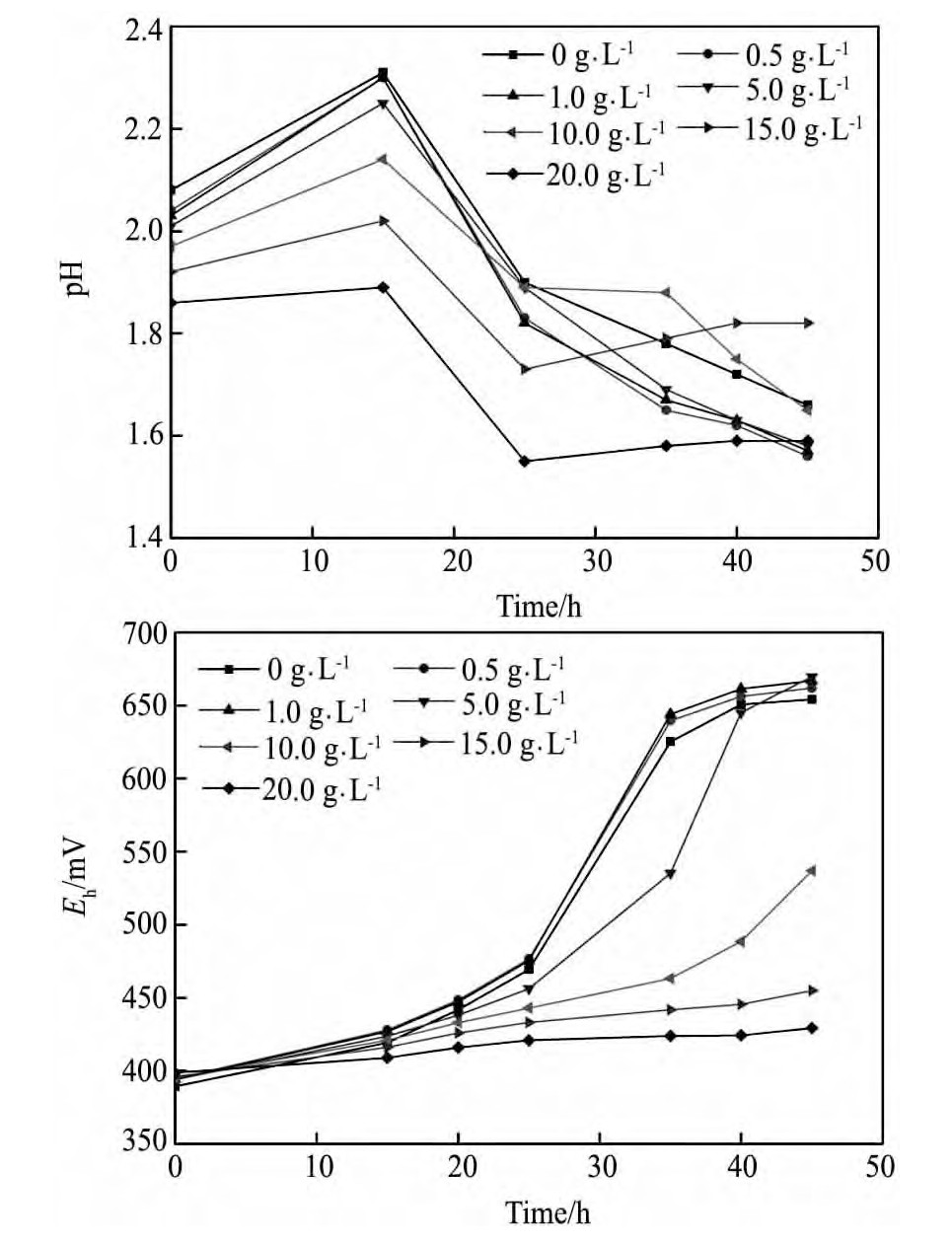
图7 不同Al3+浓度下菌种培养过程p H,Eh随时间变化曲线Fig.7 Changing curves of p H and Ehin solution with different concentrations of Al3+

图8 不同Al3+浓度下菌种的氧化活性随时间变化曲线Fig.8 Changing curves of Fe2+oxidation rate in solution with different concentrations of Al3+
2.5 不同阳离子对At.f菌活性的影响规律
图9为不同阳离子(K+,Ca2+,Mg2+,Al3+)在不同用量下,25 h内At.f菌培养体系中Fe2+的氧化率情况。
从图9可以发现,低浓度条件下(离子浓度为0.5 g·L-1时),不同阳离子均能提高细菌的氧化活性,但影响效应有所不同,25 h时K+,Ca2+作用下Fe2+的氧化率分别为67.78%和68.76%,Al3+作用下Fe2+的氧化率为65.27%,Mg2+作用下Fe2+的氧化率为61.28%,此时不添加任何离子作用下,Fe2+的氧化率为60.74%;高浓度条件下均降低了细菌的氧化活性,在离子浓度为15 g·L-1时,25 h时K+作用下Fe2+的氧化率为35.82%,Al3+作用下Fe2+的氧化率为25.25%,而Mg2+作用下Fe2+的氧化率仅为21.47%。
另外,从图9中还可以看出,相同阳离子随离子浓度的增加,会降低Fe2+的氧化速率,如K+浓度为0.5 g·L-1时,25 h时Fe2+的氧化率为67.78%,当离子浓度增加为5 g·L-1时,Fe2+的氧化率降低为59.98%,当离子浓度继续增加到15 g·L-1时,Fe2+的氧化率仅为35.82%,Mg2+,Al3+随离子浓度的增加也呈现同样的规律。这是因为K+,Mg2+,Ca2+和Al3+是细菌生长所必需的营养元素及微量元素,它们可能是酶的辅因子和蛋白质的结构组分[16],在低浓度时,对细菌生长有利,但当累积超过正常生理浓度时,便会对细胞产生毒性,从而抑制细菌生长,降低细菌的氧化活性。
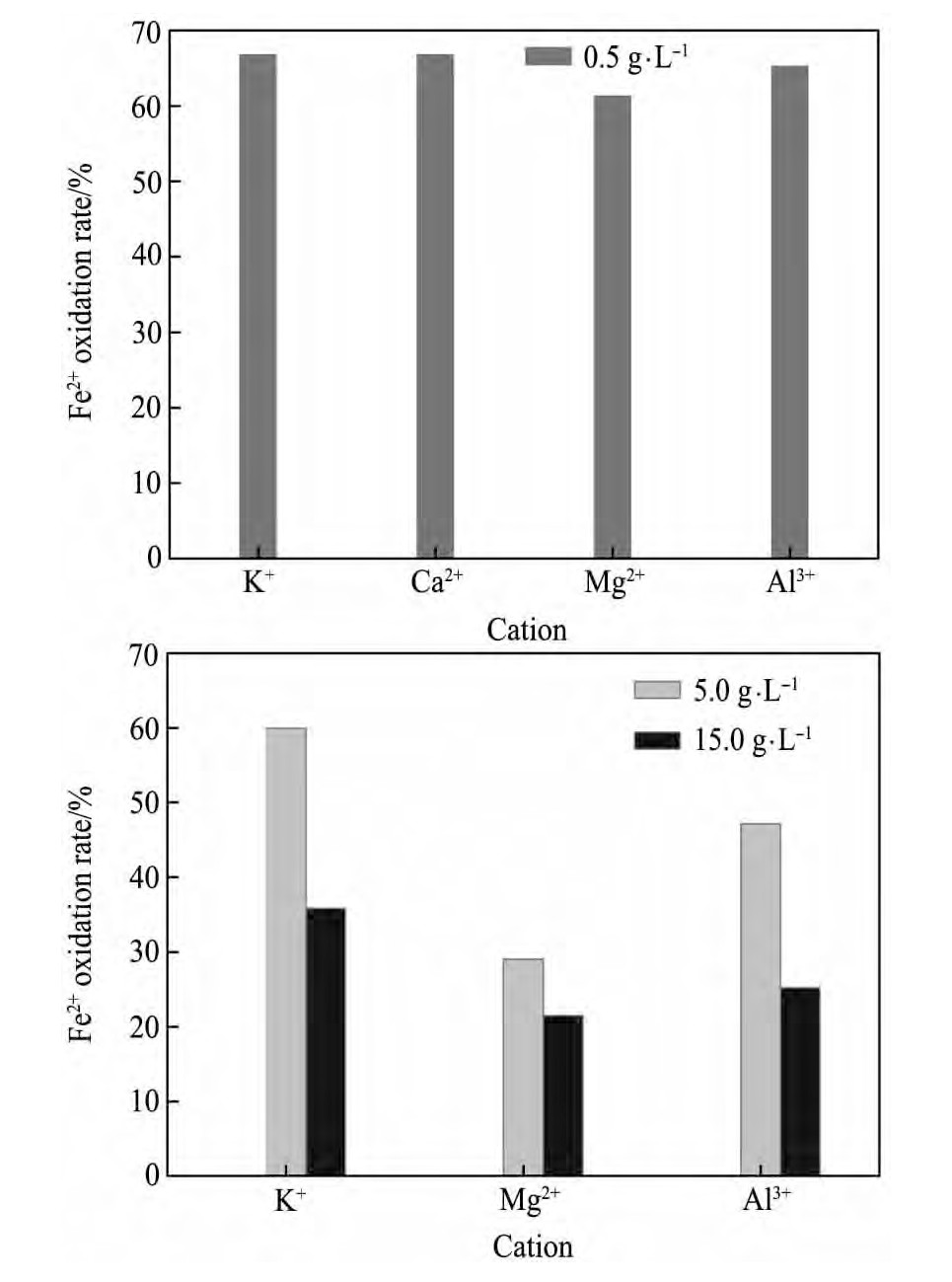
图9 不同阳离子对At.f菌种氧化活性的影响(培养时间:25 h)Fig.9 Effects of cations on activity of At.f strain(culturing time:25 h)
脉石矿物溶出阳离子在黄铜矿浸出过程中是逐渐累积的过程,研究不同阳离子不同浓度条件下对细菌活性的影响,可以为黄铜矿的浸出提供理论指导,当体系中离子浓度累积超过细菌生长最佳浓度范围时,可以采取一定的措施降低体系离子浓度,保证细菌拥有较高的氧化活性,更好地发挥其浸矿作用。
3 结论
1.不同阳离子对At.f菌氧化活性的影响不同,其影响由大到小的顺序依次为Mg2+,Al3+,K+,Ca2+,其中当Mg2+,Al3+,K+浓度分别超过1,5,10 g·L-1时可显著降低At.f菌的氧化活性,而Ca2+在所研究0~2 g·L-1浓度范围内对At.f菌活性影响不大。
2.同种离子不同浓度条件下对细菌活性的影响效应也不同,低浓度时,能够促进细菌生长,提高细菌氧化活性,随着离子浓度的增加,则会抑制细菌生长,降低细菌氧化活性。以K+作用下25 h时为例,在浓度为0.5 g·L-1时Fe2+的氧化率为67.78%,当离子浓度增加为5 g·L-1时,Fe2+的氧化率降低为59.98%,当离子浓度继续增加到15g·L-1时,Fe2+的氧化率仅为35.82%,Mg2+,Al3+随离子浓度的增加也呈现同样的规律。
参考文献
[1] Ramirez P,Guiliani N,Valenzuela L,Beard S,Jerez C A.Differential protein expression during growth of Acidithiobacillus ferrooxidans on ferrous iron sulfur compounds or metal sulfides[J].Applied and Environmental Microbiology,2004,70(8):4491.
[2] Wen J K,Ma J,Wang J X,Wu B,Wu M L,Shang H.Differences of strain succession among chalcopyrite,pyrite and pentlandite bioleaching[J].Chinese Journal of Rare Metals,2015,39(7):644.(温建康,马骏,汪菊香,武彪,武名麟,尚鹤.3种硫化矿生物浸出细菌种群演替差异性研究[J].稀有金属,2015,39(7):644.)
[3] Gu G H,Guo Y W.Chalcopyrite dissolution behavior under microbe-mineral contact/uncontact model[J].Journal of Central South University(Science and Technology),2011,42(8):2167.(顾帼华,郭玉武.细菌-矿物接触/非接触模式下黄铜矿浸出溶解行为[J].中南大学学报(自然科学版),2011,42(8):2167.)
[4] Yu R L,Liu J,Chen A,Zhong D L,Li Q,Qin W Q,Qiu G Z,Gu G H.Interaction mechanism of Cu2+,Fe3+ions and extracellular polymeric substances during bioleaching chalcopyrite by Acidithiobacillus ferrooxidans ATCC2370[J].Transactions of Nonferrous Metals Society of China,2013,23(1):231.
[5] Fan Y J,Yang H Y,Zeng J W.Influence of the ions in solution on the growth of bioleaching bacteria[J].Nonferrous Mining and Metallurgy,2004,20(2):17.(范有静,杨洪英,曾建威.溶液中离子对浸矿工程菌生长的影响[J].有色矿冶,2004,20(2):17.)
[6] Zhu C L,Yang H Y,Jiang H J,Wang D W.Toxic effects of ions in solution on the leaching bacteria[J].Nonferrous Mining and Metallurgy,2005,21(5):25.(朱长亮,杨洪英,蒋欢杰,王大文.溶液中离子对浸矿细菌的毒害作用[J].有色矿冶,2005,21(5):25.)
[7] Li H M,Ke J J.Effect of Mg2+on growth and activity of Thiobacillus ferrooxidans[J].Chinese Journal of Nonferrous Metals,2000,10(4):576.(李洪枚,柯家骏.Mg2+对氧化亚铁硫杆菌生长活性的影响[J].中国有色金属学报,2000,10(4):576.)
[8] Guo W Y,Guo Q,Sun Z X,Liu Y J,Shi W J,Zhao Z B.Effect of aluminum(Ⅲ)on the activity of mixed bacteria in bioleaching of uranium[J].Metal Mine,2014,(7):98.(韩文艳,郭勤,孙占学,刘亚洁,史维浚,赵志斌.Al3+对浸铀混合菌活性的影响[J].金属矿山,2014,(7):98.)
[9] Suwalsky M,Norris B,Villena F,Cuevas F,Sotomayor P,Zatta P.Aluminum fluoride affects the structure and functions of cell membranes[J].Food and Chemical Toxicology,2004,42(6):925.
[10] Dong Y B,Lin H,Wang H,Mo X L,Fu K B,Wen H W.Effects of ultraviolet irradiation on bacteria mutation and bioleaching of low-grade copper tailings[J].Minerals Engineering,2011,24(8):870.
[11] Liu F W,Zhou L X,Zhou J,Song X W,Wang D Z.Improvement of sludge dewaterability and removal of sludge-borne metals by bioleaching at optimum p H[J].Journal of Hazardous Materials,2012,221-222,170.
[12] Dong Y B,Lin H,Lu L F,Wen H W,Mo X L,Fu K B,Wang H.Effect of flotation reagents on activity of Acidthiobacillus ferrooxidans[J].Ciesc Journal,2011,62(6):1662.(董颖博,林海,陆琳斐,温洪伟,莫晓兰,傅开彬,汪涵.浮选药剂对嗜酸氧化亚铁硫杆菌活性的影响[J].化工学报,2011,62(6):1662.)
[13] Mo X L.Study on the Effect Law of Gangue Minerals on Chalcopyrite Bioleaching[D].Beijing:University of Science and Technology Beijing,2012.83.(莫晓兰.脉石矿物对微生物浸出黄铜矿的影响规律研究[D].北京:北京科技大学,2012.83.)
[14] Liu Q,Xu W C,Zhang Y.Effect of heavy metal ions on the activity of Thiobacillus ferrooxidans[J].Uranium Mining and Metallurgy,2004,23(3):155.(刘清,徐伟昌,张宇.重金属离子对氧化亚铁硫杆菌活性的影响[J].铀矿冶,2004,23(3):155.)
[15] Pan J H,Jin C T,Wang W Z,Zhu M Y.Study on aluminum toxicity and tolerance mechanisms of microorganisms[J].Acta Microbiologica Sinica,2004,44(5):698.(潘军航,金承涛,王闻哲,朱睦元.微生物铝毒和耐铝机制的研究现状[J].微生物学报,2004,44(5):698.)
[16] Ouziad F,Hildebrandt U,Schmelzer E,Bothe H.Different gene expressions in arbuscular mycorrhizal-colonized tomato grown under heavy metal stress[J].Journal of Plant Physiology,2005,162(6):634.