一株黄铜矿专属浸出细菌的分离与鉴定
杨 宇1, 2,万民熙1,彭 宏1,邱冠周1, 2,黄菊芳2,胡岳华1, 2
(1. 中南大学 资源加工与生物工程学院,湖南 长沙,410083;
2. 中南大学 生物冶金教育部重点实验室,湖南 长沙,410083)
摘 要:从甘肃白银硫化矿区矿坑水中分离得到一株能够浸矿的细菌(命名为BY),该菌株为革兰氏阴性细菌,短杆状,菌体的直径×长度为(0.45±0.05) μm×(1.5±0.4) μm, 最适生长温度为25~30 ℃,最适pH值为2.0,化能 自养型,能利用亚铁、单质硫和低浓度的葡萄糖生长,不能利用硫代硫酸钠、蛋白胨生长。研究结果表明:BY菌株与嗜酸氧化亚铁硫杆菌(简称A. f菌)WJ13位于系统发育树同一个分支中,相似度为99.66%,与标准A. f菌株ATCC23270的相似度为99.93%;编码区的核酸序列与报道序列(登记序列号DQ166839-DQ166841)仅差1个碱基,氨基酸序列完全一致;于30 ℃浸出27 d后,含菌株的摇瓶的Cu2+的质量浓度即达到60 mg/L,而无菌浸出时Cu2+的质量浓度仅为10 mg/L,表明该菌株具有应用于黄铜矿浸出的潜力。
关键词:嗜酸氧化亚铁硫杆菌;生物浸出;亚铁氧化酶基因;16S rRNA序列;黄铜矿
中图分类号:Q939 文献标识码:A 文章编号:1672-7207(2007)04-0639-06
Isolation and characterization of bacterium for chalcopyrite bioleaching
YANG Yu1, 2, WAN Min-xi1, PENG Hong1, QIU Guan-zhou1, 2, HUANG Ju-fang2, HU Yue-hua1, 2
(1. School of Minerals Processing and Bioengineering, Central South University, Changsha 410083, China;
2. Key Laboratory of Biometallurgy of Ministry of Education, Central South University, Changsha 410083, China)
Abstract: A bioleaching bacterium was isolated from a sulfide tailings of Baiyin, Ganshu Province in China, named as BY. The strain BY is gram-negative and rod-shaped in (0.45±0.05) μm×(1.5±0.4) μm. The optimum growth temperature is 25-30 ℃, and the optimum growth pH is 2.0. It can grow autotrophically by using ferrous, sulfur and glucose as sole energy sources, but it can not grow with NaS2O3 and peptone. In the phylogenetic tree, BY has similarity to Acidithiobacillus ferrooxidans (A.f) strain WJ12, and the type strain ATCC23270 with 99.93% sequence similarity. There is only one in coding sequence (CDS) and the same protein sequence. The copper concentration is 60 mg/L while the control is only 10 mg/L after 27 d. This bacteria can be used to leach chalcopyrite in industry application.
Key words: Acidithiobacillus ferrooxidans; bioleaching; Iro protein gene; 16S rRNA sequences; chalcopyrite
传统的火法炼铜工艺由于对环境造成污染而面临严峻的挑战。近年来,湿法炼铜的研究受到普遍关注。黄铜矿是自然界常见的铜矿物之一,但由于其特殊结构,浸出速率很慢,故黄铜矿浸出已成为铜工业研究的热点,目前,黄铜矿湿法浸出方法有硫酸高铁浸出、氯化物浸出、生物浸出以及还原浸出等[1-2]。生物浸出与其他工艺相比具有流程短、工艺简单、易操作、投资少、能耗小、成本低和对环境友好等优点,且我国铜矿资源大多品位低[3],适合采用生物浸出技术浸出。然而,黄铜矿是目前比较难浸出的矿物[2, 4],基于黄铜矿氧化速率慢的特点,选育出可以浸出黄铜矿的高效专属菌株是非常重要的。
嗜酸氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans,简称A. f菌)属微生物中原核生物界、化能营养原核生物门、细菌纲、硫化细菌科、硫杆菌属。主要代谢特点是:碳源为CO2,氮源为NH+4,以氧化Fe2+,S0及S2-的化合物等获得生长所需能量[5]。自1947年由Colmer和Hinkle首先分离纯化并命名以来, A. f菌一直是生物浸出及其他如煤脱硫方面最主要的细菌之一[6-8]。
研究表明,在相同培养条件下,不同来源的嗜酸氧化亚铁硫杆菌菌株对金属硫化矿物的浸出效果存在明显差异[5-6]。因此,采集不同样点的水样,筛选出适应于不同底物作用的优良菌株,并对不同矿物的生物浸出、不同地域和环境下A.f菌的多样性(包括种群多样性、系统发育多样性和功能多样性)和生态演化规律开展研究,对于进一步解析浸矿微生物的群落结构和功能、开发高效浸矿菌株具有重要意义[9]。在此,本文作者从甘肃白银矿区的某硫化矿矿坑水样中分离纯化出一株铁硫氧化细菌,并对其生理生化特征进行研究,同时考察它对黄铜矿的浸矿能力。
1 材料和方法
1.1 菌种分离
菌株从甘肃白银硫化矿区的矿坑水中分离得到,命名为BY。该矿区中矿石为多金属复杂硫化矿石,主要矿物有:黄铜矿、黄铁矿、锡石。矿坑水温度约为25 ℃,pH值为6.6,呈弱酸性。分离的主要步骤是:将采集到的酸性水样先用9K液体培养基[10]富集培养,待培养基的pH值下降到1.0左右后,用梯度稀释法在改进的9K固体培养基涂布[11],再用平板划线法分离。
1.2 培养基
采用液体培养基(9K),配方如下:(NH4)2SO4质量浓度为3 g/L;KCl质量浓度为0.1 g/L;K2HPO4质量浓度为0.5 g/L;MgSO4?7H2O质量浓度为0.5 g/L;Ca(NO3)2质量浓度为0.01 g/L;FeSO4?7H2O质量浓度为44.7 g/L;pH值为1.8~2.0。
分离培养基为改进的9K固体培养基,即在每升9K液体培养基中加入15 g琼脂,15.4 g KSCN,pH值为2.0~2.2。基础培养基为不加FeSO4的9K培养基。
1.3 生理生化特性
a. 最适温度。以相同的菌量接种到9K液体培养基中,分别置于不同温度下,培养3 d,用血球计数板计数,测定不同温度下细菌的生长状况。
b. 最适初始pH值。用1 mol/L硫酸将9K液体培养基调至不同pH值,接种相同的菌量,培养3 d后,用血球计数板计数,测定不同pH下菌的生长状况。
c. 能量利用特性。基础培养基(不加Fe2+的9K培养基)中分别加入蛋白胨(0.1%),葡萄糖(0.1%);硫磺(5%),NaS2O3(1%),FeSO4?7H2O(14.7%);FeSO4?7H2O(14.7%)+蛋白胨(0.1%),FeSO4?7H2O (14.7%)+葡萄糖(0.1%)。其中,NaS2O3和FeSO4?7H2O过滤除菌后加入培养基,硫磺隔水蒸煮1 h灭菌,再加入培养基。以BY菌株悬液接种,每培养3 d传代1次,连续传代3次,涂片并在显微镜下观察细菌的生长情况。
1.4 电镜观察
在30 ℃液体中培养细菌至对数生长期,收集菌体,经革兰氏染色后在光学显微镜下观察。将菌体涂布在小块盖玻片上,自然晾干后,再用导电胶贴于圆形贴片上,喷金后在扫描电镜下观察。
1.5 亚铁和硫氧化活性的测定
1.5.1 亚铁氧化活性测定
取BY菌株的液体培养物,用5×10-4 mol/L K2Cr2O7对其中的Fe2+含量进行滴定。每隔一段时间(一般为3~4 h)取0.5 mL菌液,用蒸馏水(或者1%稀硫酸)稀释10倍,再取其中的1 mL滴定,每次滴定重复3次,然后,取其平均值作为滴定值。滴定用1?1硫磷酸作为络合剂,用0.2%二苯胺磺酸钠作指示剂,滴定至亮紫色即到滴定终点。
1.5.2 硫氧化活性测定
将BY菌株接种到只含单质硫的9K基础培养基(硫的质量分数为5%)中,通过pH值的变化来考察BY菌株的硫氧化活性。
1.6 浸矿试验
矿样为黄铜矿,粒度分布为104~147 μm。接种量为10%,调节初始菌浓度为1.0×107 个/mL,浸矿条件如下:250 mL摇瓶装液100 mL,矿样量为5%,转速为160 r/min,温度为30 ℃。
1.7 细菌基因组提取和PCR扩增
1.7.1 基因组DNA提取
对纯化后培养的菌株使用Sangon公司的UNIQ-10柱式基因组DNA抽提试剂盒提取基因组DNA,并经1%凝胶电泳检测质量。
1.7.2 16S rRNA扩增
扩增体系(50 μL)为:33 μL无菌水,10×PCR buffer 5 μL,10×dNTPs 5 μL,引物FC27和RC1492各2 μL(5 pmol/μL),Taq DNA聚合酶 1 μL,BY菌株的基因组DNA 2 μL。扩增程序为:94 ℃,5 min;94 ℃,1 min;55 ℃,1 min;72 ℃,3 min(共30个循环);72 ℃,10 min。PCR引物为16S rRNA基因扩增通用引物[8]。
正向引物(FC27)为:5’-AGAGTTTGATCCTGG- CTCAG-3’;
反向引物(RC1492)为:5’-TACGGCTACCTTGT- TACGACTT-3’。
1.7.3 亚铁氧化酶基因扩增
扩增体系(50 μL)为:33 μL无菌水,10×PCR buffer 5 μL,10×dNTPs 5 μL,引物YT1和YT2各 2 μL(5 pmol/μL),Taq DNA聚合酶 1 μL,BY菌株的基因组DNA 2 μL。扩增程序为:94 ℃,2 min;94 ℃,40 s;59 ℃,30 s;72 ℃,40 s(共35个循环);72 ℃,5 min。引物设计参考NCBI中标准序列(索引号为EO3451,大小为500 bp),利用Primer5在线设计。
正向引物(YT1)为:5’-CTCTGACCGGCGAATC- GGG-3’;
反向引物(YT2)为:5’-CCAACCGCATCCGCAT- ATCTTG-3’。
1.8 基因测序及分析
采用PCR产物克隆试剂盒(上海生工SK2212)对扩增得到的16S rRNA和亚铁氧化酶基因片段进行克隆。载体为pUCm-T(PCR产物克隆试剂盒自带),蓝白筛选后所得的重组克隆交由北京三博远志生物技术有限责任公司测序。16S rRNA序列已经提交到GenBank(登录号为DQ062114),并将该16S rRNA序列与GenBank核酸序列数据库进行序列比较,用clustalx1.8软件进行全序列比对[12],并构建系统发育树。亚铁氧化酶基因序列已经提交到GenBank(登录号为AY864809),并将该序列与GenBank核酸序列数据库进行序列比对。
2 结果与讨论
2.1 菌株形态与生理生化特性
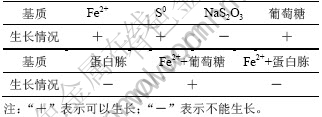
菌株是革兰氏阴性细菌,短杆状,菌体的直径×长度为(0.4±0.1) μm×(1.4±0.2) μm。在改进的9K固体培养基,菌落表面干燥,呈圆形,直径为0.6~1.0 mm,边缘不规则,菌落中央呈浅褐色(如图1所示)。最适生长温度为25~30 ℃,最适pH值为2.0。利用亚铁、单质硫和葡萄糖生长,且在亚铁葡萄糖混合培养基中也能生长;不能利用蛋白胨生长,且在亚铁蛋白胨混合培养基中也不能生长(如表1所示)。考察葡萄糖对BY菌株生长的影响,适当加大了硫酸亚铁+葡萄糖混合培养基中葡萄糖的含量,当葡萄糖浓度为3%时,菌生长量已极少,表明大量的葡萄糖对BY菌株的生长有抑制作用。

图1 BY菌株的菌落形态(a)和扫描电镜图像(b)
Fig.1 Colony of BY(a) and scanning electron
micrograph image(b)
表1 BY菌株能源利用特性
Table 1 Characteristics of BY strain using energy material
2.2 亚铁氧化活性和硫氧化活性
2.2.1 亚铁氧化活性
BY菌株具有较强的亚铁氧化活性,且亚铁氧化活性与菌的生长相关。图2和图3所示分别为在30 ℃,pH值为1.8的9K液体培养基中,BY菌株的生长曲线和亚铁氧化率曲线。结合分析图2和图3发现,7 h时,实验组和空白对照组无明显差别,这是由于细菌被转移到新环境后, 生长繁殖处于迟滞期;在7~50 h之间,菌开始生长,随着培养时间的增加,亚铁氧化率缓慢提高,与空白对照的差异逐渐显现出来;在50 h时进入对数生长期,亚铁氧化率也急剧增高;70 h以后,亚铁氧化率达到99.5%。图3所示为BY菌株在30 ℃,pH值为2.0的9K培养基中的亚铁氧化率曲线图,图中BY曲线是接种了BY菌株的培养基中Fe2+氧化率随时间的变化曲线。结合生长曲线(图2)和亚铁氧化率曲线(图3)可以看出,BY菌株的亚铁氧化活性与菌的生长密切相关,菌的生长越快,亚铁氧化活性越强。虽然BY菌株为化能自养菌,利用Fe2+为能源生长, 但与异养微生物所具有的生长规律基本一致[13]。

图2 BY菌株生长曲线
Fig.2 Growth curve of BY strain

图3 BY菌株的亚铁氧化率曲线图
Fig.3 Ferrous ion oxidation curves by BY strain
2.2.2 硫氧化活性
图4所示为BY菌株接种添加了单质硫的9K基础培养基(5%的硫)21 d内,培养基pH值随时间的变化曲线。图5所示为相应的培养过程中,在9 d,15 d和21 d时菌数的柱形图。可见,将BY菌接种至只含单质硫的9K基础培养基的前9 d时间里,pH值持续稳步下降,由此推测菌已处于对数生长期中;在18~21 d之间,pH值变化趋于平缓,此时菌已处于平稳期中,在21 d以后pH值降到1.0以下。从菌的生长情况来看,前9 d菌数的增加量要少于第9~15 d的增加量,而第9~15 d菌的增加量要少于第15~21 d的增加量,这表明在硫中,菌数不断增长,使硫逐渐氧化成硫酸,导致培养基的pH值下降,由初始的2.3降到1.0,说明该菌具有较强的硫氧化活性。

图4 BY菌株硫氧化过程的pH值的变化
Fig.4 Variation of pH values in sulfur oxidation by BY strain

图5 硫基质中BY菌的菌数变化
Fig.5 Population number of BY strain with sulfur substrate
2.3 亚铁氧化酶基因
亚铁氧化酶被认为是A. f菌能量代谢系统的关键酶[14-15],Kusano等[16]认为该基因含有1个237 bp的开放阅读框(ORF),编码含90个氨基酸的iro蛋白,其中还包括37个氨基酸的跨膜信号序列同时具有酸稳定性,故推论亚铁氧化酶(序列号为CAF21316)是一种周质蛋白,同时,通过序列比较和光谱分析发现,iro蛋白与高氧还电位铁硫蛋白(HiPIPs)具有很高的同源性。有研究者认为[14-16],亚铁氧化酶的作用是从Fe2+接受电子,为电子传递链中的第一个电子载体。为此,本研究根据Kusano等[16]报道的基因序列((登记序列号为E03451,大小为500 bp),设计了一对引物 (YT1和YT2),利用BY菌的基因组DNA为模板进行了PCR扩增、克隆,测序测定的序列长度为452 bp,Genbank中的序列登录号为AY864809。与目前Genbank中已有数据进行对比,结果显示编码区的核酸序列与已有序列 (登记序列号为DQ166839- DQ166841)仅差1个碱基,而氨基酸序列则完全一致。
2.4 16S rRNA序列分析与系统发育树
采用PCR技术,扩增出16S rRNA,然后,克隆和测序,测定的序列长度为1 503 bp,Genbank中的序列登记号为DQ062114。以16S rRNA 序列同源性为基础构建系统发育树,以A.albertensis作为外来群,如图6所示。BY菌株与A.f菌WJ13位于系统发育树同一个分支中,相似度为99.66%。与目前Genbank中已有记录的其他菌株相比,最相近的为A.f标准菌株ATCC23270(登记序列号为AF465604)相似度为99.93%。研究表明,A.f菌的分布与地域和矿区组成相关[17-18],该菌株的分离则为A.f菌的多样性和地域分布研究提供了一种新材料,这对浸矿细菌的遗传分类学研究具有一定的意义。

图6 BY菌株的16S rRNA序列系统发育树
Fig.6 Phylogenetic tree derived from 16S rRNA sequence of BY strain
2.5 浸矿实验
黄铜矿的细菌浸出实验的数据结果显示,在最初 4 d,Cu2+的浸出速度较快,可能是浸矿液呈酸性,发生化学反应所致。此后,细菌对Cu2+的浸出作用占主导地位。直到20 d,Cu2+的浸出速度保持稳定,随时间变化不显著。20 d后,Cu2+的浸出呈现出加快的趋势,到27 d,Cu2+浓度达到60 mg/L(如图7所示)。黄铜矿的浸矿实验结果表明,BY菌株具有一定的浸矿能力。若对菌株进一步驯化,对Cu2+的浸出速率可能进一步提高。
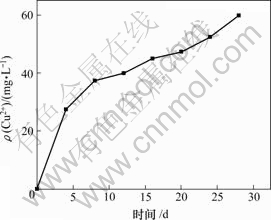
图7 BY菌株对黄铜矿中的Cu2+的浸出
Fig.7 Copper extraction from chalcopyrite concentrate by BY strain
3 结 论
a. 从甘肃白银矿区矿坑水中分离得到了一株嗜酸氧化亚铁硫杆菌BY,为革兰氏阴性细菌,短杆状,菌体的直径×长度为(0.45±0.05) μm×(1.5±0.4) μm。最适生长温度为25~30 ℃,最适pH值为2.0。
b. 该菌株能利用亚铁、单质硫和葡萄糖生长,不能利用蛋白胨生长。混合培养基中,蛋白胨、葡萄糖对BY菌株的生长起抑制作用。该菌株具有较强的亚铁氧化活性。在70 h后,亚铁氧化率达到99.5%。该菌株还具有很强的硫氧化活性,在21 d后导致培养基的pH值由初始的2.3降到1.0。亚铁氧化活性和硫氧化活性的活性与菌所处生长期相关。BY菌株具有浸出黄铜矿的能力。在27 d,细菌浸出的铜离子浓度达到60 mg/L。
c. 16S rRNA系统发育树的构建表明,BY菌株与A.f菌WJ13位于系统发育树同一个分支中,相似度为99.66%。与目前Genbank中已有记录的其他菌株相比,最相近的为标准株ATCC23270(登记序列号为AF465604)相似度为99.93%。亚铁氧化酶基因序列显示编码区的核酸序列与报道序列(登记序列号为DQ166839- DQ166841)仅存在1个碱基的差异,氨基酸序列则完全一致。
参考文献:
[1] Scott D J. The mineralogy of copper leaching: concentrates and heaps, copper’91[C]//Copper Hydrometallurgy Short Course. Santiago, 1995.
[2] Rawlings D E. Biomining: theory, microbes and industrial processes[M]. Berlin, New York: Springer–Verlag, 1997: 229-245.
[3] YANG Song-rong, XIE Ji-yuan, QIU Guan-zhou, et al. Research and application of bioleaching and biooxidation technologies in China[J]. Minerals Engineering, 2002, 15: 361-363.
[4] Olson G J, Brierley J A, Brierley C L. Bioleaching review part B: Progress in bioleaching: applications of microbial processes by the minerals industries[J]. Applied Microbiology Biotechnology, 2003, 63: 249-257.
[5] Kelly D P, Wood A P. Reclassification of some species of Thiobacillus to the newly designated genera Acidithiobacillus gen. nov., Halothiobacillus gen. nov. and Thermithiobacillus gen.nov. [J]. International Journal of Systematic and Evolutionary Microbiology, 2000, 50: 489-500.
[6] Rawlings D E. Heavy metal mining using microbes[J]. Annual Review Microbiology, 2002, 56: 65-91.
[7] SHI Shao-yuan, FANG Zhao-heng. Bioleaching of marmatite flotation concentrate by Acidithiobacillus ferrooxidans[J]. Hydrometallurgy, 2004, 75: 1-10.
[8] Brierley J A, Brierley C L. Present and future commercial applications of biohydrometallurgy[J]. Hydrometallurgy, 2001, 59: 233-239.
[9] Baker B J, Banfield J F. Microbial communities in acid mine drainage[J]. FEMS Microbiology Ecology, 2003, 44: 139-152.
[10] Silverman M P, Lundgren D C. Study on the chemoautotrophic iron bacterium Ferrobacillus ferrooxidans: I. An improved medium and harvesting procedure for securing high cell yield[J]. Journal of Bacteriology, 1959, 77: 642-647.
[11] 张在海, 邱冠周, 胡岳华, 等. 氧化亚铁硫杆菌的菌落分离研究[J]. 矿产综合利用, 2001(1): 19-23.
ZHANG Zai-hai, QIU Guan-zhou, HU Yue-hua, et al. The investigation of the colony isolation of Thiobacillus ferrooxidans[J]. Multipurpose Utilization of Mineral Resources, 2001(1): 19-23.
[12] Thompson J D, Gibson T J, Plewniak F, et al. The Clustal X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Research, 1997, 24: 4876-4882.
[13] Ageeva S N, Kondrat’eva T F, Karavaiko G I. Phenotypic characteristics of Thiobacillus ferrooxidans strains[J]. Microbiology, 2001, 70(2): 186-194.
[14] Rawlings D E. The molecular genetics of Thiobacillus ferrooxidans and other mesophilic, acidophilic, chemolithotrophic, iron- or sulfur-oxidizing bacteria[J]. Hydrometallurgy, 2001, 59: 187-201.
[15] Yamanaka T, Fukumori Y. Molecular aspects of the electron transfer system which participates in the oxidation of ferrous ion by Thiobacillus ferrooxidans[J]. FEMS Microbiology Reviews, 1995, 17: 401-413.
[16] Kusano T, Takeshima T, Sugawara K, et al. Molecular cloning of the gene encoding Thiobacillus ferrooxidans Fe(I1) oxidase[J]. The Journal of Biological Chemistry, 1992, 267(16): 11242-11247.
[17] PENG Hong, YANG Yu, LI Xuan, et al. Sturcture analysis of 16S rRNA sequences of strains from Acidithiobacillus ferrooxidans[J]. Journal of Biochemistry and Molecular Biology, 2006, 39(2): 178-182.
[18] Karavaiko G I, Turova T P, Kondrateva T F, et al. Phylogenetic heterogeneity of the species Acidithiobacillus ferrooxidans[J]. Journal of Systematic and Evolutionary Microbiology, 2003, 53: 113-119.
收稿日期:2006-11-18
基金项目:国家创新研究群体科学基金资助项目(50621063);国家“973”基础研究项目(2004CB619201)
作者简介:杨 宇(1972-),男,湖南长沙人,教授,从事微生物学研究
通讯作者:胡岳华,男,教授;电话:0731-8836019;E-mail:HYH@mail.csu.edu.cn