文章编号:1004-0609(2008)04-0745-05
D113弱酸性树脂对锌(Ⅱ)的吸附性能
熊春华,姚彩萍
(浙江工商大学 应用化学系,杭州 310035)
摘 要:研究用D113弱酸性树脂吸附锌(Ⅱ)的过程。结果表明:D113树脂对锌离子的吸附在pH=6.20的HAc-NaAc介质中最佳,每克树脂在298 K下静态饱和吸附容量为172 mg;用2~3 mol/L的盐酸溶液进行洗脱,一次洗脱率可达100%。不同温度下,树脂吸附锌的表观吸附速率常数分别为:k288 K=1.82×10-5/s、k298 K=2.34×10-5/s、k308 K=2.81×10-5/s、k313 K=3.26×10-5/s;表观吸附活化能Ea=17.0 kJ/mol。测得热力学参数分别为:?H=30.3 kJ/mol,?S=160 J/(mol·K),?G=-17.4 kJ/mol;等温吸附服从Freundlich和Langmuir经验式。
关键词:弱酸性树脂;锌;吸附;热力学;动力学
中图分类号:TQ 028.15;TF 813;TF 804.3 文献标识码:A
Sorption behavior of weak acid resin ( D113 ) for Zinc(Ⅱ)
XIONG Chun-hua, YAO Cai-Ping
(Department of Applied Chemistry, Zhejiang Gongshang University, Hangzhou 310035, China)
Abstract: The sorption of Zn(Ⅱ) with macroporous weak acid resin (D113 resin) was investigated. The results show that D113 resin has a good sorption ability for Zn(Ⅱ) at pH=6.20 in the HAc-NaAc medium. The statically saturated sorption capacity is 172 mg per gram of resin at 298 K. Zn(Ⅱ) adsorbed on D113 resin can be eluted by using over a range of 2.0-3.0 mol/L HCl quantitatively. The sorption rate constants are k288 K=1.82×10-5/s, k298 K=2.34×10-5/s, k308 K= 2.81×10-5/s, k313 K= 3.26×10-5/s, respectively. The apparent activation energy is 17.0 kJ/mol. The sorption parameters of thermodynamic are ?H=30.3 kJ/mol, ?S=160 J/(mol·K) and ?G298 K=-17.4 kJ/mol, respectively. The sorption behavior of D113 resin for Zn(Ⅱ) obeys the Freundlich and the Langmuir isotherms.
Key words: weak acid resin; zinc; sorption; thermodynamics; kinetics
锌应用很广,许多日常用品中都含有锌[1]。锌是人体正常发育中的必需元素,可参与碳酸酐酶、碱性磷酸酶、DNA聚合酶等多种酶的合成[2]。同时锌又是一种重金属,进入人体或环境超过一定限量就会引起中毒或环境污染。离子交换树脂可以有效地除去废水中的各种金属离子,其高分子配位体保留了低分子配位体的各种优良性能,且由于高分子效应而具有分离方便、可重复使用等优点,这就大大降低了使用成 本,因此是高分子配位化学发展的一个重要方向[3-5]。本文作者及有关研究者曾对锌的吸附进行了研 究[6-8],但所采用的吸附材料存在吸附容量较低之不足。D113弱酸性树脂是有大孔结构并带有羧酸基(—COOH)的弱酸性阳离子交换树脂,具有力学强度高等优点。羧基上的氢离子能与溶液中的金属离子或其他阳离子进行交换,同时羧基中的氧原子与金属离子直接配位,因此该树脂在一定酸度下能与多种金属离子形成比较稳定的配合物。本文作者系统地研究了商品化D113树脂对锌的吸附性能,发现D113树脂对锌有高的吸附容量(每克树脂吸附量172 mg)和易再生等特点,有望应用于湿法冶金和环境保护等领域。
1 实验
1.1 主要试剂和仪器
1) 试剂
D113弱酸性树脂由南开大学化工厂提供,经预处理后备用;锌标准溶液由ZnO(分析纯,广东省化学试剂工程技术研究开发中心)用一定量的体积比为1?2的HCl 溶解,由二次蒸馏水配制;pH=5.02~6.20的缓冲液由HAc-NaAc 配制;pH=9.00的缓冲液为盐酸-硼砂水溶液;显色剂为0.1%的PAR乙醇溶液;其他试剂均为分析纯。
2) 仪器
实验所用仪器为:UV-2550 型分光光度计,DELTA 320型酸度计,THX-C-1型台式冷冻恒温振荡器,DSHZ-300A型旋转式恒温振荡器,AL204型电子天平,Thermo 380 FT-IR,Vario EL型元素分析仪。
1.2 吸附和分析方法
1) 吸附平衡实验
称取一定量的D113树脂,加入一定体积的缓冲溶液,浸泡24 h后加入一定量的Zn2+标准液,在恒温振荡器中恒温振摇至平衡,分析水相中Zn2+的平衡浓度,用下列式计算吸附量(Q),分配比(D)及吸附率(E)。

2) 分析方法
Zn2+的分析用0.1%的PAR乙醇溶液显色剂和pH=9.00的盐酸-硼砂作缓冲液,在波长500 nm处,以试剂空白作参比,测定吸光度,从而求得分配比。
3) 解吸实验
称取一定量树脂,加入一定体积pH=6.20的HAc-NaAc缓冲液和一定量的Zn2+标准液,平衡后测定水相浓度,求得树脂对Zn2+的吸附量。分离出剩余水相,然后用缓冲液洗涤树脂3次,再加入解吸剂,振荡平衡后测得水相Zn2+的含量,求得解吸率。
2 结果与讨论
2.1 介质pH对分配比的影响
准确称取15.0 mg树脂4份,在T=298 K、pH= 5.02~6.20、c0=0.102 mg/mL的实验条件下,振荡至平衡,测定在HAc-NaAc缓冲体系中树脂吸附Zn2+的性 能[9-10],结果如图1所示。由图1可知,锌的分配比随pH值增大而增大,当pH=6.20时,Zn2+在HAc-NaAc体系中的分配比达到最大,lg D=3.7;pH值大于6.20 时,实验体系发生水解。所以以下实验均在pH=6.20的HAc-NaAc体系中进行。
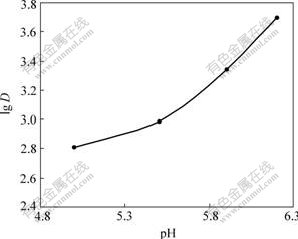
图1 pH对分配比的影响
Fig.1 Influence of pH on distribution ratio
2.2 不同温度等温吸附曲线
2.2.1 Freundlich等温吸附曲线
准确称取10.0、15.0、20.0、25.0、30.0 mg树脂5份,在T=298 K,pH=6.20,c0=0.200 mg/mL的实验条件下,按吸附平衡实验进行,测得平衡浓度ce,换算成相应吸附量Q,根据Freundlich等温式Q=ace1/b,即 lg Q=1/blg ce+lg a处理数据,式中a、b为Freundlich常数。由图2可知,lgQ与lgce有良好线性关系,直线相关系数R2=0.999 2。由此可求得常数b=2.28,b值在2~10之间,表示在该实验条件下,D113树脂吸附Zn2+的反应容易进行[11]。改变温度,其他条件与上述相同,分别作288、308和313 K的Freundlich等温吸附曲线,如图2所示,结果显示线性关系都较好,相关系数为:
 ,
, ,
, 。
。

图2 不同温度下Zn2+ 的Freundlich等温吸附曲线
Fig.2 Freundlich isotherm curves at various temperatures
2.2.2 Langmuir等温吸附曲线
准确称取5份15.0 mg的树脂,在T=288 K、pH=6.20、c0分别为0.067、0.100、0.133、0.167和0.200 mg/mL的实验条件下,按吸附平衡实验进行,测得平衡浓度ce,换算成相应吸附量Q。
将实验数据按Langmuir吸附等温式处理:
ce/Q=ce/Q0+(Q0×b)-1
式中 Q为实验所测的树脂的吸附量;Q0为理想的饱和吸附量;b为常数以ce/Q对ce作288 K时树脂对锌的Langmuir吸附曲线(图3)。改变温度,其他条件与上述相同,分别作298、308和313 K的Langmuir 等温吸附曲线(图3)。结果显示,在上述实验条件下,树脂对锌的吸附均符合Langmuir等温吸附规律。直线方程即为Langmuir 等温式,由图可见随着溶液初始浓度的增加,树脂的吸附容量也相应增加。

图3 不同温度下Zn2+ 的Langmuir等温吸附曲线
Fig.3 Langmuir isotherm curves in various temperature
由图2和3可知,在实验条件下,树脂对锌的吸附既能符合Freundlich等温吸附曲线,又能遵循Langmuir等温吸附规律。
2.3 吸附速率及表观活化能的测定
准确称取4份20.0 mg树脂,在温度分别为288、298、308和313 K,pH为6.20,c0为0.134 mg/mL的实验条件下,按吸附平衡实验,测定不同时间树脂吸附量,直至达到平衡,将测得的一系列数据经体积校正后换算成相应的吸附量,以Q对t作图得到图4所示的曲线。将实验数据用公式-ln(1-F)=kt[12]处理,式中F=Qt/Q∞,Qt和Q∞分别为反应时间t和平衡时每克树脂的吸附量,k即吸附速率常数。以-ln(1-F)对t作图,结果表明吸附阶段为一直线(图5),即在该条件下,吸附动力学行为符合该方程。由直线斜率求得D113树脂在298 K时吸附Zn2+的表观速率常数k298 K=2.34×10-5/s,相关系数R2=0.999 0。BOYD等[13]认为若-ln(1-F)对t呈线性关系,说明液膜扩散为吸附过程的主控步骤。改变温度,保持其他条件与上述相同,同理可分别得288、308和313 K时-ln(1-F)对t的线性关系图(见图5),从而求得k288 K=1.82×10-5/s,k308 K= 2.81×10-5/s,k313 K=3.26×10-5/s。根据Arrhenius公式lg k=-Ea/2.303RT+lg A,以lg k对1/T作图,得图6所示的直线,相关系数R2为0.994 7。根据直线斜率K= -0.888 3,得表观吸附活化能Ea=17.0 kJ/mol。
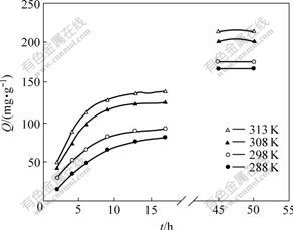
图4 不同温度下D113树脂对锌的吸附速率曲线
Fig.4 Sorption rate curves for adsorption of Zn2+ on D113 resin at various temperatures

图5 不同温度下D113树脂对锌的吸附速率常数曲线
Fig.5 Curves of rate constants for adsorption of Zn2+ on D113 resin at various temperatures
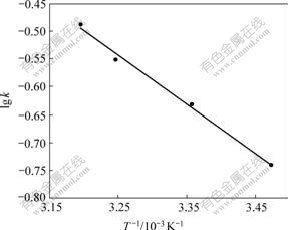
图6 D113树脂吸附锌的活化能的测定
Fig.6 Determination of activation energy for adsorption of Zn2+ on D113 resin
2.4 振荡频率对吸附的影响
准确称取20.0 mg树脂3份,在温度为298 K,c0为0.134 mg/mL,pH为6.20,振荡频率分别为50、100和150 r/min条件下进行实验,测定不同振荡频率时的吸附速率。结果表明,吸附速率随振荡频率增加而加快,吸附达到平衡所需时间也随频率的增加而减少,这是由于振荡频率越大,金属离子与树脂碰撞机会越多,吸附速率也就越快,但树脂平衡吸附总量不受频率快慢的影响。综合考虑到实验过程及实际生产过程中对设备的要求等,实验一般在振荡频率为100 r/min的条件下进行。
2.5 温度的影响
准确称取15.0 mg树脂4份,在c0为0.133 mg/mL、pH为6.20条件下,分别测得温度在288、298、308和313 K时树脂吸附Zn2+分配比的变化[14]。以lg D对1/T作图,结果如图7所示。 直线相关系数R2为 0.999 0。由图可知,升高温度对吸附有利,因而吸附过程是吸热过程,亦提示D113树脂对锌的吸附属于化学吸附作用。根据图7所示,直线斜率K=-0.393,截距为3.62。

图7 温度对D113树脂吸附锌的分配比影响
Fig.7 Influence of temperature on distribution ratio for adsorption of Zn2+ on D113 resin
根据lg D=-?H/(2.303RT)+?S/(2.303R)[15],求得?H=30.3 kJ/mol,?S=160 J/(mol·K)。根据吉布斯方程,?G=?H-T?S=-17.4 kJ/mol 。热力学数据表明自由能的减小和熵值的增大是D113树脂吸附锌的推动力。
2.6 锌的解吸与回收
解吸方法如1.2节文中所述,将吸附等量Zn2+的D113树脂加入等体积(0.5~3.0 mol/L)HCl进行解吸,振荡平衡后测定水相含Zn2+量,结果见表1,其中HCl浓度为2~3 mol/L时洗脱效果较佳,一次性解吸率均达100%。
表1 不同浓度的盐酸的解吸率
Table 1 Elution rates of different concentrations of HCl

2.7 D113树脂重复使用性能的考察
树脂吸附Zn2+后,用2 mol/L的盐酸洗脱和二次蒸馏水洗涤数次,进行多次重复使用实验[16]。结果表明,树脂的吸附率未见变化,说明D113树脂具有较强的再生能力和较好重复使用效果。为进一步证明上述效果,又进行树脂氧元素分析和红外光谱实验,树脂中氧元素的含量和红外光谱图显示树脂使用前后结果是一致的。
3 结论
1) 吸附条件实验表明,pH=6.20时吸附最佳,每克树脂静态饱和吸附容量为172 mg。用浓度为2~ 3 mol/L以上的HCl溶液作解吸剂,一次性解吸率为100%。
2) 树脂吸附Zn2+的过程符合Freundlich等温曲线,且b值在2~10之间,说明吸附反应容易进行,同时又较好的遵循Langmuir等温吸附规律。
3) 树脂吸附Zn2+热力学参数?H=30.3 kJ/mol,?S=160 J/(mol·K),?G=-17.4 kJ/mol。
4) 表观速率常数为k288 K=1.82×10-5/s、k298 K= 2.34×10-5/s、k308 K=2.81×10-5/s、k313 K=3.26×10-5/s,表观吸附活化能Ea=17.0 kJ/mol。
REFERENCES
[1] 肖松文, 马荣骏. 生态环境友好锌材料及其清洁生产: 我国锌工业的发展方向[J]. 有色金属, 2000, 52(3): 84-86.
XIAO Song-wen, MA Rong-jun. Environmental friendly zinc materials and its cleaner production: The development direction of zinc industry in China[J]. Nonferrous Metals, 2000, 52(3): 84-86.
[2] 陈文强. 微量元素锌与人体健康[J]. 微量元素与健康研究, 2006, 23(4): 62-65.
CHEN Wen-qiang. The trace element zinc and human body’s health[J]. Studies of Trace Elements and Health, 2006, 23(4): 62-65.
[3] GODE F, PEHLIVAN E. Removal of chromium(Ⅲ) from aqueous solutions using Lewatit S 100: The effect of pH, time, metal concentration and temperature[J]. Journal of Hazardous Materials, 2006, B136: 330-337.
[4] WEI J F, WANG Z P, ZHANG J,WU YY, ZHNG Z P, XIONG C H. The preparation and the application of grafted polytetrafluoroethylene fiber as a cation exchanger for adsorption of heavy metals[J]. Reactive & Functional Polymers, 2005, 65: 127-134.
[5] CHEN Y Y, ZHAO Y. Synthesis and characterization of polyacrylonitrile-2-thiazoline resin and its sorption behavior for noble metal ions[J]. Reactive & Functional Polymers, 2003, 55(1): 89-98.
[6] PEHLIVAN E, ALTUN T. The study of various parameters affecting the ion exchange of Cu2+, Zn2+, Ni2+, Cd2+, and Pb2+ from aqueous solution on Dowex 50W synthetic resin[J]. Journal of Hazardous Materials, 2006, B134: 149-156.
[7] 熊春华, 徐银荣. 甲壳素对锌(Ⅱ)的吸附性能[J]. 有色金属, 2007, 59(1): 72-76.
XIONG Chun-hua, XU Yin-rong. Sorption behavior of chitin for zinc[J]. Nonferrous Metals, 2007, 59(1): 72-76.
[8] 施林妹, 莫建军, 舒增年. 氨基吡啶树脂对锌的吸附及解吸性能的研究[J]. 浙江海洋学院学报: 自然科学版, 2002, 21(2): 133-135.
SHI Lin-mei, MO Jian-jun, SHU Zheng-nian. Studies on the sorption of 4-the stuctures of aminopyidine resin for zinc[J]. Journal of Zhejiang Ocean University Natural Science, 2002, 21(2): 133-135.
[9] 莫建军, 熊春华. 亚胺基二乙酸树脂对镉的吸附性能及其机理[J]. 中国有色金属学报, 2006, 16(5): 924-928.
MO Jian-jun, XIONG Chun-hua. Sorption behavior and mechanism of iminodiacetic acid resin for cadmium[J]. The Chinese Journal of Nonferrous Metals, 2006, 16(5): 924-928.
[10] GODE F, PEHLIVAN E. A comparative study of two chelating ion-exchange resins for the removal of chromium(Ⅲ) from aqueous solution[J]. Journal of Hazardous Materials, 2003, B100: 231-243.
[11] 北川浩, 铃木谦一郎. 吸附的基础与设计[M]. 鹿政理, 译. 北京: 化学工业出版社, 1983: 33-36.
KITAGAWA H, SUZUKI K. Adsorption basis and design[M]. LU Zheng-li, transl. Beijing: Chemical Industry Press, 1983: 33-36.
[12] BRYKINA G D, MARCHAK T V, KRYSINA L S. Sorption- photometric determination of copper by using AV-17 anion exchanger modified with 1-(2-thiazolyl-azo)-2-naphthol-3, 6- disulphonic acid[J]. Zh Anal Khim, 1980, 35(12): 2294-2299.
[13] BOYD G E, ADAMSON A W, MYERS L S. The exchange adsorption of ions from aqueous solutions by organic zeolites: Ⅱ Kinetics[J]. J Am Chem Soc, 1947(69): 2836-2848.
[14] 熊春华, 舒增年, 王永江. 4-氨基吡啶树脂吸附钼(Ⅵ)[J]. 化工学报, 2005, 56(7): 1267-1270.
XIONG Chun-hua, SHU Zheng-nian, WANG Yong-jiang. Sorption of Mo (Ⅵ) by 4-aminopyridine resin[J]. Journal of Chemical Industry and Engineering (China), 2005, 56(7): 1267-1270.
[15] XIONG C H, YAO C P, WANG Y J. Behaviour and mechanism of ytterbium(Ⅲ) on imino-diacetic acid resin[J]. Hydrometallurgy, 2006, 82(3/4): 190-194.
[16] 王永江, 熊春华, 张启伟, 王桂仙. 氨基膦酸树脂对铅的吸附性能及机理[J]. 中国有色金属学报, 2002, 12(4): 832-836.
WANG Yong-jiang, XIONG Chun-hua, ZHANG Qi-wei, WANG Gui-xian. Adsorption behavior and mechanism of amino methylene phosphonic acid resin for Pb2+[J]. The Chinese Journal of Nonferrous Metals, 2002, 12(4): 832-836.
基金项目:浙江省高校中青年学科带头人基金资助项目;浙江省自然科学基金资助项目(Y404279)
收稿日期:2007-07-22;修订日期:2007-12-24
通讯作者:熊春华,教授;电话:0571-88932083;E-mail: xiongch@163.com
(编辑 何学锋)