文章编号:1004-0609(2013)05-1447-10
细菌亚硝酸钠诱变育种及铝土矿浸矿脱硅
钟婵娟1, 2,孙德四1, 2,王化军1,张 强1
(1. 九江学院 化学与环境工程学院,九江 332005;
2. 北京科技大学 土木与环境工程学院,北京 100083)
摘 要:以胶质芽孢杆菌CGMCC11和环状芽孢杆菌CGMCC12为出发菌株,采用亚硝酸钠对其进行诱变育种与浸矿研究。结果表明:菌株CGMCC11和CGMCC12的最适生长温度分别为28和30 ℃,最适pH值分别为7.2和8.3。采用40和60 mg/L亚硝酸钠分别处理出发菌株CGMCC11和CGMCC12,致死率分别为87%和85%,正突变率分别为18% 和 20%;筛选获得两株突变菌CGMCC11KP和CGMCC12KP,其达到生长稳定期的时间分别比对应的出发菌株达到生长稳定期的时间缩短了48和24 h,且具有更大的菌体密度、产酸和产大分子胞外聚合物的能力。浸矿15 d,与对应的出发菌株相比,突变菌株CGMCC11KP和CGMCC12KP溶出的SiO2量分别提高了30.47%和29.57%,且达到浸出终点的时间分别提前了5和3 d;混合诱变菌株浸出液中SiO2 的量分别比对应的诱变菌株浸出液中SiO2的量提高了20.0% 和37.5%,且达到浸出终点的时间比出发菌株达到浸出终点的时间提前了6 d。SEM和XRD结果表明:混合诱变菌株对铝土矿的溶蚀分解最为明显,混合浸出15 d后,诱变前后胶质芽孢杆菌CGMCC11 和环状芽孢杆菌CGMCC12的菌落个数比由1:1变为10:1。
关键词:胶质芽孢杆菌;环状芽孢杆菌;亚硝酸钠;诱变;细菌浸出; 脱硅;铝土矿
中图分类号:TD925.5;Q939.97 文献标志码:A
Sodium nitrite induced mutagenesis of bacteria and bioleaching silicon from bauxite
ZHONG Chan-juan1, 2, SUN De-si1, 2, WANG Hua-jun2, ZHANG Qiang2
(1. School of Chemistry and Environmental Engineering, Jiujiang University, Jiujiang 332005, China;
2. School of Civil and Environmental Engineering, University of Science and Technology Beijing, Beijing 100083, China)
Abstract: The original strains, Bacillus mucilaginosus CGMCC11 and Bacillus circulans CGMCC12, were treated by sodium nitrite to induce mutagenesis and investigate bioleaching of bauxite. The results show that the optimum temperature and pH value are 28 ℃ and 7.2 for B·M CGMCC11, and 30 ℃ and 8.3 for B·C CGMCC12. The lethal rates of B·M CGMCC11 and B·C CGMCC12 are 87% and 85%, and the positive mutant rates are 18% and 20% after being treated by 40 and 60 mg/L sodium nitrite culturing, respectively. The two mutants, B·M CGMCC11KP and B·C CGMCC12KP, screened from positive mutant strains reach stationary stages by 48 and 24 h ahead of the corresponding original strains, and have higher bacterial concentrations and higher ability of producing organic acids and macromolecule extracellular polymers than the original strains. After leaching for 15 d, the SiO2 concentrations in supernatants of the mutant stains of B·M CGMCC11KP and B·C CGMCC12KP are improved by 30.47% and 29.57%, and the leaching time of 5 and 3 d shorter, respectively, than those of the two corresponding original strains. After bioleaching with the mixture of B·M CGMCC11KP and B·C CGMCC12KP, the SiO2 concentration of the supernatant is 20.0% and 37.5% higher than those of the corresponding mutants, and the mixture can shorten the leaching time by 6 d in comparison with the original strains. The SEM and XRD analyses of bauxite surfaces before and after leaching show that the mixture of B·M CGMCC11KP and B·C CGMCC12KP has the greatest corrosion and decomposition ability on bauxite. After bioleaching for 15 d, the proportion of cell density in the supernatants of B·M CGMCC11 and B·C CGMCC12 is changed from 1:1 to approximately 10:1.
Key words: Bacillus mucilaginosus; Bacillus circulans; sodium nitrite; mutagenesis; bioleaching; desilicon; bauxite
随着优质铝土矿资源的日趋匮乏及人类对环境保护意识的增强,开发环境友好的低铝硅比铝土矿选矿脱硅技术日益受到人们的重视[1-2]。长期以来,铝土矿脱硅主要采用高污染与高能耗的物理及化学方法[3]。而微生物方法脱硅因其具有高选择性、高脱硅率与无环境污染等优点曾广受关注[4-6]。在20世纪70—90年代,铝土矿微生物选矿研究在俄罗斯、保加利亚与印度开展较为活跃,并取得了大量的理论研究成果,但进入21世纪以来,还未见相关报道,且至今尚无工业化应用实例[7-9]。铝土矿中的硅主要赋存于脉石矿物如高岭石、石英等硅酸盐矿物中,因此,铝土矿微生物选矿的实质是利用特定微生物风化降解铝土矿中的硅酸盐矿物,从而释放其中的硅、铁等有害元素[10]。大量研究表明,微生物主要通过有机酸、生物膜、胞外聚合物和氧化还原作用的方式风化硅酸盐矿物,微生物产酸、产胞外聚合物的能力直接影响其对硅酸盐矿物的降解效果[11-16]。迄今为止,从土壤与铝硅酸盐矿场中分离得到了细菌、真菌等多个能分解硅酸盐矿物的微生物种属[17-22]。至今用于铝土矿脱硅的菌种中效果最好的为环状芽孢杆菌Bacillus circulans(B·C)与黏液胶质芽孢杆菌Bacillus mucilaginosus(B·M)。浸矿过程中,菌种对铝硅酸盐的脱硅作用是由细菌代谢产生的大分子胞外聚合物与硅结合成络合物的直接作用,以及细菌代谢与分解大分子有机物产生的小分子有机酸酸解硅酸盐或铝硅酸盐的间接作用两部分组成的[14, 23-25]。目前,所有有关铝土矿微生物选矿技术仍处于理论与实验室研究阶段,制约其工业化应用的原因主要有:菌种生长速率缓慢,生物浸出周期较长;优良浸矿性能菌种筛选难度大,不同环境筛选所得菌种产酸、产胞外聚合物的能力不同;菌种性能不稳定,多次传代培养后分解硅酸盐矿物的能力会显著降低。这些缺陷急需在生物浸矿过程中得到解决。
诱变育种作为一种有效地提高微生物代谢产物产量的手段得到了广泛应用。在湿法冶金与矿物加工领域,国内外有关浸矿菌种的诱变育种技术的大量研究成果主要应用于铜矿、硫铁矿等重金属与贵金属矿物的生物浸出[26-28]。目前,除Groudeva[6]采用环状芽孢杆菌与粘液芽孢杆菌的诱变菌种对铝土矿进行脱硅研究外,至今国内外很少有关用于铝土矿脱硅的“硅酸盐”细菌诱变育种方面的报道。具有氧化活性的诱变剂通过对 DNA 中碱基的氧化损伤发挥致突变作用,因其诱变效果好而备受关注。其中亚硝酸及其盐是一种常用的氧化性诱变化学药剂,它们中的硝基可氧化微生物中 DNA 的腺嘌呤,使腺嘌呤经脱氨基氧化后变成次黄嘌呤。而次黄嘌呤则在 DNA 复制中替代 G 与 C 配对,其主要生物效应是引起细菌DNA 链AT→GC 的转换[29-30]。
本文作者选用两株购自中国普通微生物菌种保藏管理中心(CGMCC)的胶质芽孢杆菌B·M CGMCC11 和 环状芽孢杆菌B·C CGMCC12作为出发菌株,采用亚硝酸钠(NIT) 对出发菌株进行诱变育种,通过对诱变菌株的初筛与复筛及遗传稳定性培养,筛选出两株正突变菌B·M CGMCC11KP和B·C CGMCC12KP,并以出发菌株作为对照,采用单独菌株与混合菌株对铝土矿进行浸矿分解及脱硅试验研究。
1 实验
1.1 试验矿样
试验所用纯高岭石矿样购买于中国地质博物馆,矿样纯度为98%;浸矿用铝土矿样品采自河南中州铝厂(焦作)选矿铝土矿原矿样,为沉积型一水硬铝石铝土矿,脉石矿物主要为硅酸盐矿物,通过XRD分析,其主要矿物组成(质量分数)为:水铝石 64.6%, 高岭石16.50%,伊利石9.1%,石英1.63%,铁矿物5.40%,方解石2.50%。主要化学成分组成(质量分数)为:Al2O3 65.00%,SiO2 12.58%,Fe2O3 4.53%,TiO2 1.09%,K2O 1.09%,CaO 1.55%,MgO 0.13%,Na2O 1.17%。
1.2 出发菌株与培养基
试验所用的两株出发菌种为胶质芽孢杆菌B·M CGMCC11 和 环状芽孢杆菌B·C CGMCC12,购买于中国普通微生物菌种保藏管理中心(CGMCC)。两株菌种的表型特征基本一致,在硅酸盐盐细菌平板培养基上的菌体特征(28 ℃,培养3 d)为菌体呈杆状,两端钝圆,形成无色透明隆起菌落,菌落表面光滑,富有弹性,挑起时能拉成很长的丝,革兰氏阴性。但B·C CGMCC12 在平板上产生的芽孢比 B· M CGMCC11 的大且多,粘度较B·M CGMCC11 的低。在含纯高岭石的该类菌种的专性培养基中,在初始pH值为7.0,温度为28~30 ℃,摇床转速为150~200 r/min的条件下,培养7 d 后,两株菌种的上清液中SiO2的质量浓度可达到40 mg/L左右,表明出发菌株具有较高的分解铝硅酸盐矿物能力,并能释放其中的硅。
两株菌种的固体与液体培养基均为硅酸盐细菌专性培养基[10, 13]。
1.3 细菌诱变
试验菌株在硅酸盐细菌改性培养基(专性培养基+ (NH4)2SO4)中扩大培养至对数生长期,将菌液在5 000 r/min条件下离心分离20 min,去上清液,收集菌体,然后用无菌水制备成菌悬浮液,菌体密度控制在107~108 个/mL。
亚硝酸钠(NIT)诱变:取菌悬浮液 10 mL,分别加入250 mL 锥型瓶中,瓶中装有90 mL含不同质量浓度(0、5、10、20、40、60和80 mg/L)NIT的硅酸盐细菌改性培养基,在30 ℃、200 r/min条件下处理40 min,然后离心分离,并用无菌水洗涤3次,除去NIT,终止诱变。 然后取各诱变菌液1 mL稀释涂布于改性培养基琼脂平板上,在30 ℃下培养 48 h 后进行菌落计数,计算致死率,确定最佳诱变剂量并挑取该诱变剂量下的菌落进行初筛与复筛。菌株的正突变率由传代时间、生长稳定期和在发酵培养液中产酸与产胞外聚合物的量共同决定。菌株的代谢能力通过装有90 mL 硅酸盐细菌改性培养基+2 g高岭土矿粉的250 mL锥型瓶中进行培养测定,试验条件同1.2节所述。在培养过程中,每隔1 d 测定发酵液中的pH 值与黏度;菌株的生长稳定期通过对细菌在装有不含矿样的纯发酵液体培养基的锥型瓶,在以上同样条件下培养测定。
诱变菌株的遗传稳定性测定:将筛选出的相对较高代谢活性的菌株在含高岭石的液体培养基中连续培养7代,并于第7代测定培养液中的pH 值与黏度随培养时间的变化规律,考察诱变菌株代谢活性的稳定性。
1.4 铝土矿细菌浸出试验
在250 mL锥型瓶中装入90 mL的硅酸盐细菌专性培养基,接入对数生长期菌液(细菌初始浓度1.1×106个/mL),矿浆质量浓度为45 g/L,在30 ℃、初始pH值为7.2、200 r/min条件下连续培养15 d,定期测定上清液中SiO2的质量浓度。设计7个试验浸矿体系,每个体系做3个平行试验:1) 培养基中接种诱变前的出发菌株B·M CGMCC11;2) 培养基中接种诱变菌株B·M CGMCC11KP;3) 培养基中接种诱变前的出发菌株B·C CGMCC12;4) 培养基中接种诱菌株B·C CGMCC12KP;5) 培养基中接种诱变前的混合出发菌株B·M CGMCC11+ B·C CGMCC12(1:1);6) 培养基中接种诱变混合菌株B·M CGMCC11KP+B·C CGMCC12KP(1:1);7) 对照组CK(不接菌)。
1.5 测试分析方法
细菌浸出液中的硅形态主要有两种:细菌代谢产物(主要指胞外聚合物)对石英、高岭石与伊利石等微细颗粒(≤45 μm)硅酸盐矿物具有一定的分散作用,所以浸出液中一部分硅赋存于这些矿物中,以硅酸盐矿物形态存在,这一部分硅为非活性硅,但在HF作用下可以消解;另一部分硅在酸解、大分子有机酸等胞外聚合物的络解作用下以硅酸与有机硅的形态存在于浸出液体中,这一部分硅称为活性硅,可以与钼酸铵直接进行显色反应。
上清液中硅含量以SiO2的质量浓度进行定量,采用硅钼蓝分光光度法(721E分光光度仪,上海光谱公司生产)测定;pH 值用PHS-3C 型pH 计(上海雷磁仪器厂生产)测定;浸矿上清液黏度用黏度计测定,仪器型号为NDJ-5(上海天平厂生产);细菌培养液及浸矿上清液中的细菌数量在XS-212生物显微镜(南京江南永新光学仪器)下用平板计数法测定;用SEM(型号为VEGA∥LSU,TESCAN公司生产)与XRD(D/Max- 2500型X 射线衍射仪,日本Rigaku 生产)观察细菌浸出前后铝土矿的表面微观形态及矿物组成变化。
1.6 细菌浸矿后期浸出液中微生物群落组成分析
细菌DNA提取与纯化采用 UNIQ-10 柱式试剂盒。采用上游引物(5′AGAGTTTGATCCTGGCTCAG 3′)和下游引物为(5′ GGTTACCTTGTTACGACTT 3′) 扩增16S rRNA 基因片断。通过低熔点琼脂糖凝胶电泳观察PCR 结果,使用UNIQ-10 柱式试剂盒试剂盒回收目的片断。将转化后重组菌涂琼脂平板30 ℃过夜培养,LB 琼脂平板加入5-Bromo-4-chloro-3-indolyl β-D-galactopyranoside,筛选出100个目的菌落,使用载体引物7f(5′-CAGAGTTTGATCCTGGCT-3′)和1540r(1522)(5′-AGGAGGTGATCCAGCCGCA-3′),将携带重组质粒的细菌破壁,进行菌落PCR 扩增。16S rRNA PCR 扩增产物经HindI 和MspI(Fermentas)30 ℃酶切过夜,3.0% 琼脂糖凝胶电泳分离后,在紫外光下观察扩增性 16S rDNA 限制性酶切片段分析结果,与试验出发菌株的 16S rDNA 限制性酶切片段进行比较分析。以上主要试剂的提供与基因测序工作由上海生工生物工程技术有限公司完成。
2 结果与讨论
2.1 出发菌株的生理生化特性
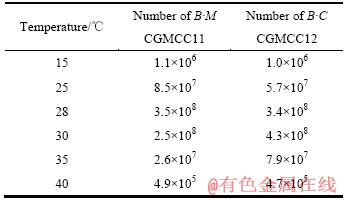
pH 值和温度对B·M CGMCC11和B·C CGMCC12生长的影响见表1和2。由表1和2可见,两株出发菌株在pH 值为5.0~9.1 和温度为25~35 ℃ 的范围内都能生长;最佳pH 值范围为7.2~8.3,最适温度范围为28~30℃;B·M CGMCC11 生长的最佳pH 值为7.2,最适温度为28 ℃;B·C CGMCC12 生长的最佳 pH 值为8.3,最适温度为30 ℃。尽管两株菌的最佳pH 值和最适温度的差别不大,但根据前期浸矿实验结果,B·M CGMCC11的浸矿效果明显要比B·C CGMCC12的好,在浸矿中起主要作用,所以,在组合菌种的浸矿试验中取pH=7.2,温度为28 ℃。
表1 pH 值对 B·M CGMCC11 和 B·C CGMCC12 生长的影响
Table 1 Effect of pH value on B·M CGMCC11 and B·C CGMCC12 growth
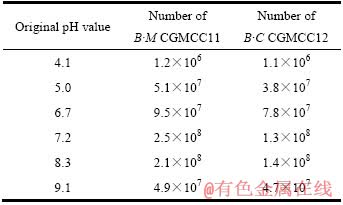
表2 温度对 B·M CGMCC11 和 B·C CGMCC12 生长的 影响
Table 2 Effect of temperature on B·M CGMCC11 and B·C CGMCC12 growth
2.2 B·M CGMCC11的亚硝酸钠诱变结果
B·M CGMCC11 的致死率和正突变率如图1 所示。从图1可见:致死率与亚硝酸钠的质量浓度成正比,以细菌在稳定期具有比原始菌株更大的菌体密度为正突变指标。当亚硝酸钠的质量浓度为40 mg/L 时,致死率为87%,正突变率为18%,为最佳诱变剂量。从正突变菌株中选取传代时间或到达生长稳定期时间较短的菌体用于浸出试验,并经过7次传代培养后获得的诱变菌株编号为B·M CGMCC11KP。
B·M CGMCC11 诱变前和诱变后的生长曲线如图2 所示。从图2可见:诱变后正突变菌株达到稳定期的时间为5 d,比原始菌株提前了2 d,菌体密度也由原来的108 个/mL左右上升到109 个/mL左右。
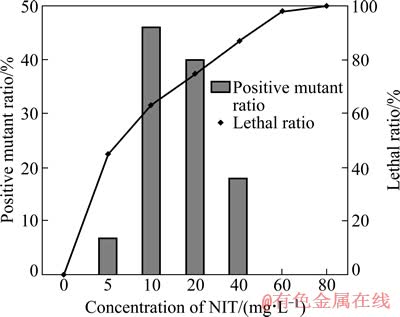
图1 亚硝酸质量浓度对B·M CGMCC11的致死率的影响
Fig. 1 Effect of mass concentration of NIT on lethal ratio of B·M CGMCC11

图2 B·M CGMCC11诱变前后的生长曲线
Fig. 2 Growth curves of B·M CGMCC11 before and after NIT-induced mutagenesis
2.3 B·C CGMCC12的亚硝酸诱变结果
B·C CGMCC12 的致死率和正突变率如图3所示。从图3 可见:B·C CGMCC12 的致死率与亚硝酸钠的质量浓度成正比,以细菌具有比出发菌更快达到生长稳定期和在生长稳定期具有更高菌体密度为正突变指标。当亚硝酸钠的质量浓度为60 mg/L 时,致死率为85%,正突变率为20%,为最佳诱变剂量。同样,从正突变菌株中选取传代时间或到达生长稳定期时间较短的菌体用于浸出试验,并经7次传代培养后,获得的诱变菌株编号为B·C CGMCC12KP。
B·C CGMCC12 诱变前和诱变后的生长曲线如图4 所示。由图4 可见:诱变后正突变菌株B·C CGMCC12KP 达到稳定期的时间为6 d,比原始菌株提前了1 d,菌体密度也由原来的108 个/mL 左右上升到大于109 个/mL。
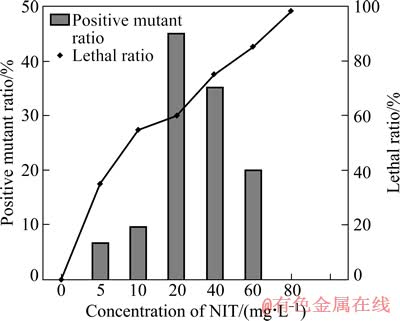
图3 亚硝酸质量浓度对B·C CGMCC12的致死率的影响
Fig. 3 Effect of mass concentration of NIT on lethal ratio of B·C CGMCC11

图4 B·C CGMCC12诱变前后的生长曲线
Fig. 4 Growth curves of B·C CGMCC11 before and after NIT-induced mutagenesis
最佳的亚硝酸钠诱变剂量取决于细菌自身的特性及基因的特异性,试验表明:对于B·M CGMCC11和B·C CGMCC12,采用亚硝酸钠的质量浓度分别在20~40和40~60 mg/L的诱变剂量更为适合。诱变剂量过大,出发菌株致死率过高(90%~100%),因为高剂量的亚硝酸钠会导致细菌大量基因严重损伤,这些基因的功能得不到及时修复就会造成负突变长生;小剂量进行处理,致死率为30%~60%,在单位存活细胞中正突变株多,然而挑选出大幅度提高产量的菌株可能性较小。
2.4 诱变菌株遗传稳定性培养
出发菌株在亚硝酸钠诱变处理后,必然破坏了其 DNA 结构的稳定性,使突变位点可能处于亚稳定状态,增大了回复突变或抑制基因突变的概率。为保证突变菌株的遗传稳定性,在诱变育种过程中做一段长期的培养和观测,反复传代7次观测其性状稳定性。铝硅酸盐矿物的微生物风化破坏程度与细菌产酸、产胞外多聚物(主要为蛋白质与多糖)等代谢产物的能力密切相关。细菌代谢产生的有机酸对增加硅酸盐矿物的溶解度和释放硅、铝、铁等有显著促进作用;由细菌分泌的胞外聚合物而形成的生物膜可以为微生物获取矿物中的营养元素提供十分有利的微环境,这是影响硅酸盐矿物风化的关键因素之一;多糖等黏性代谢产物的络合功能有利于细菌-矿物复合体的形成,这有助于提高微生物对矿物的机械破坏作用和代谢产物对矿物的化学溶蚀作用。在浸矿与硅酸盐矿物微生物风化实验中发现,Bacillus mucilaginosus 等“硅酸盐”细菌会产生一定量的有机酸与大量的胞外聚合物,使风化培养液的pH值小幅下降,而黏度大幅度的增加。
为此,以细菌代谢产酸与产胞外聚合物为诱变菌株的另两个重要正突变指标,对经过7次传代培养后所挑选出来的诱变菌株B·M CGMCC11KP,B·C CGMCC12KP与出发菌株在各菌株的最佳生理生化条件下进行培养,定时测定培养体系中的pH 值与黏度,进一步考察诱变菌株的遗传稳定性,测定结果见图5。黏度可以初步衡量细菌产大分子胞外聚合物的能力。
由图5可知,诱变菌株B·C CGMCC12KP 和B·M CGMCC11KP的产酸与产大分子胞外聚合物的能力明显要比诱变前的强,且达到最大量的发酵时间更短。在发酵培养到第5 d和第6 d时,B·M CGMCC11KP发酵液中的黏度和pH 值分别到达最大与最低值,为512 mPa·s 和 4.7,而相对应的出发菌株的最大黏度与最低pH 值分别为490 mPa·s 和 5.2,且所需时间比前者分别延时了4和2 d;B·C CGMCC12KP的发酵液在第7 d 达到最大黏度(510 mPa·s)和最低pH值(5.0),而B·C CGMCC12的发酵液则分别延时了2和1 d后到达最大黏度(470 mPa·s)和最低pH值(5.4)。由以上结果可以进一步推断,出发菌株经亚硝酸钠诱变后引起了遗传变异,筛选所得到的突变菌株产酸与产胞外聚合物的能力较出发菌株有了较大的提高,其中诱变菌株B·M CGMCC11K产酸与产胞外聚合物的能力最强。
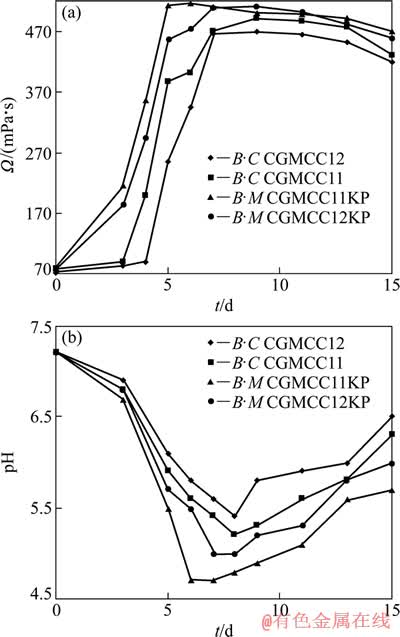
图5 发酵体系中B·C CGMCC12与B·M CGMCC11诱变前后黏度与pH值的变化规律
Fig. 5 Changes of viscosity (a) and pH values(b) of B·C CGMCC12 and B·M CGMCC11 before and after NIT-induced mutagenesis
2.5 铝土矿细菌浸出效果
以无菌培养液作为对照(CK),采用单一与组合菌种的形式,选用出发菌株B·C CGMCC12 和B·M CGMCC11与诱变菌株B·C CGMCC12KP 和B·M CGMCC11KP浸出铝土矿,试验结果见图6。
由图6可以看出,在整个浸出过程中,各浸出体系的上清液中SiO2的浸出质量浓度的变化规律一致,大致可以分为持续快速增加期、平缓增加期与停滞期3个阶段,但在不同的浸出体系中,SiO2的质量浓度的增加幅度与时间跨度存在明显差异。

图6 不同浸出体系中SiO2的质量浓度随浸出时间的变化
Fig. 6 Change of SiO2 concentrations with leaching time in different systems
在接种了出发菌株B·M CGMCC11 和B·C CGMCC12的浸出体系中,上清液中SiO2的浸出质量浓度随浸出时间的变化规律一致。在0~10 d,浸出体系上清液中SiO2的质量浓度持续快速增加,从0 mg/L分别增加至41.25和35.60 mg/L;在10~15 d,SiO2的质量浓度平缓增加至42.66和37.2 mg/L;试验中发现,15 d 后,菌种对铝土矿的溶蚀作用才基本停止,SiO2的质量浓度不再增加,达到浸出终点。
在接种了诱变菌株B·C CGMCC12KP的浸出体系中,上清液中SiO2的浸出质量浓度的快速增加期、平缓增加期与停滞期3个阶段分别为0~9 d、9~12 d 和12~15 d。当浸出到第12 d 时,浸出液中SiO2的浸出质量浓度为48 mg/L左右,且随浸出时间的延长不再增加,达到浸出终点。
在接种了诱变菌株B·M CGMCC11KP的浸出体系中,对应的3个浸出阶段分别为0~8 d、8~10 d和10~15 d。浸出10 d 后,浸出液中SiO2的质量浓度随浸出时间的延长而增加的幅度十分微弱,可以认为浸出到第10 d 时已经达到浸出终点,浸出液中SiO2的质量浓度为55 mg/L左右。
在接种了诱变前的B·M CGMCC11+B·C CGMCC12(数量比为1:1)的混合浸出体系中,对应的3个浸出阶段与诱变前单一菌株浸矿体系的一致,达到浸出终点(15 d)时,浸出液中SiO2的质量浓度为51 mg/L左右。这一结果表明混合菌种的浸矿溶硅效果要比单一菌种的要好。
在接种了诱变菌株B·M CGMCC11KP+B·C CGMCC12KP(数量比为1:1)的混合浸出体系中,对应的3个浸出阶段分别为0~8 d、8~9 d和10~15 d。根据浸出液中SiO2的质量浓度随浸出时间的变化幅度,可以认为在浸出到第9 d 时,浸出体系已经达到浸出终点,此时浸出液中SiO2的质量浓度为66 mg/L左右。
从以上试验结果可以看出:出发菌株B·M CGMCC11的浸矿脱硅效果要稍好于出发菌株B·C CGMCC12的浸矿效果,结合它们产酸与产胞外聚合物的能力结果(见图5),说明代谢能力是影响细菌对矿物溶蚀与分解的关键因素之一;诱变菌株B·M CGMCC11KP 和B·C CGMCC12KP对铝土矿的脱硅率明显比对应的出发菌株要高,浸出液中SiO2的质量浓度分别提高了30.47%和29.57%,且达到浸出终点的时间分别提前了5和3 d,说明出发菌株经亚硝酸钠诱变后,引起了生物变异,使出发菌株的铝土矿脱硅性能得到了较大的提高;使用两种菌的混合浸矿效果大于两种菌单独浸矿效果,其中,在接种了诱变菌株B·M CGMCC11KP+B·C CGMCC12KP的混合浸出体系中,达到浸出终点的时间比出发菌株提前了6 d,比浸矿效果较好的诱变菌株B·M CGMCC11KP提前了1 d,浸出液中SiO2的质量浓度分别比单一诱变菌株B·M CGMCC11KP 和 B·C CGMCC12KP提高了20.0% 和37.5% 左右,说明混合浸出是一个相互促进过程。
2.6 浸渣表面分析
铝土矿对照样(CK)及不同浸矿体系中浸渣表面的SEM与XRD 的检测结果见图7和8。

图7 浸出7 d后不同浸出体系中铝土矿浸渣表面的SEM像
Fig. 7 SEM images of bauxite surfaces after leaching for 7 d in different systems
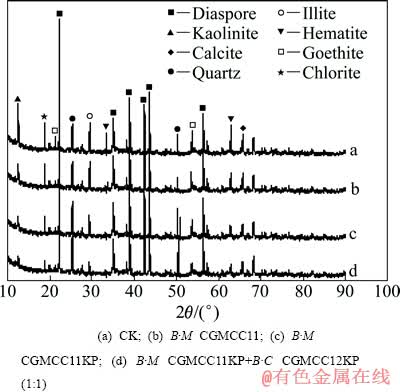
图8 浸出7 d后不同浸出体系中铝土矿浸渣的XRD谱
Fig. 8 XRD patterns of bauxite surfaces after leaching for 7 d in different systems
由图7可知,与未经细菌处理的铝土矿对照样(见图7(a))比较,各浸出体系中铝土矿浸渣表面均有明显的变化,且不同浸出体系造成的浸渣表面的溶蚀程度不同。未经细菌作用的铝土矿对照样表面较为光滑平整,表面有少量的细小颗粒(见图7(a));出发菌株B·M CGMCC11 和 B·C CGMCC12 作用后的铝土矿表面溶蚀程度基本一致,表面粗糙不平,小颗粒被溶蚀,出现了大量裂缝与棱角分明的较大颗粒,铝土矿表面结构被基本破坏(见图7(b)和(c));诱变菌株B·M CGMCC11KP作用后的铝土矿表面原始结构的破坏程度较出发菌株更加显著,溶蚀量明显增加,表面出现了大量溶蚀坑,细小颗粒明显增多,颗粒之间呈絮状粘连(见图7(d));诱变菌株B·C CGMCC12KP作用后的矿样表面的溶蚀程度较B·M CGMCC11KP作用后的铝土矿表面溶蚀程度略小,浸渣表面有大量的溶蚀带与圆滑的细小颗粒(见图7(e));在诱变菌株B·M CGMCC11KP+B·C CGMCC12KP的混合浸出体系中,铝土矿表面的溶蚀量最大,现象最为明显,铝土矿表面原始结构被完全破坏,看不到明显的单独细小颗粒,颗粒之间基本呈絮状粘连到一起(见图7(f))。
从图8可以看出,与对照组比较,在3组浸出体系中,细菌对铝土矿中的高岭石、伊利石、绿泥石、赤铁矿和针铁矿均有明显的溶蚀与分解作用,各自特征峰的衍射锐锋强度均有不同程度的降低或消失。混合诱变菌株B·M CGMCC11KP+B·C CGMCC12KP的浸出体系对铝土矿的分解作用最为明显,浸出终点后,铝土矿中的高岭石、伊利石与赤铁矿特征峰基本消失,而石英的特征锐锋明显增强;单一诱变菌株B·M CGMCC11KP的浸出体系明显要比单一出发菌株B·M CGMCC11的浸出体系对铝土矿的风化分解作用要强,高岭石、伊利石、绿泥石、赤铁矿和针铁矿特征峰下降更为明显。 从图8还可以看出,细菌对具有层状结构的高岭石与伊利石的分解作用明显要大于具架状结构的石英,表明该类细菌对铝土矿中的硅酸盐矿物的风化分解具有一定的选择性。
2.7 铝土矿细菌浸出后浸出液中生物群落组成
在细菌浸出反应的初始阶段,诱变前后的B·M CGMCC11和B·C CGMCC12具有相同的细胞浓度。浸出15 d 后,在接种了诱变前混合菌B·M CGMCC11 + B·C CGMCC12的浸矿体系中,经过限制性片断长度多态性(ARDRA)分析,浸出液中B·M CGMCC11和B·C CGMCC12的数量比约为13:1;在相同条件下,接种了诱变后混合菌B·M CGMCC11KP + B·C CGMCC12KP 的浸出矿体系中,它们的数量比约为10:1。这证明了B·C 不是浸矿过程的优势菌,只占菌落结构的小部分,协助B·M 起浸矿促进作用。因此,可以在以后的铝土矿浸矿脱硅研究中更多考虑有利于B·M 浸矿的因素,并在浸出体系中接种少量的B·C。
3 结论
1) 试验中所选用的出发菌株B·M CGMCC11生长的最佳pH 值为7.2,最适温度为28 ℃;出发菌株B·C CGMCC12生长的最适 pH 值为8.3,最适温度为30 ℃。
2) 亚硝酸钠诱变B·M CGMCC11和B·C CGMCC12的最佳剂量分别为40和60 mg/L,致死率分别为87% 和85%,正突变率分别为18% 和20%。诱变后筛选所得的诱变菌株B·M CGMCC11KP和B·C CGMCC12KP 达到生长稳定期的时间分别比对应的出发菌株缩短了48和24 h,且有更大的细菌浓度;诱变菌株产酸与产胞外聚合物的能力较出发菌株有了较大的提高,其中诱变菌株B·M CGMCC11K产酸与产胞外聚合物的能力最强。
3) 诱变菌株B·M CGMCC11KP 和B·C CGMCC12KP对铝土矿溶蚀分解能力比对应的出发菌株要强,浸出液中SiO2的质量浓度分别比出发菌株提高了30.47% 和29.57%,且达到浸出终点的时间分别提前了5和3 d;混合诱变菌株优于单独出发菌株、单独诱变菌株和混合出发菌株对铝土矿的风化分解效果,浸出体系达到浸出终点的时间比出发菌株提前了6 d,比浸矿效果较好的诱变菌株B·M CGMCC11KP提前了1 d,浸出液中SiO2的质量浓度分别比单一诱变菌株B·M CGMCC11KP和B·C CGMCC12KP提高了20.0%和37.5% 左右。
4) 在铝土矿混合浸矿过程中,B·M与B·C相比,B·M为浸矿过程中的优势菌,浸出15 d后,B·M CGMCC11和B·C CGMCC12 数量比由1:1变为13:1左右;而B·M CGMCC11KP 和 B·C CGMCC12KP数量比由1:1变为10:1左右。
REFERENCES
[1] 梁汉轩, 鹿爱莉, 李翠平. 我国铝土矿贫矿资源的开发利用条件及方向[J]. 中国矿业, 2011, 20(7): 10-13.
LIANG Han-xuan, LU Ai-li, LI Cui-ping. Conditions and directions for utilization of low-grade bauxite in China[J]. China Mining Magazine, 2011, 20(7): 10-13.
[2] 孙 莉, 肖克炎, 王全明, 娄德波, 阴江宁. 中国铝土矿资源现状和潜力分析[J]. 地质通报, 2011, 30(5): 722-728.
SUN Li, XIAO Ke-yan, WANG Quan-ming, LOU De-bo, YIN Jiang-ning. The analysis on the present situation and potential of bauxite resources in China[J]. Geological Bulletin of China, 2011, 30(5): 722-728.
[3] 李军旗, 张 煜. 含铝硅矿物预脱硅工艺研究进展[J]. 湿法冶金, 2011, 29(4): 229-231.
LI Jun-qi, ZHANG Yu. Research progress on pre-desilicificationf from minerals containing aluminum and silicon[J]. Hydrometallurgy of China, 2011, 29(4): 229-231.
[4] 徐 靖, 张一敏, 王 娟. 一种微生物脱除铝土矿中二氧化硅的方法研究[J]. 中国矿业, 2010, 19(3): 72-75.
XU Jing, ZHANG Yi-min, WANG Juan. One kind of microorganism removing bauxite silicon dioxide method study[J]. China Mining Magazine, 2010, 19(3): 72-75.
[5] GROUDEVAVI,GROUDEVSN.BauxitedressingbymeansofBacilluscirculans[J]. Travaux ICSOBA,1983, 13(18): 257-263.
[6] GROUDEVA V I, 仲崇渡. 铝土矿的微生物选矿[J]. 国外金属矿选矿, 1989, 26(11): 9-10.
GROUDEVA V I, ZHONG Cong-du. Bauxite dressing by microorganisms[J]. Metallic Ore Dressing Abroad, 1989, 26(11): 9-10.
[7] GROUDEV S N. Biobeneficiation of mineral raw materials[J]. Minerals and Metallurgical Processing Journal, 1999, 16(4): 19-28.
[8] NATAYAUAN K A. Some microbiological aspects of bauxite mineralization and beneficiation[J]. Minerals and Metallurgical Processing, 1997, 14(2): 47-53.
[9] BANDYOPADHYAY. Optimization of physical factors for bioleaching of silica and iron bauxite ore by a mutant strain of Aspergillus Niger[J]. Research India, 1995, 40(1): 14-17.
[10] 钮因健, 邱冠周, 周吉奎. 硅酸盐细菌的选育及铝土矿细菌脱硅效果[J]. 中国有色金属学报, 2004, 14(2): 281-285.
NIU Yin-jian, QIU Guan-zhou, ZHOU Ji-kui. Screening of silicate bacteria and bioleaching silicon from bauxite[J]. The Chinese Journal of Nonferrous Metals, 2004, 14(2): 281-285.
[11] 莫彬彬, 连 宾. 长石风化作用及影响因素分析[J]. 地学前缘, 2010, 17(3): 281-288.
MO Bin-bin, LIAN Bin. Study on feldspar weathering and analysis of relevant impact factors[J]. Earth Science Frontiers , 2010, 17(3): 281-289.
[12] 陆现彩, 屠博文, 朱婷婷, 李 娟, 王朝华, 周跃飞, 赵兴青, 陆建军, 王汝成. 风化过程中矿物表面微生物附着现象及意义[J]. 高校地质学报, 2011, 17(1): 21-28.
LU Xian-cai, TU Bo-wen, ZHU Ting-ting, LI Juan, WANG Chao-hua, ZHOU Yue-fei, ZHAO Ying-qing, LU Jian-jun, WANG Ru-cheng. Attachment of microbes on mineral surface in microbial weathering and its significance[J]. Geological Journal of China Universities, 2011, 17(1): 21-28.
[13] 孙德四, 于盛禄, 孙剑奇. 不同矿物对硅酸盐细菌JXF菌株生长的抑制作用[J]. 黄金, 2008, 29(1): 45-47.
SUN De-si, YU Sheng-lu, SUN Jian-qi. Inhibitory effect of different minerals on silicate bacteria JXF strain growth[J]. Gold, 2008, 29(1): 45-47.
[14] 孙德四, 张贤珍, 张 强. 硅酸盐细菌代谢产物对硅酸盐矿物的浸溶作用研究[J]. 矿冶工程, 2006, 26(3): 27-29.
SUN De-si, ZHANG Xian-zhen, ZHANG Qiang. Leaching effects of metabolites of silicate bacterium on silicate minerals[J]. Mining and Metallurgical Engineering, 2006, 26(3): 27-29.
[15] 吴 涛, 陈 骏, 连 宾. 微生物对硅酸盐矿物风化作用研究进展[J]. 矿物岩石地球化学通报, 2007, 26(3): 263-268.
WU Tao, CHEN Jun, LIAN Bin. Advance in studies on the function of microbes to the weathering of silicate minerals[J]. Bulletin of Mineralogy, Petrology and Geochemistry, 2007, 26(3): 263-268.
[16] 惠 明, 侯银臣, 田 青. 硅酸盐细菌GSY-1胞外多糖的性质及其对铝土矿的脱硅效果[J]. 河南师范大学学报, 2010, 38(1): 142-146.
HUI Ming, HOU Yin-chen, TIAN Qing. Characteristics of exo-polysyccharides from the silicate bacterium GSY1 and its leaching effects on bauxite mineral[J]. Journal of Henan Normal University, 2010, 38(1): 142-147.
[17] BHATTI T M, BIGHAM J M, VUORINEN A, TUOVINEN O H. Weathering of phlogopite in simulated bioleaching solutions[J]. International Journal of Mineral Processing, 2011, 98(1): 30-34.
[18] GERICKE M A. Mintek perspective of the past 25 years in minerals bioleaching[J]. Journal of the Southern African IMM, 2009, 109(10): 324-328.
[19] BRIERLEY C L. Biohydrometallurgical prospects[J]. Hydrometallurgy, 2010, 104(3): 216-221.
[20] DOPSON M, LOVYGREN L, BOSTROM D. Silicate mineral dissolution in the presence of acidophilic microorganisms: Implications for heap bioleaching[J]. Hydrometallurgy, 2009, 96(4): 325-329.
[21] MOCKOVCIAKOVA A, IVETA S, JIRI S, IVANA K. Characterization of changes of low and high defect kaolinite after bioleaching[J]. Applied Clay Science, 2008, 39(3/4): 451-455.
[22] ANJUM F, SHAHID F, AKCIL A. Biohydrometallurgy techniques of low grade ores: A review on black shale[J]. Hydrometallurgy, 2012, 117/118: 1-12.
[23] 周跃飞, 王汝成, 陆现彩,陆建军. 微生物-矿物接触模式影响矿物溶解机制的实验研究[J]. 高校地质学报, 2007, 13(4): 658-662.
ZHOU Yue-fei, WANG Ru-cheng, LU Xian-cai, LU Jian-jun. Influence of microbe-mineral contact model on mineral dissolution: A primary study on microperthite dissolution by Paenibacillus polymyxa[J]. Geological Journal of China Universities, 2007, 13(4): 658-662.
[24] ZHOU Y F, WANG R C, LU X C, CHEN T H. Roles of adhered Paenibacillus polymyxa in the dissolution and flotation of bauxite: a dialytic investigation[J]. Frontiers of Earth Science in China, 2010, 4(2): 167-173.
[25] 惠 明, 侯银臣, 田 青, 窦丽娜. 硅酸盐细菌在铝土矿开发中的应用研究进展[J]. 安徽农业科学, 2009, 37(23): 10881-10882.
HUI Ming, HOU Yin-chen, TIAN Qing, DOU Li-na. Research advances on the application of silicate bacteria in bauxite exploitation[J]. Journal of Anhui Agricultural Sciences, 2009, 37(23): 10881-10882.
[26] 董颖博, 林 海, 傅开彬, 莫晓兰, 汪 涵. 细菌化学诱变对低品位铜尾矿微生物浸出的影响[J]. 北京科技大学学报, 2011, 33(5): 532-538.
DONG Yin-bo, LIN Hai, FU Kai-bin, MO Xiao-lan, WANG Han. Effects of chemical mutation on the microbial leaching of low grade copper tailings[J]. Journal of University of Science and Technology Beijing, 2011, 33(5): 532-538.
[27] DONG Y, LIN H, WANG H, MO X, FU K, WEN H, Effects of ultraviolet irradiation on bacteria mutation and bioleaching of low-grade copper tailings[J]. Minerals Engineering, 2011, 24(8): 870-875.
[28] 杨 宇, 张 帅, 徐爱玲, 邹俐宏, 历 丽, 邱冠周. 隐藏嗜酸菌 DX1-1和氧化亚铁硫杆菌CMS的紫外诱变育种及浸矿研究[J]. 中南大学学报: 自然科学版, 2010, 41(2): 393-399.
YANG Yu, ZHANG Shuai, XU Ai-ling, ZOU Li-hong, LI Li, QIU Guan-zhou. UV-induced mutagenesis and bioleaching of Acidiphilium cryptum and Acidithiobacillus ferrooxidans[J]. Journal of Central South University: Science and Technology, 2010, 41(2): 393-399.
[29] 程 明, 崔承彬, 李长伟, 田从魁, 杜智敏. 化学诱变技术在微生物育种研究中的应用[J]. 国际药学研究杂志, 2009, 36(12): 412-417.
CHEN Ming, CUI Cheng-bin, LI Chang-wei, TIAN Cong-kui, DU Zhi-min. Chemical mutation technique applied microorganism breeding[J]. Journal of International Pharmaceutical Research, 2009, 36(12): 412-417.
[30] 周 丹, 曾宪鹏, 李盛钰, 赵玉娟, 张 雪, 谢达平, 杨贞耐. 植物乳杆菌荚膜缺陷型菌株的诱变选育[J]. 微生物学报, 2010, 37(11): 1666-1671.
ZHOU Dan, ZHENG Xian-peng, LI Sheng-yu, ZHAO Yu-juan, ZHANG Xue, XIE Da-ping, YANG Zhen-nai. Mutagenesis and breeding of capsule-deficient Lactobacillus plantarum[J]. Microbiology China, 2010, 37(11): 1666-1671.
(编辑 何学锋)
基金项目:国家自然科学基金资助项目(51064011,51264014);江西省自然科学基金资助项目(2008GZN0045)
收稿日期:2011-07-27;修订日期:2012-11-27
通信作者:孙德四,教授,博士;电话:15170295286;E-mail:sundesi1215@126.com