DOI: 10.11817/j.issn.1672-7207.2019.09.001
铜冶炼含砷废水水热臭葱石沉砷及亚稳态铁物相转化行为
张俊,李存兄,魏昶,邓志敢,李兴彬,张鹏
(昆明理工大学 冶金与能源工程学院,云南 昆明,650093)
摘要:以铜冶炼过程所产生的含砷废水为研究对象,研究宏观技术参数对水热臭葱石沉砷及过程亚稳态铁物相的转化影响规律。研究结果表明:适当提高初始Fe与As物质的量比、氧分压以及反应温度,控制初始pH为1,不仅能提高As和Fe的沉淀率,也有利于亚稳态铁物相的分解与转化。延长反应时间可显著降低沉砷渣中S的质量分数,并形成大颗粒臭葱石。在初始Fe与As物质的量比为1.5,初始pH为1,氧分压为0.6 MPa及反应温度为160 ℃的条件下,As和Fe的沉淀率分别为98.28%与87.89%,获得了以臭葱石为主要物相的沉砷渣,其As,Fe和S的质量分数分别为22.04%,25.58%和3.54%,粒度为18.6 μm,比表面积为0.019 m2/g。
关键词:含砷废水;水热沉砷;臭葱石;铁矾;碱式硫酸铁
中图分类号:TF09 文献标志码:A 文章编号:1672-7207(2019)09-2053-10
Hydrothermal scorodite precipitation and conversion behavior of metastable iron phase from wastewater produced in copper smelting
ZHANG Jun, LI Cunxiong, WEI Chang, DENG Zhigan, LI Xingbin, ZHANG Peng
(Faculty of Metallurgical and Energy Engineering, Kunming University of Science and Technology,Kunming 650093, China)
Abstract: The arsenic-containing wastewater produced by the copper smelting process was studied to investigate the hydrothermal precipitation arsenic as scorodite and the conversion behavior of process metastable phases. The results show that the increase of initial molar ratio of Fe to As, oxygen partial pressure and reaction temperature, and control of initial pH of 1, can not only increase the precipitation rate of As and Fe in solution, but also improve the metastable conversion in the solution. With the increase of the reaction time, the mass fraction of S in the precipitates can be reduced, and the precipitates of large size are formed. When the initial molar ratio of Fe to As is 1.5, initial pH is 1, oxygen partial pressure is 0.6 MPa and reaction temperature is 160 °C, the removal rates of As and Fe are 98.28% and 87.89%, respectively. The mass fractions of As, Fe and S are 22.04%, 25.58% and 3.54% in the precipitates, respectively. The particle size is 18.6 μm, and the specific surface area is 0.019 m2/g.
Key words: wastewater containing arsenic; hydrothermal removal arsenic; scorodite; jarosite; basic ferric sulfate
砷是一种剧毒元素,广泛存在于金属矿物中。矿业活动是导致砷污染的重要原因之一[1-2],铜冶炼是产生含砷废水的主要行业,日益严格的环保要求使铜冶炼企业面临前所未有的挑战,因此,铜冶炼过程的含砷废水无害化处理具有重要意义[3-4]。长期以来,化学沉淀法[5-6]因具有成本低、沉砷效率高等特点[7],被广泛应用于铜冶炼含砷废水的净化处理[8-9]。然而,采用化学沉淀法处理含砷废水时,易产生大量危废砷酸钙、非晶型砷酸铁渣,而造成二次污染[10],且安全填埋和处置费用高。臭葱石(FeAsO4·2H2O)是一种天然的含砷矿物,具有浸出毒性小及稳定性高的特点,被认为是理想的固砷矿物[10-11],是目前砷固化的研究热点。近年来,国内外众多科研工作者采用常压法或水热法开展了以含砷铁溶液为对象所进行的臭葱石沉砷的研究工作。刘志宏等[12-14]在FeSO4-H3AsO4-H2O体系中开展了常压沉砷研究,获得了臭葱石沉砷渣。然而,采用该方法获得的臭葱石沉砷渣中含有一定比例的非晶型砷酸铁[15],影响了沉砷渣的稳定性[16]。MAMBOTE等[17-18]绘制并分析了Fe-As-H2SO4系的热力学优势图,认为水热条件下形成稳定臭葱石物相的温度范围为150~170 ℃。余自秀等[19-20]通过研究发现水热条件下不利于形成非晶型砷酸铁,且水热臭葱石沉砷渣的稳定性比常压下的高,所需反应时间短。然而,SWASH等[21]发现水热条件下形成的臭葱石沉砷渣中伴有铁矾、碱式硫酸铁等亚稳态铁物相。李存兄等[22-24]在水热赤铁矿沉铁过程中研究发现,通过控制体系酸度、温度、铁离子浓度等因素可实现亚稳态铁矾的溶解与转化。但采用常压法或水热法获得的臭葱石沉砷渣中含有亚稳态铁物相,降低了臭葱石沉砷渣的纯度及其稳定性。工业含砷废水杂质含量高、成分复杂,以此为原料获得的臭葱石沉砷渣成分将更为复杂,将影响臭葱石沉砷渣的稳定性,易引发环境污染问题。水热臭葱石沉砷工艺是处理工业含砷废水的有效方法,研究该过程中亚稳态铁物相的抑制及转化对获得性质稳定、杂质含量低的臭葱石沉砷渣具有重要意义。在此,本文作者以铜冶炼含砷废水为研究对象,研究了水热条件下Fe与As物质的量比、初始pH、氧分压及反应温度等宏观技术参数对水热臭葱石沉砷及亚稳态铁物相转化行为的影响规律。
1 实验
1.1 实验原料及设备
本研究所用含砷废水取自云南某炼铜企业,该含砷废水具有砷浓度高、成分复杂等特点,其主要化学组成如表1所示。由表1可知:含砷废水砷质量浓度为19 g/L,并富含锌、铜、镁等杂质离子。由于含砷废水中铁浓度极低,为满足臭葱石沉砷的需要,需补加铁源。由于溶液中的锌质量浓度为5.51 g/L,可对沉砷后液中的锌进行富集处理,以利于后续对锌的回收。
表1 含砷废水的主要化学组成(质量浓度)
Table 1 Major chemical composition of arsenic-containing wastewater g/L

以七水硫酸亚铁(FeSO4·7H2O,分析纯,天津市凤船化学试剂科技有限公司生产)作为铁源,氢氧化钠(NaOH,分析纯,天津市大茂化学试剂厂生产)和98%(质量分数,成都市科龙化工试剂厂生产)硫酸调节溶液pH,氧化剂为工业级氧气。
实验主体设备为2L-GSH型高压釜及温控仪(山东威海化工机械有限公司),辅助设备包括真空干燥箱(上海一恒科学仪器有限公司)、旋片真空泵(浙江台州求精真空泵有限公司)、电子分析天平(梅特勒-托利多METTLER)、PHSJ-5型实验室pH计(上海雷磁仪器有限公司)、实验室用超纯水机(四川沃特尔水处理设备有限公司)等。
1.2 实验过程
向含砷废水加入七水硫酸亚铁,调节pH之后,量取1 L混合溶液加入高压釜内,检查设备气密性后连接供氧设备。预设氧分压、搅拌转速和实验反应温度,待釜内温度达到预设值,开始供氧。每30 min取样1次,经液固分离后待检。到达反应时间后,关闭氧气阀快速降温,用真空泵抽出抽滤过滤,量取液样体积,滤渣称质量,在70 ℃恒温干燥箱内烘干,保存待检。
1.3 分析检测
采用D/max-2200X线衍射仪(XRD)、VEGA 3 SBH扫描电镜(SEM)、JXA-8100电子探针(EPMA)、Bettersize-2000激光粒度仪及Rise-1001比表面积测试仪等现代分析检测手段表征沉砷渣,从而获得其物相组成、形貌特征、粒度及比表面积等参数。含砷废水化学组成及沉砷渣成分在云南有色冶金研究院分析。采用式(1)计算水热臭葱石沉砷过程的沉砷率或沉铁率:
η=[1-( 2V2/
2V2/ 1V1)]×100% (1)
1V1)]×100% (1)
其中:η为沉铁率或沉砷率,%; 2为滤液中铁或砷的质量浓度,g/L;
2为滤液中铁或砷的质量浓度,g/L; 1为初始溶液中铁或砷的质量浓度,g/L;V2为反应后液的体积,L;V1为初始溶液体积,L。
1为初始溶液中铁或砷的质量浓度,g/L;V2为反应后液的体积,L;V1为初始溶液体积,L。
1.4 实验原理
在Fe(II)- As(Ⅴ)-H2O系中形成臭葱石的反应方程式为[17]
4H3AsO4+4FeSO4+O2+6H2O→
4FeAsO4·2H2O+4H2SO4 (2)
式(2)由Fe(II)的氧化反应及As(Ⅴ)与Fe(Ⅲ)共沉淀反应组成:
4FeSO4+O2+2H2SO4=Fe2(SO4)3+2H2O (3)
Fe2(SO4)3+2H3AsO4+4H2O=2FeAsO4·2H2O+3H2SO4 (4)
当溶液中Fe(Ⅲ)达到过饱和状态及低酸度状态时,发生Fe(Ⅲ)水解副反应,形成铁矾或碱式硫酸铁等亚稳态铁物相[22]:
M2SO4+3Fe2(SO4)3+12H2O=2MFe3(SO4)2(OH)6+6H2SO4
(M=K+, Na+, NH4+, H3O+等) (5)
Fe2(SO4)3+2H2O=2Fe(OH)SO4+H2SO4 (6)
由式(2)可知,砷酸为三元弱酸,其电离能力明显弱于硫酸的电离能力[14],总体上,反应属于一个产酸的过程。实验证明:反应后溶液pH较反应前溶液pH均有降低。然而,反应(2)由反应(3)和(4)组成,亚铁的氧化是一个耗酸过程,当体系Fe(II)的氧化速率(反应(3))大于Fe(Ⅲ)与As(Ⅴ)的共沉淀速率(反应(4))时,体系中的酸度快速降低;当Fe(II)氧化一定时间后,Fe(Ⅲ)与As(Ⅴ)的共沉反应(反应(4))成为主要反应,形成臭葱石物相。若Fe(Ⅲ)在较短时间浓度急剧升高达到过饱和状态,则此时易发生Fe(Ⅲ)水解副反应(反应(5)和(6)),形成亚稳态铁物相,导致渣中砷的质量分数降低,硫质量分数升高,影响臭葱石沉砷渣的纯度及稳定性。可通过控制过程Fe(II)氧化速率和技术参数抑制或使形成的亚稳态铁物相发生转变。
2 结果与讨论
2.1 Fe与As物质的量比和时间的影响
在溶液初始pH为1,搅拌速度为500 r/min,反应温度为160 ℃,氧分压为0.6 MPa及反应时间为180 min的条件下,考察Fe与As物质的量比、时间对砷、铁沉淀率以及沉砷渣中亚稳态铁物相形成及转化的影响规律,结果分别如图1~3所示。
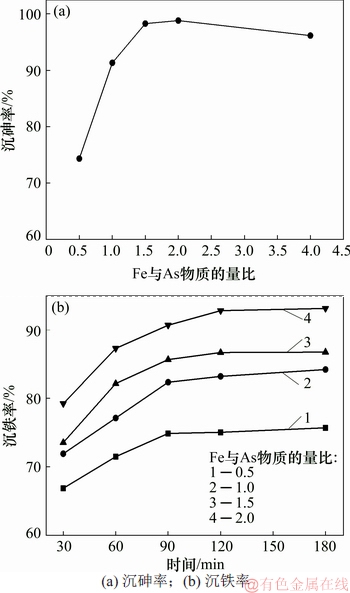
图1 初始Fe与As物质的量比与时间对沉铁率和沉砷率的影响
Fig. 1 Effect of initial molar ratio of Fe to As and time on Fe and As removal efficiencies

图2 不同初始Fe与As物质的量比沉积物的XRD图谱
Fig. 2 XRD patterns of precipitates with different initial molar ratios of Fe to As
由图1可知:沉铁率随着反应时间延长和Fe与As物质的量比升高而逐渐升高;当反应时间为3 h,Fe与As物质的量比分别为0.5,1.0,1.5和2.0时,对应的沉铁率分别为75.69%,84.21%,86.76%和93.15%,沉砷率分别为74.3%,91.33%,98.28%和98.81%,表明Fe与As物质的量比对砷与铁的沉淀率影响显著。
由图2可知:当反应时间分别为90 min和180 min,Fe与As物质的量比分别为0.5和1.0时,沉砷渣中只检测到臭葱石物相;当反应时间为90 min,Fe与As物质的量比分别为1.5与2.0时,沉砷渣中伴有少量亚稳态铁矾和碱式硫酸铁物相,且二者的衍射峰随Fe与As物质的量比的增大而增强(图2(a));当反应时间为180 min,Fe与As物质的量比为1.5与2.0时,沉砷渣中只检测到臭葱石和亚稳态铁矾物相,且随着Fe与As物质的量比升高,铁矾衍射峰增强,臭葱石衍射峰减弱,因受到溶液中Fe(Ⅲ)达到过饱和状态影响,部分Fe(Ⅲ)发生副反应形成铁矾物相,导致Fe与As物质的量比为2.0时,沉砷渣中S的质量分数上升,臭葱石的衍射峰减弱,铁矾物相衍射峰增强;当Fe与As物质的量比大于2.0时,体系中的沉砷率降低,而沉铁率随着物质的量比升高而升高。由于臭葱石的形成与铁矾等亚稳态形成时彼此竞争,溶液中的Fe(Ⅲ)处于过饱和状态,进一步削弱了形成臭葱石物相的动力[25],导致溶液中的铁以铁矾等亚稳态物相的形式沉淀,降低了砷的沉淀率,而沉铁率上升。
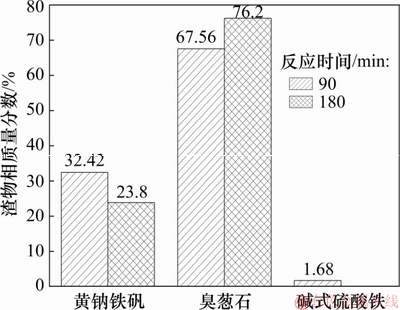
图3 反应时间对初始Fe与As物质的量比为1.5的沉砷渣物相组成的影响
Fig. 3 Effect of reaction time on phase composition of precipitates with initial molar ratio of Fe to As of 1.5
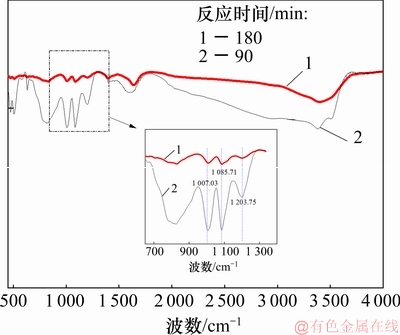
图4 反应时间分别为90 min和180 min时沉砷渣的红外光谱图
Fig. 4 FT-IR spectra of precipitates reaction for 90 min and 180 min
由图3可知:当反应时间为90 min时,沉砷渣中臭葱物相、亚稳态的铁矾和碱式硫酸铁的质量分数分别为67.56%,32.42%和1.68%;当反应时间为180 min时,渣中的臭葱石质量分数升高为76.2%,铁矾质量分数降低为23.8%,未检测到Fe(OH)SO4。这表明延长反应时间有利于渣中亚稳态铁物相的转化。在图4中,红外波段范围为900~1 300 cm-1[22],为S—O键的拉伸震动峰,在此范围内存在的3个吸收峰属于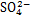 的震动吸收峰;随着反应时间的延长,由于渣中的含硫的亚稳态铁矾物相转化,导致在180 min时
的震动吸收峰;随着反应时间的延长,由于渣中的含硫的亚稳态铁矾物相转化,导致在180 min时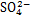 的震动吸收峰明显弱于90 min时的震动吸收峰。
的震动吸收峰明显弱于90 min时的震动吸收峰。
2.2 初始pH的影响
在Fe与As物质的量比为1.5,反应温度为160 ℃,搅拌速度为500 r/min,氧分压为0.6 MPa及反应时间为180 min的条件下,考察初始pH对砷与铁沉淀率、物相组成及沉砷渣元素质量分数的影响,结果如图5~7所示。
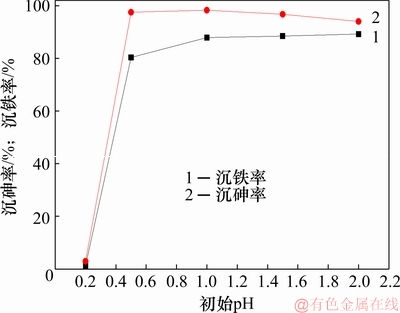
图5 不同初始pH对沉砷率和沉铁率的影响
Fig. 5 Effect of initial pH on As and Fe removal efficiency
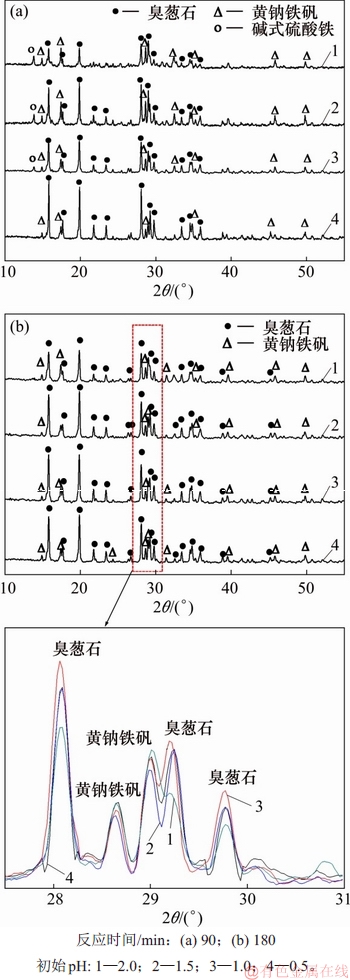
图6 不同初始pH沉砷渣的XRD图谱
Fig. 6 XRD patterns of precipitates with different initial pH
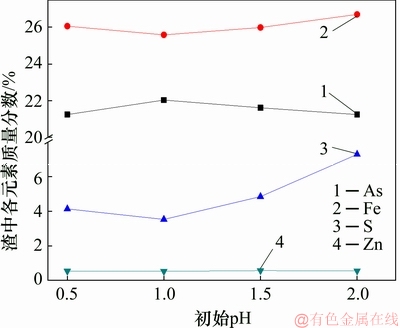
图7 初始pH对沉砷渣化学成分的影响
Fig. 7 Effect of initial pH on chemical composition in precipitates
由图5可知:当初始pH为0.2时,沉砷率与沉铁率极低,由于酸度过高,导致在此条件时,形成臭葱石较为困难。随着初始pH升高,溶液中的沉砷率升高,表明初始pH对于沉砷率有影响。在图6中,臭葱石物相衍射峰强度达最强,这是因为在初始pH为1时,处于臭葱石的物相稳定区[25],有利于As(Ⅴ)与Fe(Ⅲ)共沉淀,形成臭葱石物相。结合图7可以看出:当初始pH升高至1.5及2.0时,沉铁率升高,沉砷率降低,导致渣中臭葱石衍射峰减弱,渣中硫质量分数由3.54%升高至7.00%。由于初始pH的升高,导致溶液中Fe(Ⅲ)开始水解,促使形成铁矾等亚稳态物相。然而,渣中锌的质量分数均保持0.5%左右,不受反应条件变化影响。
2.3 氧分压的影响
在Fe与As物质的量比1.5,初始pH为1,搅拌速度为500 r/min,反应温度为160 ℃及反应时间为180 min条件下,考察了氧分压对沉砷率、沉铁率以及沉砷渣物相的影响规律,结果分别如图8~10所示。
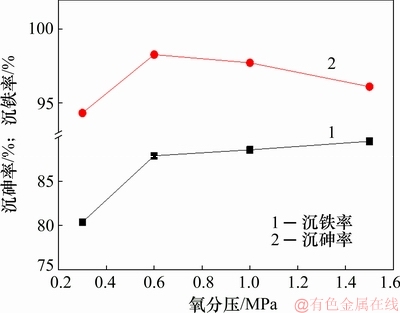
图8 不同氧分压对沉铁率及沉砷率的影响
Fig. 8 Effect of oxygen partial pressure on As and Fe removal efficiencies
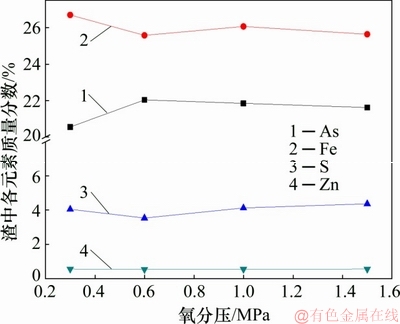
图9 氧分压对渣中化学成分的影响
Fig. 9 Effect of oxygen partial pressure on chemical composition in precipitates
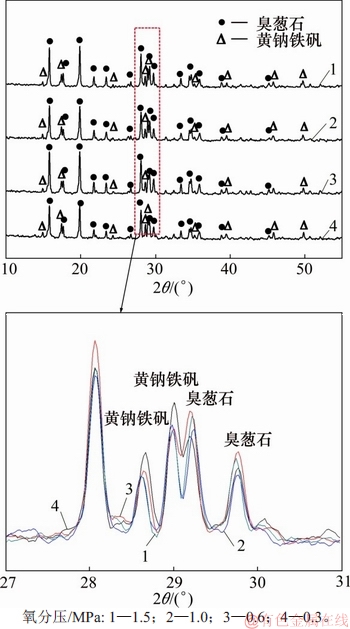
图10 反应时间180 min时不同氧分压下沉砷渣XRD图谱
Fig. 10 XRD pattern of precipitates reaction for 180 min at different oxygen partial pressures
由图8~10可知:在低氧分压下,溶液中的Fe(Ⅱ)氧化较为缓慢,阻碍As(Ⅴ)与Fe(Ⅲ)共沉淀,导致铁以亚稳态铁矾形式沉淀,渣中硫含量较高,臭葱石衍射峰较弱;当氧分压升至0.6 MPa时,渣中硫含量最低,沉砷率提高,臭葱石物相衍射峰增强;当氧分压为1.0 MPa与1.5 MPa时,由于Fe(Ⅱ)氧化速率过快,导致溶液中的Fe(Ⅲ)浓度达到过饱和状态,易发生Fe(Ⅲ)水热水解副反应,生成铁矾等亚稳态物相,从而使渣中含硫的质量升高。
2.4 反应温度的影响
在Fe与As物质的量比为1.5,初始pH为1,搅拌速度为500 r/min,氧分压为0.6 MPa及反应时间为180 min条件下,考察反应温度对于沉砷率、沉铁率以及沉砷渣物相的影响规律,结果分别如图11~13所示。
由图11~13可知:渣中以臭葱石物相为主,说明在实验反应温度时均能形成臭葱石物相,然而,不同温度时所形成的铁矾物相衍射峰不一;当反应温度较低为150 ℃时,不利于形成臭葱石物相,此时溶液中的铁形成亚稳态铁矾物相,导致渣中含硫量过高,减弱臭葱石物相衍射强度;当反应温度升高至160 ℃时,有利于形成臭葱石[18],同时使亚稳态铁矾物相转化,渣含硫量较低;当反应温度为180 ℃时,更易导致Fe(Ⅱ)的氧化,导致Fe(Ⅲ)浓度过高达到过饱和状态,易发生副反应(反应(5))或(反应(6))形成亚稳态铁物相,并且过高的温度也将抑制铁矾物相转化[24],溶液中的铁以亚稳态铁矾物相形式存在渣中,导致渣含硫升高。
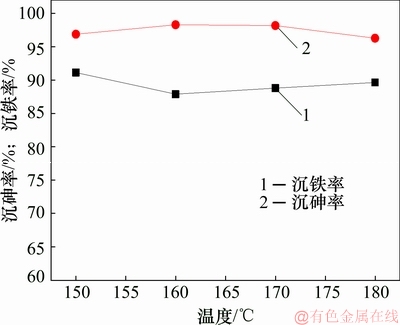
图11 温度对沉砷率及沉铁率影响
Fig. 11 Effect of temperature on As and Fe removal efficiency
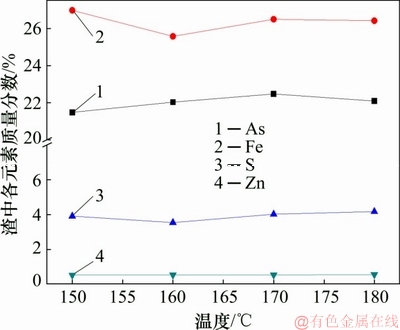
图12 温度对沉砷渣成分的影响
Fig. 12 Effect of temperature on chemical composition in precipitates

图13 不同温度反应的沉砷渣XRD图谱
Fig. 13 XRD pattern of precipitates at different temperatures
3 臭葱石沉砷渣形貌及组成
3.1 臭葱石沉砷渣形貌及物相分析
在Fe与As物质的量比为1.5,初始pH为1,反应温度为160 ℃,氧分压为0.6 MPa及反应时间为180 min的条件下,对臭葱石沉砷渣的物相及形貌进行分析与表征,结果如图14~16所示。
由图14可知:在XRD谱图中只检测臭葱石物相,说明在该条件下获得了较为纯净、成分单一的臭葱石沉砷渣。采用电子探针对沉砷渣进行检测,结果如图15所示。臭葱石具有良好的晶体结构,为正八面体结构,正八面晶体颗粒不仅单独存在或聚集长大为较大尺寸的颗粒。对单独存在的颗粒进行波谱分析主要元素为Fe和As。为明确在聚集的颗粒上的元素分布,进行SEM-EDS分析,在聚集的颗粒上进行点扫,结果见图16。由图16可知:该点元素主要为As,Fe及O。对聚集颗粒进行面扫,由聚集长大的颗粒为臭葱石,As和Fe主要均分布在臭葱石颗粒上,且分布紧密,由于聚集过程中造成亚稳态铁矾被吸附,导致含少量的S零散分布在颗粒上。
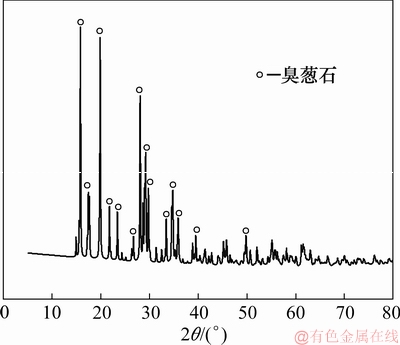
图14 沉砷渣XRD图谱
Fig. 14 XRD pattern of arsenic precipitates

图15 沉砷渣的EPMA图像及波谱
Fig. 15 EPMA images and spectrum of precipitates
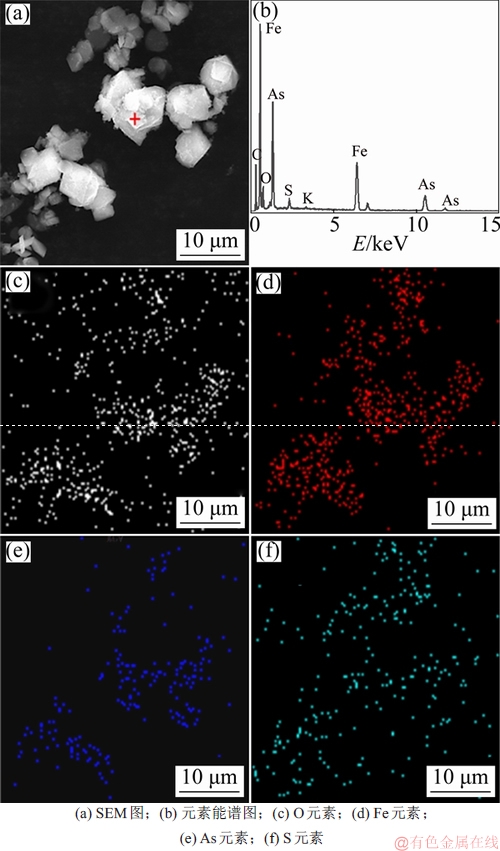
图16 沉砷渣的SEM-EDS图谱
Fig. 16 SEM-EDS of precipitates
3.2 粒度分析
在Fe与As物质的量比为1.5,初始pH为1,反应温度为160 ℃,氧分压为0.6 MPa条件下,对反应60~180 min所获得的沉砷渣进行比表面积及粒度分析,结果分别如图17和图18所示。
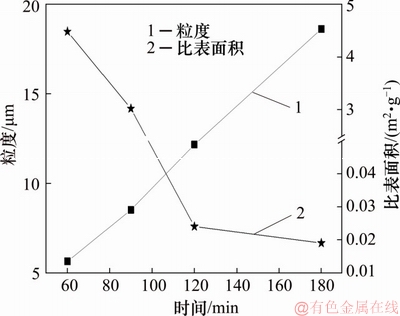
图17 沉砷渣粒度、比表面积与反应时间的关系
Fig. 17 Relationships of particle size, BET and reaction time
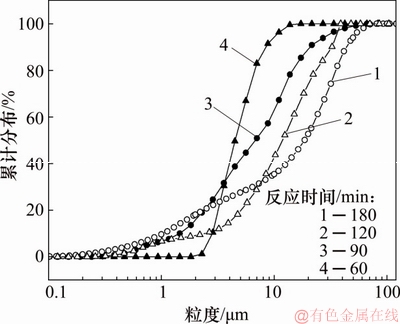
图18 反应60~80 min沉砷渣粒度分布
Fig. 18 Size distribution of precipitates reaction for 60-180 min
由图17可知:随着反应时间延长,渣中的比表面积由4.477 m2/g降低至0.019 m2/g。由图18可知:渣的粒度随着反应时间延长而增加,当反应时间60~180 min时,平均粒径D50由5.63 μm增加至18.6 μm。说明此实验条件下,随着时间延长渣中的臭葱石晶体在彼此吸附聚集长大[17],形成了粒度较大、比表面积小、稳定性强的臭葱石沉砷渣。而反应时间越短,渣粒度越小,比表面积越大,不利于获得稳定的臭葱石物相。
4 结论
1) 控制初始Fe与As物质的量比、初始pH、氧分压、反应时间以及反应温度不仅有利于提高溶液中的As与Fe的沉淀率,更有利于促使溶液中得Fe向形成臭葱石物相转化,降低渣中的S含量,以获得更高品质的臭葱石沉砷渣。
2) 在初始Fe与As物质的量比为1.5,初始pH 为1,氧分压为0.6 MPa以及反应温度为160 ℃的条件下,沉砷率和沉铁率分别为98.28%与87.89%,在沉砷渣中As,Fe和S的质量分数分别为22.04%,25.58%及3.54%,渣粒度为18.6 μm,比表面积为0.019 m2/g,沉砷渣中以稳定物相臭葱石为主。
3) 沉砷渣中以臭葱石稳定物相和铁矾等亚稳态2种形式存在,延长反应时间,渣中SO42-震动吸收峰减弱,可促进亚稳态物相转化,同时也可促使臭葱石晶粒长大,降低比表面积,提高沉砷渣的稳定性。
参考文献:
[1] 张旭, 刘志宏, 李玉虎, 等. 苛性碱溶液氧压浸出高砷锑烟尘[J]. 中南大学学报(自然科学版), 2014, 45(5): 1390-1396.
ZHANG Xu, LIU Zhihong, LI Yuhu, et al. Oxygen pressure leaching of arsenic and antimony bearing flue dust in NaOH solution[J]. Journal of Central South University(Science and Technology), 2014, 45(5): 1390-1396.
[2] 吴健, 王敏, 张辉鹏, 等. 复垦工业场地土壤和周边河道沉积物重金属污染及潜在生态风险[J]. 环境科学, 2018, 39(12): 5620-5627.
WU Jian, WANG Min, ZHANG Huipeng, et al. Heavy metal pollution and potential ecological risk of soil from reclaimed industrial sites and surrounding river sediments[J]. Environmental Science, 2018, 39(12): 5620-5627.
[3] 张倩, 陈宗娟, 彭昌盛, 等. 大港工业区土壤重金属污染及生态风险评价[J]. 环境科学, 2015, 36(11): 4232-4240.
ZHANG Qian, CHEN Zongjuan, PENG Changsheng, et al. Heavy metals pollution in topsoil from dagang industry area and its ecological risk assessment[J]. Environmental Science, 2015, 36(11): 4232-4240.
[4] 徐志峰, 聂华平, 李强, 等. 高铜高砷烟灰加压浸出工艺[J]. 中国有色金属学报, 2008, 18(z1): 59-63.
XU Zhifeng, NIE Huaping, LI Qiang, et al. Pressure leaching technique of smelter dust with high-copper and high-arsenic[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(z1): 59-63.
[5] 易宇, 石靖, 田庆华, 等. 高砷烟尘碱浸渣制备焦锑酸钠的新工艺[J]. 中国有色金属学报, 2015, 25(1): 241-249.
YI Yu, SHI Jing, TIAN Qinghua, et al. Novel technology for preparation of sodium pyroantimonate from alkali leaching residue of high arsenic dust[J]. The Chinese Journal of Nonferrous Metals, 2015, 25(1): 241-249.
[6] 李阔, 徐瑞东, 何世伟, 等. 采用碱性加压氧化浸出从高铋铅阳极泥中脱除砷锑[J]. 中国有色金属学报, 2015, 25(5): 1394-1402.
LI Kuo, XU Ruidong, HE Shiwei, et al. Arsenic and antimony removal from bismuth-rich lead anode slime by alkaline pressure oxidation leaching[J]. The Chinese Journal of Nonferrous Metals, 2015, 25(5): 1394-1402.
[7] 方兆珩, 石伟, 韩宝玲, 等. 高砷溶液中和脱砷过程[J]. 化工冶金, 2000, 21(4): 359-362.
FANG Zhaoheng, SHI Wei, HAN Baoling, et al. Removal of arsenic from high arsenic solutions by scorodite precipitation[J]. Engineering Chemistry & Metallurgy, 2000, 21(4): 359-362.
[8] 郑雅杰, 张胜华, 龚昶. 含砷污酸资源化回收铜和砷的新工艺[J]. 中国有色金属学报, 2013, 23(10): 2985-2992.
ZHENG Yajie, ZHANG Shenghua, GONG Chang. Novel technique for recovery of copper and arsenic from arsenic-containing waste acid[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(10): 2985-2992.
[9] 许根福. 处理高砷浓度工业废水的化学沉淀法[J]. 湿法冶金, 2009, 28(1): 12-17.
XU Genfu. Chemical precipitation methods for treatment of high-arsenic concentration industrial effluents[J]. Hydrometallurgy of China, 2009, 28(1): 12-17.
[10] 柯平超, 刘志宏, 刘智勇, 等. 固砷矿物臭葱石组成与结构及其浸出稳定性研究现状[J]. 化工学报, 2016, 67(11): 4533-4540.
KE Pingchao, LIU Zhihong, LIU Zhiyong, et al. Research status on composition, structure, and leaching stability of an arsenic solidification mineral scorodite[J]. CIESC Journal, 2016, 67(11): 4533-4540.
[11] WANG Suiling, MULLIGAN C N. Occurrence of arsenic contamination in Canada: sources, behavior and distribution[J]. Science of the Total Environment, 2006, 366(2/3): 701-721.
[12] 刘志宏, 潘庆琳, 刘智勇, 等. As(Ⅲ)在酸性水溶液中与金属铁的反应行为[J]. 中国有色金属学报, 2015, 25(10): 2945-2952.
LIU Zhihong, PAN Qinglin, LIU Zhiyong, et al. Reactive behaviors between As(Ⅲ)and metallic iron in acidic aqueous solution[J]. The Chinese Journal of Nonferrous Metals, 2015, 25(10): 2945-2952.
[13] FUJITA T, TAGUCHI R, ABUMIYA M, et al. Novel atmospheric scorodite synthesis by oxidation of ferrous sulfate solution, Part I[J]. Hydrometallurgy, 2008, 90(2/3/4): 92-102.
[14] FUJITA T, TAGUCHI R, ABUMIYA M, et al. Effect of pH on atmospheric scorodite synthesis by oxidation of ferrous ions: physical properties and stability of the scorodite[J]. Hydrometallurgy, 2009, 96(3): 189-198.
[15] YUAN Zidan, ZHANG Danni, WANG Shaofeng, et al. Effect of hydroquinone-induced iron reduction on the stability of scorodite and arsenic mobilization[J]. Hydrometallurgy, 2016, 164: 228-237.
[16] MIN Xiaobo, LIAO Yingping, CHAI Liyuan, et al. Removal and stabilization of arsenic from anode slime by forming crystal scorodite[J]. Transactions of Nonferrous Metals Society of China, 2015, 25(4): 1298-1306.
[17] MAMBOTE R C M, KRIJGSMAN P, REUTER M A. Hydrothermal precipitation of arsenic compounds in the ferric-arsenic (III)-sulfate system: thermodynamic modeling[J]. Minerals Engineering, 2003, 16(5): 429-440.
[18] GOMEZ M A, BECZE L, CUTLER J N, et al. Hydrothermal reaction chemistry and characterization of ferric arsenate phases precipitated from Fe2(SO4)3-As2O5-H2SO4 solutions[J]. Hydrometallurgy, 2011, 107(3/4): 74-90.
[19] 余自秀, 李存兄, 魏昶, 等. 含砷铁溶液水热臭葱石沉砷研究[J]. 昆明理工大学学报(自然科学版), 2017, 42(1): 1-8.
YU Zixiu, LI Cunxiong, WEI Chang, et al. Hydrothermal precipitation of arsenic in solution containing arsenic and iron based on scorodite formation[J]. Journal of Kunming University of Science and Technology(Natural Science Edition), 2017, 42(1): 1-8.
[20] KITAMURA Y, OKAWA H, KATO T, et al. Size and morphology of scorodite particles synthesized using ultrasound irradiation[J]. Japanese Journal of Applied Physics, 2014, 53(S7): 467-468.
[21] SWASH P M, MONHEMIUS A J. Hydrothermal precipitation from aqueous solutions containing iron(III), arsenate and sulphate[M]. Dordrecht: Springer Netherlands, 1994: 177-190.
[22] 李存兄, 魏昶, 邓志敢, 等. FeSO4-H2O体系中水热赤铁矿沉铁及亚稳态铁物相转变行为[J]. 中国有色金属学报, 2018, 28(3): 628-636.
LI Cunxiong, WEI Chang, DENG Zhigan, et al. Hydrothermal hematite precipitation and conversion behavior of metastable iron phase in FeSO4-H2O system[J]. The Chinese Journal of Nonferrous Metals, 2018, 28(3): 628-636.
[23] 王益昭, 李存兄, 魏昶, 等. 湿法炼锌过程中赤铁矿生成及硫的吸附转化[J]. 中国有色金属学报, 2017, 27(10): 2145-2153.
WANG Yizhao, LI Cunxiong, WEI Chang, et al. Production of hematite and conversion of adsorption S in zinc hydrometallurgy process[J]. The Chinese Journal of Nonferrous Metals, 2017, 27(10): 2145-2153.
[24] 陈永明, 唐谟堂, 杨声海, 等. NaOH分解含铟铁矾渣新工艺[J]. 中国有色金属学报, 2009, 19(7): 1322-1331.
CHEN Yongming, TANG Motang, YANG Shenghai, et al. Novel technique of decomposition of ammonium jarosite bearing indium in NaOH medium[J]. The Chinese Journal of Nonferrous Metals, 2009, 19(7): 1322-1331.
[25] 余自秀. 含砷铁溶液水热臭葱石沉砷研究[D].昆明:昆明理工大学冶金与能源工程学院, 2017: 30-90.
YU Zixiu. Hydrothermal precipitation of arsenic in solution containing arsenic and iron based on Scorodite formation[D]. Kunming: School of Metallurgical and Energy Engineering. Kunming University of Science and Technology, 2017: 30-90.
(编辑 赵俊)
收稿日期: 2019 -01 -16; 修回日期: 2019 -03 -06
基金项目(Foundation item):国家自然科学基金资助项目(51664038,51474117,51364022)(Projects(51664038, 51474117, 51364022) supported by the National Natural Science Foundation of China)
通信作者:李存兄,博士,教授,从事湿法冶金研究;E-mail:licunxiong@126.com