网络首发时间: 2015-04-07 09:27
稀有金属 2015,39(09),847-853 DOI:10.13373/j.cnki.cjrm.2015.09.013
旋流电解提取铜冶炼污泥模拟浸出液中有价金属研究
纪仲光 王巍 徐政 杨丽梅
北京有色金属研究总院生物冶金国家工程实验室
摘 要:
配制模拟铜冶炼污泥的硫酸浸出液作为电解原液,考察了旋流电解技术分离提取溶液中Cu,Zn,Ni 3种有价金属的效果。结果表明,旋流电解可以实现3种有价金属的分步电解分离,实验中直接获得了电解铜和电解锌产品。对于Cu,Zn,Ni混合溶液的旋流电解过程,Cu优先在阴极电解,电解铜产品以铜粉为主,另含有少量的铜片;电流密度越大,Cu的沉积速度越快,在电流密度为0.04 A·cm-2时,30 min内Cu的回收率达到54.4%;由于Cu的电阻率较低,因此其在阴极上的沉积可以提高系统的导电性,从而使槽电压下降,降低能耗。对于Zn,Ni混合溶液的旋流电解过程,Zn优先于Ni电解,在阴极得到形貌较好的Zn板;槽电压随运行时间下降较电解铜时更加缓慢,30 min内仅下降9.1%;电解产品上部有Ni沉积,且表面由于氢的析出产生类似月球表面环形山的椭圆坑;旋流电解槽内部的旋流流态加之镍的特殊超电势使得Zn优先于Ni电解。
关键词:
铜冶炼污泥;模拟浸出液;旋流电解;超电势;
中图分类号: X758
作者简介:纪仲光(1983-),男,河北遵化人,博士,研究方向:膜技术、电化学技术等在废水处理及湿法冶金中的应用;E-mail:ichandihr@sina.com;;徐政,教授级高级工程师;电话:010-82241783;E-mail:xzh63@126.com;
收稿日期:2014-07-01
基金:国家国际科技合作专项项目(2014DFA90920);北京有色金属研究总院科技创新基金项目(53315,53313)资助;
Extracting of Valuable Metal in Simulated Leaching Solution of Sludge from Copper Smelting Process with Cyclone Electrowinning
Ji Zhongguang Wang Wei Xu Zheng Yang Limei
National Engineering Laboratory of Biohydrometallurgy,General Research Institute for Nonferrous Metals
Abstract:
Simulated sulfate leaching solution of sludge from copper smelting process was prepared as electrolyte to investigate the performance of cyclone electrowinning in the separation and extraction of Cu,Zn and Ni from solution. The results showed that three valuable metals could be extracted step by step with cyclone electrowinning. Electrolytic copper and electrolytic zinc were produced.For the process of cyclone electrowinning of mixed solution containing Cu,Zn and Ni,Cu was the first to precipitate in negative electrode. The electrolytic copper products basically consisted of copper powder,as well as a little copper plate. The electrodeposition rate of Cu increased with current density. The recovery rate of 54. 4% for Cu was achieved in 30 min at current density of 0. 04 A·cm- 2.With the depositing of Cu on surface of negative electrode,the conductivity of the system was improved because of the low resistivity of Cu. So,the energy could be saved due to the decrease of cell voltage. For the process of cyclone electrowinning of mixed solution containing Zn and Ni,Zn electrodeposition was prior to Ni. Excellent morphology of Zn plate was obtained in negative electrode. The cell voltage decreased by 9. 1% in 30 min. The decrease amplitude was less than that in the process of Cu electrodeposition. A little Ni deposited in the upper half region of the electrolytic zinc product. Owing to the reduction of hydrogen,elliptical hole,which was similar to the crater on the surface of moon,appeared on the surface of electrolytic product. The flow pattern of solution in the electrolytic cell and special overpotential of Ni were considered to be related with the preferential electrodeposition of Zn.
Keyword:
copper smelting sludge; simulated leaching solution; cyclone electrowinning; overpotential;
Received: 2014-07-01
我国是铜生产大国,2013年我国精炼铜产量为685万吨。铜生产以火法冶炼为主,而铜的火法冶炼过程中会产生大量的含重金属的废水,企业一般采用絮凝 + 化学沉淀的方法处理重金属废水, 从而将废水中的重金属转移到污泥中[1]。这就导致产生大量含有Cu,Zn,Ni,Cd,As,Cr等重金属的污泥,此类污泥则属于危险固体废弃物[2]。为避免污泥中有价资源的浪费,彻底消除污泥对环境的潜在危害,需要回收污泥中的重金属。目前从冶炼废水污泥中提取有价金属的方法主要是浸出法, 铜冶炼废水污泥中Cu,Zn,Ni等有价金属主要以氢氧化物或氧化物形态存在,对此,硫酸是最常用的浸取剂。研究表明,通过控制浸出工艺条件,可以实现对Cu,Zn,Ni有价金属的选择性浸出[3,4]。
选择性浸出后获得的溶液也要面临进一步分离提取的问题,由于常见冶炼污泥中铜锌镍等金属的品位一般较低,因此,所获得的浸出液中各有价金属浓度较低,且很多情况下由于污泥的复杂性,即便经过选择性浸出,各有价金属之间的浓度差仍然较小,无法直接进入常规电解。一般采用萃取技术对 溶液中的 金属进行 分离、提纯和富 集[5,6],获得浓度较高的单金属电解液,然后进入电解过程获得金属电解产品。此外,还有一种称为旋流电解的新型电解技术,通过高速液流消除浓差极化等对电解不利的因素,能够在低浓度、且目标金属和非目标金属浓度差较小的多金属溶液体系中实现对目标金属进行选择性电解,该技术最早出现在美国专利[7]中,属于一种强化电解技术[8,9]。若采用旋流电解技术处理铜冶炼污泥的浸出液并直接获得金属单质电解产品,可以省略萃取工序,从而大幅降低有价金属回收成本。旋流电解对浓差极化的消除作用使得其能获得极高的金属回收效率,如采用旋流电解技术从含钯[10]以及含铑[11]金属的酸性氯化物溶液中回收钯和铑,回收效率超过了99% 。如果杂质离子的析出电位与目标金属差距较大,旋流电解受杂质离子的影响较小,产品纯度高[12]。
由于旋流电解具备优良的选择性,可被视为是一种精度电解技术,可实现多金属复杂体系溶液中各金属的分步电解。目前已有一些文献对旋流电解分离提取多金属混合液中的有价金属进行了研究[9,13]。本研究通过配制模拟含Cu,Zn,Ni 3种有价金属的铜冶炼废水污泥浸出液,考察旋流电解技术对模拟溶液中有价金属的电解分离效果。
1实验
1 . 1材料模拟浸出 液为含有Cu2 +, Zn2 +,Ni2 +3种有价金属离子的硫酸盐溶液 ,由Cu SO4·5H2O,Ni SO4·6H2O,Zn SO4·7H2O( 均为分析纯) 和去离子水配制而成。根据铜冶炼污泥的实际浸出结果,拟定模拟浸出液中各金属离子的浓度如表1所示。
1. 2旋流电解装置及工作原理旋流电解实验装置如图1所示,工艺流程如下: 料液瓶中模拟浸出液经循环水泵驱动进入电解槽底部,然后沿槽内壁螺旋流至电解槽顶部,电解原液中特定金属离子在电解槽内壁阴极上析出,电解剩余液回流至料液瓶。电解阳极为表面镀铱的钛棒,阴极为钛片。旋流电解装置的核心部分为电解槽,电解原液从电解槽底部切向流入,并在槽内壁形成螺旋上升流。电解槽内部工作原理如图2所示。电解原液在螺旋上升过程中,金属阳离子向阴极运动,并在阴极处得电子沉积析出; 高速螺旋流则在很大程度上削弱了浓差极化的负面影响,间接增加了各金属理论电位差对析出顺序的决定程度,因此旋流电解相比传统电解具有更强的选择性,且对金属浓度范围有更宽的普适性。
表1 模拟浸出液中各金属浓度 Table 1 Concentration of metals in simulated leaching solution 下载原图

表1 模拟浸出液中各金属浓度 Table 1 Concentration of metals in simulated leaching solution
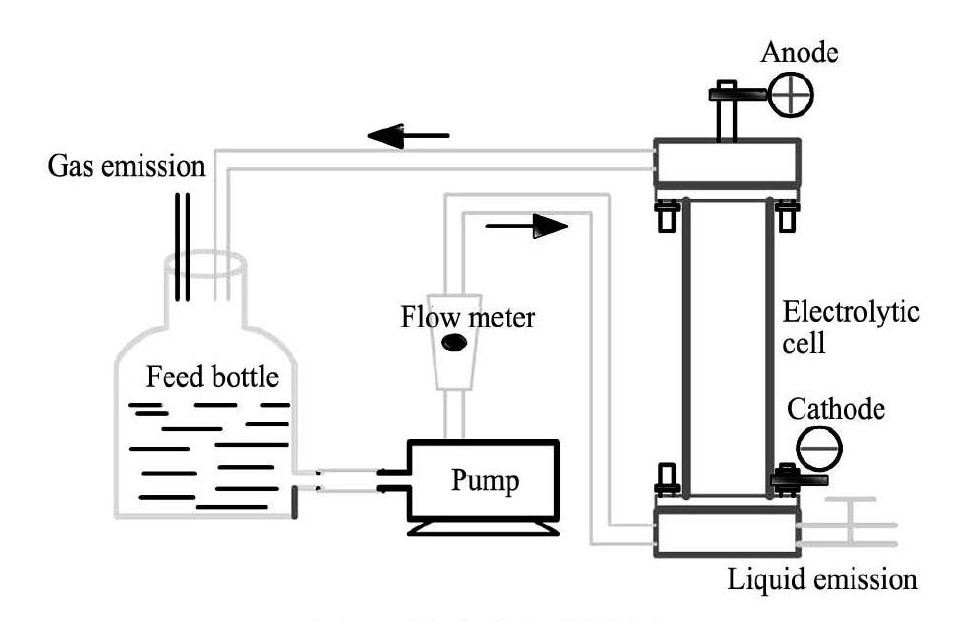
图1 旋流电解装置图 Fig.1 Schematic diagram of cyclone electrowinning setup
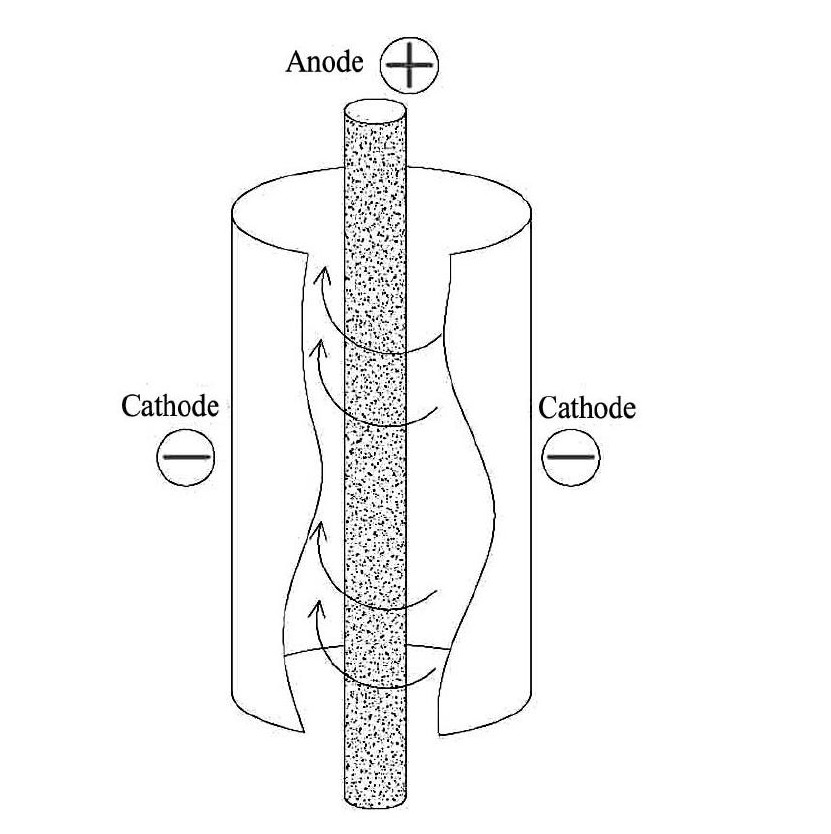
图2 旋流电解工作原理图 Fig.2 Working principle of cyclone electrowinning
1. 3实验方法配制含Cu2 +,Zn2 +,Ni2 +3种有价金属离子的硫酸盐溶液作为模拟浸出液( 电解原液) ,电解原液中各金属离子的浓度如表1所示。理论上Cu优先析出,因此首先考察电流密度、 操作时间等对电解铜产品的影响; 然后考察Zn和Ni两种金属 的电解析 出情况,并采用能 谱仪 ( SEM-EDS) 对电解产品进行观察分析。
2结果与讨论
2. 1 Cu,Zn,Ni混合溶液旋流电解本研究中的研究对象为Cu,Zn,Ni 3种金属离子的溶液,基于常规电解理论,3种金属的析出电位分别为0. 3402, - 0. 7632, - 0. 2300 V,根据电位越正越容易析出的常规电解理论,一般情况下Cu首先在阴极析出。首先考察Cu,Zn,Ni 3种金属共同存在的情况下的旋流电解效果,配制含Cu,Zn,Ni分别为5,12,1 g·L- 1的溶液3 L,溶液的p H值为5. 16。理论上溶液中共计含Cu,Zn,Ni分别为15, 36和3 g。
首先考察不同电流密度下旋流电解的效果, 确定操作条件: 溶液循环流速为600 L·h- 1,电解时间为30 min。分别固定电流密度为0. 02,0. 03, 0. 04 A·cm- 2,对应工作电流分别为8,12,16 A, 监测槽电压在旋流电解过程中的变化,测定电解结束后电解液中各金属离子的含量,并观察电解产品的形态。每次电解过程的前5 min,控制循环流速为350 L·h- 1,5 min后增加至600 L·h- 1,目的在于避免阴极上沉积的初期金属单质被料液高流速冲刷掉。在固定电流密度的情况下,考察槽电压随时间的变化情况,如图3所示,所获得的电解产品如图4所示。
图3所示的曲线表明,电解开始时3个电流密度下的起始槽电压均较高,随着溶液循环流速从0 min的350 L·h- 1上升到5 min的600 L·h- 1,槽电压迅速下降。电解5 min后,溶液循环流速稳定在600 L·h- 1,下面主要讨论电解过程运行5 min后的情况。对于电流密度为0. 02和0. 03 A·cm- 2两个电解过程,槽电压从第5 min到电解结束时下降幅度较缓,分别从3. 3和4. 0 V下降到2. 9和3. 4 V, 各自下降了12. 1% 和15. 0% ; 而在电流密度为0. 04 A·cm- 2的情况下,槽电压下降幅度较大,从第5 min的4. 8 V下降到最后的2. 9 V,下降幅度达到了40% 左右。
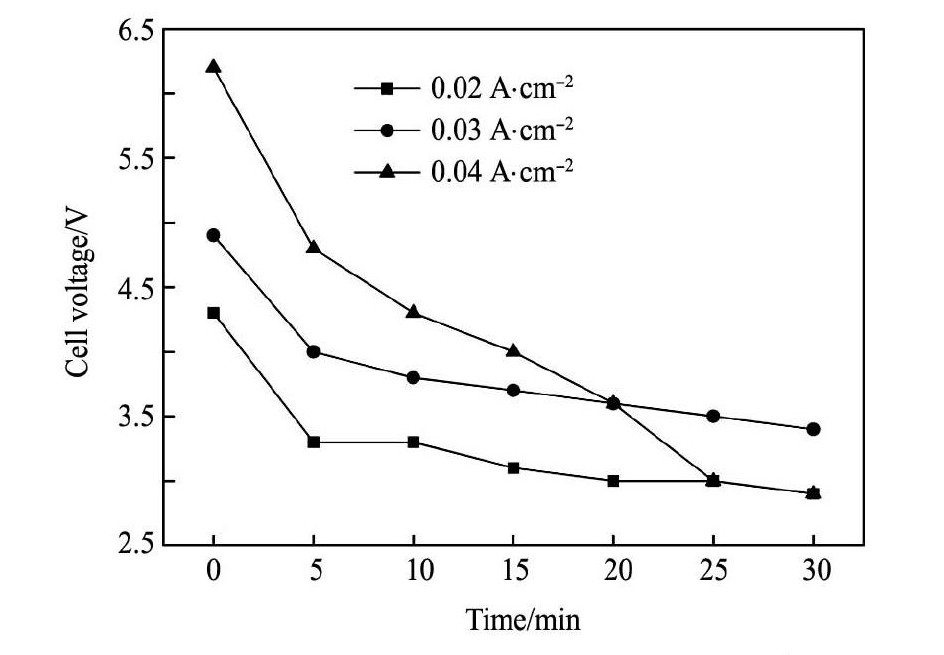
图3 不同电流密度下槽电压随时间的变化情况 ( Cu,Zn, Ni 溶液) Fig.3 Change of cell voltages with operation time under different current densities ( Cu,Zn,Ni solution)

图4 不同电流密度的电解产品实图 Fig.4 Images of electrolysis products at different current densities
( a) 0. 02 A·cm- 2; ( b) 0. 03 A·cm- 2; ( c) 0. 04 A·cm- 2
在固定电流密度的情况下,槽电压值直接反映了电解系统的导电性,槽电压下降,表明导电性增强,电阻率下降。电解过程中,电解系统主要发生两个变化: 一是电解液金属离子浓度不断降低, 二是阴极不断附着电解金属产品。如果电解液游离态金属离子的总浓度较高,且电解过程中金属浓度下降幅度较小,那么电阻率将主要由阴极附着的电解金属产品决定。本研究中,溶液金属总浓度较高,则系统的电阻率主要取决于阴极表面附着的金属产品。电解产品如图4所示,从表观来看,阴极表面沉积的主要是电解铜,产品主要以铜粉为主,另有少量的铜片。通过测试电解液中各金属浓度的变化情况来进一步分析。
表2所示为电解原液及电解后液中各金属离子浓度的测试结果。结果表明,各电流密度下,电解后液中Ni和Zn的浓度均基本维持稳定不变的态势,且与原液浓度相近,只有Cu的浓度相比原液明显减小。研究中还称量了实际电解产品的质量,并与电解前后电解液中Cu的减量进行比较 ( 表3) ,并结合图4中电解产品的形貌图,可确定阴极表面主要为Cu。分析表2还可以发现,随着电流密度增加,电解后液中Cu的浓度不断降低, 即电流密度越大,Cu的电沉积越快。观察图4中电流密度为0. 04 A·cm- 2时所获得的电解产品还可以发现,在电解铜粉产品表面,还附着了少量的其他金属产品,而在电流密度较低的电解产品中未发现此现象,这说明要获得纯度较高的电解产品, 适当控制电流密度是必要的。
表2 电解后液中各金属浓度 Table 2 Concentration of metals in solution after electrolysis 下载原图
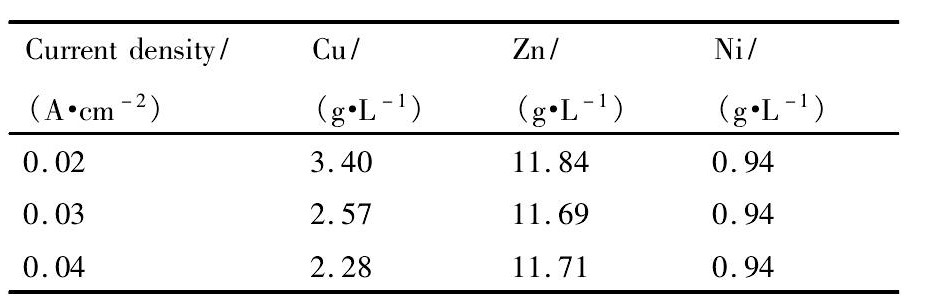
表2 电解后液中各金属浓度 Table 2 Concentration of metals in solution after electrolysis
表3 不同电流密度下获得电解产品质量和溶液铜减量 Table 3Mass of electrolysis products and copper decrement in solution under different current densities 下载原图
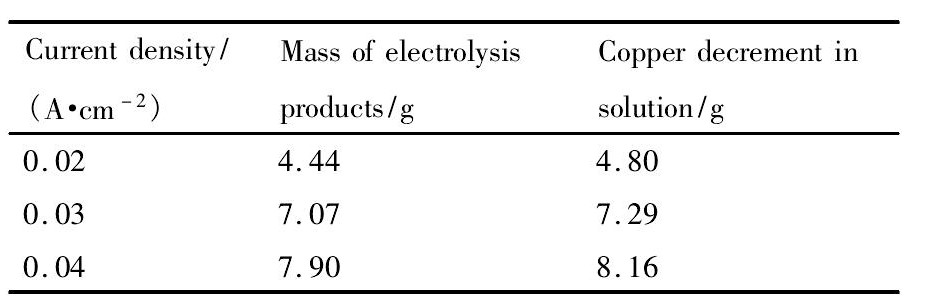
表3 不同电流密度下获得电解产品质量和溶液铜减量 Table 3Mass of electrolysis products and copper decrement in solution under different current densities
Cu,Zn,Ni,Ti 4种金属的电阻率如表4所示, 可以看到铜的电阻率仅为钛的1 /25左右,所以如果钛阴极表面附着了铜,将会降低材料的电阻率, 增强系统的导电性,这也解释了图3中槽电压随运行时间的增加不断下降的现象。同时,槽电压的变化趋势也直接体现了Cu在钛阴极表面电积的速度,电流密度为0. 04 A·cm- 2时,Cu电积的速度最快,电解后液中Cu的浓度最低,Cu的回收率为54. 4% 。
2. 2 Zn,Ni混合溶液旋流电解上述研究得到了比较理想的结果,即Cu,Zn,Ni混合溶液进行旋流电解时,Cu首先被电解出来,而Zn,Ni在一定的条件下基本保持不变。本节则在此基础上进一步考察只含有Zn,Ni的混合溶液进行旋流电解时的情况,配制含Zn,Ni分别为24和2 g·L- 1的溶液3 L作为电解原液( 模拟溶液继续浓缩1倍的情况) ,溶液p H为6. 16。
基于常规电解理论,Zn,Ni两种金属的析出电位分别为 - 0. 7632, - 0. 2300 V,二者电位为负,因此理论上氢会比两种金属优先析出。但是氢在金属阴极上具有超电势,而多数金属超电势较小,因此一些比氢活泼的金属也可以在阴极析出。 这就为Zn,Ni两种金属的电解提取提供了理论依据。通过如公式( 1) 所示的塔非尔公式可以计算出氢的超电势,

式中,a值反映了相同电流密度下氢在不同金属电极上超电势的相对大小,因此a值的大小取决于电极材料; 而b值对大多数金属电极来说是一通用常数,其值约为0. 12 V,b的大小反映了电流密度的变化对氢超电势的影响; i为电流密度,单位为A·cm- 2。对钛阴极,a,b值分别为0. 82和0. 14( H在部分金属表面析出时塔非尔公式常数a和b值如表5所示) ,因此在电流密度为0. 03 A·cm- 2的条件下,经过计算氢的超电势为 - 0. 6068 V( 阴极超电势用负值,所以加负号) 。此外氢的理论平衡电势为0,但实际反应电极电势( ΦH+/ H) 与p H值有关,如公式( 2) 所示,
表4 部分金属的电阻率 Table 4 Resistivity of several metals( 20 ℃) 下载原图

表4 部分金属的电阻率 Table 4 Resistivity of several metals( 20 ℃)
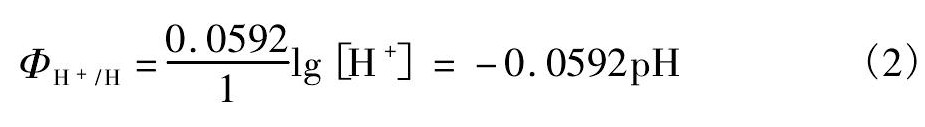
由于本研究中混合溶液的p H值为6. 16,则氢的实际平衡电势经公式( 2) 计算为 - 0. 3634 V,再加上氢在钛阴极上的超电势,氢的实际析出电势为 - 0. 9702 V。而Zn,Ni两种金属的理论析出电位分别为 - 0. 7632和 - 0. 2300 V,因此两者均可以优先于氢电解析出,而且Ni的电位相对Zn更正,因此一般情况下Ni优先于Zn析出。本研究在电流密度为0. 03 A·cm- 2的条件下运行旋流电解过程60 min,考察槽电压随运行时间的变化情况,如图5所示; 并观察电解产品的形貌以及进行表面元素分析,如图6和7所示。
图5所示的结果表明,Zn,Ni混合溶液旋流电解过程中,槽电压随时间增加缓慢下降,且变化趋势相比Cu,Zn,Ni溶液的旋流电解过程更加平缓, 电解0 min时,槽电压为4. 4 V; 电解30 min时, 槽电压下降至4 V( 下降9. 1% ) ; 而到电解60 min结束时,也仅降至3. 8 V( 下降13. 6% ) 。这表明阴极附着的电解产品增强导电性的贡献小于电解铜产品。对电解原液和剩余液中Zn,Ni的含量进行比较分析( 如表6所示) ,并结合电解产品的质量和形貌( 如图6所示) 分析电解产品的性质。
表5 氢在部分金属表面析出时塔非尔公式常数 a 和 b 值 ( 酸性溶液,温度为 20 ℃) Table 5 a and b values in Tafel's equation for H electrolysis on surface of several metals 下载原图
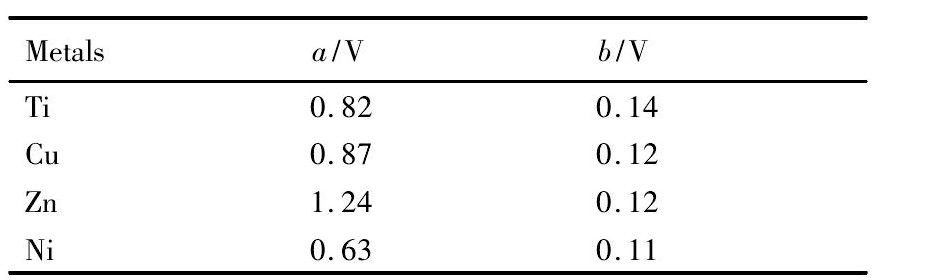
表5 氢在部分金属表面析出时塔非尔公式常数 a 和 b 值 ( 酸性溶液,温度为 20 ℃) Table 5 a and b values in Tafel's equation for H electrolysis on surface of several metals
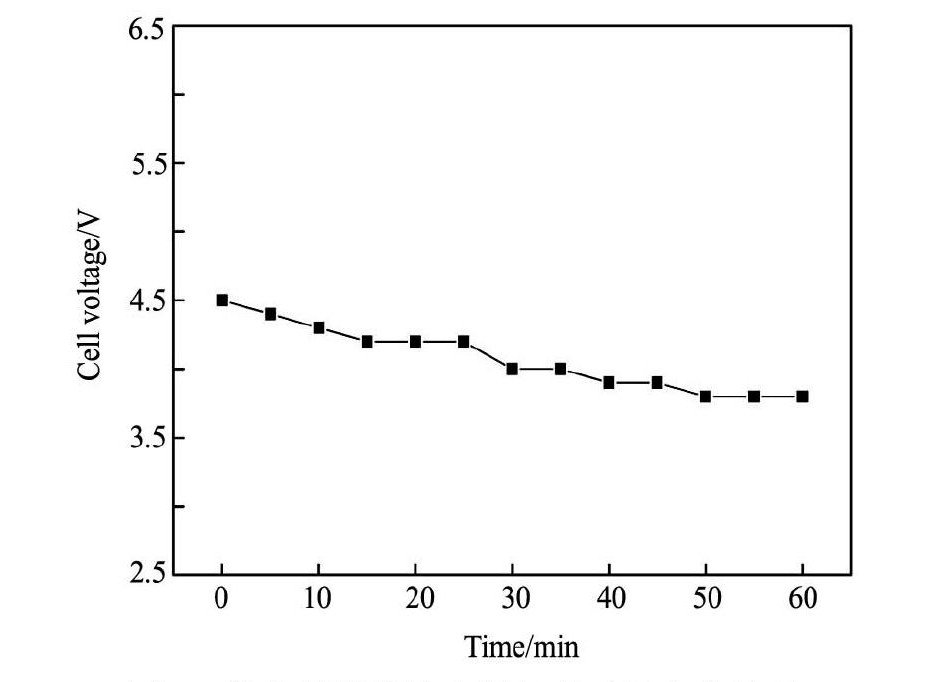
图5 槽电压随旋流电解运行时间变化情况 Fig.5 Change of cell voltages with operation time under different current densities ( Zn,Ni solution)
如表6所示,电解实际产品质量为11. 48 g, 而电解原液中Zn的减量为12. 39 g,两者比较接近,而Ni的减量仅为0. 48 g,初步确定电解形成的产品主要为Zn。而根据表4的数据,Zn的电阻率为5. 196,是Cu的3倍左右,因此对增强导电性的贡献小于Cu,这也解释了图5中槽电压随运行时间下降相比图3较缓的现象。如图6所示,电解产品呈现明显的黑色和灰色分界线,分别对灰色部分( A区域) 和黑色部分( B区域) 进行SEM-EDS分析,结果如图7所示。
结果表明,A,B两个区域的相同之处在于: O元素的含量都达到了8% 左右,另外还有S元素, 说明电解产品表面沉积了少量的硫酸盐晶体或氧化物; 不同之处在于: 区域A表面较为光滑,Zn的含量达到了90% 以上,且没有杂质金属,而B区别表面较为粗糙,Zn的含量略低,为80% 左右, 且含有少量的Ni和Cu杂质,Ni杂质源于电解原液,Cu杂质源于管道残留。观察区域B,还发现表面有类似月球表面环形山式的椭圆坑,这是因为随着电解过程的进行,溶液的p H值下降,这使得氢的超电势不断下降,直至出现氢的析出[14],从而容易导致出现如图7( b) 所示的椭圆坑。而由于H在Ni表面的超电势要明显小于Zn( 如表5所示) , 因此区域B出现椭圆坑,而A区域没有出现。至于Ni沉积主要出现在区域B,这可能与电解槽内部不同区域p H值的差别有关,需要进一步实验考察电解槽内部槽电压均匀性及混合溶液旋流流态。前面提到,一般情况下Ni优先于Zn在阴极析出,但实验结果表明Zn优先于Ni析出,虽然在区域B也出现了Ni的沉积,但对区域B表面进行适当打磨,可发现内层仍为Zn,进一步证实Zn优先于Ni析出。 前面提到多数金属的超电势较小,但实际上第八族的Fe,Co,Ni 3种金属电解时也具有较大的极化超电势[15],这使得在一定条件下Zn优先于Ni析出成为可能。通过进一步精密控制电流密度,操作时间等工艺条件,可获得纯度更高的电解锌产品。
表6 电解原液和后液中 Zn,Ni 含量比较 Table 6 Content of Zn and Ni in solution before and after electrolysis ( g) 下载原图
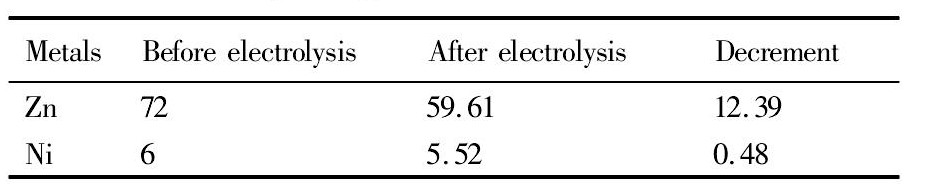
表6 电解原液和后液中 Zn,Ni 含量比较 Table 6 Content of Zn and Ni in solution before and after electrolysis ( g)

图6 Zn,Ni 混合溶液旋流电解的电解产品实图 Fig.6 Product image of cyclone electrowinning in solution containing Zn and Ni
( a) Area B; ( b) Area A

图7 电解产品的 SEM-EDS 分析 Fig.7 SEM-EDS analysis of electrolysis product
( a) Area A; ( b) Area B
3结论
1. 对于配制的模拟溶液,旋流电解可以实现分步电解,从而实现混合金属的分离并直接获得单质产品的目标,首先电解出铜产品,然后电解出锌产品,最后得到Ni的溶液,选择合适的阴极,预期也可以实现Ni的电解。
2. Cu,Zn,Ni混合溶液的旋流电解研究表明, Cu可以优先在阴极电解,电解铜产品以铜粉为主, 另含有少量的铜片,电流密度越大,电解产品产量越大; 由于Cu的电阻率较低,因此其在阴极上的沉积可以提高系统的导电性,从而使槽电压下降, 降低能耗。
3. Zn,Ni混合溶液旋流电解研究表明,Zn优先于Ni电解,在阴极得到形貌较好的Zn板,但含有少量的硫酸盐晶体和氧化物,还含有少量金属Ni和Cu; 在旋流电解运行60 min的情况下,槽电压从开始时的4. 4 V下降到3. 8 V,相比电解Cu时下降幅度较小; 旋流电解槽内部的旋流流态与金属的电沉积过程有关,加之镍的特殊超电势使得Zn优先于Ni电解,此方面需要进一步的研究。