DOI: 10.11817/j.ysxb.1004.0609.2020-36487
二苯硫腙萃取分离磷酸钠溶液中微量锌离子
欧小菊,何 倩,李正科,王威燕,刘文英,杨运泉
(湘潭大学 化工学院,湘潭 411105)
摘 要:采用理论分析与实验验证相结合的方法,研究了二苯硫腙萃取分离磷酸钠溶液中锌离子的萃取行为,考察了二苯硫腙在甲苯、苯、三氯甲烷及四氯化碳中的溶解度。在此基础上,研究以苯及三氯甲烷为溶剂的二苯硫腙萃取体系对磷酸钠溶液中微量锌的萃取平衡关系,探讨体系pH值、搅拌速度、萃取剂用量、温度及相比等因素对萃取效果的影响。结果表明:二苯硫腙在三氯甲烷中的溶解度最大,25 ℃时达17.55 g/L;在萃取体系pH为7.25、搅拌转速为550 r/min、温度为25 ℃、相比(A/O)为1:1时,浓度为1.2 g/L的二苯硫腙-三氯甲烷有机相对磷酸钠溶液中微量锌的单级萃取率可达92.57%;萃取时,二苯硫腙与溶液中的锌离子以近似2:1的摩尔比进行螯合;该螯合反应为吸热反应,反应焓变值为26.02 kJ/mol。
关键词:二苯硫腙;萃取;锌离子;磷酸钠溶液;反应焓变
文章编号:1004-0609(2020)-10-2435-09 中图分类号:TQ115 文献标志码:A
钢铁制品表面磷化处理过程中会产生大量的酸性固废磷化渣。磷化渣中主要成分为磷酸铁,但还存在其它有害杂质成分,如磷酸锌,磷酸钙等,属于国家危险废物,不能随意排放,必须对其进行处理。而磷酸铁是目前制备电池磷酸铁锂的主要基础原料[1-2],工业上主要用高纯度磷酸或磷酸盐为磷源来生产[3-4]。因此,若能利用钢铁磷化渣固废来制备电池级磷酸铁,既能有效地处理危险固废,又能对磷化渣中的磷资源进行高附加值回收利用,这是实现钢铁磷化渣固废无害化处理和资源化利用的新途径。但是,由于磷化渣中含有较多的钾、钠、钙、镁、锌等杂质金属化合物,因此,无法直接利用其作为电池材料级磷酸铁。目前,工业上主要是通过将磷化渣与氢氧化钠液碱反应的方法,得到含微量锌离子的磷酸钠溶液,再经蒸发结晶得到工业级固体磷酸钠[5-6],该法所得的产物磷酸钠其附加值较低。若能对其进行深度除锌,便可将其用来制备高附加值的电池级磷酸铁。因此,对含微量锌的磷酸钠溶液进行深度除锌处理,是实现磷化渣高值化回收利用的重要途径[7-8]。
由于从磷化渣制备的磷酸钠溶液中,锌离子的含量在20~30 mg/L以内,属于微量级杂质,因此,无法采用常规的化学沉淀法对其进行脱除。而研究表明,萃取工艺能针对溶液中的微量金属离子进行有效的分离去除,同时不易对溶液中的其他有用组分含量产生不利影响,据此,本文作者采用萃取工艺对磷酸钠溶液中的微量锌离子进行分离脱除。目前,工业上所用的锌离子萃取剂主要有二(2-乙基己基)磷酸酯(P204)、乙基己基磷酸单-2-乙基己酯(P507)及磷酸三丁酯等[9-10],但这些萃取剂具有酸性,在萃取体系中易乳化[11],会使萃取相/萃余相中含有微小的水滴/油滴,既影响了萃取溶剂的循环使用,又会对萃取产品质量造成不利影响(如产生黏稠性块状物等)。二苯硫腙是一种可以测定多种金属离子含量的灵敏络合试剂,可与微量的金属离子络合显色,萃取时具有达到分配平衡的时间短、萃取容量大、能溶于多种有机溶剂、萃取过程不易产生乳化等优点,从而在测量微量金属离子浓度和分离金属离子等领域有广泛的应用[12-13]。目前,用溶剂萃取法对氨性溶液中锌离子的萃取分离已取得较大的进展[14-15],但对于磷酸盐体系中锌离子的萃取分离研究较少。
本文作者以含微量锌离子的磷酸钠溶液为萃取分离体系,测定了常温下二苯硫腙在几种不同溶剂中的溶解度,研究了二苯硫腙对磷酸钠溶液中微量锌的萃取效果及萃取过程相关因素对萃取平衡的影响规律,从而确定二苯硫腙与锌离子在萃取体系中的表观螯合比及其反应焓变。
1 实验
1.1 主要仪器和试剂
主要仪器:PHS-38W型pH计(理达公司)、 ZA3000原子吸收光谱仪(日立高新技术公司)、SXJQ-1型电动搅拌器(郑州长城工贸有限公司)、DF-101S恒温水浴锅(巩义市予华仪器厂)、79-1磁力搅拌器(常州市金坛大地仪器厂)、Nicolet 380傅里叶变换红外光谱仪(美国Thermo Nicolet公司)、Ascend400核磁共振波谱NMR(瑞士Bruker公司)。
主要试剂:十二水磷酸钠、苯,国药集团化学试剂;二苯硫腙,麦克林试剂有限公司;甲苯,湖南汇虹试剂有限公司;四氯化碳、三氯甲烷、磷酸,湖南汇虹试剂有限公司;六水合硝酸锌,西陇化工股份有限公司;以上试剂均为分析纯。
1.2 分析方法
水相pH测定:通过pH计对磷酸钠溶液进行测定。
水相锌离子浓度的测定:通过原子吸收光谱法测定水相中锌离子的浓度,即可得到水相中锌离子浓度。
有机相锌离子浓度的测定:根据水相萃取前后锌离子浓度的变化,通过差减法可计算出有机相中锌离子浓度。
红外光谱测定:取少量的有机相涂覆在溴化钾压片上,通过采用傅里叶变换红外光谱仪对其进行测定,得有机相的红外光谱图。
核磁共振氢谱测定:取一定量样品及氘代氯仿于核磁管中,超声10 min后进行核磁共振氢谱测定。
锌离子萃取率( )及分配比(D)的计算公式如下:
)及分配比(D)的计算公式如下:
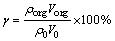 (1)
(1)
 (2)
(2)
式中: 为磷酸钠溶液中初始锌离子浓度,mg/L;
为磷酸钠溶液中初始锌离子浓度,mg/L; 为萃取平衡后有机相中的锌离子浓度,mg/L;V0为初始时磷酸钠溶液的体积,mL;Vorg为萃取平衡后有机相的体积,mL。
为萃取平衡后有机相中的锌离子浓度,mg/L;V0为初始时磷酸钠溶液的体积,mL;Vorg为萃取平衡后有机相的体积,mL。
1.3 实验方法
以十二水磷酸钠配制质量浓度在15 g/L之间的磷酸钠溶液,并在其中加入硝酸锌溶液,使溶液中锌离子浓度在20~25 mg/L之间,通过磷酸调pH,按一定的相比(A:O)取该含锌磷酸钠溶液(A)及有机相(O)于单口烧瓶中,在一定温度及搅拌转速下,搅拌10 min,静置6 min使其分层,得萃余相(R)及萃取相(E)(平行实验2次),取一定体积的萃余相经原子吸收光谱仪测定其中的锌离子浓度,同时测定萃取前原磷酸钠溶液中初始锌离子浓度,再结合物料平衡,计算出有机相萃取相(E)中锌离子的浓度,进而计算出锌离子的萃取率( )及其在两相中的分配比(D)。
)及其在两相中的分配比(D)。
2 结果与分析
2.1 二苯硫腙在不同溶剂中的溶解度
二苯硫腙常温下是不溶于水的粉末形态,无法直接用于萃取磷酸钠溶液中的锌离子,因此需要采用溶剂对其进行溶解,以增大其萃取时与水溶液的接触面积,有效地萃取溶液中的微量锌离子。由于二苯硫腙含有苯环结构,根据相似相溶性原理,推测其在苯及甲苯中也应有较好的溶解度,且由文献知:二苯硫腙能易溶于四氯化碳及三氯甲烷[16-17],但未能具体找出其在这四种溶剂中的溶解度数据,因此,需要对其溶解度数据进行实测,以方便后续研究中考察不同有机溶剂溶解的二苯硫腙对萃取分离锌离子的效果。二苯硫腙在不同有机溶剂中的溶解度测定方法如下:取一定量的二苯硫腙和溶剂于锥形瓶中,置于25 ℃的恒温摇床中摇晃3 h后取出过滤,90 ℃下烘干滤渣,得滤渣中二苯硫腙的净重,然后计算其在不同溶剂中的溶解度。实验结果如表1所示。
表1 二苯硫腙在不同溶剂中溶解度的测定
Table 1 Determination of solubility of dithizone in different solvents

由表1所知,二苯硫腙在三氯甲烷中的溶解度最大,其次是苯;25 ℃下,二苯硫腙在三氯甲烷中的溶解度为17.55 g/L。二苯硫腙在溶剂中的溶解度越大,越有利于增大其在有机相中的浓度,或在相同的萃取率下,能进一步减少溶剂的用量。
2.2 不同工艺条件对二苯硫腙萃取锌离子的影响
2.2.1 不同溶剂对二苯硫腙萃取锌离子的影响
在相比(A/O)为3:1、pH为7.25、搅拌速度为550 r/min、温度25 ℃、萃取剂质量浓度为0.6 g/L的条件下,分别以甲苯、苯和三氯甲烷为溶剂进行实验,实验结果如表2所示。由表2可知,溶剂对萃取过程有一定的影响,以苯与三氯甲烷为溶剂时,二苯硫腙对锌离子的萃取性能差别不大,都高于以甲苯为溶剂时的萃取性能,因此,选用三氯甲烷做溶剂。
表2 溶剂对萃取过程的影响
Table 2 Effect of solvent on extraction process

2.2.2 水相初始pH对二苯硫腙萃取锌离子的影响
据文献介绍二苯硫腙在不同的pH值下可以萃取不同的金属离子,pH在5~10下对锌离子有强萃取性[18]。可见,二苯硫腙萃取锌离子时,pH值是萃取过程中一个极为重要且敏感的控制因素,因此,必须考察水相初始pH对萃取过程的影响。本实验在水相锌离子浓度为22.8 mg/L,相比(A/O)为3:1,搅拌速度为550 r/min,温度为25 ℃,萃取剂质量浓度为0.6 g/L的条件下,在pH为6.5~8.5范围内,分别考察苯及三氯甲烷为溶剂时pH对二苯硫腙萃取锌离子效果的影响,实验结果如图1所示。从图1可知,无论有机相组成为二苯硫腙-苯还是二苯硫腙-三氯甲烷,随着pH的增大,有机相对锌的萃取率先增大后减少。在pH为7.25时,溶剂为苯与三氯甲烷都能达到最佳萃取率,分别为18.48%和19.57%。这是因为二苯硫腙属于螯合萃取剂,螯合金属离子时会释放出H+,螯合锌离子后有机相颜色由墨绿色变成红色[19-20]。因此,pH的增大有利于该反应的进行,从而增大了二苯硫腙对锌离子的萃取。pH为7.25时,无论溶剂为苯还是三氯甲烷,其萃取率都达到了最大。当pH大于7.25后,溶液呈碱性,二苯硫腙溶于碱性溶液,有机相萃取剂浓度减少,不利于萃取。另一方面,随着溶液pH的上升,OH-在溶液中变多,会减少游离Zn2+浓度,阻碍了二苯硫腙与Zn2+的螯合。因此,后续实验选用7.25为水相初始pH值,溶剂选用三氯甲烷。
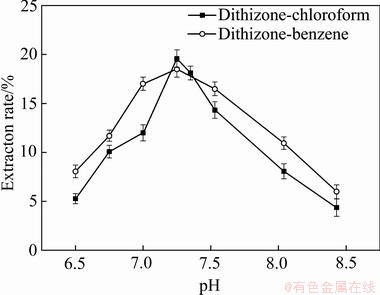
图1 水相初始pH对锌离子萃取率的影响
Fig. 1 Effect of initial pH of aqueous phase on zinc ion extraction rate

图2 萃取温度对锌离子萃取率的影响
Fig. 2 Effect of extraction temperature on zinc ion extraction rate
2.2.3 萃取温度对萃取过程的影响
在水相锌离子浓度为24.1 mg/L、相比(A/O)为3:1、pH为7.25、搅拌速度为550 r/min、萃取时间为10 min、萃取剂质量浓度为0.6 g/L的条件下,考察了萃取时的温度对萃取过程的影响,结果如图2所示。从图2中可知,萃取温度对该过程有较大的影响,锌离子萃取率随着温度的升高而增大,可见升温对二苯硫腙萃取锌离子是有利的,但温度升高会加剧溶剂的挥发性,增大溶剂的损失,不利于萃取过程。
根据van’t Hoff方程[21]:
 (3)
(3)
变换可得
 (4)
(4)
根据式(4)可知,分配比D的对数值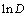 与萃取温度T的倒数1/T呈线性关系。以二苯硫腙-三氯甲烷为有机相,用萃取温度的倒数1/T对锌的分配比对数值
与萃取温度T的倒数1/T呈线性关系。以二苯硫腙-三氯甲烷为有机相,用萃取温度的倒数1/T对锌的分配比对数值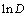 作图,拟合结果如图3所示。通过拟合方程可计算得ΔH=26.02 kJ/mol,说明该反应是吸热反应。根据焓变值可计算出该萃取过程的自由能为ΔG=3.73 kJ/mol,熵变为ΔS=74.80 J/(mol·K)。
作图,拟合结果如图3所示。通过拟合方程可计算得ΔH=26.02 kJ/mol,说明该反应是吸热反应。根据焓变值可计算出该萃取过程的自由能为ΔG=3.73 kJ/mol,熵变为ΔS=74.80 J/(mol·K)。

图3 萃取温度对锌分配比的影响
Fig. 3 Effect of extraction temperature on zinc partition ratio
2.2.4 搅拌速度对二苯硫腙萃取过程的影响
搅拌速度会影响有机相与水相的接触面积,进而影响萃取过程的效率。在水相锌离子浓度为22.3 mg/L、相比(A/O)为3:1、pH为7.25、温度为25 ℃、萃取时间为10 min、萃取剂质量浓度为0.6 g/L的条件下,实验考察了搅拌速度对萃取过程效率的影响,结果如图4所示。从图4中可以看出,当搅拌速度为250~550 r/min时,增加搅拌速度,锌的萃取率从 8.94%上升到20.82% ,萃取率有显著提高;当搅拌速度从550 r/min增加到750 r/min时,增加搅拌速度,锌的萃取率从20.82%上升到21.79%,缓慢上升。这是因为在萃取过程中,锌离子通过与二苯硫腙发生螯合反应,锌离子与二苯硫腙接触得越充分,反应就进行得越完全。当反应时的搅拌速度由250 r/min增加到550 r/min时,油相和水相混合更加充分,加快了锌离子与二苯硫腙的接触,所以出现萃取率随着搅拌速度的增大而显著提高的现象。当搅拌速度高于550 r/min后,锌离子萃取率提高缓慢,此时螯和反应达到平衡,增加搅拌速率对反应影响不大。考虑到能耗问题,因此,控制萃取过程的搅拌速度在550 r/min较为适宜。

图4 搅拌速度对锌离子萃取率的影响
Fig. 4 Effect of stirring speed on zinc ion extraction rate
2.2.5 萃取时间对萃取过程的影响
在水相锌离子浓度为21.9 mg/L、相比(A/O)为3:1、pH为7.25、搅拌速度为550 r/min、温度为25 ℃、萃取剂质量浓度为0.6 g/L的条件下,实验考察了搅拌时间对萃取过程的影响,即萃取时间对萃取平衡的影响,结果如图5所示。从图5中可知,二苯硫腙萃取锌能快速达到平衡,3 min时,已经接近平衡,3~6 min内锌离子萃取率缓慢上升;6 min后,锌离子萃取率基本不变。由于二苯硫腙是一种螯合型萃取剂,它通过螯合反应来萃取金属离子,可以认为其螯合反应速率很大,反应时间很短,萃取过程速率主要受传质步骤控制。因此,萃取过程所花费的平衡时间实际上反映了萃取组分在有机相与水相之间的传质速率大小,换言之,萃取平衡时间越短,说明萃取组分在两相间的传质速率越大。

图5 搅拌时间对锌离子萃取率的影响
Fig. 5 Effect of stirring time on zinc ion extraction rate
2.2.6 二苯硫腙用量对萃取过程的影响
为探究二苯硫腙与锌离子发生络合反应时的表观螯合比,在水相锌离子浓度为23.3 mg/L、pH为7.25、搅拌转速为500 r/min、温度为25 ℃、萃取时间为10 min的条件下,实验考察了二苯硫腙用量及相比(A/O)对萃取过程影响,其结果如图6所示。
从图6中可以看出,在相比一定时,随着二苯硫腙用量的增大,萃取率呈快速上升。当相比(A/O)为1:1时,二苯硫腙质量浓度增大到1.2 g/L后,萃取相中锌离子浓度接近于饱和(平衡),此时锌离子萃取率达92.57%。但在相比(A/O)为2:1及3:1的条件下,二苯硫腙质量浓度达到1.2 g/L后,萃取相中锌离子的浓度仍未饱和,锌离子的萃取率依旧维持线性上升。由此可知,一定相比下,萃取剂双硫腙的用量与锌的萃取率具有正比关系。

图6 萃取剂浓度对锌离子萃取率的影响
Fig. 6 Effect of extractant concentration on zinc ion extraction rate
为了验证实际磷酸钠溶液中二苯硫腙对锌离子的萃取效果,采用质量浓度为30%、碱渣质量比mNaOH:mresidue为0.65的氢氧化钠溶液对磷化渣进行浸取,将抽滤后获得的含微量锌的磷酸钠溶液在以下条件下进行二苯硫腙萃取:萃取剂在三氯甲烷溶剂中的浓度为1.2 g/L,萃取有机相与水相的比例A/O为1:1,萃取体系pH为7.25,搅拌转速为550 r/min,温度为25 ℃,萃取时间为10 min,静置分层10 min。结果表明,萃余液中锌离子浓度从22.8 mg/L降至1.6 mg/L,锌离子萃取率为92.98%。进一步地,将萃余液在搅拌下,加入一定量的六水合氯化铁溶液反应一段时间后,抽滤、水洗多次,所得滤饼干燥后可制得符合行业标准的电池用磷酸殊产品(HG/T 4701—2014)。表明该萃取方法适用于磷酸钠溶液中微量锌的萃取分离,萃取后的磷酸钠溶液适合制备电池级磷酸铁产品。
在萃取剂质量浓度为0~1.2 g/L的范围内对二苯硫腙浓度及锌分配比取对数,拟合直线的斜率反映了螯合物中的锌离子与二苯硫腙的表观化学计量关系,所得结果如图7所示。
从图7中可知,3个不同油水比下拟合直线的斜率为1.98、2.03和1.74,接近于二苯硫腙与锌离子螯合反应的定量关系理论值2[22],由此证明,二苯硫腙在磷酸钠溶液中与锌离子的螯合反应是以摩尔比近似2:1的形式进行螯合。

图7 萃取剂浓度对锌分配比的影响
Fig. 7 Effect of extractant concentration on zinc partition ratio
2.3 二苯硫腙-三氯甲烷萃取锌的反应机理分析
2.3.1 萃取前后有机相及水相红外光谱表征分析
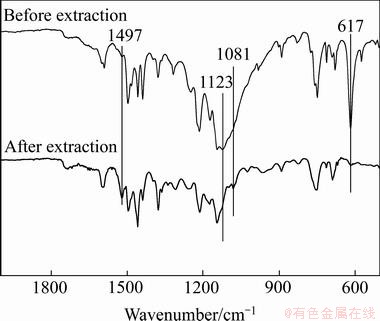
图8 二苯硫腙萃取前后红外光谱图
Fig. 8 FTIR spectra of dithizone before and after extraction
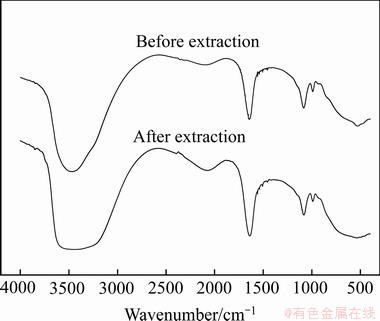
图9 萃取前后水相红外光谱图
Fig. 9 FTIR spectrum of aqueous phase before and after extraction
通过对萃取前后的有机相及水相进行红外表征,进一步探究了二苯硫腙与锌离子螯合反应的化学键变化情况。萃取前后有机相的傅里叶红外表征结果如图8所示,水相的傅里叶红外表征结果如图9所示。从图8可知,萃取前后的有机相化学键发生了明显的变化。萃取前二苯硫腙中,出现了二苯硫腙在617 cm-1的N—H键变角振动吸收峰[23];1123 cm-1处为C=S伸缩振动峰[24-25];并未出现C—S键的吸收峰,因此,可确定二苯硫腙为固态时,以硫酮的形式存在。萃取后,N—H的变角振动吸收峰及C=S伸缩振动峰消失,在1497和1081 cm-1处出现了新的吸收峰,推测其是由于二苯硫腙与锌离子螯合,导致N—H键及C=S键的断裂,而新出现的吸收峰可理解为二苯硫腙与锌离子形成了化学键,即二苯硫腙中的N或S与锌离子形成了N—Zn键或S—Zn所引起的振动峰。从图9中可知,萃取前后水相红外检测并未发生改变。由于锌离子在水相含量较小,红外检测中为发现与其相关的振动峰,但从一定程度上可以表明有机相在水中溶解量极小。
2.3.2 二苯硫腙的1H NMR分析
对萃取后的有机相进行蒸发干燥,得二苯硫腙与锌离子的螯合物。对二苯硫腙及其螯合物进行1H NMR测试,测试结果如图10所示。
从图10(a)中可知,在二苯硫腙的1H NMR图中,δ=12.61处为N—H的特征峰;δ=7.2~7.8处为苯环的特征峰[26];δ=1.79处为S—H的特征峰。在根据其峰面积之比近似于1:10:1,结合其分子式C13H12N4S,由此可确定二苯硫腙在三氯甲烷中以烯醇形式存在。从图10(b)中可知,δ=7.2~7.8处苯环的特征吸收峰没有明显变化,S—H的特征吸收峰红移至δ=0.88~1.32处,证明二苯硫腙螯合锌离子后对S—H上有一定的影响,N—H的吸收峰消失且并未出现其它新的吸收峰,进一步证实二苯硫腙是利用N—H跟锌离子进行螯合反应。

图10 二苯硫腙以及萃取后螯合物的1H NMR图
Fig. 10 1H NMR spectra of dithizone(a) and extracted complex(b)
2.3.3 二苯硫腙跟锌离子螯合反应机理
结合FTIR及1H NMR表征可知,二苯硫腙溶于三氯甲烷后,主要是通过在N—H键及S—H键与锌离子发生螯合反应,再根据反应过程定量分析可知,二苯硫腙跟锌离子是以摩尔比为2:1的关系进行反应,由此提出其螯合反应机理如下所示。

3 结论
1) 二苯硫腙在甲苯、苯、三氯甲烷及四氯化碳中都有一定的溶解度,在三氯甲烷中的溶解度最大,可达17.55 g/L。
2) 在含微量锌离子的磷酸钠溶液中,在pH为7.25时,二苯硫腙和锌离子以摩尔比2:1形式螯合,形成红色螯合物,且萃取过程能快速达到平衡。
3) 在萃取体系pH为7.25、萃取搅拌转速为550 r/min、萃取温度为25 ℃、相比(A/O)为1:1时,以质量浓度为1.2 g/L的二苯硫腙-三氯甲烷有机相萃取磷酸钠溶液中的微量锌离子,其单级萃取率可达92.57%,表明二苯硫腙能有效地萃取分离对磷酸钠溶液中微 量锌。
4) 根据萃取过程的定量分析及萃锌过程前后的有机相的FTIR和1H NMR 分析表征结果,由此得出了该螯合反应的机理。
5) 萃取分液后所得的水相中含有少量的残留溶剂,应做进一步回收处理以减少其对环境的污染和溶剂损耗。
REFERENCES
[1] 李越湘, 华国新. 磷化渣的再生利用[J]. 化工环保, 1994(2): 121-122.
LI Yue-xiang, HUA Guo-xin. Recycling of phosphating slag[J]. Environmental Protection of Chemical Industry, 1994(2): 121-122.
[2] SHAO Jin-ying, LI Xin-ran, WEI Ji-lei, PANG Huan, CHEN Chang-yun. Synthesis of iron phosphate and their composites for lithium/sodium ion batteries[J]. Advanced Sustainable Systems, 2018, 2(8/9): 1700154.
[3] JIANG Dan-ping, ZHANG Xiang-jun, LU Shi-gang, GU Yuan, CONG Chang-jie, KAN Su-rong. Research on process of preparation and performance of iron phosphate as precusor of lithium iron phosphate[J]. Rare Metals, 2011, 30(1): 52-54
[4] 朱志全, 王春云. 一种针状纳米级二水磷酸铁的制备与表征[J]. 江西化工, 2018, 140(6): 64-66.
ZHU Zhi-quan, WANG Chun-yun. Preparation and characterization of a needle-like nano-sized iron phosphate dihydrate[J]. Jiangxi Chemical Industry, 2018, 140(6): 64-66.
[5] 王光宙. 用磷铁渣为原料制备磷酸三钠[J]. 河南化工, 1991(7): 26-27.
WANG Guang-zhou. Preparation of trisodium phosphate from phosphorus iron slag[J]. Henan Chemical Industry, 1991(7): 26-27.
[6] 武晓燕, 黄继承, 郎庆成, 赵海运. 磷化渣资源化研究进展与展望[J]. 再生资源与循环经济, 2015(8): 38-41.
WU Xiao-yan, HUANG Ji-cheng, LANG Qing-cheng, ZHAO Hai-yun. Researching advancement and prospect of resource utilization of phosphated residue[J]. Recyclable Resources and Circular Economy , 2015(8): 38-41.
[7] 高 波. 固废磷化渣资源化的研究[D]. 湘潭: 湘潭大学, 2011.
GAO Bo. Research in resource utilization of phosphated residue[D]. Xiangtan: Xiangtan University, 2011.
[8] 刘 旗, 陈晓军, 乔永民, 王利军. 磷化渣制备羟基磷酸铁及其电催化性能[J]. 环境工程学报, 2017, 11(5): 3135-3141.
LIU Qi, CHEN Xiao-jun, QIAO Yong-min, WANG Li-jun. Preparation and electrocatalytic performance of hydroxyl iron phosphate with phosphate sludge[J]. Chinese Journal of Environmental Engineering , 2017, 11(5): 3135-3141.
[9] 徐庆鑫, 史英杰, 和晓才. 杂质元素对P204萃取锌过程的影响[J]. 云南冶金, 2017, 46(5): 29-32.
XU Qing-xin, SHI Ying-jie, HE Xiao-cai. The effect of impurity element on zinc extraction process by P204[J]. Yunnan Metallurgy, 2017, 46(5): 29-32.
[10] LIU Fu-peng, LIU Zhi-hong, LI Yu-hu, WILSON B P, LIU Zhi-yong, ZENG Li, LUNDSTROM M. Recovery and separation of gallium(Ⅲ) and germanium(Ⅳ) from zinc refinery residues: Part Ⅱ: Solvent extraction[J]. Hydrometallurgy, 2017, 171: 149-156.
[11] 沈 毅, 柴 琪, 肖江平, 杨运泉, 刘 宪, 王威燕, 李同春. 一种利用磷化渣为原料制备电池用磷酸铁的方法. 湖南省: CN107720715[P]. 2019-04-30.
SHEN Yi, CHAI Qi, XIAO Jiang-ping, YANG Yun-quan, LIU Xian, WANg Wei-yan, LI Tong-chun. A method for preparing iron phosphate for battery by using phosphating slag as raw material. CN107720715[P]. 2019-04-30.
[12] 司文会, 朱金坤. 双硫腙萃取光度法测定锌的研究[J]. 分析科学学报, 2002, 18(6): 522.
SI Wen-hui, ZHU Jin-kun. A study on spectrophotometric determination of zinc with dithizone extraction[J]. Journal of Analytical Science, 2002, 18(6): 522.
[13] IU K L, PULFORD I D, DUNCAN H J. Determination of cadmium, cobalt, copper, nickel and lead in soil extracts by dithizone extraction and atomic absorption spectrometry with electrothermal atomization[J]. Analytica Chimica Acta, 1979, 106(2): 319-324.
[14] HU Jiu-gang, CHEN Qi-yuan, HU Hui-ping, YIN Zhou-lan. Synergistic extraction of zinc from ammoniacal solutions using β-diketone mixed with CYANEX923 or LIX84I[J]. Transactions of Nonferrous Metals Society of China, 2012, 22(5): 1217-1223.
[15] 朱如龙, 李兴彬, 魏 昶, 黄 卉, 李存兄, 邓志敢, 樊 刚. 采用Meextral54-100从Zn(Ⅱ)-NH4Cl-NH3配合的溶液中萃取锌[J]. 中国有色金属学报, 2015, 25(4): 1056-1062.
ZHU Ru-long, LI Xing-bin, WEI Chang, HUANG Hui, LI Cun-xiong, DENG Zhi-gan, FAN Gang. Solvent extraction of zinc from Zn(Ⅱ)-NH4Cl-NH3 complex solution using Mextral54-100[J]. Chinese Journal of Nonferrous Metals, 2015, 25(4): 1056-1062.
[16] BAG S P, FREISER H. Preferential solvation of dithizone in chloroform in cyclohexane[J]. Analytica Chimica Acta, 1982, 136(1): 439-441.
[17] 黄选忠. 双硫腙水相光度法测定微量锌[J]. 理化检验(化学分册), 1992(5): 290-291.
HUANG Xuan-zhong. Determination of trace zinc by dithizone aqueous phase spectrophotometry[J]. Physical Testing and Chemical Analysis Part B (Chemical Analysis), 1992(5): 290-291.
[18] SRAMKOVA I, BURKHARD H, FIKAROVA K, SKLENAROVA H. Direct-immersion single-drop microextraction and in-drop stirring microextraction for the determination of nanomolar concentrations of lead using automated lab-in-syringe technique[J]. Talanta, 2018, 184: 162-172.
[19] CATAPANO M C, TVRDY V, KARLICKOVA J, MERCOLINI L, MLADENKA P. A simple, cheap but reliable method for evaluation of zinc chelating properties[J]. Bioorganic Chemistry, 2018, 77(2): 87-92.
[20] CATAPANO M C, TVRDY V, KARLICKOVA J, MERCOLINI L, MLADENKA P. A simple, cheap but reliable method for evaluation of zinc chelating properties[J]. Bioorganic Chemistry, 2018, 77: 287-292.
[21] ASAD T, AZIZI A, LEE J, JAHANI M. Solvent extraction of zinc from sulphate leaching solution of a sulphide-oxide sample using D2EHPA and Cyanex 272[J]. Journal of Dispersion Science and Technology, 2017, 193(1): 1532-2351.
[22] 魏复盛. 水和废水监测分析方法指南(中册)[M]. 北京: 中国环境科学出版社, 1994.
Wei Fu-sheng. Guide to monitoring methods for water and wastewater monitoring[M]. Beijing: China Environmental Science Press, 1994.
[23] WASUKAN N, SRISUNG S, KUNO M, KULIHONG K, MANIRATANACHOTE R. Interaction evaluation of silver and dithizone complexes using DFT calculations and NMR analysis[J]. Spectrochimica Acta Part A (Molecular and Biomolecular Spectroscopy), 2015, 149: 830-838.
[24] 张 东, 苏会东, 高 虹. 双硫腙包覆钛酸锶钡粉体对水中镉的吸附性能[J]. 光谱学与光谱分析, 2008, 28(3): 693-696.
ZHANG Dong, SU Hui-dong, GAO Hong. Study on the adsorption capability of barium-strontium titanate powder coated with dithizone for cadmium ion in water[J]. Spectroscopy and Spectral Analysis, 2008, 28(3): 693-696.
[25] 康 莹. 双硫腙接枝聚氨酯泡塑的制备及其吸附水中镉、汞、铅性能与机理研究[D]. 西安: 长安大学, 2015.
KANG Ying. Preparation of polyurethane foam plastic grafted with dithizone and its performance for adsorbing cadmium, mercury and lead from water[D]. Xi’an: Chang’an University, 2015.
[26] SCHONHERR T, LINDER R, ROSELLEN U, SCHMID V. Spectroscopic and quantum chemical study on electronic and geometric properties of free and embedded dithizone molecules[J]. International Journal of Quantum Chemistry, 2002, 86(1): 90-99.
Extraction and separation of trace zinc ion in sodium phosphate solution by dithizone
OU Xiao-ju, HE Qian, LI Zheng-ke, WANG Wei-yan, LIU Wen-ying, YANG Yun-quan
(School of Chemical Engineering, Xiangtan University, Xiangtan 411105, China)
Abstract: The extraction behavior of trace zinc(II) in sodium phosphate solution was studied by dithizone extraction. The solubility of dithizone in toluene, benzene, chloroform and carbon tetrachloride was investigated experimentally. On this basis, the extraction equilibrium relationship of trace zinc in sodium phosphate solution was studied by using dithizone as extractant and benzene or chloroform as its solvent, respectively. The effects of the extraction system pH , the stirring speed, the amount of extractant, the temperature and the phase ratio on the extraction efficiency were investigated. The results show that, among the four solvents, the solubility of dithizone in chloroform is the highest, reaching 17.55 g/L at 25 ℃. When the pH of the extraction system is 7.25, the stirring speed is 550 r/min, the temperature is 25 ℃ and the phase ratio is 1:1, the single-stage extraction efficiency of trace zinc can reach 92.57% with a concentration of 1.2 g/L of dithizone in trichloromethane. During the extraction, the molar ratio of dithizone and zinc in the chelate was estimated at approximately 2:1; the chelating reaction was an endothermic reaction with a reaction enthalpy change of 26.02 kJ/mol.
Key words: dithizone; extraction; zinc ion; sodium phosphate solution; reaction enthalpy
Foundation item: Project(51974274) supported by the National Natural Science Foundation of China; Project(14JJ5027) supported by the Natural Science Foundation of Hunan Province, China
Received date: 2019-10-25; Accepted date: 2020-06-18
Corresponding author: YANG Yun-quan; Tel: +86-13055142055; E-mail: yangyunquan@xtu.edu.cn
(编辑 李艳红)
基金项目:国家自然科学基金资助项目(51974274);湖南省自然科学基金资助项目(14JJ5027)
收稿日期:2019-10-25;修订日期:2020-06-18
通信作者:杨运泉,教授,博士;电话:13055142055;E-mail:yangyunquan@xtu.edu.cn