DOI: 10.11817/j.issn.1672-7207.2016.08.048
Fe2+激活过氧单硫酸盐去除水中氨氮分析
杨颖1,郭洪光1,邓钦祖2,张永丽1
(1. 四川大学 建筑与环境学院,四川 成都,610065;
2. 中国市政工程西南设计研究总院有限公司,四川 成都,610065)
摘要:为了有效地去除水中低浓度氨氮,采用二价铁(Fe2+)激活过氧单硫酸盐(PMS)的新型高级氧化工艺,对水中氨氮的去除进行研究分析。考察不同初始pH、氨氮浓度(c(NH4+-N)0)、Fe2+与PMS物质的量比(n(Fe2+)/n(PMS))及供电子剂对Fe2+/PMS体系去除水中氨氮的影响。研究结果表明:随着pH降低,Fe2+/PMS体系对氨氮的去除效果增强;增加n(Fe2+)/n(PMS)可以促进体系对氨氮的去除;随着NH4+-N初始浓度升高,氨氮的去除率呈现下降趋势。当pH=3,PMS初始投量为0.22 mmol/L,n(Fe2+)/n(PMS)为1:1,NH4+-N初始浓度为0.044 mmol/L,反应60 min时,氨氮去除率达到最大,为88.27%。另一方面,分别向Fe2+/PMS体系投加单宁酸、柠檬酸、抗坏血酸和草酸等供电子试剂,可以促进体系对氨氮的去除效果,其中单宁酸对其促进效果最佳,使氨氮去除率提高2.60%。Fe2+向Fe3+转化的效率极高,约为91.8%。Fe2+/PMS工艺去除氨氮符合拟一级动力学模型。
关键词:Fe2+;过氧单硫酸盐;氨氮;硫酸根自由基;供电子剂
中图分类号:X131.2 文献标志码:A 文章编号:1672-7207(2016)08-2900-07
Analysis on removal of ammonia nitrogen using peroxymonosulfate activated by Fe2+
YANG Ying1, GUO Hongguang1, DENG Qinzu2, ZHANG Yongli1
(1. College of Architecture & Environment, Sichuan University, Chengdu 610065, China;
2. Southwest Municipal Engineering Design & Research Institute of China, Chengdu 610065, China)
Abstract: In order to remove low concentration ammonia nitrogen in water effectively, remove the ammonia nitrogen in aqueous system by ferrous ion (Fe2+)/peroxymonosulfate (PMS), a new advanced oxidation process was analysed. The effects of initial pH, ammonia nitrogen concentration (c(NH4+-N)0), mole ratios of Fe2+ to PMS (n(Fe2+)/n(PMS)) as well as electronic agents on the removal of ammonia nitrogen were investigated. The results show that the removal rate is enhanced with the decrease of pH; the increase of n(Fe2+)/n(PMS) shows a positive effect, while the removal of contaminant exhibits a decline trend with the increase of initial NH4+-N concentration. At pH=3, 0.22 mmol/L PMS dosage, n(Fe2+)/n(PMS) at 1:1, and 0.044 mmol/L NH4+-N, the maximum removal rate of ammonia nitrogen is 88.27% after reacting for 60 min. On the other hand, adding tannic acid, citric acid, ascorbic acid and other electronic regent to this system can improve the efficiency of the removal rate. 2.60% increase of ammonia nitrogen removal rate is observed for the dosage of tannic acid. Meanwhile, the transformation of Fe2+ to Fe3+ is very high, which reaches 91.8%. The removal of ammonia nitrogen by Fe2+/PMS system fits the pseudo first order kinetics model.
Key words: Fe2+; peroxymonosulfate; ammonia nitrogen; sulfate radical; electronic agent
近年来,氨氮超标引起的水体富营养化及供水水质不达标事件呈现多发态势。水中残余的过量氨氮会引发水中藻类及其他微生物大量繁殖,导致输水管道和用水设备形成生物垢,堵塞设备[1]。水环境中的氨氮主要来源于污水处理厂出水和农业废弃物[2],大多数的污水处理厂能够使水中90%以上的含氮有机物得以去除,而残余的氮大部分仍以氨氮形式排放,从而促使含氮营养物质的污染逐渐成为主要的环境问题[3]。传统的水处理工艺对过量氨氮的去除存在低效性且受到一定的温度及营养物质限制,为此亟需开发高效处理工业废水及水环境中氨氮的新型工艺。国内外常见的氨氮去除方法主要有膜处理法、物化法、生物法等[2],其中物化法中的高级氧化工艺具有处理方法简单、快速、彻底的优点而得到广泛应用。然而前人研究发现该工艺对原水的进水水质要求较高,且处理成本高昂[4]。HUANG等[5]亦发现基于羟基自由基(·OH,E0=2.8 V)的传统高级氧化工艺虽能够氧化去除大部分有机污染物质,然而对于水中氨氮的去除却较为低效(·OH与NH4+的反应速率仅为9.7×107 L/(mol·s) [6])。近年来,研究发现过渡金属(如Fe2+,Cu2+,Co2+ 等)能够激活过硫酸盐(S2O82-,PDS)或过氧单硫酸盐(HSO5-,PMS)产生硫酸根自由基(·SO4-,E0=2.5~3.1V[7])(见式(1)和(2))[8-11],其作为一种新型高级氧化工艺,能够有望去除水中的氨氮[12]。
 (1)
(1)
 (2)
(2)
基于此,本文作者提出基于·SO4-对氨氮的新型高级氧化去除工艺即Fe2+/PMS工艺,并考察不同pH,NH4+-N初始浓度(c(NH4+-N)0),Fe2+与PMS物质的量比(n(Fe2+)/n(PMS))及供电子剂等对该工艺的动力学影响,以期为工业废水及水环境中过量氨氮的去除提供参考。
1 试验
1.1 主要试剂
主要试剂为:氯化亚铁、氯化铵、硝酸、氢氧化钠、亚硝基铁氰化钠、次氯酸钠、单宁酸、抗坏血酸、草酸,均为分析纯,购自成都科龙化学试剂有限公司;过氧单硫酸钾、甲醇,购自Sigma-Aldrich公司;试验用水,为去离子水。
1.2 仪器及方法
1.2.1 氨标准液的配制
称取1.91 g经100 ℃干燥过的氯化铵(NH4Cl)溶于去离子水中(去离子水中不含有氨),配制成500 L的氨标准液。此溶液氨氮浓度为1.0 g/L(以N计)。
1.2.2 试验方法
室温下((25±2) ℃)取一定体积的氨标准液置于500 mL平底烧瓶中,采用0.1 mol/L的稀硝酸(HNO3)及氢氧化钠(NaOH)调节溶液pH至设定值,并保持磁力搅拌器转速为160 r/min。根据试验设定向氨反应液中加入不同量的氯化亚铁(FeCl2)母液(0.1 mol/L)和过氧单硫酸钾(PMS)母液(0.1 mol/L),同时开始计时。反应开始后,在设定时间节点上定时取样并迅速投加0.1 mL甲醇以终止反应(甲醇与·OH反应速率为9.7×108 L/(mol·s),与·SO4-的反应速率为3.2×106 L/(mol·s)[13]),在24 h内进行定量分析。
氨氮去除率(η)的计算公式为
 (3)
(3)
式中: 为t时刻溶液中NH4+-N浓度的实测值,mmol/L;
为t时刻溶液中NH4+-N浓度的实测值,mmol/L; 为反应初始时刻溶液中NH4+-N浓度的实测值,mmol/L。
为反应初始时刻溶液中NH4+-N浓度的实测值,mmol/L。
1.2.3 分析方法
溶液中NH4+-N浓度采用水杨酸-次氯酸盐比色法测定[14],测定仪器为“UV-1800,MAPADA”型紫外分光光度计,检测波长为697 nm,购自苏州净化设备公司;总铁采用“PinAAcle 900T”型原子吸收仪测定;pH采用上海雷磁“pHB-4”型分析仪测定,购自上海精密科学仪器有限公司。
2 结果与分析
2.1 pH的影响
前人研究结果表明:体系pH的改变会对·SO4-工艺氧化污染物具有显著影响作用[15]。pH对本试验的影响主要表现在如下3个方面:一方面pH会影响Fe2+和NH4+在水中的存在形式,从而影响PMS的激活效果和NH3的初始浓度。此外,在不同pH条件下,体系的自由基种类不同。基于此,本试验考察在不同pH条件下(3,5和7),PMS初始投量为0.22 mmol/L,n(Fe2+)/n(PMS)为1:1,NH4+-N初始浓度为0.044 mmol/L时,Fe2+/PMS工艺对氨氮氧化去除效果,结果如图1所示。
由图1可知:Fe2+/PMS工艺对氨氮的去除能力随着pH的增大而降低。如式(4)和式(5)所示[16-19],PMS在水中不仅可产生·SO4-,还会通过链式反应生成羟基自由基(·OH)。当体系pH为酸性时,以·SO4-为主[16],则更有助于去除水中无机氮。此外,根据式(6)[20],水中氨氮主要以NH4+形式存在,为电正性,更易与·SO4-结合,从而被降解。随着pH不断升高,·SO4-逐渐向·OH转化,而由于·OH几乎不能去除水中氨氮,从而降低了水中·SO4-的浓度。
 ,
,
 (4)
(4)
 (5)
(5)
 (6)
(6)
此外,根据式(7)~(9)[20-21],pH的增大会促使Fe3+和Fe2+不断向铁羟络合体转化,削弱了Fe2+对PMS的激活效能,从而降低了氨氮的去除率。ZOU等[22]在Fe2+激活PMS的研究中也发现:当pH=3时,Fe2+/PMS体系的氧化能力最强。
 ,
,
 (7)
(7)

 (8)
(8)
 (9)
(9)

图1 不同初始pH下氨氮的去除
Fig. 1 Removal of ammonia nitrogen at different initial pH values
2.2 n(Fe2+)/n(PMS)的影响
在Fe2+/PMS体系中,Fe2+作为金属催化剂可激活PMS(E0=1.85 V)产生氧化性更强的·SO4-(E0=2.5~3.1 V),并且不同的Fe2+投量会影响·SO4-的产量[23]。试验考察了在pH=3,PMS初始投量为0.22 mmol/L,NH4+-N初始浓度为0.044 mmol/L时,通过改变体系中Fe2+的投量,探究Fe2+/PMS的投量比对氨氮去除率的影响。
由图2可知:随着Fe2+投量的不断增大,氨氮的去除效果越来越好。根据式(4),(6)和(10),随着Fe2+投量的不断增大,由PMS激活所产生·SO4-的量不断增大,NH4+不断被转化为NO2-,NO3-和N2等物质[24],氨氮去除率在n(Fe2+)/n(PMS)为1:1时达到最大,约为88.27%。

图2 pH=3时不同n(Fe2+)/n(PMS)下氨氮的去除
Fig. 2 Removal of ammonia nitrogen at different n(Fe2+)/n(PMS) at pH=3
 [6-8] (10)
[6-8] (10)
 ,
,
 [25-26] (11)
[25-26] (11)


 [27] (12)
[27] (12)


 [27] (13)
[27] (13)
 [8] (14)
[8] (14)
而当n(Fe2+)/n(PMS)升高至2:1时,氨氮的去除率反而降低。这是由于如式(10)~(14)所示,过量的Fe2+会被转化为Fe3+,Fe3+亦能可激活PMS产生去除水中氨氮。但根据ANIPSITAKIS等[8]的研究表明:Fe3+/PMS体系去除污染物的能力低于Fe2+/PMS体系去除污染物的能力,因此,当n(Fe2+)/n(PMS)为2:1时,水中氨氮的去除率略低,约为83.84%。
2.3 NH4+-N初始浓度的影响
试验考察了Fe2+/PMS体系对不同氨氮浓度的水体的去除能力,反应体系pH=3,PMS初始投量为0.22 mmol/L,n(Fe2+)/n(PMS)为1:1,控制NH4+-N初始浓度为0.044,0.088,0.110和0.220 mmol/L,该复合体系对氨氮的去除效果如图3所示。
在一定范围内,氨氮去除效果随着NH4+-N初始浓度的减小而显著提高。根据式(15),NH4+-N初始浓度减小,使得·SO4-相对于目标物的量越来越多,足以快速、高效地去除氨氮。反应40 min后,水中氨氮的浓度趋于稳定,并在NH4+-N初始浓度为0.044 mmol/L时达到最低,约为0.005 mmol/L。WANG等[28]采用Fe2+/PMS体系去除染料时,亦发现该体系对低浓度染料去除效果较好。
 [20, 28-30] (15)
[20, 28-30] (15)

图3 pH=3时不同NH4+-N初始浓度下氨氮的去除
Fig. 3 Removal of ammonia nitrogen for different NH4+-N initial concentrations at pH=3
2.4 供电子还原剂的影响
前人研究结果表明:Fe2+/PMS工艺中Fe3+向Fe2+的转化是该工艺的限速步骤,其传质能力决定了该工艺对污染物的去除效果,如式(7)~(14)所示,通过向体系投加供电子还原剂,可在一定程度上促进Fe3+还原成Fe2+,以削弱Fe3+的累积[22]。本试验通过在反应最佳条件下向体系中投加0.22 mmol/L(与Fe2+的物质的量比为1:1)的单宁酸、柠檬酸、抗坏血酸和草酸,测定反应60 min时各体系氨氮的浓度,以考察该类物质对Fe2+/PMS工艺去除氨氮的影响,并且通过监测发现该体系在投加还原剂前后pH几乎保持不变(pH=3±0.4)。
反应60 min时,不同还原剂下氨氮的去除率如图4所示。由图4可知:不同种类的还原剂对反应的作用不尽相同。相比其他3种供电子物质,单宁酸对氨氮去除率的提高效果相对最明显,去除率约为90.87%。ZOU等[22]以苯甲酸作为Fe2+/PMS高级氧化体系的目标物,并投加羟胺以促进Fe2+/Fe3+的循环。如式(16)所示,通过还原作用,羟胺能在一定程度上削弱Fe3+在该体系中的累积,从而提高氧化能力。
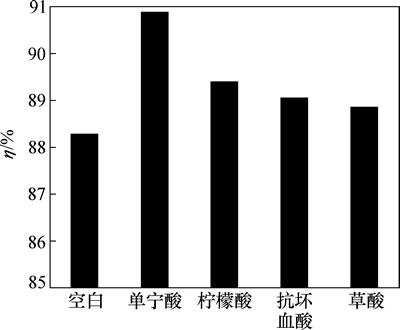
图4 反应60 min时不同还原剂下氨氮的去除率
Fig. 4 Removal of ammonia nitrogen at different reductants at 60 min
 (16)
(16)
与羟胺类似,单宁酸等具有强还原性且本身不含有氮元素,从而可将Fe3+不断地还原成Fe2+以提高体系去除氨氮的能力。
2.5 铁的变化情况
如式(10)所示,Fe2+在激活PMS去除水中氨氮的过程中,会不断向Fe3+转化。这里采用原子吸收仪和紫外分光光度仪测定了pH=3,PMS初始投量为0.22 mmol/L,n(Fe2+)/n(PMS)为1:1,NH4+-N初始浓度为0.044 mmol/L时,体系中Fe2+和总铁浓度的变化。
pH=3时Fe2+和总铁的浓度以及Fe2+与总铁的浓度比的变化如图5所示。由图5可见:Fe2+/PMS体系中的铁始终以离子形态存在,因此,反应前后总铁的浓度几乎保持不变,约为0.22 mmol/L;反应前20 min,Fe2+不断向Fe3+转化,从而使Fe2+在总铁中的比例由1.00迅速降低为0.11左右。由此可知:Fe2+对PMS的激活效果较显著,能产生足量的·SO4-去攻击水中氨氮等物质。然而,Fe2+的浓度在最后40 min的反应过程中几乎无变化,说明Fe3+不断累积抑制了Fe2+的进一步转化。在该试验条件下,反应60 min后,Fe2+的转化率达91.8%。
2.6 动力学机理
现有研究表明Fe2+/PMS降解水环境污染物质符合拟一级动力学模型拟合,本试验亦尝试采用拟一级动力学模型来考察各影响因素对该工艺降解水中氨氮的影响。根据式(4),(6)和(10)~(15),模型可表示为
 (17)
(17)

图5 pH=3时Fe2+和总铁的浓度以及Fe2+与总铁的浓度比的变化情况
Fig. 5 Changes of Fe2+, total iron concentrations and mole ratio of Fe2+ to total iron at pH=3
对式(17)进行积分并整理得
 (18)
(18)
考虑在不同试验条件下,NH4+衰减的半衰期对比情况,取c(NH4+-N)t=1/2c(NH4+-N)0得
 (19)
(19)
其中:kapp为拟一级表观速率常数,反映了NH4+被Fe2+/PMS体系中众多因素的影响作用(如温度、pH和PMS等);c(NH4+-N)0和c(NH4+-N)t分别为NH4+-N初始浓度和反应t时刻的浓度。采用拟一级动力学模型拟合不同情况下反应体系中拟一级表观速率常数,相关系数r2及半衰期t1/2拟合参数如表1所示。
图6所示为不同试验条件对Fe2+/PMS去除氨氮速率的影响。由表1和图6可见:NH4+-N初始浓度、n(Fe2+)/n(PMS)和pH这3个影响因子符合线性公式。NH4+-N初始浓度增大,降解速率降低,拟合曲线线性良好(拟合系数r2=0.92~0.99),说明NH4+的增加抑制了Fe2+/PMS体系对NH4+-N的降解速率;随n(Fe2+)/n(PMS)的增大,降解速率先增加后减小,最大值在n(Fe2+)/n(PMS)为1:1处,说明Fe2+对PMS有明显的激活作用,Fe2+浓度增大能促使PMS生成更多的氧化性自由基,提高NH4+-N的降解速率;pH增大使降解速率减小,拟合曲线线性良好(r2=0.93~0.97),说明酸性条件(pH=3)下该体系去除NH4+-N的效果较好。
表1 Fe2+/PMS体系中氨氮在不同条件下的去除反应动力学
Table 1 Kinetic of ammonia nitrogen removal at different conditions in Fe2+/PMS system


图6 不同试验条件对Fe2+/PMS去除氨氮速率的影响
Fig. 6 Effects on removal rate of ammonia nitrogen at different conditions by Fe2+/PMS
3 结论
1) 溶液初始pH对氨氮的去除率影响较大,并且在pH=3时,Fe2+/PMS体系对氨氮的去除效果最佳。
2) 在Fe2+/PMS体系降解氨氮的反应中,n(Fe2+)/n(PMS)为1:1时,Fe2+激活PMS的效率最高。
3) Fe2+/PMS体系对低浓度的含氨溶液去除效果较好,并在体系pH=3,PMS初始投量为0.22 mmol/L,n(Fe2+)/n(PMS)为1:1,NH4+-N初始浓度为0.044 mmol/L时,氨氮去除率最高,为88.27%。
4) 供电子剂的投加对Fe2+/PMS体系总体影响不明显,投加单宁酸对氨氮去除率的提高效果相对于柠檬酸、抗坏血酸和草酸的效果均较好,可达90.87%。
5) Fe2+/PMS体系降解NH4+-N的速率随pH和NH4+-N初始浓度的增加而降低,而随n(Fe2+)/n(PMS)的增大而先增大后减小,并在体系pH=3,PMS初始投量为0.22 mmol/L,n(Fe2+)/n(PMS)为1:1,NH4+-N初始浓度为0.044 mmol/L时,达到最大。
参考文献:
[1] KHUNTIA S, MAJUMDER S K, GHOSH P. Removal of ammonia from water by ozone microbubbles[J]. Industrial & Engineering Chemistry Research, 2013, 52(1): 318-326.
[2] HEGGEMANN M H, WARNECKE H J, VILJOEN H J. Removal of ammonia from aqueous systems in a semibatch reactor[J]. Industrial & Engineering Chemistry Research, 2001, 40(15): 3361-3368.
[3] HUANG Y, SONG C, LI L, et al. The mechanism and performance of zeolites for ammonia removal in the zeolite packed electrolysis reactor[J]. Electrochemistry, 2014, 82(7): 557-560.
[4] 关小红, 辛晓岩, 高乃云, 等. Fe2+激活过硫酸氢钾法降解扑热息痛[J]. 华南理工大学学报(自然科学版), 2015, 43(3): 137-142.
GUAN Xiaohong, XIN Xiaoyan, GAO Naiyun, et al. Degradation of acetaminophen by Fe2+ activated peroxymonosulfate oxidation[J]. Journal of South China University of Technology (Natural Science Edition), 2015, 43(3): 137-142.
[5] HUANG L, LI W, DONG Y, et al. Removal of ammonia by OH radical in aqueous phase[J]. Environmental Science & Technology, 2008, 42(21): 8070-8075.
[6] VON GUNTEN U. Ozonation of drinking water: part 1. oxidation kinetics and product formation[J]. Water Research, 2003, 37(7): 1443-1467.
[7] 高乃云, 胡栩豪, 邓靖, 等. 紫外激活过硫酸盐降解水中卡马西平研究[J]. 华中科技大学学报(自然科学版), 2013, 41(12): 117-122.
GAO Naiyun, HU Yuhao, DENG Jing, et al. Study on UV-activated persulfate oxidation of carbamazepine in water[J]. Journal of Huazhong University of Science and Technology (Nature Science Edition), 2013, 41(12): 117-122.
[8] ANIPSITAKIS G P, DIONYSIOU D D. Radical generation by the interaction of transition metals with common oxidants[J]. Environmental Science & Technology, 2004, 38(13): 3705-3712.
[9] CHEN X Y, CHEN J W, QLAO X L. Performance of nano Co3O4/peroxymonosulfate system: kinetics and mechanism study using acid orange 7 as a model compound[J]. Applied Catalysis B: Environmental, 2008, 80(1/2): 116-121.
[10] HOUSE D A. Kinetics and mechanism of oxidations by peroxy disulfate[J]. Chemical Reviews, 1962, 62(3): 185-203.
[11] 邓靖, 冯善方, 马晓雁, 等. 均相活化过硫酸氢盐高级氧化技术研究进展[J]. 水处理技术, 2015, 41(4): 13-19.
DENG Jing, FENG Shanfang, MA Xiaoyan, et al. Research development in advanced oxidation processed based on homogeneous activation of peroxymonosulfate[J]. Technology of Water Treatment, 2015, 41(4): 13-19.
[12] ANIPSTTAKIS G P, STATHATOS E, DIONYSIOU D D. Heterogeneous activation of oxone using Co3O4[J]. The Journal of Physical Chemistry B, 2005, 109(27): 13052-13055.
[13] KEENAN C R, SEDLAK D L. Factors affecting the yield of oxidants from the reaction of manoparticulate zero-valent iron and oxygen[J]. Environmental Science & Technology, 2008, 42(4): 1262-1267.
[14] 国家环境保护总局.水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002: 1-836.
State Environmental Protection Administration of China.Monitoring and analytic methods of water and wastewater[M]. 4th ed. Beijing: Environmental Science Press of China, 2002: 1-836.
[15] RASTOGI A, ALABED S R, DIONYSIOU D D. Sulfate radical-based ferrous–peroxymonosulfate oxidative system for PCBs degradation in aqueous and sediment systems[J]. Applied Catalysis B: Environmental, 2009, 85(3/4): 171-179.
[16] ABU AMR S S, AZIZ H A, ADLAN M N. Optimization of stabilized leachate treatment using ozone/persulfate in the advanced oxidation process[J]. Waste Management, 2013, 33(6): 1434-1441.
[17] BACHEL H W, PAUL G T, RICHARD L J, et al. Oxidation of chlorinated ethenes by heat-activated persulfate: kinetics and products[J]. Environmental Science &Technology, 2007, 41(3): 1010-1015.
[18] 郭洪光, 高乃云, 张永丽, 等. 热激活过硫酸盐降解水中典型氟喹诺酮抗生素分析[J]. 四川大学学报(工程科学版), 2015, 47(2): 191-197.
GUO Hongguang, GAO Naiyun, ZHANG Yongli, et al. Analysis on the degradation of typical fluoroquinolone in the water by thermally activated persulfate[J]. Journal of Sichuan University (Engineering Science Edition), 2015, 47(2): 191-197.
[19] 高乃云, 朱延平, 谈超群, 等. 热激活过硫酸盐氧化法降解敌草隆[J]. 华南理工大学学报(自然科学版), 2013, 41(12): 36-42.
GAO Naiyun, ZHU Yanping, TAN Chaoqun, et al. Degradation of diuron via heat-activated persulfate oxidation[J]. Journal of South China University of Technology (Natural Science Edition), 2013, 41(12): 36-42.
[20] LEE D K. Mechanism and kinetics of the catalytic oxidation of aqueous ammonia to molecular nitrogen[J]. Environmental Science & Technology, 2003, 37(24): 5745-5749.
[21] EVANS M G, GEORGE P U N. The Fe(OH)2+ and Fe(O2H)2+ complexes[J]. Trans Araday Soc, 1949, 45: 230-239.
[22] ZOU J, MA J, CHEN L, et al. Rapid acceleration of ferrous iron/ peroxymonosulfate oxidation of organic pollutants by promoting Fe(III)/Fe(II) cycle with hydroxylamine[J]. Environmental Science & Technology, 2013, 47(20): 11685-11691.
[23] WANG Z, BUSH R T, SULLIVAV L A, et al. Selective oxidation of arsenite by peroxymonosulfate with high utilization efficiency of oxidant[J]. Environmental Science & Technology, 2014, 48(7): 3978-3985.
[24] DENG Y, EZYSKE C M. Sulfate radical-advanced oxidation process (SR-AOP) for simultaneous removal of refractory organic contaminants and ammonia in landfill leachate[J]. Water Research, 2011, 45(18): 6189-6194.
[25] ANIPSITAKES G P, DIONYSIOU D D. Transition metal/UV-based advanced oxidation technologies for water decontamination[J]. Applied Catalysis B: Environmental, 2004, 54(3): 155-163.
[26] XU X R, LI X Z. Degradation of azo dye orange G in aqueous solutions by persulfate with ferrous ion[J]. Separation and Purification Technology, 2010, 72(1): 105-111.
[27] DE L J, LE T G. Kinetics and modeling of the Fe(III)/H2O2 system in the presence of sulfate in acidic aqueous solutions[J]. Environmental Science & Technology, 2005, 39(6): 1811-1818.
[28] WANG Y R, CHU W. Degradation of a xanthene dye by Fe(II)-mediated activation of oxone process[J]. J Hazard Mater, 2011, 186(2/3): 1455-1461.
[29] BALL R E, CHAKO A, EDWARDS J O, et al. Mechanism of oxidation of nitrogen nucleophiles by peroxodisulfate ion: nitrate ion and ammonia[J]. Inorganica Chimica Acta, 1985, 99(1): 49-58.
[30] LEE D K, CHO J S, YOON W L. Catalytic wet oxidation of ammonia: why is N2 formed preferentially against[J]. Chemosphere, 2005, 61(4): 573-578.
(编辑 杨幼平)
收稿日期:2016-01-08;修回日期:2016-02-25
基金项目(Foundation item):四川省环保科技计划项目(2013HB08);国家自然科学基金资助项目(51508354) (Project(2013HB08) supported by Sichuan Provincial Environmental Protection Office; Project(51508354) supported by the National Natural Science Foundation of China )
通信作者:张永丽,教授,博士生导师,从事水处理技术研究;E-mail: zxm581212@163.com