文章编号:1004-0609(2013)04-1140-05
锌湿法冶金过程中臭氧氧化沉淀除去微量钴
田庆华1, 2,辛云涛1,姚 标1,郭学益1
(1. 中南大学 冶金科学与工程学院,长沙 410083;
2. 大冶有色金属股份有限公司 博士后科研工作站,黄石 435005)
摘 要:为有效去除锌湿法冶金过程中的微量钴,探索采用臭氧氧化净化ZnSO4溶液中钴的可行性,考察搅拌速度、反应温度、气体流量、溶液pH值、钴离子浓度、锌离子浓度等因素对除钴效果的影响。结果表明:在锌离子初始浓度100 g/L、钴离子初始浓度20 mg/L、温度30 ℃、气体流量800 mL/min、pH=5.0、搅拌速度800 r/min等条件下,反应30 min后,钴浓度可降至0.2 mg/L,除钴率高达99%。
关键词:臭氧;氧化;除钴率;ZnSO4溶液
中图分类号:TF111.3 文献标志码:A
Efficient purification of trace cobalt in
zinc hydrometallurgical process by ozone oxidation
TIAN Qing-hua1, 2, XIN Yun-tao1, YAO Biao1, GUO Xue-yi1
(1. School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China;
2. Postdoctoral Workstation, Daye Nonferrous Metals Co., Ltd., Huangshi 435005, China)
Abstract: In order to remove trace cobalt in the process of zinc extractive hydrometallurgy, a novel method to precipitate cobalt from ZnSO4 solution by ozone oxidation was proposed. The factors influencing the effect of removing cobalt, including stirring speed, temperature, gas flow rate, pH and concentrations of cobalt ion and zinc ion were investigated. The results show that the cobalt concentrations and elimination rate can reach 0.2 mg/L and 99%, respectively, under the solution conditions as initial concentrations of cobalt and zinc 20 mg/L and 100 g/L, controlling pH of 5.0, stirring speed of 800 r/min, gas flow rate of 800 mL/min, reacting time of 30 min at 30 ℃.
Key words: ozone; oxidation; cobalt removal rate; ZnSO4 solution
基金项目:国家自然科技基金资助项目(51104181/E0412);中国博士后科学基金资助项目(20110491279);湖南省科技计划资助项目(2010FJ3117)
收稿日期:2012-03-05;修订日期:2012-12-20
通信作者:郭学益,教授,博士;电话/传真:0731-88877863;E-mail: xyguo@mail.csu.edu.cn
湿法炼锌生产过程中,经中性浸出得到的硫酸锌溶液主要含有如Co、Ni、Cd和Cu等杂质[1-2],这些杂质均会影响随后的电积过程。因此,电积前需要净化除杂,而净化阶段的最大困难是除钴。目前,国内外湿法炼锌厂所采用的除钴方法归纳起来有两类:一类是采用特殊的化学试剂(如黄药、β-萘酚)直接沉钴法;另一类是添加砷盐、锑盐作活化剂的锌粉或合金锌粉置换除钴法[3-4]。
黄药净化法深度除钴效果差,生产过程中黄药气味大,操作环境恶劣[3, 5]。采用β-萘酚净化,残留在溶液中的亚硝酸根离子会引起锌电积时阳极铅的腐蚀并降低电积的电流效率,此外,β-萘酚药剂价格也较昂贵,试剂耗量较大[6]。砷盐净化法易造成二次污染,产生剧毒的AsH3气体,须在密闭负压的装置中进行[7]。锑盐净化法有两种工序:其中先热后冷工艺须添加相当多的硫酸铜,且镉、钴不能分别回收;逆锑净液工艺蒸汽耗量大,净化温度要求较高[8]。合金锌粉净化法不但温度要求高,而且对合金锌粉的要求很高[9]。针对这些方法存在的诸多不足,研究者尝试采用强氧化剂进行氧化沉钴。OWUSU[10]采用过硫酸从含锌 54.5 g/L、镉19.3 g/L、镍0.07 g/L、钴2.33 g/L的硫酸盐溶液中除钴,以NaOH作为中和剂,钴沉淀率达98%~99%。CALZADO等[11]探讨了臭氧氧化沉淀镍回收硫酸体系中镍。本文作者利用臭氧的强氧化性,将Co(Ⅱ)氧化成Co(Ⅲ),控制适当的pH使Co(Ⅲ)从溶液中沉淀分离,从而达到高效净化硫酸锌溶液的目的。
1 实验
1.1 实验仪器和试剂
实验仪器如下:OZOMJB-10B型臭氧发生器;ZDJ-4A型自动电位滴定仪;DK-2000-ⅢL型电热恒温水浴锅;JAS-2/90恒速数显搅拌器;721型可见分光光度计;自制玻璃反应器。
试剂如下:硫酸锌(天津市博迪化工有限公司生产),分析纯;硫酸钴(天津市光复精细化工研究所生产),分析纯;氧化锌(广东汕头市西陇化工厂生产),分析纯;无水乙酸钠(广东省化学试剂工程技术研究开发中心生产),分析纯;亚硝基R盐(上海三爱思试剂有限公司生产),分析纯;硝酸(湖南省株洲市化学工艺研究所生产),分析纯。
1.2 实验过程及分析方法
试验装置参照文献[12],以氧气为原料制得含臭氧7.8%(体积分数)的氧气流,通入500 mL含微量钴的硫酸锌溶液。反应过程加入氧化锌控制pH在设定值,实验过程采用同一体系连续取样的方法进行取样分析,使用亚硝基R盐吸光光度法测钴的含量,计算残留钴浓度,推算除钴率。计算除钴率的公式如下:
μ=(1-ct/c0)×100% (1)
其中:ct为t时刻的钴离子浓度;c0为初始的钴离子 浓度。
1.3 实验现象和原理
通气后氧化反应迅速,溶液pH值先略有升高,然后迅速降低。溶液颜色首先由无色变为浅黄色,又很快变成棕黑色,并迅速出现黑色沉淀。推测硫酸锌溶液中臭氧氧化除钴的反应可能如下[13]:
O3(gas)→O3(dissolve) (2)
O3+2Co2++2H+→O2+2Co3++H2O (3)
2Co3++4H2O→2CoOOH↓+6H+ 或
2Co3++6H2O→2Co(OH)3↓+6H+ (4)
1.4 氧化锌用量计算
氧化锌与氢离子的主要反应为:ZnO+2H+→ Zn2++H2O。根据溶液中钴的含量计算添加的氧化锌用量。
2 结果与讨论
2.1 搅拌速度对除钴效果的影响
气液反应体系中通常包括如下3个步骤:反应物的扩散、界面化学反应和生成物的扩散。搅拌可以强化扩散步骤,并且为体系提供能量,强化传质与传热,避免了浓度梯度和温度梯度的产生,保证了体系环境高度一致,有利于气体均匀分布于溶液中,提高气体通过气液膜扩散到溶液中的速度。在温度30 ℃、气体流量800 mL/min、溶液pH=5.0、初始钴浓度20 mg/L、锌初始浓度100 g/L等条件下,改变搅拌速度得到的实验结果如图1所示。
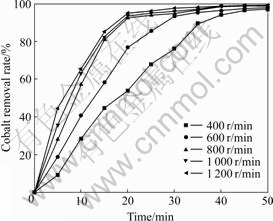
图1 在温度30 ℃、气体流量800 mL/min、溶液pH=5.0、初始钴浓度20 mg/L、锌初始浓度100 g/L等条件下搅拌速度对除钴效果的影响
Fig. 1 Effect of stirring speed on cobalt removal result under 30 ℃, air flow rate of 800 mL/min, pH 5.0, intial concentrations of Co2+ and Zn2+ of 20 mg/L and 100 g/L
由图1可知,在此条件下,当搅拌速度为800 r/min时,30 min后除钴率基本达到最高值。当搅拌速度超过800 r/min时,加大搅拌速度对除钴效果影响甚微,加强搅拌已经不能够显著提高反应物质之间的相互接触强度,对整个反应进行的促进作用也已经基本上达到最大值。说明此时整个反应过程的控制步骤由扩散传质步骤改为化学反应步骤。
其他条件不变,将初始钴浓度提高到2 g/L进行实验,实验结果如图2所示。随着搅拌速度的增加,除钴速率也相应地增加。
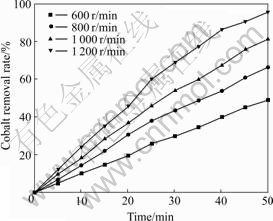
图2 在温度30 ℃、气体流量800 mL/min、溶液pH=5.0、初始钴浓度2 g/L、锌初始浓度100 g/L等条件下搅拌速度对除钴效果的影响
Fig. 2 Effect of stirring speed on cobalt removal result under 30 ℃, air flow rate of 800 mL/min, pH 5.0, initial concentrations of Co2+ and Zn2+ of 2 g/L and 100 g/L
初始钴浓度为20 mg/L时,搅拌速度超过800 r/min后,过程受化学反应控制而不再受搅拌的影响。初始钴浓度为2 g/L、相比浓度为20 mg/L时,反应物粒子浓度增加,除钴速率(除钴速率为除钴达到平衡前的除钴曲线斜率,其值分别为1、1.423、1.793和2.253)随着搅拌速率的增加而增大,这是因为搅拌速度越大,臭氧和钴离子扩散越快,传质速率增加,反应物粒子间的有效碰撞增加,进而加强反应进程,臭氧氧化沉淀钴的反应速率大于臭氧在溶液中的传质速率,整体反应为扩散控制。锌湿法冶金硫酸锌溶液中的钴含量很低,通常在100 mg/L以下,综合以上因素,搅拌速度选择800 r/min比较合适。
2.2 温度对除钴效果的影响
从理论上讲,反应温度直接影响反应的反应速度。一方面臭氧在水中的溶解度随着温度的升高而降低,导致反应速率减慢;另一方面温度升高臭氧的传质速率加快[14-15],使得反应速率加快。实验探讨了在搅拌速度800 r/min、气体流量800 mL/min、钴初始浓度20 mg/L、锌浓度100 g/L、溶液pH=5.0的固定条件下,反应温度分别为15、30、45和60 ℃时对除钴率的影响,实验结果如图3所示。由图3可知,随着温度的升高,除钴率并无明显改变。这是因为臭氧通入溶液后就迅速参与反应,沉钴反应未完成时,臭氧在水中的溶解度很少,温度对于臭氧溶解度的影响是可以忽略的;在搅拌速度充分的条件下,温度对臭氧传质速度的影响可以忽略不计;而反应活化能在温度变化很小的情况下是基本不变的,所以温度对于化学反应过程的影响很小。因此,温度对除钴效果无明显影响。
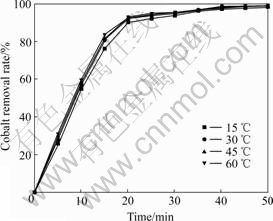
图3 温度对除钴效果的影响
Fig. 3 Effect of temperature on cobalt removal result
2.3 气体流量对除钴效果的影响
气体流量是影响臭氧氧化除钴效果的一个重要因素。在温度30 ℃、搅拌速度800 r/min、钴初始浓度20 mg/L、锌初始浓度100 g/L、溶液pH=5.0不变的条件下,改变气体流量实验结果如图4所示。
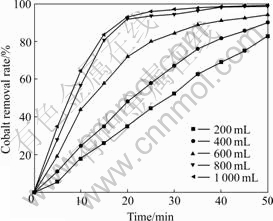
图4 气体流量对除钴效果的影响
Fig. 4 Effect of gas flow rate on cobalt removal result
从图4可以看出,随着气体流量的增加,除钴率逐渐提高,当气体流量达到800 mL/min时,除钴率的增加的趋势减缓。在臭氧反应比较充分的条件下,气体流量大,就会有更多的臭氧分子扩散到溶液中参与反应,增强了传质过程,氧化反应越快,除钴效果越好;当气体流量增加到一定程度,传质过程达到极大值,增加气体流量并不能显著提高反应过程。考虑到硫酸锌溶液中钴是微量的,气体流量选择800 mL/min比较合适。
2.4 溶液pH值对除钴效果的影响
反应过程中介质溶液的酸碱度对沉淀产物的形成有明显的影响。在臭氧氧化沉淀硫酸锌溶液中微量钴的过程中,pH值对除钴效果的影响非常明显。在温度30 ℃、气体流量为800 mL/min、搅拌速度为800 r/min、钴浓度为20 mg/L、锌浓度为100 g/L的实验条件下,控制溶液pH值分别为2、3、4和5进行实验,得到的实验结果如图5所示。
由图5可知,溶液pH越大,除钴率越高。这是因为溶液pH越高,氧化得到的Co(Ⅲ)越容易水解沉淀下来。考虑到溶液pH太高将导致锌离子水解沉淀,选择 pH为5.0比较适宜。
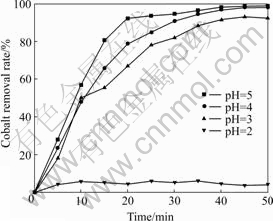
图5 pH值对除钴效果的影响
Fig. 5 Effect of pH value on cobalt removal result
2.5 溶液中初始钴离子浓度对除钴效果的影响
在温度30 ℃、搅拌速度800 r/min、气体流量800 mL/min、锌浓度100 g/L、溶液pH=5.0等不变的条件下,改变钴初始浓度进行实验,结果如图6所示。
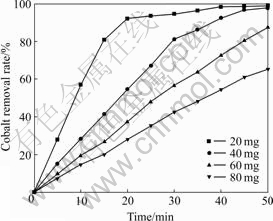
图6 溶液中钴初始浓度对除钴效果的影响
Fig. 6 Effect of initial concentration of cobalt ion on cobalt removal result
由图6可知,溶液中初始钴浓度越低,除钴达到平衡所需时间越短。在钴初始浓度不同的情况下,根据实验结果,可以得到它们在达到平衡前的除钴速率分别为1.116(20 mg)、1.098(40 mg)、1.115(60 mg)、1.114(80 mg),结合不同气体流量对于沉钴反应的影响,可以得到在不同初始钴浓度和固定气体流量的情况下,除钴速率是相同的。因此初始钴浓度对于除钴速率没有影响。
2.6 溶液中锌离子浓度对除钴效果的影响
理论上,锌离子浓度越高,钴离子周围锌离子越多,臭氧在溶液中的传质扩散过程就会受到一定的阻碍[16],除钴效果将受到影响。实验探讨了在温度30 ℃、搅拌速度800 r/min、气体流量800 mL/min、钴初始浓度20 mg/L、溶液pH=5.0不变的条件下,锌离子浓度分别为75、100、125和150 g/L时对除钴效果的影响,实验结果如图7所示。结果表明,锌离子浓度对除钴效果无明显影响,搅拌速度足够充分时,锌离子浓度对臭氧的扩散影响甚微。
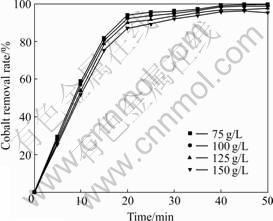
图7 锌离子浓度对除钴效果的影响
Fig. 7 Effect of concentration of zinc ion on cobalt removal result
2.7 钴渣的分析
实验反应完全后,过滤真空干燥后得到钴渣,其XRD谱如图8所示。对照标准图谱分析可知,最终的产物为CoOOH。
因此,最后一步反应如下:
Co3++2H2O=CoOOH+3H+ (11)
臭氧氧化沉淀钴的总反应为
O3+2Co2++3H2O=O2+2CoOOH+4H+ (12)
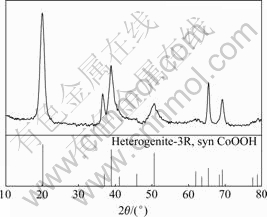
图8 钴渣的XRD谱
Fig. 8 XRD patterns of cobalt slag
3 结论
1) 除钴效果与钴的初始浓度、温度均无关,锌离子浓度无明显影响。随着搅拌速度的提高和气体流量的加大,臭氧扩散速度加大,氧化速率增快,除钴速率明显提高。溶液pH越高除钴效果越好。
2) 以臭氧为氧化剂去除硫酸锌溶液中的钴,除钴效果良好。当钴初始浓度为20 mg/L时、在pH 5.0、搅拌速度800 r/min、气体流量为800 mL/min、温度30 ℃等条件下,反应30 min后,钴浓度可降到0.2 mg/L,除钴率达到99%。
3) XRD分析得到臭氧氧化除硫酸锌溶液中钴的最终产物为CoOOH,臭氧氧化沉淀钴的总反应为O3+2Co2++3H2O→O2+2CoOOH↓+4H+。
REFERENCES
[1] 梅光贵. 湿法炼锌学[M]. 长沙: 中南大学出版社, 2001: 277-279.
MEI Guang-gui. Hydrometallurgy of zinc[M]. Changsha: Central South University Press, 2001: 277-279.
[2] 杨显万, 邱定蕃. 湿法冶金[M]. 北京: 冶金工业出版社, 1998: 255-257.
YANG Xian-wan, QIU Ding-fan. Hydrometallurgy[M]. Beijing: Metallurgical Industry Press, 1998: 255-257.
[3] 刘继军. 湿法炼锌中的贫镉液除钴[J]. 有色金属, 2006, 58(4): 36-38.
LIU Ji-jun. Cobalt removal from poor cadmium solution in zinc hydrometallurgical process[J]. Nonferrous Metals, 2006, 58(4): 36-38.
[4] 马杨辉, 阳雄魁. 湿法炼锌锑盐锌粉除钴的生产实践[J]. 中国有色冶金, 2005, 2(1): 22-23.
MA Yang-hui, YANG Xiong-kui. Production practice of cobalt removal with antimony trioxide and zinc powder in zinc hydrometallurgical process[J]. China Nonferrous Metallurgy, 2005, 2(1): 22-23.
[5] 吴健辉, 李义兵, 林泓富. 湿法炼锌溶液净化β-萘酚除钴的研究[J]. 中国有色冶金, 2008(1): 24-26.
WU Jian-hui, LI Yi-bing, LIN Hong-fu. Study on removing cobalt by β-naphthol in solution purification for zinc hydrometallurgy[J]. China Nonferrous Metallurgy, 2008(1): 24-26.
[6] 王鸿振, 吴 筱. 砷盐净化工艺的研究[J]. 中国有色冶金, 2011(3): 21-23.
WANG Hong-zhen, WU Xiao. Study on process of solution purification by As2O3[J]. China Nonferrous Metallurgy, 2011(3): 21-23.
[7] 张秉青. 硫酸锌溶液净化工艺改造实验[J]. 有色冶炼, 2000(4): 12-13.
ZHANG Bing-qing. Modification of zinc sulfate solution purification process[J]. Non-Ferrous Smelting. 2000(4): 12-13.
[8] 蒋学先, 唐 罡, 何贵香. 硫酸锌溶液锑盐净化工艺改造实践[J]. 有色金属: 冶炼部分, 2010(4): 22-24.
JIANG Xue-xian, TANG Gang, HE Gui-xiang. Reconstruction practice of the purification process for zinc sulfate solution with antimony trioxide [J]. Nonferrous Metals: Extractive Metallurgy, 2010(4): 22-24.
[9] 曾桂生, 谢 刚. 高钴硫酸锌溶液中锌粉净化除钴的机理[J]. 中国有色金属学报, 2008, 18(1): 117-120.
ZENG Gui-sheng, XIE Gang. Mechanism of cobalt removal from high cobalt zinc sulphate solution with zinc powder[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(1): 117-120.
[10] OWUSU G. Oxidation-precipitation of Co from Zn-Cd-Co-Ni sulphate solution using Caro's acid[J]. Hydrometallurgy, 1998, 48: 91-99.
[11] CALZADO L E, GOMEZ C O, FINCH J A. Nickel recovered from solution by oxidation using ozone: some physical properties[J]. Mineral Engineering, 2005, 18: 537-543.
[12] TIAN Qing-hua, GUO Xue-yi, YI Yu, LI Zhi-hai. Kinetics of oxidation-precipitation of cobalt (Ⅱ) from solution by ozone[J]. Transactions of Nonferrous Metals Society of China, 2010, 20(S1): s42-s45.
[13] 黄可龙. 无机化学[M]. 北京: 科学出版社, 2007: 547-551.
HUANG Ke-long. Inorganic chemistry[M]. Beijing: Science Press, 2007: 547-551.
[14] BARRIGA-ORDONEZ F, NAVA-ALONSO F, URIBE-SALAS A. Cyanide oxidation by ozone in a steady-state flow bubble column[J]. Minerals Engineering, 2006, 19: 117-122.
[15] MU?OZ F, VON SONNTAG C. Determination of fast ozone reaction in aqueous solution by competition kinetics[J]. The Royal Society of Chemistry, 2000, 2: 661-664.
[16] ROTH J A, SULLIVAN D E. Solubility of ozone in water[J]. Industrial & Engineering Chemistry, Fundamentals, 1981, 20: 137-140.
(编辑 龙怀中)