网络首发时间: 2017-09-20 14:38
稀有金属 2018,42(09),996-1001 DOI:10.13373/j.cnki.cjrm.xy17080008
直接乙醇燃料电池阳极催化剂Pt-SnO2/C的制备及性能表征
郭瑞华 景晓环 安胜利 张捷宇 周国治
上海大学材料科学与工程学院
内蒙古科技大学材料与冶金学院
内蒙古自治区先进陶瓷材料与器件重点实验室
摘 要:
采用水热反应法来制备不同浓度及不同反应时间的碳球, 以葡萄糖为反应原料, 在未添加任何模板剂的条件下, 制备了尺寸可控的中空碳球为催化剂载体, 加入自制的SnO2为助剂, 运用微波辅助乙二醇还原氯铂酸法合成催化剂。利用扫描电镜 (SEM) 对所制备的碳球载体进行了表征, 利用电化学工作站对所制备的催化剂进行了电化学性能测试。结果表明, 碳球随葡萄糖溶液浓度的增长, 碳球的粒径随之增大, 其中0. 5 mol·L-1, 4 h的碳球分散性最好, 且粒径尺寸较小约为0. 62μm;同时碳球随反应时间的增加, 粒径增大, 但反应时间过长会出现焦结粘着现象, 从而降低催化剂的催化氧化性能;加入助剂SnO2合成的催化剂可显著提高乙醇的催化氧化的活性, 稳定性和抗中毒能力。
关键词:
碳球;直接乙醇燃料电池;Pt-SnO2/C催化剂;
中图分类号: O643.36;TM911.4
作者简介:郭瑞华 (1978-) , 女, 内蒙古四子王旗人, 硕士, 副教授, 研究方向:燃料电池关键材料及稀土氧化物制备研究;电话:13484725918;E-mail:grh7810@163.com;
收稿日期:2017-08-05
基金:国家自然科学基金项目 (51474133);内蒙古自治区自然科学基金项目 (2018LH02006);内蒙古科技大学材料与冶金学院青年人才孵化器平台资助项目 (2014CY012) 资助;
Preparation and Characterization of Anodic Catalyst Pt-SnO2/C for Direct Ethanol Fuel Cells
Guo Ruihua Jing Xiaohuan An Shengli Zhang Jieyu Zhou Guozhi
School of Materials Science and Engineering, Shanghai University
School of Materials and Metallurgy, Inner Mongolia University of Science and Technology
Inner Mongolia Key Laboratory of Advanced Ceramic Materials and Devices
Abstract:
Hydrothermal reaction method was used to prepare carbon spheres with different concentrations and different reaction time.Glucose was used as the reaction material. Without any templating agent, hollow carbon spheres with controllable size were prepared as catalyst carrier, and self-made SnO2 as co-catalyst was added to synthesize catalysts by microwave-assisted ethylene glycol reduction of chloroplatinic acid method. The prepared carbon spheres were characterized by scanning electron microscopy (SEM) . The electrochemical properties of the prepared catalysts were tested by electrochemical workstation. The results showed that the diameter of carbon spheres increased with the concentration of glucose solution. Among them, 0. 5 mol·L-1, 4 h carbon spheres had the best dispersibility and its particle size was smaller about 0. 62 μm. At the same time, the size of carbon spheres increased with reaction time, but if the reaction time was too long, coking adhesion phenomenon would occur and catalytic oxidation performance of catalysts would be reduced. The synthetic catalysts by adding SnO2 could significantly increase the catalytic oxidation activity, stability and resistance to poisoning of ethanol.
Keyword:
carbon spheres; direct ethanol fuel cells; Pt-SnO2/C catalysts;
Received: 2017-08-05
燃料电池是一类将燃料和氧化剂的化学能直接转化为电能的新型高效的发电装置[1], 而且具有发电效率高、绿色环保、辐射低、成本低、稳定性强和工作噪声低等优点[2]。乙醇分子具有广泛的来源, 可再生, 价格便宜, 结构简单, 没有毒性和渗透率低以及理论能量密度高等优点, 因此研究直接乙醇燃料电池 (DEFC) 逐渐成为燃料电池探索的热点话题[3]。DEFC的研究与发展对能源短缺以及环境保护等问题的解决有着重要的意义, 而且在可移动电源设备中有着广泛的潜在应用, 原因是其便携, 易于操作的优点, 如在手机、笔记本电脑等电子产品中的应用[4,5]。但是, 目前对DEFC的研究尚未取得重大突破, 其原因是:首先, 电极动力学过程进行得较为缓慢, 使得Pt电极表面的活性位被反应副产物 (类CO物种) 占据, 从而产生了中毒的现象。其次, 乙醇分子中的C-C键断裂较为困难, 所以其充分氧化成为CO2的12电子迁移过程较难进行, 从而使乙醇的氧化效率较低[6]。再次, 目前对乙醇催化氧化所使用的电极材料主要是Pt及Pt基材料[7,8], 但Pt属于贵金属, 并且Pt催化剂的催化效率不高, 使得DEFC走向商业化更为困难[9,10]。因此, 对具有高催化活性, 抗CO中毒能力强, 制造成本较低的一系列新型电极催化剂的探究是直接乙醇燃料电池技术进步的关键[11]。为了获得对乙醇催化氧化具有高稳定性、高活性及高抗中毒能力的催化剂, 科研人员通过加入充当催化剂载体的金属氧化物, 得到了新型电催化剂[12]。SnO2由于具有一些特有的优良性质, 得到了科研人员们的广泛关注。本文主要通过对碳球添加助剂SnO2和负载Pt金属粒子制备得到催化剂, 并对其进行表征和分析, SnO2助剂是一种重要的宽带隙型半导体材料[13], SnO2的作用是使水吸附解离[14], 同时提供OHads基团, 和Pt吸附的CO发生反应得到CO2, 提高Pt活性。因此, 将Pt金属和SnO2镀到碳球的外层, 形成核壳结构[15], 使其可以作为载体或催化剂在催化氧化反应中发挥其独有的作用。
1 实验
1.1 碳球制备
配制浓度分别为0.5和1.0mol·L-1的葡萄糖溶液。将配制好的葡萄糖溶液放入到反应釜, 并放入鼓风干燥箱, 在180℃的温度下加热4和6 h。待反应釜冷却至室温, 进行离心, 呈现分层现象, 碳球会沉积到底部, 用去离子水反复洗涤。最后, 将离心后的物质在干燥箱80℃下干燥, 碳球反应条件如表1。
1.2 Pt-SnO2/C催化剂的制备
将SnCl2·2H2O与乙二醇溶液超声混合30 min, 然后加入5.0 ml的去离子水, 再超声5 min混合均匀, 微波5 min, 得到含有SnO2的混合溶液。将制备得到的含有SnO2的溶液与所制备的碳球充分超声混合均匀, 搅拌12 h, 然后进行抽滤, 在80℃下干燥得到SnO2/C的复合载体。向含有25 ml乙二醇的100 ml烧杯中, 加入H2Pt Cl6溶液。再称取SnO2/C复合载体加入其溶液, 然后超声混合30 min, 使其充分分散均匀, 滴加适量的NaOH溶液, 调节溶液的p H值至10, 再次超声混合30 min, 使混合物分散均匀。将浆料放到微波炉中加热20 s, 停10 s, 重复6次。微波完成后将其取出冷却至室温, 然后进行抽滤, 用蒸馏水洗涤到没有Cl-离子。在80℃下干燥得到Pt-SnO2/C催化剂, 四组催化剂反应条件如表1。
表1 四组催化剂反应条件Table 1 Reaction conditions of four kinds of catalysts 下载原图
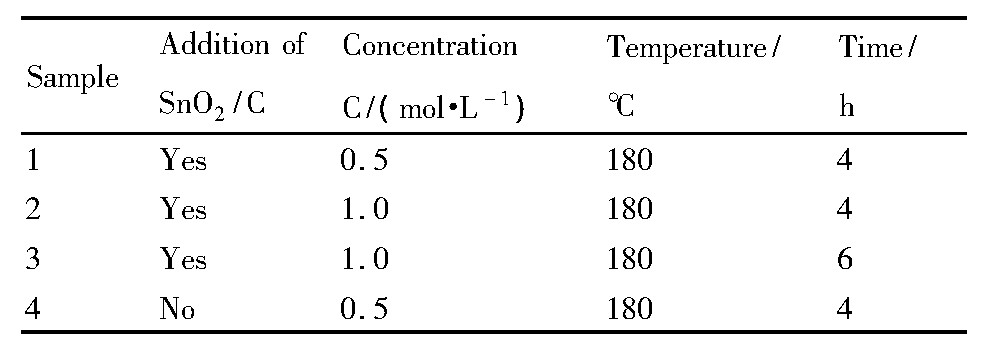
表1 四组催化剂反应条件Table 1 Reaction conditions of four kinds of catalysts
四组催化剂Pt载量分别为样品1:4.3mg·cm-2;样品2:3.1 mg·cm-2;样品3:2.6mg·cm-2;样品4:1.2 mg·cm-2。
1.3 性能表征
运用上海中科鑫欣国际贸易有限公司生产的热场发射扫描电镜Apollo300 (SEM) , 对碳球进行电镜扫描, 分析碳球性能。运用荷兰生产的IVIUM电化学工作站, 进行循环伏安测试、H吸附脱附测试、计时安培测试和CO循环伏安曲线测试, 测试使用三电极体系, 铂丝对电极, 饱和甘汞电极为参比电极和电位均相对于饱和的甘汞电极, 在测试之前向所用溶液中通入N2约为30 min, 排出多余O2。
2 结果与讨论
2.1 碳球制备结果与分析
图1是不同条件下制备的碳球SEM图。如图1, 通过水热反应制备的碳球没有杂质, 且在0.5 mol·L-1, 4 h的条件下所制备的碳球分散度和均匀性最佳, 粘结程度最低。1.0 mol·L-1, 4 h次之, 1.0 mol·L-1, 6 h碳球之间粘结比较严重。因此, 相较之下0.5 mol·L-1, 4 h的碳球最适宜做催化剂载体。

图1 不同条件下制备的碳球SEM图Fig.1 SEM images of carbon spheres prepared under different conditions (a) 0.5 mol·L-1, 4 h; (b) 1.0 mol·L-1, 4 h; (c) 1.0 mol·L-1, 6 h
图2为碳球粒径分布图。由图2可知, 0.5 mol·L-1, 4 h的碳球平均粒径为0.62μm;1.0 mol·L-1, 4 h的碳球平均粒径为0.71μm;1.0 mol·L-1, 6 h的碳球平均粒径为0.85μm。可以看出, 随葡萄糖溶液的浓度或者反应时间的增加, 碳球的平均粒径均会随之增大。综上所述, 0.5 mol·L-1, 4 h条件下制备的碳球平均尺寸最小且粒径分布最均匀, 分散度最佳, 适合做催化剂的载体材料。
2.2 Pt-SnO2/C催化剂特性的表征
Pt-SnO2/C催化剂的循环伏安表征:图3是在室温下测试的四组催化剂在0.5 mol·L-1H2SO4+1.0 mol·L-1C2H5OH中的循环伏安曲线, 扫描速度为50m V·s-1, 电位范围在0.05~1.20 V之间。四组催化剂都有两个正扫方向的氧化峰和一个负扫方向的氧化峰, 两个正扫方向的氧化峰 (峰1和峰2) 是因为乙醇氧化而出现的, 负扫方向的氧化峰 (峰3) 由于反应中的中间氧化产物 (如COads) 继续氧化而出现的。在0~0.4 V电流密度出现了小幅上升;在0.4~0.7 V之间出现了电流密度峰值, 但在0.7~0.8 V又出现了小幅下降, 原因是催化剂产生了表面氧化物, 占据了有效活性位, 使得电流密度降低;在0.9~1.1 V之间又出现了电流密度峰值, 在电位的负扫区域, 开始扫描的区域的表面氧化物被还原, 再次出现了氧化峰。氧化峰 (峰2) 的电流密度值常作为衡量乙醇催化氧化的指标[16]。样品1的氧化峰电流密度值最高, 达到了285A·g-1, 各催化剂氧化峰值排序为:样品1>样品2>样品3>样品4, 说明样品1的制备工艺最佳, 催化性能好, 微观粒径小, 分散性好, 催化氧化性能好, 另外, 虽然样品4催化剂载体碳球的综合性能最好, 但其峰电流值最小为53 A·g-1。其原因是SnO2的加入解离吸附水, 生成OHads基团, 与Pt吸附的CO等中间产物反应, 产生CO2, 从而Pt的活性位被释放, 减少催化剂中毒。
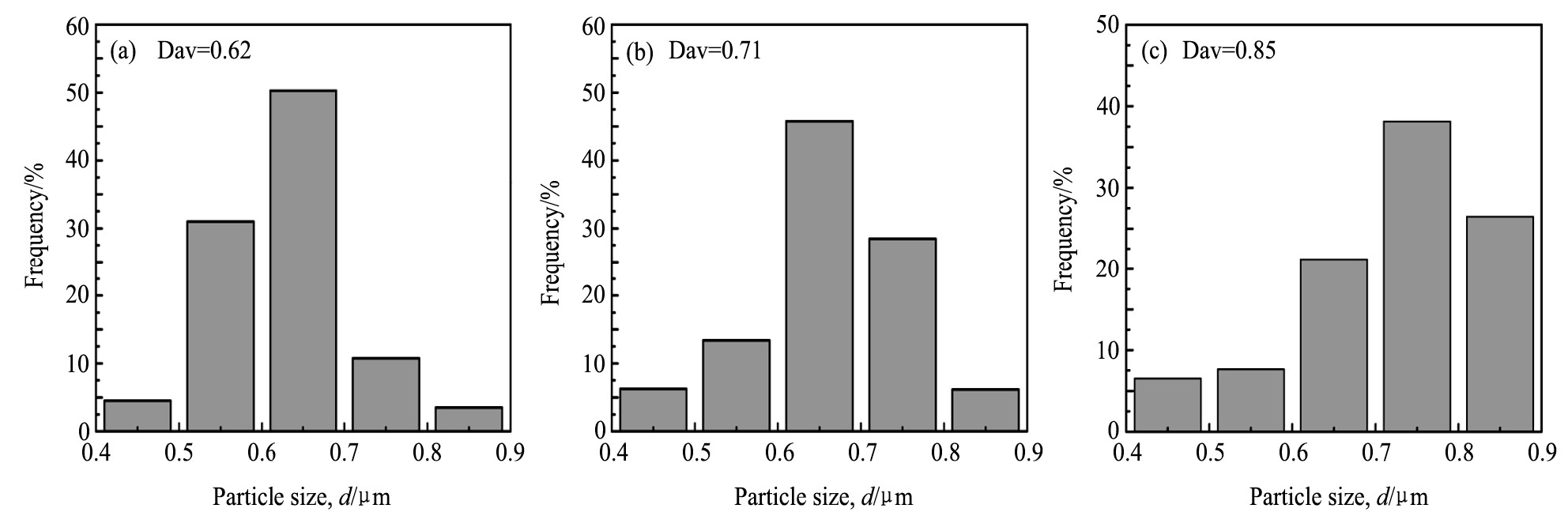
图2 碳球的粒径分布图Fig.2 Particle size distribution of carbon spheres
(a) 0.5 mol·L-1, 4 h; (b) 1.0 mol·L-1, 4 h; (c) 1.0 mol·L-1, 6 h
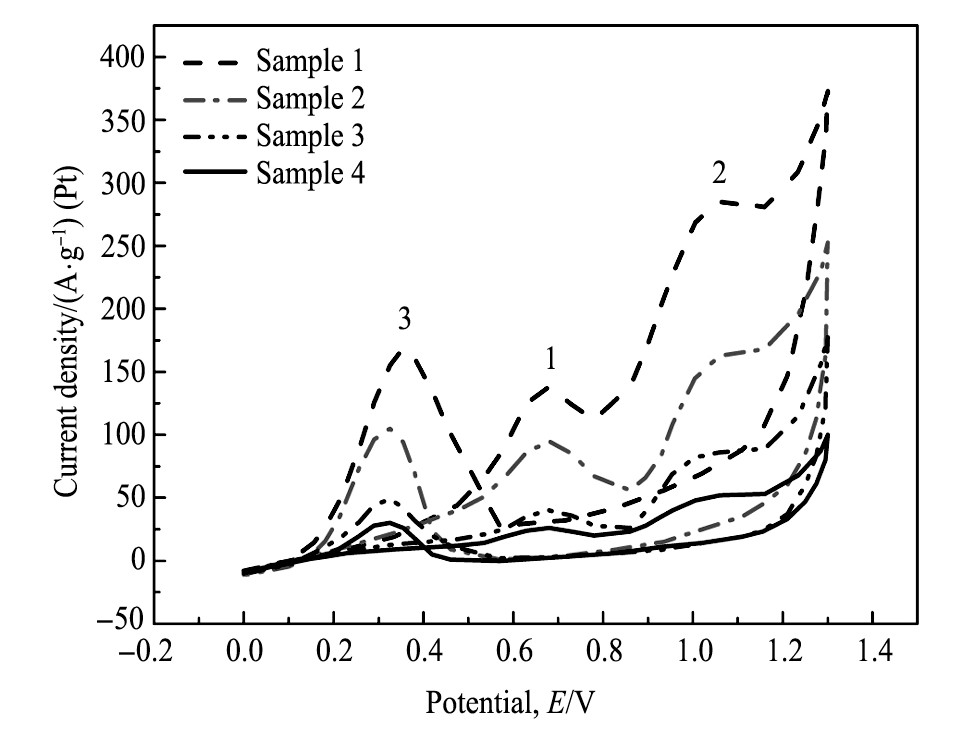
图3 不同浓度碳球制备的催化剂在0.5 mol·L-1H2SO4+1.0 mol·L-1C2H5OH中的循环伏安曲线Fig.3Cyclic voltammetric curves of Pt-SnO2/C catalyst pre-pared with different carbon concentrations in 0.5 mol·L-1H2SO4+1.0 mol·L-1C2H5OH
Pt-SnO2/C催化剂的氢吸附脱附表征:图4是在室温下测试的不同浓度碳球制备的催化剂在饱和N2的0.5 mol·L-1H2SO4溶液中的H吸附曲线, 扫描速度为50 m V·s-1, 电位范围在-0.3~0.6 V之间。电化学的活性面积是衡量催化剂电化学活性的重要指标[17], 扣除双层电容的影响, 通过积分计算四组催化剂的活性面积分别为样品1:101.2 m2·g-1;样品2:85.3 m2·g-1;样品3:64.6m2·g-1;样品4:32.1 m2·g-1, 排列次序是样品1>样品2>样品3>样品4, 说明活性面积越大表明H吸附脱附能力越强, 催化剂的反应活性位点越多, 进而表明电化学活性会相对更高, 催化剂的催化氧化性能更强, 因此样品1的催化氧化性能最强, 原因是碳球是通过葡萄糖的缩水聚合而形成的, 随着葡萄糖浓度的增大或水热反应时间的增长, 形成碳球的葡萄糖溶液消耗完后就会使各碳球之间产生粘着现象, 并随着碳球粒径增大, 碳球表面缺陷密度及比表面积降低, 就会使得碳球对Pt纳米粒子的吸附能力显著降低, 同时催化剂的电化学活性表面积也会降低。
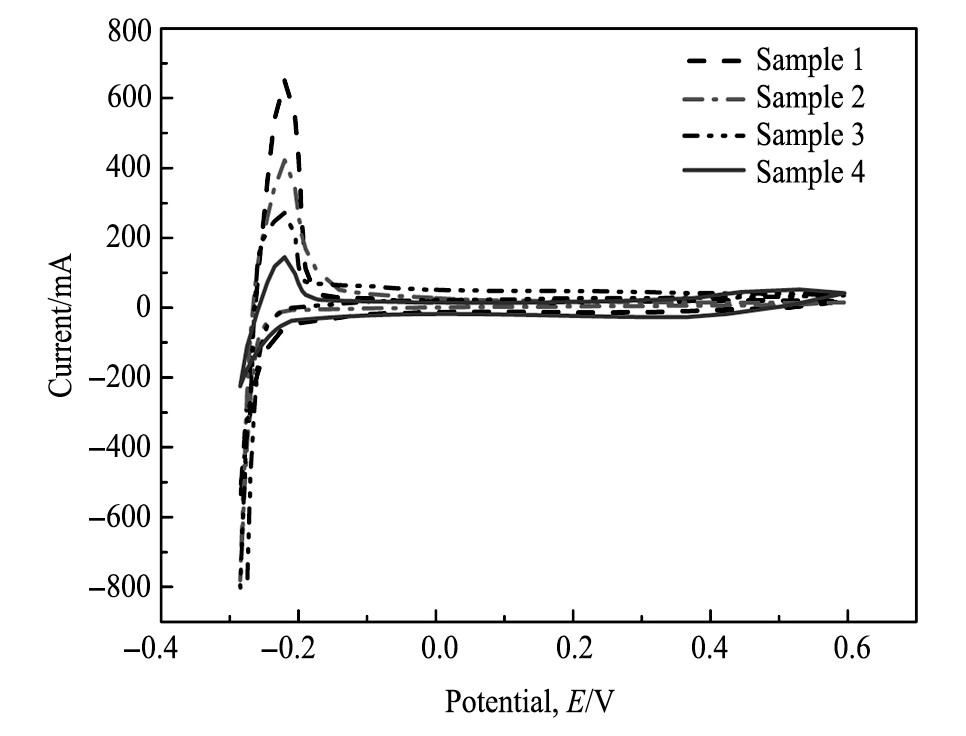
图4 不同浓度碳球制备的Pt-SnO2/C催化剂在0.5 mol·L-1H2SO4中的H吸附曲线Fig.4 H absorption curves of Pt-SnO2/C catalyst prepared with different carbon concentrations in 0.5 mol·L-1H2SO4
Pt-SnO2/C催化剂的i-t曲线的表征:图5是在室温下测试的不同浓度碳球制备的催化剂在饱和N2的0.5 mol·L-1H2SO4+1 mol·L-1C2H5OH中的i-t计时电流曲线, 测试初始电位是0.05 V, 测试电位为0.6 V, 时间为1000 s。四组催化剂的计时电流曲线在刚开始5 s前电流值都较大, 分别为样品1:288 A·g-1;样品2:190 A·g-1;样品3:144A·g-1;样品4:90 A·g-1。但随时间t的增加计时电流曲线都开始快速下降达到稳定, 1000 s秒时电流密度仅为18 A·g-1, 这可能是在电催化氧化中, 中间生成物 (COads) 使得催化剂出现了中毒现象, 因此可通过对比该时间条件下的电流密度值来判断催化剂稳定性及抗中毒能力。稳态时的电流密度分别为样品1:18.1 A·g-1;样品2:12.3 A·g-1;样品3:9.2 A·g-1;样品4:5.1 A·g-1, 顺序为样品1>样品2>样品3>样品4。并且可以看出, 加入SnO2助催化剂的样品1, 2和3的稳态电流密度均比未添加SnO2的样品4高, 说明Sn O2助催化剂可增强催化剂的稳定性, 同时提高对乙醇的催化氧化性。综上, 样品1催化剂对乙醇催化氧化的稳态电流密度最高, 其电流密度衰减的趋势最小, 对乙醇催化氧化的稳定性以及抗中毒能力最佳, 因此与乙醇循环伏安曲线所测试的实验结果基本一致。
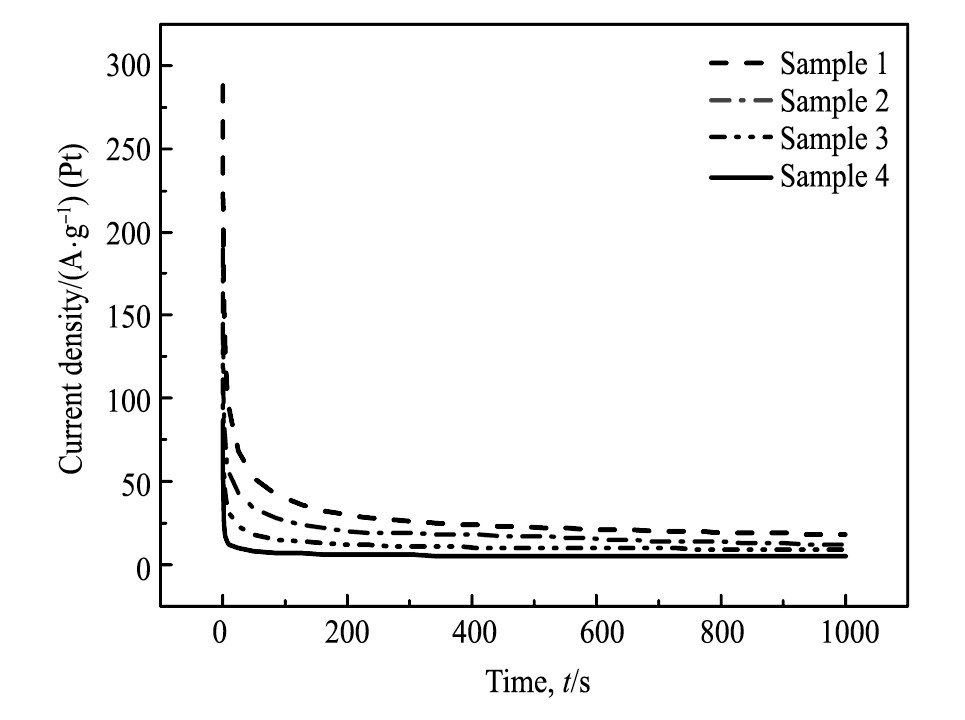
图5 不同浓度碳球制备的Pt-SnO2/C催化剂在0.5 mol·L-1H2SO4+1.0 mol·L-1C2H5OH中的i-t计时电流曲线Fig.5 i-t curves of Pt-SnO2/C catalyst prepared with different carbon concentrations in 0.5 mol·L-1H2SO4+1.0mol·L-1C2H5OH
Pt-SnO2/C催化剂的CO循环伏安曲线的表征:图6是在室温下测试的不同浓度催化剂在0.5mol·L-1的H2SO4溶液中的CO循环伏安曲线, 测试过程的扫描速度为50 m V·s-1, 电位范围在0.0~1.0 V。因为Pt/C催化剂在对乙醇的催化氧化过程中产生COads中间产物, 占据了Pt纳米粒子表面的活性位点, 从而降低了催化剂的催化氧化性能。所以制备的新型催化剂应具有优良的抵抗COads中间产物中毒的性能, 催化剂的电流密度越高, 抗中毒能力就会越强。CO循环伏安测试属于循环伏安测试法, 共进行2圈测试, 第一圈表示吸附的CO的氧化结果, 第二圈表示CO被氧化后的电极循环伏安曲线。如图6所示, 四组催化剂的电流密度分别为:样品1:141 A·g-1;样品2:112 A·g-1;样品3:96 A·g-1和样品4:72 A·g-1, 电流密度排序为:样品1>样品2>样品3>样品4;起始电位值分别为:样品1:0.425 V;样品2:0.460 V;样品3:0.485 V;样品4:0.550 V, 起始电位值排序分别为:样品1<样品2<样品3<样品4。因此, 起始电位值越小, 电流密度越大, 催化剂的抗中毒能力越强。同时, 碳球的制备条件不同对催化剂的抗中毒能力有一定影响, 由电流密度样品1>样品2可知, 在相同水热反应时间的条件下, 碳球粒径越小, 电催化剂的抗中毒能力越强;由电流密度样品2>样品3可知, 碳球制备的水热反应时间越短, 电催化剂的抗中毒能力越强。同时, 样品1, 2和3催化剂中Sn O2助剂的加入, 使其起始电位都比样品4催化剂要小, 说明SnO2的加入使低电位处的CO被氧化, 而且增加了活性位点的释放, 提高了催化剂的催化氧化性能。综上所述, 样品1催化剂抗CO中毒能力最强, 具有最佳的催化氧化性能, 与上述实验结果相吻合。
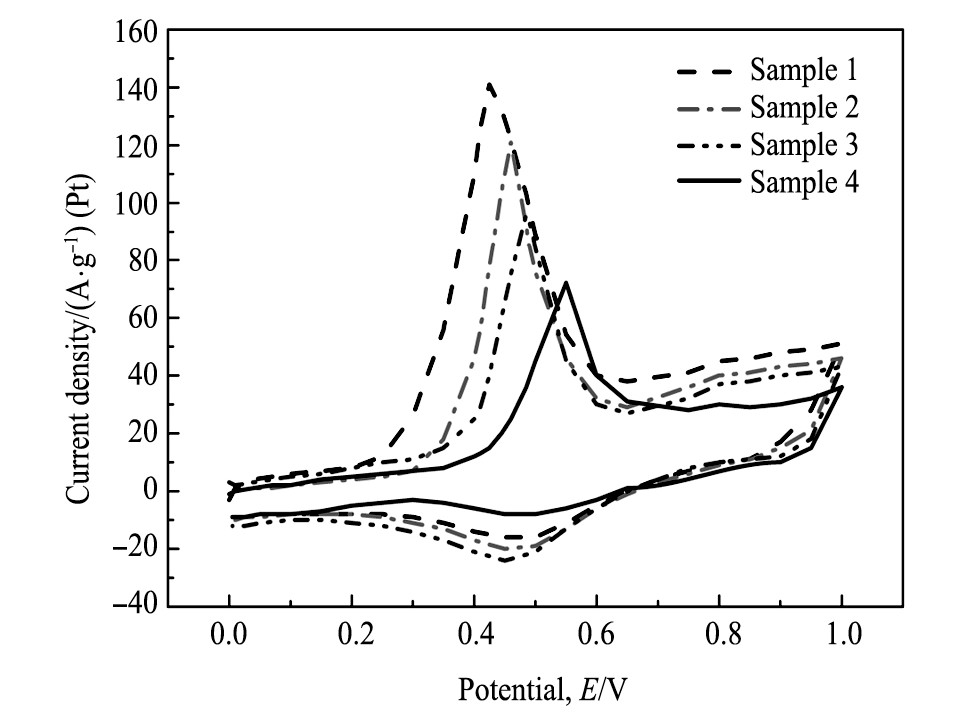
图6 不同浓度的碳球制备的Pt-Sn O2/C催化剂在0.5 mol·L-1H2SO4中的CO循环伏安曲线Fig.6 CO cycle volt-ampere curves of Pt-SnO2/C catalyst pre-pared with different carbon concentrations in 0.5mol·L-1H2SO4
3 结论
1.通过水热反应制备的各浓度的碳球, 加热温度及时间相同的情况下, 葡萄糖溶液浓度越高制备的碳球粒径尺寸就会越大。加热时间太短的话, 不会形成碳球或者碳球分散性不好, 粒径尺寸差异大;但如果加热时间太长, 所制备的碳球就会发生粘结现象, 都会影响碳球作为催化载体的性能。
2.通过电化学工作站对催化剂测试乙醇循环伏安曲线 (CV) 、H吸附脱附曲线、计时电流曲线 (i-t) 和CO循环伏安曲线的测试实验表明:0.5mol·L-1, 4 h Pt-SnO2/C催化剂电催化氧化性最佳, 乙醇循环伏安值为285 A·g-1, 且SnO2的添加, 使催化剂的电催化氧化性能明显提高, 原因是SnO2解离吸附水分子, 形成OHads基团, OHads可以祛除Pt邻近活性位上COads等中间生成物, 使Pt活性位被释放, 提高催化剂的催化氧化性及抗CO中毒的能力。
参考文献
[1] Zhao X L, Han M F. Study on catalysts for proton exchange membrane fuel cells[J]. Rare Metal Materials and Engineering, 2007, 36 (S2) :645. (赵晓林, 韩敏芳.质子交换膜燃料电池催化剂研究[J].稀有金属材料与工程, 2007, 36 (S2) :645.)
[2] Wang X H, Yuan S M, Zhu Y, Ni H J. Preparationand performance research of Pt Sn catalyst supported on carbon fiber for direct ethanol fuel cells[J]. Journal of Fuel Chemistry and Technology, 2012, 40 (12) :1454. (王旭红, 袁善美, 朱昱, 倪红军.碳纤维基Pt Sn催化剂直接乙醇燃料电池制备及性能研究[J].燃料化学学报, 2012, 40 (12) :1454.)
[3] Ermete A. Catalysts for direct ethanol fuel cells[J].Journal of Power Sources, 2007, 170 (13) :1.
[4] Wang X H, Zhu H, Huang J S, Ji W J, Luo X Q.Performance of carbon fiber supported Pt-SnO2anode catalyst for direct ethanol fuel cells[J]. Journal of Fuel Chemistry and Technology, 2014, 42 (6) :763. (王旭红, 朱慧, 黄金山, 纪网金, 骆秀淇.新型碳纤维负载直接乙醇燃料电池Pt-SnO2阳极催化剂的性能研究[J].燃料化学学报, 2014, 42 (6) :763.)
[5] Li L, Yuan X X, Xia X Y. Effect of Mo doping on catalytic oxidation performance of Pt/C catalyst for ethanol oxidation[J]. Journal of Inorganic Materials, 2014, 29 (10) :1044. (李琳, 原鲜霞, 夏小芸. Mo掺杂对Pt/C催化剂乙醇氧化催化性能的影响[J].无机材料学报, 2014, 29 (10) :1044.)
[6] Silva M D'Villa, Sim7es F C, Souza R F D, Santos M C. Comparative studies of oxygen reduction reaction and ethanol oxidation reaction on Pt Sn/C and Pt Ni/C catalysts[J]. ECS Trans., 2011, 41 (1) :1299.
[7] Cai Z Q, Zhang M, Meng Y Y. Electrocatalytic oxidation of ethanol by Pt nanoparticles Pd nanowire composite[J]. Chemical Research and Application, 2014, (4) :572. (蔡志泉, 张敏, 孟煜阳. Pt纳米粒子Pd纳米线复合材料对乙醇的电催化氧化研究[J].化学研究与应用, 2014, (4) :572.)
[8] Zhu Y, Zhou Y Q, Wei J D, Zhang Y, Ni H J. Research progress of electrocatalysts for direct ethanol fuel cells[J]. Modern Chemical Industry, 2016, (4) :18. (朱昱, 周燕琴, 魏金栋, 张宇, 倪红军.直接乙醇燃料电池电催化剂研究进展[J].现代化工, 2016, (4) :18.)
[9] Wang Y Z, Wang Y. Preparation of Pt-Sn/graphene catalysts and their activities for ethanol electrooxidation in polyol synthesis[J]. New Carbon Materials, 2014, 29 (3) :231. (王永祯, 王勇.不同p H值下Pt-Sn/石墨烯复合材料的电催化性能[J].新型炭材料, 2014, 29 (3) :231.)
[10] Liu P, Lin S J, Yang M L, Chen Y J, Zhang M, Chen F L. Preparation of silver-palladium fractal composite for ethanol electro-oxidation in alkaline media[J]. Chinese Journal of Rare Metals, 2017, 41 (6) :635. (柳鹏, 林顺蛟, 杨明龙, 陈粤佳, 张敏, 程发良.枝状银-钯复合材料的制备及电催化氧化乙醇性能研究[J].稀有金属, 2017, 41 (6) :635.)
[11] Zhu M Y, Sun G Q, Li H Q. Effect of the Sn (II) /Sn (IV) redox couple on the activity of Pt Sn/C for ethanol electro-oxidation[J]. Chinese Jounal of Catalysis, 2008, 29 (8) :765.
[12] Surbhi S, Bruno G P. Support materials for PEMFC and DMFC electrocatalysts[J]. Journal of Power Sources, 2012, 208 (2) :96.
[13] Zhang X W. Study on Novel Anode Catalysts for Direct Ethanol Fuel Cells[D]. Beijing:Beijing Jiaotong University, 2011. 35. (张新卫.直接乙醇燃料电池新型阳极催化剂的研究[D].北京:北京交通大学, 2011. 35.)
[14] Wang M. Preparation and Electrochemical Properties of Carbon Spheres and Sn O2Hollow Spheres[D]. Dalian:Dalian University of Technology, 2013. 12. (王萌.碳球与Sn O2空心球的制备及其电化学性能研究[D].大连:大连理工大学, 2013. 12.)
[15] Li G L, He T, Li X M. Preparation and application of core-shell nanocomposites[J]. Progress in Chemistry, 2011, 23 (6) :1081. (李广录, 何涛, 李雪梅.核壳结构纳米复合材料的制备及应用[J].化学进展, 2011, 23 (6) :1081.)
[16] Zhou Y, Gao Y F, Liu Y C, Liu J R. High efficiency Pt-CeO2/CNTs hybrid composite as an anode electrocatalyst for direct methanol fuel cells[J]. Journal of Power Sources, 2010, 195 (6) :1605.
[17] Sogaard M, Odgaard M, Skou E M. An improved method for the determination of the electrochemical active area of porous composite platinum electrodes[J]. Solid State Ionics, 2017, 145 (1) :31.