穗花杉双黄酮罗伯斯特双黄酮质谱裂解特征研究
黎霜1, 2,黄可龙1,钟明1,鲁曼霞1
(1. 中南大学 化学化工学院,湖南 长沙,410083
2. 桂林电子科技大学 生命与环境科学院,广西 桂林,541004)
摘要:采用负离子检测模式下的电喷雾多级串联质谱(ESI-MS)方法对穗花杉双黄酮和罗伯斯特双黄酮的质谱行为进行研究,讨论C3′—C8″与C3′—C6″连接的双黄酮类化合物结构特征与质谱裂解行为之间的异同。实验结果表明:2种C—C连接的双黄酮类化合物在相同的质谱条件下均可以在C环发生0,4键断裂,生成质荷比m/z=375的碎片离子。此离子峰为C—C连接的双黄酮类化合物共有的特征离子峰;但是由于C—C连接位置的不同,这一对同分异构体的裂解途径也存在着明显差异。C3′—C6″连接的罗伯斯特双黄酮,由于空间构型的影响,在质谱条件下,C4′位的羟基更易于与C5″或者C7″位上的羟基发生分子内脱水,生成丰度响应值较高的碎片离子m/z为519和309。这2个碎片离子是罗伯斯特双黄酮的特征碎片离子,可用于区分穗花杉双黄酮和罗伯斯特双黄酮。
关键词:穗花杉双黄酮;罗伯斯特双黄酮;ESI-MS;质谱裂解特征
中图分类号:R917 文献标志码:A 文章编号:1672-7207(2012)04-1244-05
Fragmentation pathways of amentoflavone and robustaflavone using ESI-MS
LI Shuang1, 2, HUANG Ke-long1, ZHONG Ming1, LU Man-xia1
(1. School of Chemistry and Chemical Engineering, Central South University, Changsha 410083, China;
2. School of Life and Environmental Science, Guilin University of Electronic Technology, Guangxi 541004, China)
Abstract: Amentoflavone and robustaflavone were investigated by negative ion electrospray ionization tandem mass spectrometry (ESI-MS). The relationship between their structural features and the corresponding characteristic ions fragmentation behavior was discussed. The results show that bi-flavonoid linkage of C3′—C8″and C3′—C6″ has the same fragmentation pathways. Under the condition of bi-flavonoid linkage, the bond of C-ring breaks at 0, 4 positions, and then gives the principal fragment ion at m/z=375 by losing of neutral species. For amentoflavone and robustaflavone, the positions at m/z=375 in MS spectrum may belong to the characteristic fragment ion. However, there are different fragmentation pathways because of the difference of the position of C—C linkage between amentoflavone and robustaflavone. C3′—C6″linkage may induce the changes in stereostructure. The dehydration will be easy between C4′—OH and C5″—OH or C4′—OH and C7″′—OH. For robustaflavone, the m/z=519 and m/z=309 are the characteristic ions, which may be used to distinguish between amentoflavone and robustaflavone.
Key words: amentoflavone; robustaflavone; ESI-MS; fragmentation pathway
卷柏属植物由于其良好的药理作用,引起了国内外研究者极大的兴趣,对其化学成分进行了较深入研究[1-2]。研究表明,卷柏属植物中含有大量的双黄酮类化合物,是该属植物具有药理活性的物质基础。自1971年Okigawa等[3]从卷柏 (S.tamariscina)中分离出穗花杉双黄酮(amentoflavone)、异柳杉双黄酮(isoeryptomixin)、扁柏双黄酮(hinokiflavone)、苏铁双黄酮(sotetsuflavone及芹菜素共5个黄酮类化合物以来,人们已经从卷柏属植物中分离得到30多个双黄酮类化合物[4-8]。双黄酮类化合物由于其独特的化学结构而获得越来越多的关注。本课题组在对深绿卷柏和兖州卷柏的研究中分别获得穗花杉双黄酮,罗伯斯特双黄酮(robustaflavone)2个双黄酮化合物单体;这2个化合物均为芹菜素的二聚体。二者之间的区别在于2个芹菜素之间连接方式不同:穗花杉双黄酮通过 Ⅰ3′—Ⅱ8″连接,而罗伯斯特双黄酮则通过Ⅰ3′—Ⅱ6″连接。连接方式不同造成2个化合物药理活性存在明显差异[9]。但是,由于二者之间结构的相似性,很难用简单的方法将它们区别开来;特别是这2个化合物同时存在时,将2种化合物分别定性更加困难。一些研究者对黄酮类化合物质谱裂解规律进行了研究。Xu等[10]根据大豆黄酮苷元和大豆异黄酮苷元在电喷雾-离子阱-飞行时间串联质谱负离子模式下的质谱数据,总结了2类化合物C环上的裂解规律,提出了黄酮化合物的交叉共轭体系和异黄酮的非交叉共轭体系对C环的裂解影响较大,而且黄酮化合物的B环和异黄酮化合物的A,B环上取代基的类型和位置对生成碎片离子的稳定性也有影响。Colovic等[11]报道了C3—C8″ 连接的Biapigenin 正离子模式下的裂解特征。 de Daniel等[12-13]也对C—O—C连接的7,7″—O—dimethyllanaraflavone和 Lonoflavone等双黄酮化合物的质谱裂解特征进行报道。Lin等[7-8]研究了穗花杉双黄酮和罗伯斯特双黄酮的质谱碎片特征。但是尚未有关于穗花杉双黄酮和罗伯斯特双黄酮质谱裂解规律的报道。鉴于液相色谱-质谱联用技术在对卷柏属植物中穗花杉双黄酮的定性定量研究的广泛应用[14-15],对于双黄酮类化合物的质谱裂解规律的研究就显得尤为重要。本文作者应用LC-ESI/MS质谱仪在负离子模式下对穗花杉双黄酮和罗伯斯特双黄酮质谱裂解特征进行研究。
1 试验
1.1 仪器
仪器为:Finnigan LCQ DECA XP高效液相色谱-质谱联用仪(美国Thermo Quest Finnigan公司生产)包括HPLC系统;P4000 四元泵;UV 6000 LP二极管阵列检测器(DAD);电喷雾电离( ESI)接口。
1.2 材料与试剂
穗花杉双黄酮和罗伯斯特双黄酮均为本实验室从兖州卷柏中分离并纯化所得。乙腈为色谱纯,德国默克公司生产。
1.3 试验方法和条件
取适量样品溶解于甲醇中,在负离子模式下,采用直接进样法进行电喷雾质谱分析。离子源温度为110 °C;脱溶剂气(N2)流速为350 L/h;锥孔气(N2)流速为50 L/h;毛细管电压为3.0 kV;m/z(质荷比)为100~600;锥孔电压为60 V;碰撞气体为氩气(Ar);碰撞室能量为40 V。m/z采集范围为180~600。
2 结果与讨论
穗花杉双黄酮与罗伯斯特双黄酮互为C—C连接的同分异构体,广泛存在于卷柏属植物中。它们的分子式为:C30H18O10,相对分子质量为:538.45,结构见图1。
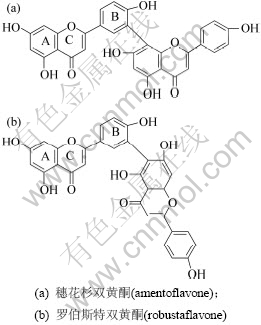
图1 穗花杉双黄酮和罗伯斯特双黄酮的分子结构
Fig.1 Chemical structures of amentoflavone and robustaflavone
穗花杉双黄酮为Ⅰ3′—Ⅱ8″连接的双黄酮类化合物,其负离子模式下的电喷雾质谱碎片见图2。由图2可知:在负离子模式下产生的主要碎片离子的质荷比m/z为:537.09,493.09,443.19,416.99,374.99,330.99,306.90和203.10。穗花杉双黄酮分子可能的裂解途径见图3。第1种裂解途径是Ⅰ-A环的2个γH 发生麦氏重排,丢失C3O2分子,紧接着,Ⅰ-C环发生0,4键断裂(0,4A)断裂,失去C2H2离子,得到 m/z=443的碎片离子峰,丰度为18%。裂解规律与Zhang等[16]在对玄参酮的质谱研究中的发现一致。第2种裂解途径是Ⅱ-C环的 0,2键断裂(0,2A),丢失C7H5O2 离子碎片,得到丰度为21%,m/z=417的碎片离子。在碎片离子峰中可观察到1个丰度约为6%,m/z=331的碎片。可能是m/z=417的碎片离子的Ⅰ-A环的2个γH发生麦氏重排,丢失C3O2碎片的同时,Ⅰ-B环C4′位的羟基与Ⅱ-A环C7″上的羟基出现分子内脱水,失去1个水分子所产生。第3种的裂解途径为:Ⅱ-C环出现0,4键断裂(0,4A),丢失C9H6O3离子,得到m/z=375的碎片离子峰,丰度为70%,这说明此离子碎片峰比较稳定。Shi等[17-18]在对不同C—C连接的双黄酮类化合物的质谱研究中观察到此碎片离子的存在。
罗伯斯特双黄酮为Ⅰ3′—Ⅱ6″连接的双黄酮化合物,在负离子模式下的电喷雾质谱碎片见图4。与穗花杉双黄酮的质谱图比较,出现3个不同的碎片离子m/z峰,分别为519.09, 308.90, 226.90;m/z一致的碎片离子也表现出不一样的丰度。罗伯斯特双黄酮分子可能的裂解途径见图5。第1种和第3种的裂解途径与穗花杉双黄酮一样,分别得到m/z为443和375的碎片离子,丰度分别为 7%和 100%。2个分子的芹菜素通过C3′—C6″连接,在质谱条件下,Ⅱ-C环更易于出现0,4键断裂(0,4A), 丢失 C9H6O3 离子。此裂解途径应是罗伯斯特双黄酮的主要裂解途径。第2种裂解途径为:Ⅱ-C环的 0,2键断裂(0,2A),丢失 C7H5O2 碎片,得到丰度为30%,m/z=417的碎片离子峰,由于罗伯斯特双黄酮是C3′—C6″连接,存在空间结构的影响,促使 m/z=417碎片进一步裂解,于Ⅰ-A环失去C2H2 O分子产生丰度值为79%,m/z=309 的碎片离子,此离子继续裂解,于Ⅰ-B环,Ⅱ-B环相继失去2分子的 C2H2O,得到微量的m/z=227 碎片。第4种裂解途径:与C3′—C8″连接的穗花杉双黄酮相比,由于空间构型的影响,使得罗伯斯特双黄酮Ⅰ-B环C4′ 位上的羟基与Ⅱ-B环 C5″或者7″位上的羟基较容易出现分子内脱水,失去1个水分子,产生m/z=519的碎片,丰度为20%;Ⅱ-C环0,2键断裂(0,2A),丢失C7H5O2碎片,得到丰度为22%,m/z=399的碎片;此离子进一步裂解,经过Ⅰ-A环的2个γH 发生麦氏重排,丢失C3O2分子,得到m/z=331的碎片;此碎片离子的Ⅰ-C 环发生0,4键断裂(0,4A)断裂,失去C2H2离子,得到少量的m/z=305碎片离子。m/z=331碎片的丰度40%,提示该离子比较稳定。第5种裂解途径:在质谱(图4)中还可以观察到丰度约为10%的m/z=493 碎片,可能是Ⅰ-A环失去CO2分子所致[12]。在穗花杉双黄酮的质谱图中也能观察到此碎片离子,但是丰度太小,几乎可以忽略不计。说明空间立体构型对化合物的质谱裂解途径存在重要影响。丰度为82%,m/z=309碎片离子也进一步说明C3′—C6″连接所造成的空间结构,促使了m/z=417 碎片的进一步裂解。与穗花杉双黄酮的裂解途径相比较,第4种裂解途径可能是Ⅰ3′—Ⅱ6″连接的罗伯斯特双黄酮化合物质谱裂解的特征途径。m/z为519,309以及226的碎片离子即为罗伯斯特双黄酮的特征碎片离子。
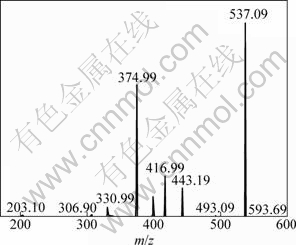
图2 负离子模式下穗花杉双黄酮的质谱图
Fig.2 Amentoflavone MS scan spectra obtained in ESI negative ion mode
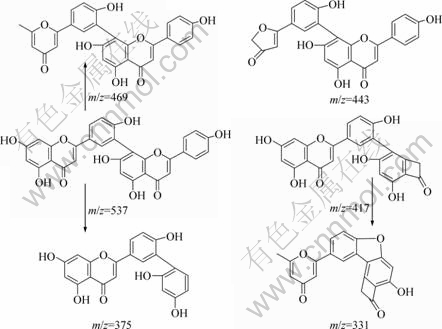
图3 穗花杉双黄酮可能的质谱裂解途径
Fig.3 Fragmentation pathways of amentoflavone
在黄酮化合物的质谱裂解规律中,C环上1,3键容易断裂,发生RDA裂解[9]。但是,黄酮分子通过C—C连接成双黄酮分子后,在C3—C8″ 连接的双黄酮化合物的质谱裂解中出现这样的裂解情况[10]。由于连接位置的关系,在C3′—C8″和C3′—C6″连接的双黄酮化合物中,C环上0,2键或者0,4键更易断裂。可能的原因是:所产生碎片离子中的电荷密度由于另一个黄酮分子的大π作用,更易于得到分散。
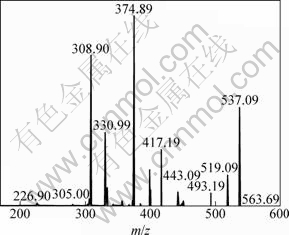
图4 负离子模式下罗伯斯特双黄酮的质谱图
Fig.4 Robustaflavone MS scan spectra obtained in ESI negative ion mode
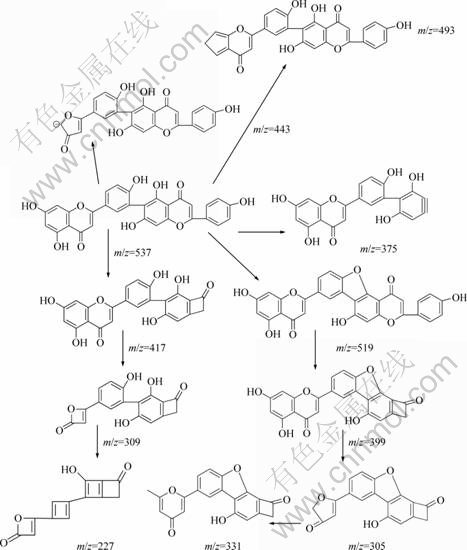
图5 罗伯斯特双黄酮的裂解途径
Fig.5 Fragmentation pathways of robustaflavone
3 结论
(1) 根据穗花杉双黄酮和罗伯斯特双黄酮在负离子模式下电喷雾多级串联质谱给出的碎片质谱数据,对裂解途径进行理论分析,在一定程度上得到规律性认识。通过这2种双黄酮化合物的质谱裂解行为,可分别对穗花杉双黄酮和罗伯斯特双黄酮进行定性 鉴别。
(2) 穗花杉双黄酮和罗伯斯特双黄酮均为C—C连接的双黄酮化合物,它们有着相同的裂解途径:C环中的0,4键容易发生断裂,生成m/z=375的碎片离子。此离子峰为这2个同分异构体的共有特征离子峰。
(3) 空间立体构型对化合物的质谱裂解途径存在重要影响:与穗花杉双黄酮的C3′—C8″连接相比较,C3′—C6″连接模式在离子碎片中脱去水分子出现环化过程。产生m/z=519和m/z=309这2个罗伯斯特双黄酮的特征碎片离子;这种连接所造成的空间结构,也促使了碎片离子m/z=417的进一步裂解。
致谢:特别感谢实验室的施树云老师在谱图分析方面给予的指导。
参考文献
[1] 吕瑜平, 陈业高, 文静. 深绿卷柏的一个新双黄酮[J].云南植物研究, 2004, 26(2): 226-228.
LU Yu-ping, CHEN Ye-gao, WEN Jing. A new biflavone from Selaginella doederleinii[J]. Acta botanicu Yunnanica, 2004, 26(2), 226-228.
[2] Lee N Y, Min H Y, Lee J, et al. Identification of a new cytotoxic biflavanone from Selaginella doederleinii[J]. Chemical & Pharmaceutical Bulletin, 2008, 56(9), 1360-1361.
[3] Okigawa M, Hwa C W, Kawano N, et al. Biflavones in Selaginella species[J]. Phytochem, 1971, 10(12): 3286-3287.
[4] Huneck S, Khaidav T. Amentoflavone from Selaginella sanguinolenta[J]. Pharmazie, 1985, 40(6): 431-435.
[5] 谭桂山, 陈立章, 徐康平. 垫状卷柏的化学成分研究[J]. 有机化学, 2004, 24(9): 1082-1085.
TAN Gui-shan, CHEN Li-zhang, XU Kang-ping, et al. Study on the chemical constituents of Selaginella pulvinata Maxim[J]. Chinese Journal of Organic Chemistry, 2004, 24(9): 1082-1085.
[6] Lin L C, Kuo Y C, Chou C J. Cytotoxic Biflavonoids from Selaginella delicatula [J]. J Nat Prod, 2000, 63(5): 627-630.
[7] Lin R C, Alexios-Leandros S, Elisabeth S, et al. Phenolic constituents of Selaginella doederleinii[J]. Planta Medica, 1994, 60(2): 168-170.
[8] 江雪平, 陈科力. 江南卷柏中双黄酮类化合物的研究[J]. 中国药学杂志, 2009, 44(2): 96-98.
JIANG Xue-ping, CHEN Ke-li. Biflavonoids from Selaginella moellendorfii Hieron[J]. Chinese Pharmacentical Journal, 2009, 44(2): 96-98.
[9] Sasaki H, Miki K, Kinoshita K, et al. β-Secretase (BACE-1) inhibitory effect of biflavonoids[J]. Bioorganic & Medicinal Chemistry Letters, 2010, 20(15): 4558-4560.
[10] 徐英,董静,王弘, 等. 电喷雾-离子阱-飞行时间质谱联用研究黄酮和异黄酮苷元C环上的裂解规律[J]. 高等学校化学学报, 2009, 30(1): 46-50.
XU Ying, DONG Jing, WANG Hong, et al. Fragmentation study of the C ring in flavone and isoflavone aglycones by electrospray ion trap time-of-flight mass spectrometry[J]. Chemical Journal of Chinese University, 2009, 30(1): 46-50.
[11] Colovic M, Caccia S. Liquid chromatography-tandem mass spectrometry of I3,II8-biapigenin, the major biflavone in Hypericum perforatum extracts[J]. Journal of Chromatography B: Analytical Technologies in the Biomedical and Life Sciences, 2008, 863(1): 74-79.
[12] de Daniel J F S, Carvalho M G, Cardosoa R da S, et al. Others Flavonoids from Ouratea hexasperma (Ochnaceae)[J]. Journal Brazil Chemical Society, 2005,16(3B): 634-638.
[13] Kumar N, Singh B, Bhandari P, et al. Biflavonoids from Lonicera japonica[J]. Phytochemistry, 2005, 66: 2740-2740.
[14] 焦玉,王荣荣,史超, 等. HPLC法同时测定中药五灵脂中3种成分的含量[J]. 沈阳药科大学学报, 2010, 27(7): 574-578, 582.
JIAO Yu, WANG Rong-rong, SHI Chao, et al. Determination of protocatechuic acid, amentoflavone and hinokiflavone in faeces trogopterori by HPLC[J]. Journal of Shenyang Pharmaceutical University, 2010, 27(7): 574-578, 582.
[15] 郑晓珂, 赵献敏, 王彦, 等. 反相高效液相色谱法测定不同产地卷柏中阿曼托双黄酮的含量[J]. 时珍国医国药, 2009, 20(6): 1408-1410.
ZHENG Xiao-ke, ZHAO Xian-min, WANG Yan, et al. HPLC determination of amentoflavone in Selaginella tamariscina from producing areas[J]. Lishizhen Medicine and Materia Medica, 2009, 20(6): 1408-1410.
[16] Zhang L, Xu L, Xiao S S, et al. Characterization of flavonoids in the extract of Sophora flavescens Ait. by high-performance liquid chromatography coupled with diode-array detector and electrospray ionization mass spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis, 2007, 44(5): 1019-1028.
[17] Shi S Y, Zhou H H, Huang K L, et al. Hyphenated HSCCC-DPPH for Rapid Preparative Isolation and Screening of Antioxidants from Selaginella moellendorffii[J]. Chromatographia, 2008, 68(3/4): 173-178.
[18] Romani A, Galardi C, Pinelli P, et al. HPLC quantification of flavonoids and Biflavonoids in Cupressaceae leaves[J]. Chromatographia, 2002, 56(7/8): 469-474.
(编辑 赵俊)
收稿日期:2011-03-10;修回日期:2011-06-12
基金项目:国家自然科学基金资助(20876179)
通信作者:黎霜(1968-), 女,广西桂林人,副主任药师,从事中药活性成分筛选研究;电话:0731-88879850;E-mail:lishuang_5058@yahoo.com.cn