水相中长波长CdTe量子点的制备及其荧光性能
夏姣云,徐万邦
(长沙理工大学 化学与生物工程学院 电力与交通材料保护湖南省重点实验室,湖南 长沙,410004)
摘要:分别用谷胱甘肽(GSH)和巯基乙酸(TGA)为稳定剂,在水相中制备长波长荧光发射峰CdTe QDs。并用透射电子显微镜、X线粉末衍射和荧光光谱技术对其进行表征,研究不同水相合成条件对CdTe QDs荧光性能的影响。研究结果表明:以GHS为稳定剂制备得到的CdTe QDs为立方晶系纤锌矿结构,平均粒径约为5 nm,分散性良好。在2 h内能获得光发射峰为530~650 nm之间的任意波长量子点,具有明显的量子尺寸效应和较强的荧光强度;以TGA为稳定剂制备的CdTe QDs,平均粒径在10 nm以下,其中在水热条件下制备的CdTe QDs分散性较差,但能加快量子点的生长速率和荧光半峰宽的窄化。而在加热回流(分别为空气和氮气)条件下制备的CdTe QDs,分散性较好。相对于氮气保护氛围下的合成,通过氧气参与作用,也能加快CdTe QDs的生长。
关键词:CdTe;量子点;荧光;长波长
中图分类号:TQ050.4 文献标志码:A 文章编号:1672-7207(2011)11-3277-07
Synthesis and fluorescence spectrum analysis of long-wavelength CdTe quantum dots in aqueous solution
XIA Jiao-yun,XU Wang-bang
(Hunan Provincial Key Laboratory of Materials Protection for Electric Power and Transportation, School of Chemistry and Biological Engineering, Changsha University of Science and Technology, Changsha 410004, China)
Abstract: CdTe QDs were synthesized in aqueous solution with two stabilizers (Glutathione (GSH) and thioglycollic acid (TGA)) by a simple route, respectively, and were characterized by transmission electron microscopy, X-ray diffractrometry, and fluorescence spectra. The effect of aqueous synthesis conditions on the fluorescence properties of CdTe QDs was investigated and the result shows that CdTe QDs by using GSH as a stabilizer was identified as cubicalnanocrystal with an even size of 5 nm. The CdTe QDs with the emission wavelength ranging from 530 nm to 650 nm could be synthesized in 2 h, and has obvious quantum size effect and strong fluorescence. However, hydrothermal method is applied into synthesis of CdTe QDs by using TGA, an even size of 10 nm of CdTe QDs is obtained with bad dispersivity, but higher temperature accelerates the growth rate and full width at half maximum (FWHM) narrowing of CdTe QDs, and oxygen plays an important role in the process of synthesis of CdTe QDs by refluxing and it can also accelerate the growth rate.
Key words: CdTe; quantum dots; fluorescence; long-wavelength
Ⅱ-Ⅵ族半导体纳米粒子(量子点,Quantum dots,QDs)由于其独特的光学、光化学、电化学以及非线性光学性质已逐渐引起人们的广泛关注,而量子点最诱人的潜在应用是作为荧光探针应用于生物体系,在生命科学研究中起到定性和定量标记分子和细胞的作 用[1]。自Alivisatos[2]和Chan等[3]利用CdSe-ZnS纳米 粒子的荧光特性对老鼠的成纤维细胞进行了标记和细胞的非同位素检测的新方法以来,激起了科学家对Ⅱ-Ⅵ族半导体纳米粒子的研究热潮。由于CdE (E= S, Se, Te) QDs具有良好的光学性质,在近几年的研究与相关文献报道中,CdE QDs的制备与性能研究很受重视[4-11]。其中CdTe QDs具有很大的激子波尔直径(15 nm)[12]和独特的光电特性,例如荧光量子产率高、荧光光谱对称且半峰宽窄、吸收光谱连续、发光的连续可调性、强抗光漂白性等,CdTe QDs的制备与性能研究备受关注[13]。目前,应用得最多最广泛的水相合成CdTe QDs是在无氧的条件下将Al2Te3和浓硫酸反应制得的H2Te通入到含有RSH(巯基乙酸、巯基丙酸、硫代甘油等)稳定的Cd2+溶液中,然后在氮气保护下加热回流,通过控制回流时间来控制CdTe QDs的生长速率,获得一系列的不同发射波长的荧光CdTe QDs[14-17]。 但是,由于溶液中粒子的奥氏熟化过程随回流时间的延长而逐步减缓,因此,很难获得长波长发射峰(>600 nm)的CdTe QDs。并且,随着加热回流时间的延长,所获得的CdTe QDs 的荧光量子产率明显下降。针对上述问题,本文作者采用谷胱甘肽(GSH)为稳定剂,直接、快速、高效地合成长波长CdTe QDs。在2 h内能获得荧光发射峰从530~650 nm之间的任意波长量子点。另外,为了进一步在水溶液中高效快速合成高质量的长波长荧光量子点的拓宽渠道,尝试不同条件下,水热法制备CdTe QDs。
1 实验
1.1 试剂
试剂为:碲粉(Te,纯度为99.99%,质量分数)和谷胱甘肽(GSH,AR)购自百灵威化学试剂有限公司;硼氢化钠(AP)、氯化镉(AP)、巯基乙酸(TGA,AP)、氢氧化钠(AP)、氯化氢(CP),均由国药集团上海化学试剂公司提供;去离子水,自制。
1.2 CdTe QDs的制备
配制1.0×10-3 mol/L的氯化镉溶液,1.0 mol/L的氢氧化钠和盐酸溶液,备用。
实验1:取适量的Te粉于小试剂瓶中,按照一定的化学计量比,在无氧条件下,加入适量的硼氢化钠水溶液,塞上橡胶塞,反应过夜,获得NaHTe水溶液。此时的NaHTe为无色透明的溶液。按照n(Cd2+): n(TGA):n(HTe-)=2:3:1的比例,调节pH为9.2,将 NaHTe水溶液加入到上述溶液中,得到橙红色TGA-CdTe原始溶液。将该原始溶液在氮气保护下加热回流,不同时间点取样。样品稀释10倍后进行测试与表征。
实验2:在实验1 的基础上,对所获得的原始溶液,在空气中直接加热回流,不同时间点取样,样品稀释10倍后进行测试与表征。
实验3:在实验1的基础上,对所获得的原始溶液,在无氧条件下,分别对其在100,120,140和160 ℃下进行水热合成反应。不同时间点取样,样品稀释10倍以后对所获得的样品进行测试与表征。
实验4:采用GSH替代TGA重复实验1,所得样品稀释10倍后进行表征。
1.3 CdTe QDs的表征
实验中,使用X线衍射仪(Pert-Pro MPD,荷兰)、分子荧光光谱仪(F- 4500,日本)、透射电子显微镜(JSM-6700F,日本)对所得到的CdTe 量子点的结构、形貌和光学性质进行研究。
2 结果与讨论
2.1 TEM分析
采用透射电子显微镜对样品的形貌进行过观测。图1~4所示分别为本实验方法在不同条件下制备CdTe QDs的TEM像。
从图1,2和4可以看到:采用加热回流的方法能获得粒径相对均一的CdTe QDs,QDs形貌近似为球形。其中,以GSH修饰的CdTe QDs,球状晶体的平均尺寸约为5 nm(图4),而以TGA为修饰的CdTe QDs,其球状晶体的平均尺寸在10 nm以下,且分散性良好。而图3所示为水热法制备的CdTe QDs,其粒径分布不均匀,分散性较差。

图1 氮气保护下加热回流5 h后制备TGA-CdTe QDs的TEM像
Fig.1 TEM photograph of TGA-CdTe QDs after refluxing for 5 h in N2 atmosphere

图2 空气中加热回流2 h后制备TGA-CdTe QDs的TEM像
Fig.2 TEM image of TGA-CdTe QDs after refluxing for 2 h in air atmosphere

图3 140 ℃水热条件下加热1 h后制备TGA-CdTe QDs的TEM像
Fig.3 TEM image of TGA-CdTe QDs after hydrothermal at 140 ℃ for 1 h

图4 氮气保护下加热回流2 h后制备GSH-CdTe QDs的TEM像
Fig.4 TEM image of GSH-CdTe QDs after refluxing for 30 min in N2 atmosphere
2.2 XRD分析
图5和6所示分别为在空气氛围中回流5 h以及在氮气氛围中回流2 h制备CdTe QDs的XRD谱。根据XRD谱可知:CdTe QDs均在(111),(220)和(311)晶面处出现明显的衍射峰,又由于粒径处于纳米级而导致宽化现象。根据衍射峰的峰位对照标准卡片可知该产物为立方晶系纤锌矿结构的CdTe。所以,没有其他晶形的可能原因是CdTe QDs的晶形与合成温度关系较大。在低温下很难获得除立方晶系纤锌矿结构之外的结构。同时,从XRD衍射模型也可以看出:随着回流时间的延长,所得QDs的晶体结构趋于完善。相对于在空气中回流5 h的XRD谱,回流2 h的GSH-CdTe QDs的XRD衍射峰明显宽化,也说明随着加热回流时间延长,粒径变小。
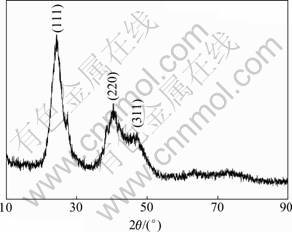
图5 空气中加热回流5 h后制备TGA-CdTe QDs XRD谱
Fig.5 XRD pattern of TGA-CdTe QDs after refluxing for 5 h in air atmosphere
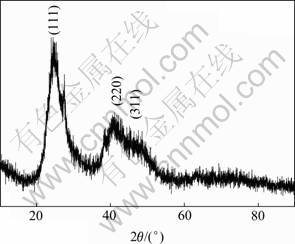
图6 氮气保护下加热回流2 h后制备GSH-CdTe QDs的 XRD谱
Fig.6 XRD pattern of GSH-CdTe QDs after refluxing for 2 h in N2 atmosphere
2.3 荧光光谱分析
2.3.1 GSH修饰CdTe QDs的荧光光谱变化
采用GSH为稳定剂来合成CdTe QDs,研究前驱体的不同pH和不同前躯体配比对于量子点的量子产率的影响。发现量子点表面的Cd2+-GSH层对于量子点量子产率的提高有很重要的作用[14]。本实验中采用的合成条件为:pH 9.0,n(Cd2+): n(NaHTe): n(GSH)= 2:1:5, 在高纯氩气保护氛围中加热,加热温度100 ℃。在不同时间点取样并用高纯水稀释10倍后测量荧光,结果如图7所示。
由图7可知:随着反应时间的延长,CdTe QDs的发射波长发生明显红移(520~640 nm),同时量子点的粒径也逐渐变大。一般认为,在粒子生长中,发生奥氏熟化过程,在任何单体浓度下存在一个临界尺寸,即生长速率平衡点。比临界尺寸小的纳米粒子有负的增长速率(溶解),而比临界尺寸更大的纳米粒子生长速率与尺寸有关。随着颗粒逐渐长大,单体浓度达到平衡,这时临界尺寸大于平均尺寸,比临界尺寸小的颗粒随反应时间延长开始溶解,导致颗粒缩小或最终消失,而比临界尺寸大的颗粒继续增长,导致最终尺寸分布变宽,这可以从荧光峰随粒子尺寸的增加而变宽得到证明,而窄的尺寸分布则对应非常尖锐的荧光发射峰。随着粒子的生长,其荧光发射峰半峰宽逐渐变大。

图7 GSH-CdTe QDs随加热时间的变化(a)以及荧光发射峰峰位与加热回流时间的关系(b)
Fig.7 FL spectra of GSH-CdTe QDs with different refluxing time(a) and peak position vs reaction time(b)
从上面的分析可以看出:加热回流时间的长短能间接地决定着荧光发射峰的峰位。因此,对加热回流时间与荧光峰的峰位进行线性拟合。获得如下线性方程:
y=528.94+0.87x (1)
其中:y为荧光峰位,nm;x为加热回流时间,s;R= 0.998 68,标准偏差为1.943 85。
因此,根据方程式(1),通过控制反应条件,就能够获得所需波长的CdTe 纳米粒子。
2.3.2 氮气保护下TGA修饰的CdTe QDs荧光光谱 变化
在弱碱性条件下,采用价低廉的Te粉和硼氢化钠为原料代替Al2Te3,TGA作为稳定剂,加热不同时间所得到的CdTe QDs的荧光光谱。图8所示为氮气保护下TGA-CdTe QDs随加热时间的变化。从图8可以看出:在初始阶段,荧光强度比较强,随着加热时间的延长,荧光峰出现了和采用GSH修饰的CdTe QDs一致的生长情况。不过,生长速度明显放慢。特别是加热2 h以上荧光峰位变化很小(如图中虚线所示)。造成这种情况的原因可能与反应体系的浓度以及奥氏熟化过程有关。
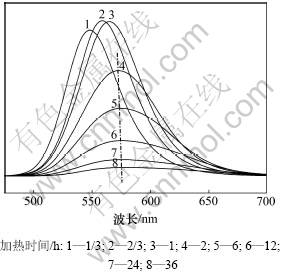
图8 氮气保护下TGA-CdTe QDs随加热时间的变化
Fig.8 FL spectra of TGA-CdTe QDs with different refluxing time in N2 atmosphere
2.3.3 空气中直接合成TGA修饰的CdTe QDs荧光光谱变化
Rogach[18]在氮气保护下合成Ⅱ-Ⅵ族半导体纳米粒子的过程中发现,由于TGA和MPA等巯基化合物不稳定,在加热回流过程容易分解。分解后能产生游离出S2-,而S2-易与溶液中富余的Cd2+络合,形成CdS并黏附在Ⅱ-Ⅵ族半导体纳米粒子表层,形成薄薄的一层壳层。在本实验设计中,使氧气参与CdTe QDs的合成反应,加速TGA的分解。从而获得了制备长波长CdTe QDs的一条新途径。图9所示为在空气中直接加热回流前驱体溶液过程中通过取样并测量其荧光光谱的光谱。

图9 空气中TGA-CdTe QDs随加热时间的变化(a)以及荧光发射峰峰位与加热回流时间的关系(b)
Fig.9 FL spectra of TGA-CdTe QDs with different refluxing time in air atmosphere(a) and peak positions of TGA-CdTe QDs vs reaction time(b)
从图9可知:直接在空气条件下更容易获得不同发射波长的CdTe QDs。根据图9中加热回流时间与荧光峰的峰位变化关系,对其进行线性拟合。获得非线性方程为:
y=18.801 ln x+553.24 (2)
其中:y为荧光峰位,nm;x为加热回流时间,h。
因此,根据方程式(2),通过控制反应条件,直接在空气氛围中能够很容易的获得所需波长的CdTe 纳米粒子。
2.3.4 水热条件下TGA修饰的CdTe QDs荧光光谱 变化
图10所示是在160 ℃采用水热方法制备TGA-CdTe QDs的荧光光谱,光谱的半峰宽度较窄。新制备的CdTe前驱体并无荧光,前驱体经过随后的热处理发生结构重组和表面有序化,从而产生荧光。160 ℃的高温可以更加有效地减少QDs表面缺陷,加快晶体生长的速率,提高发光效率。从制备TGA-CdTe QDs的时间来看,在160 ℃条件下,采用水热方法大大缩短了制备长波长TGA-CdTe QDs的时间,获得荧光发射峰为620 nm 的CdTe QDs仅需100 min。
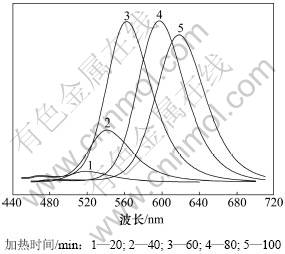
图10 160 ℃水热条件下反应不同时间制备TGA-CdTe QDs的荧光光谱
Fig.10 FL spectra of TGA-CdTe QDs with different emission positions grown at 160 ℃ for different hydrothermal reaction time
2.4 CdTe QDs生长情况探讨与分析
Ostwald ripening(OR)原理(尺寸宽化)是比较公认的描述QDs生长规律的理论。Talapin等[19-20]针对有机金属法提出了Ⅱ-Ⅵ族及Ⅲ-Ⅴ族QDs在溶液中的生长规律。对于纳米尺寸的晶体,带边荧光强烈依赖其尺寸,根据这一特性,可以估计出QDs生长过程中荧光对应的能量随时间的变化。QDs荧光能量与其尺寸的偏差可以通过透射电镜矫正。注射单体后,QDs迅速成核,并在温度与单体浓度间平衡低于某临界值时终止,开始生长。虽然成核的动力学很难研究,但接下来的生长阶段比较容易研究。如果一个体系固定了单体浓度,并假设扩散是生长速率的决定因素,那么,由QDs尺寸决定生长速率可以概括为Gibbs-Thompson方程:
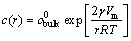 (3)
(3)
其中:c(r)为半径为r的QDs的溶解度; 为体相材料的溶解度;
为体相材料的溶解度; 为表面张力;Vm为固相摩尔体积;R为摩尔气体常数;T为热力学温度。
为表面张力;Vm为固相摩尔体积;R为摩尔气体常数;T为热力学温度。
如果 << 1,由扩散控制的尺寸为r的QDs的生长速率可以简化为:
<< 1,由扩散控制的尺寸为r的QDs的生长速率可以简化为:
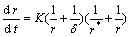 (4)
(4)
式中:K为正比于单体扩散系数的常数;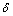 为扩散层的厚度;在固定浓度的条件下r*为溶液中零生长率QDs(溶解度等于溶液中单体浓度的QDs)的特征半径。比特征半径小的QDs,其净生长速率为负,表现为溶解;而比特征半径大的QDs,其生长速率强烈依赖自身尺寸。开始生长时,溶液中QDs的尺寸都略大于r*,体系发生尺寸分布窄化,在这一条件下,尺寸小的QDs比尺寸大的生长快。QDs生长会导致单体浓度下降,导致r*比QDs平均尺寸大。由于一些尺寸较小的QDs萎缩并最终消失,而尺寸大些的QDs还在生长,尺寸分布会变宽。这就是OR原理或叫尺寸宽化。尺寸宽化理论有一定的指导意义,但它的数学推导基于很多假设,在比较理想的条件下才成立。根据上述理 论,结合本实验水相中合成的CdTe QDs具体情况进行了一些定性探讨:在其他条件相同的情况下,温度越高,量子点的生长速度越快。如采用TGA为稳定剂时,100 ℃温度太低,生长过于缓慢。提高合成温度后(水热条件下),生长速度明显提高,温度越高,生长速度差异越小。原因应该是温度越高分子扩散速度越快,所以,生长速度加快。这与上述描述基本一致;CdTe QDs粒径的变化速度并不呈线性。在粒径较小时生长速度最快。随着时间的加长,粒径继续长大,生长速度减小增大交替出现,而且还出现了粒径零生长平台(如氮气保护下合成CdTe QDs时,当荧光发射峰到达570 nm左右时,粒子几乎停止了生长)。这是因为开始生长时,原溶液中单体的浓度较大,QDs尺寸都略大于r,因此,生长速度最快,体系发生尺寸分布窄化。随着粒径的生长,单体浓度减小,生长速度有所减慢,在粒径长大的过程中,同时伴随着自身表面缺陷的修饰,因此经历一段快速生长,将需要一段时间修饰自身表面缺陷,出现生长速度增大减小交替出现的现象,形成一种动态平衡过程。这也与上述描述基本类似;热处理的重要作用。新合成的CdTe QDs溶液没有荧光,是因为激子受激发后跃迁到导带,迅速被表面缺陷所捕获,由于热运动,电子在导带和表面缺陷之间迁移,无法完成导带和价带之间的跃迁,不出现荧光。在一定的温度下加热处理,表面很快被Cd-SR修饰,减少了CdTe QDs的表面缺陷,表面态发射和非辐射跃迁减少,被表面缺陷所俘获的电子大量释放,使电子从导带到价带的复合跃迁几率大大增加,带边发射增强,出现荧光。
为扩散层的厚度;在固定浓度的条件下r*为溶液中零生长率QDs(溶解度等于溶液中单体浓度的QDs)的特征半径。比特征半径小的QDs,其净生长速率为负,表现为溶解;而比特征半径大的QDs,其生长速率强烈依赖自身尺寸。开始生长时,溶液中QDs的尺寸都略大于r*,体系发生尺寸分布窄化,在这一条件下,尺寸小的QDs比尺寸大的生长快。QDs生长会导致单体浓度下降,导致r*比QDs平均尺寸大。由于一些尺寸较小的QDs萎缩并最终消失,而尺寸大些的QDs还在生长,尺寸分布会变宽。这就是OR原理或叫尺寸宽化。尺寸宽化理论有一定的指导意义,但它的数学推导基于很多假设,在比较理想的条件下才成立。根据上述理 论,结合本实验水相中合成的CdTe QDs具体情况进行了一些定性探讨:在其他条件相同的情况下,温度越高,量子点的生长速度越快。如采用TGA为稳定剂时,100 ℃温度太低,生长过于缓慢。提高合成温度后(水热条件下),生长速度明显提高,温度越高,生长速度差异越小。原因应该是温度越高分子扩散速度越快,所以,生长速度加快。这与上述描述基本一致;CdTe QDs粒径的变化速度并不呈线性。在粒径较小时生长速度最快。随着时间的加长,粒径继续长大,生长速度减小增大交替出现,而且还出现了粒径零生长平台(如氮气保护下合成CdTe QDs时,当荧光发射峰到达570 nm左右时,粒子几乎停止了生长)。这是因为开始生长时,原溶液中单体的浓度较大,QDs尺寸都略大于r,因此,生长速度最快,体系发生尺寸分布窄化。随着粒径的生长,单体浓度减小,生长速度有所减慢,在粒径长大的过程中,同时伴随着自身表面缺陷的修饰,因此经历一段快速生长,将需要一段时间修饰自身表面缺陷,出现生长速度增大减小交替出现的现象,形成一种动态平衡过程。这也与上述描述基本类似;热处理的重要作用。新合成的CdTe QDs溶液没有荧光,是因为激子受激发后跃迁到导带,迅速被表面缺陷所捕获,由于热运动,电子在导带和表面缺陷之间迁移,无法完成导带和价带之间的跃迁,不出现荧光。在一定的温度下加热处理,表面很快被Cd-SR修饰,减少了CdTe QDs的表面缺陷,表面态发射和非辐射跃迁减少,被表面缺陷所俘获的电子大量释放,使电子从导带到价带的复合跃迁几率大大增加,带边发射增强,出现荧光。
3 结论
(1) 以GSH为稳定剂,能直接且高效地合成高质量的CdTe量子点。GSH包覆的量子点荧光发射峰位置覆盖530~650 nm。相比较目前其他的合成方法,这种方法更加温和、绿色和廉价。
(2) 以GTA为稳定剂,在160 ℃高温条件下,采用水热方法大大缩短了制备长波长TGA-CdTe QDs的时间。获得荧光发射峰为620 nm 的CdTe QDs仅需100 min。根据加热回流时间与荧光峰的峰位进行线性拟合得到线性方程,可通过控制反应条件,就能够很容易地获得所需波长的CdTe 纳米粒子。该方法弥补了水相合成不利制备较大尺寸量子点的缺点。
(3) 在弱碱性条件下,采用价低廉的Te粉和硼氢化钠为原料代替Al2Te3,TGA为稳定剂,通过氧气参与CdTe QDs的合成反应,能加速TGA的分解,加快了CdTe QDs的生长。根据加热回流时间与荧光峰的峰位变化关系进行线性拟合得到非线性方程,可通过控制反应条件,直接在空气氛围中很容易获得所需波长的CdTe 纳米粒子。相对于氮气保护氛围下的合成,该法大大加快了CdTe QDs的生长速率,为在水溶液中高效快速合成高质量的长波长荧光量子点拓宽了 渠道。
参考文献:
[1] Michalet X, Pinaud F F, Bentolila L A, et al. Quantum dots for live cells, in vivo imaging, and diagnostics[J]. Science, 2005, 307: 538-544.
[2] Bruchez M, Moronne M, Gin P, et al. Semiconductor nanocrystals as fluorescent biological labels[J]. Science, 1998, 281: 2013-2016.
[3] Chan W C W, Nie S M. Quantumdot bioconjugates for ultrasensitive nonisotopic detection[J]. Science, 1998, 281: 2016-2018.
[4] Lao U L, Mulchandani A, Chen W. Simple conjugation and purification of quantum dot-antibody complexes using a thermally responsive elastin-protein L scaffold as immunofluorescent agents[J]. J Am Chem Soc, 2006, 128(46): 14756-14757.
[5] Hsieh S C, WANG Fung-fang, Lin C S, et al. The inhibition of osteogenesis with human bone marrow mesenchymal stem cells by CdSe/ZnS quantum dot labels[J]. Biomaterials, 2006, 27(8): 1656-1664.
[6] GAO Xiao-hu, Yang L, Petros J A, et al. In vivo molecular and cellular imaging with quantum dots[J]. Current Opinion in Biotechnology, 2005, 16: 63-72.
[7] Kubik T, Bogunia-Kubik K, Sugisaka M. Nanotechnology on duty in medical applications[J]. Current Pharmaceutical Biotechnology, 2005, 6(1): 17-33.
[8] Markus S. Reversible molecular photoswitches: A key technology for nanoscience and fluorescence imaging[J]. PNAS, 2005, 102(27): 9433-9434.
[9] Andrew M S, Shivang D, Shuming N, et al. Multicolor quantum dots for molecular diagnostics of cancer[J]. Expert Review of Molecular Diagnostics, 2006, 6(2): 231-244.
[10] So M K, XU Chen-jie, Loening A M, et al. Self-illuminating quantum dot conjugates for in vivo imaging[J]. Nature Biotechnology, 2006, 24(3): 339-343.
[11] 谷俐, 李菲, 张洋, 等. CdSe 量子点的制备及其被聚乳酸包被的研究[J]. 中南大学学报: 自然科学版, 2009, 40(4): 904-908.
GU Li, LI Fei, ZHANG Yang, et al. Preparation of CdSe quantum dots and coating with polylactide[J]. Journal of Central South University: Science and Technology, 2009, 40(4): 904-908.
[12] Mopelola I, Emmanuel L, Tebello N. Interaction ofwaters-souble thiol capped CdTe quantum dots and bovine serum albumin[J]. Journal of Photochemistry and Photobiology A, 2008, 198(1): 7-12.
[13] 梁佳然, 钟文英, 于俊生. 高质量CdTe量子点的水相快速合成[J]. 高等学校化学学报, 2009, 30(1): 14-18.
LIANG Jia-ran, ZHONG Wen-ying, YU Jun-sheng. Rapid aqueous syn thesis of high-quality CdTe Colloida quantum dots[J]. Chemical Journal of Chinese Universities, 2009, 30(1): 14-18.
[14] GUO Jia, YANG Wu-li, WANG Chang-chun. Systematic study of the photoluminescence dependence of thiol-capped CdTe nanocrystals on the reaction conditions[J]. The Journal of Physics Chemistry B, 2005, 109: 17467-17473.
[15] Zhang H, Wang L, Xiong H, et al. Hydrothermal synthesis for high-quality CdTe nanocrystals[J]. Advanced Materials, 2003, 15: 1712-1715.
[16] WANG Qiang, PAN Dao-cheng, JIANG Shi-chun, et al. A solvothermal route to size- and shape-controlled CdSe and CdTe nanocrystals[J]. Journal of Crystal Growth, 2006, 286(1): 83-90.
[17] YANG Rui, YAN Yu-xi, MU Ying, et al. A rapid and facile method for hydrothermal synthesis of CdTe nanocrystals under mild conditions[J]. Journal of Nanoscience and Nanotechnology, 2006, 6(1): 215-220.
[18] Rogach A L. Nanocrystalline CdTe and CdTe(S) particles: Wet chemical preparation, size-dependent optical properties and perspectives of optoelectronic applications[J]. Materials Science and Engineering B, 2000, 69/70: 435-440.
[19] Talapin D V, Rogach A L, Haase M, et al. Evolution of an ensemble of nanoparticles in a colloidal solution: Theoretical study[J]. The Journal of Physics Chemistry B, 2001, 105(49): 12278-12285.
[20] Yu W W, QU Lian-hua, GUO Wen-zhou, et al. Experimental determination of the extinction coefficient of CdTe, CdSe, and CdS nanocrystals[J]. Chemistry of Materials, 2003, 15(14): 2854-2860.
(编辑 陈爱华)
收稿日期:2010-12-11;修回日期:2011-03-09
基金项目:国家自然科学基金资助项目(20775010);电力与交通材料保护湖南省重点实验室(长沙理工大学)开放基金资助项目(2010cl05)
通信作者:夏姣云(1974-),女,湖南邵阳人,讲师,从事生物医用材料研究;电话:0731-85258733;E-mail: xiajy625@yahoo.com.cn