文章编号:1004-0609(2015)02-0472-07
CoOOH的热力学性质
田庆华,辛云涛,毛芳芳,王恒利,郭学益
(中南大学 冶金与环境学院,长沙 410083)
摘 要:利用渐近法计算并得到在臭氧氧化体系下CoOOH在水溶液中的准溶解平衡常数,并通过换算得到在臭氧氧化体系下溶液中钴离子浓度溶解平衡与pH值的关系。采用同步热分析仪(DSC-TGA)测定CoOOH粉末加热并分解得到Co3O4时在常温到516 K温度范围内的恒压热流,并得到在恒压条件下加热过程的DSC曲线。利用三线法得到CoOOH的摩尔定压热容,并且拟合CoOOH粉末的摩尔定压热容与温度的函数关系式;利用相关物质的已知热力学参数,设计热力学循环,计算在标准压强和298.15 K时CoOOH粉末的标准生成热力学函数。
关键词:CoOOH;臭氧;溶解平衡;热容;标准热力学函数
中图分类号:O642 文献标志码:A
Thermodynamic porperties of CoOOH
TIAN Qing-hua, XIN Yun-tao, MAO Fang-fang, WANG Heng-li, GUO Xue-yi
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
Abstract: The pseudo solubility-product constant of CoOOH was detected by the asymptotic method, and then the relationship between precipitation-dissolution equilibrium of cobalt and pH value was calculated in the acid-oxidation system of ozone. The DSC curve and heat flow of CoOOH powders were detected by DSC-TGA in the range of room temperature to 516 K, where the CoOOH decomposed. The molar heat capacity of CoOOH powders was calculated by three-line method and the fitting function of molar heat capacity at constant pressure and temperature was obtained. The thermodynamic cycle was designed based on the known thermodynamic data, the standard thermodynamic functions of CoOOH under slandard pressure at temperature of 298.15 K were calculated.
Key words: CoOOH; ozone; precipitation-dissolution equilibrium; heat capacity; standard thermodynamic function
钴是一种重要的战略金属元素,它具有熔点高、强度高和耐磨性好等优点,是制造各种合金、磁性材料的重要原料,广泛应用于航天、航空、电器、机械制造、陶瓷等领域[1]。羟基氧化钴(CoOOH)是一种重要的钴化合物,由于其优越的电化学性能,作为电极材料的活性添加剂包覆在电极表面,使电池具有较高的充电效率、可逆性和循环性能等优点[2],因而被广泛应用电池材料制备领域。在材料制备领域中 CoOOH通常采用化学沉淀法制备,包括在碱性条件下利用二价钴盐氧化制备和采用电化学氧化沉积法制备[3-4]。
相比电池材料领域,CoOOH在冶金领域酸性体系中的相关研究较少,通常溶液中的二价钴离子被强氧化剂氧化,如黑镍(NiOOH)和臭氧[5],可以将钴离子氧化并水解沉淀得到CoOOH,CoOOH可以直接用来制备钴氧化物以及相应钴酸盐。作为氧化沉淀分离溶液中钴的新方法,臭氧氧化清洁无污染,不会向体系引入杂质,且效率高、操作简单,采用臭氧氧化沉钴制备羟基氧化钴的方法具有较好的发展前景[6-7]。然而,关于羟基氧化钴的相关热力学数据的研究极少,只有其煅烧的分解温度[8]以及通过溶液体系研究得到CoOOH标准生成吉布斯自由能[9],但是并没有其固相时的摩尔定压热容等更加关键的数据,为了更深入地了解羟基氧化钴的性质及其生成反应的本质,有必要对其相关热力学数据进行探索。本文作者将对羟基氧化钴的臭氧氧化体系溶解度平衡、摩尔定压热容Cp,m,标准摩尔生成焓 ,标准摩尔生成熵
,标准摩尔生成熵 和标准摩尔生成吉布斯自由能
和标准摩尔生成吉布斯自由能 等热力学参数进行测定和研究。
等热力学参数进行测定和研究。
1 实验
1.1 实验原料与仪器
本实验中所使用的原料有七水合硫酸钴、硫酸、氧气,其中除了氧气是工业级,其余原料为分析纯级。将溶解平衡实验得到的产物进行烘干-磨细处理后得到CoOOH粉末物料,对其进行DSC检测。本实验中所使用的仪器有:臭氧发生器、恒温磁力搅拌器、电位pH计、离心机、SDTQ600同步热分析仪。
溶解平衡实验条件如下:温度为10、30、50 ℃,钴离子初始浓度分别为0.2、1、10 g/L,初始pH值为3,搅拌速度为300 r/min,气体流速为2 L/min,臭氧浓度为10 g/H。DSC检测条件如下:升温速度为5 K/min,常压,空气气氛,升温范围为常温到600 K。
1.2 研究内容与方法
1.2.1 臭氧氧化体系酸性条件下钴离子溶解平衡
溶液中的Co2+被强氧化剂O3氧化,并水解生成CoOOH,由于其溶解平衡常数较小,因而从溶液中分离出来,臭氧氧化沉淀反应式如下所示:
O3+2Co2++2H+=O2+2Co3++H2O (1)
Co3++3OH-=CoOOH↓+H2O (2)
由于CoOOH存在溶解平衡,所以式(2)为可逆反应,即当溶液中沉淀较多而酸度较低的时候,会发生CoOOH的反溶。根据式(2)的逆反应以及组成,CoOOH的溶解平衡常数为K=c[Co3+]·c[OH-]3。
检测强氧化体系下钴浓度与pH值之间的关系对反应过程的判断具有重大的意义,具体方法如下:溶液中的OH-离子浓度可以通过溶液pH值的换算得到,因为Kw=c[OH-]·c[H+],不同温度下的Kw为常数[10],而pH=-lgc[H+],溶液pH值通过电位pH计检测得到,通过反向推倒可得c[OH-]=10(pH+lgKw)。受于实验条件限制,溶液中的Co3+浓度很难被检测到,同时该氧化体系的氧化还原电位较高,在此条件下Co2+离子很容易被氧化为Co3+离子,因此假设溶液中的钴离子都为Co3+离子。而整个CoOOH溶解平衡常数的研究采用渐近法进行,即向水溶液中添加一定量的七水合硫酸钴(CoSO4·7H2O),然后向含钴溶液中通入臭氧,发生氧化-水解-沉淀反应过程;随着反应过程的进行,溶液中Co3+浓度不断降低,pH值(c[OH-])不断下降,当溶液中钴离子浓度与氢氧根离子浓度低于一定程度时,不再发生水解沉淀反应,即当c[Co3+]·c[OH-]3≈ K[CoOOH]时,溶液中pH值不再发生变化,同时检测溶液中钴离子浓度,即可得到CoOOH的近似溶解平衡常数-准溶解平衡常数,设c[Co3+]·c[OH-]3=K′。最后利用准溶解平衡常数(K′)和水的离子积常数的相关换算,可以得到臭氧氧化体系酸性条件下钴的平衡浓度与pH之间的关系。
1.2.2 CoOOH热力学数据的测定
1) 摩尔定压热容
要得到CoOOH的相关热力学数据,最重要的步骤是测定其在一定温度范围内的热容。定压热容是物质的一个重要物理参数,经常在热力学计算中使用。采用DSC测定摩尔定压热容的方法具有灵敏度高、操作简便的特点。在DSC中试样在线性升温下,任意瞬间进入试样的热量与试样在该时刻的摩尔定压热容成正比,即
 (3)
(3)
式中:dH/dt为热流率;n为试样摩尔量;Cp,m为试样摩尔定压热容;dT/dt为升温速率。
测定试样摩尔定压热容的具体方法分为单线法和多线法[11]。单线法只要有DSC曲线就可以导出比热容曲线,具体计算公式如下所示:
 (4)
(4)
式(4)中:q为被测样未扣除基线时的功率,J/s;β为升温速率,K/s;Cp,m为被测样摩尔定压热容,J/(mol·K)。
由式(4)可以导出公式如下所示:
 (5)
(5)
然而,这种方法并没有指明反应的基线,仪器检测过程中两个坩埚之间的功率差异都被算进入样品的差热之中,使得计算出的摩尔热容存在误差。
多线法主要为双线法和三线法。双线法相比单线法多了一条基线,是单线法扣除空白基线后进行换算得到的摩尔热容数据。相比单线法得到的数据,双线法得到的数据更加准确可靠,适用于大多数场合。三线法得到的摩尔热容数据比较精确,误差较小,通常用于摩尔热容数据的精确测定和理论分析。采用三线法计算摩尔热容时,需要3条数据曲线-样品DSC曲线、空白基线和标样(一般选α-Al2O3),如图1所示,从图1中可以求得在一定温度范围内的DSC曲线对空白基线的偏移量,即矫正后热流率。将这3条曲线数据进行一系列的计算和代换,可以得到待测物质相关热力学数据[12]。

图1 三线法DSC曲线示意图
Fig. 1 Schemat diagram of DSC curve of three-line method
其计算公式如下所示:
 (6)
(6)
 (7)
(7)
式中:qr、qs、qb分别为标准物质(蓝宝石片)、待测物质、空白基线的热流率;nr、ns分别为标准物质、待测物质的量;Cp,r,m、Cp,s,m分别为标准物质、待测物质的摩尔定压热容。
进而通过换算可得
 (8)
(8)
2) 标准生成焓、熵和吉布斯自由能
首先采用DSC方法检测CoOOH从室温升温到516 K时的吸附水和结合水的脱除以及转化为Co3O4的过程,反应式如下:
CoOOH=1/3 Co3O4+1/12O2+1/2 H2O (9)
Co3O4的生成反应是在516 K左右时发生,根据Hess定律[13],设计如图2所示的热力学循环。

图2 在不同温度下反应式(9)的反应过程热力学循环图
Fig. 2 Thermodynamic diagram of Reaction(9) at different temperatures
在图2中,不同温度下的Co3O4、O2、H2O等物质的相关热力学数据(摩尔热容、热焓、熵)都可以在相应热力学手册上查到,其中516 K时的反应热焓ΔH2可以通过DSC实验直接测量得出,而升温过程中CoOOH的摩尔热容可以通过检测和计算得出[14],进而得出该升温过程吸热焓ΔH1,再通过能量守恒 (即△H1+△H2=△H3+△H4+△H5+△H6和△S1+△S2=△S3+△S4+△S5+△S6),计算可得出在一定温度下(298.15 K)的反应焓△H3和反应熵ΔS3,然后通过计算反应式的过程热力学数据,得到标准生成焓 和生成熵
和生成熵 ,再根据关系式
,再根据关系式
 (10)
(10)
可以得到在一定温度下CoOOH的标准生成吉布斯自由能。
2 结果与分析
2.1 CoOOH的溶解平衡与溶液pH值之间的关系
在溶解平衡实验中,采用原子吸收光谱法(AAS)检测溶液中剩余钴离子浓度c[Co],而此时溶液的氢氧根离子浓度c[OH-]=10(pH+lgKw),其准溶解平衡常数为K′=c[Co]·c[OH-]3。实验结果如表1所列。
从表1可以看出,随着温度的增加,CoOOH的伪溶解平衡常数常数逐步增加。虽然结果略有差异,但是数量级比较稳定,所以相对可靠的数据认为在实验结果中CoOOH伪溶解平衡常数的数量级分别为10-39、10-38和10-37,选择其作为CoOOH的伪溶解平衡常数。在高温时CoOOH的伪溶解平衡常数较大,这是由于CoOOH的溶解反应为吸热反应(即式(2)的逆反应),而当体系温度较高时,CoOOH的水解沉淀-溶解平衡反应的逆反应趋势增加,相应的溶液中钴离子平衡浓度较大。
表1 在不同温度时CoOOH的伪溶解平衡常数
Table 1 Per-precipitation-dissolution equilibrium constant of CoOOH at different temperatures

由结果看出CoOOH的伪溶解平衡常数远大于Co(OH)3的溶解平衡常数(1×10-44),这表明同样Co3+的水解程度较小。这是因为在臭氧氧化体系中Co3+会水解生成CoOOH沉淀而不是Co(OH)3。图3所示为CoOOH粉末的XRD谱和SEM像,从产物的物相分析XRD谱看出,衍射线较宽,且强度较低,表明其结晶不完整,得到的沉淀为无定型态,该产物相对晶型完整的Co(OH)3稳定性较差,处于能位较高的介稳状态[15];同时,结合SEM像可以看出沉淀产物为不规则极小的微粒聚集而成的无规则蓬松物质,比表面积很大,表面能比较高,稳定性较差而易于溶解。

图3 CoOOH粉末的XRD谱和SEM像
Fig. 3 XRD pattern(a) and SEM image(b) of CoOOH powder
利用实验伪溶解平衡常数和不同温度下水的离子积常数并结合相关公式换算,做出溶液中钴离子浓度与溶液体系pH值平衡曲线,得到强氧化体系下溶液中钴离子浓度与pH值平衡关系图(即lgc[Co]T-pH图),如图4所示,该结果可以为臭氧氧化除钴时提供参考控制条件。

图4 在不同pH值条件下臭氧氧化反应体系中CoOOH溶解平衡曲线
Fig. 4 Curves of precipitation-dissolution equilibrium of CoOOH at different pH values
2.2 CoOOH的相关热力学函数
2.2.1 摩尔定压热容的测定
采用SDTQ600同步热分析仪检测得到的CoOOH粉末的DSC-TGA曲线如图5所示,反应中CoOOH粉末和蓝宝石质量分别为12.24和61.71 mg。从图5中可以看出,该升温过程中在373 K和516 K左右时各有一个吸热峰,分别对应吸附水的吸热挥发和CoOOH粉末的吸热分解,并对应一定的质量损失,加热过程中稳定的重量减少对应的是少量CoOOH脱水转化为Co2O3的过程。根据该分析曲线,可以得到分解反应时的焓变为14.57 kJ/(mol·K)。

图5 CoOOH粉末的DSC-TGA曲线
Fig. 5 DSC-TGA curve of CoOOH powder
同时得到该升温过程中检测到CoOOH粉末的热流率、空白基线以及蓝宝石的热流率。查阅相关热力学数据,可得α-Al2O3的比热容等详细数据,本温度范围内其摩尔定压热容公式如下所示:
Cp,m(α-Al2O3)=103.851+26.267·10-3T-29.091·105·T-2 (J·mol-1·K-1) (11)
已知实验检测过程中升温速率β,可知其在不同温度下的热流功率。通过三线法进行计算,即可得到CoOOH粉末的比热容数据。为了排除粉末中吸附水的影响同时又考虑到结合水,将温度范围定为较高温度。
其中,CoOOH粉末与α-Al2O3的质量随着反应的进行会有所变化,其中CoOOH和α-Al2O3的相对分子量为91.93和102,β为5 K/min。通过计算得出CoOOH和α-Al2O3的物质的量,并将上表中数据根据三线法中换算方法,即可得到不同温度时CoOOH粉末的摩尔定压热容,如表2所列。
将得到的数据作图,得到下图6,利用最小二乘法[16],结合比热容经典公式对所得数据进行拟合,得到在一定温度范围内的拟合摩尔定压热容函数公式如下所示:
Cp,m(CoOOH)=-140.8T-1.055×109T-2+0.1332T2+4.237×104 (J·mol-1·K-1) (12)
2.2.2 标准生成热力学函数的计算
表2 在不同温度下CoOOH的摩尔定压热容
Table 2 Mole heat capacities of CoOOH at different temperatures


图6 CoOOH粉末的摩尔热容曲线
Fig. 6 Curve of mole heat capacity of CoOOH powder
根据热力学公式
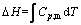 (13)
(13)
 (14)
(14)
 (15)
(15)
同时结合图2和图5中在516 K时的反应热△H,即可计算并得到CoOOH在不同温度下的相关热力学数据如下所示:
△H1+△H2=△H3+△H4+△H5+△H6 (16)
△S1+△S2=△S3+△S4+△S5+△S6 (17)
 (18)
(18)
根据差热扫描检查,可知在516 K左右时,反应热焓为△H2=-14.5 kJ/mol,其余物质的热焓同样可以通过查阅相关数据并计算得到,相关公式如下所示:
 (19)
(19)
 (20)
(20)
 (21)
(21)
通过循环计算可以得到298.15 K时分解反应的热焓△H3如下所示:
△H3=△H4+△H5+△H6-(△H1+△H2)=145.01 kJ/mol (22)
同时,该反应方程式中
△H3=1/3△fHm[Co3O4(s)]+1/12△fHm[H2O(g)]+1/2△fHm[O2(g)]-△fHm[CoOOH(s)] (23)
因此,可得
△fHΘm[CoOOH(s)]=1/3△fHm[Co3O4(s)]+1/12△fHm[H2O(g)]+1/2△fHm[O2(g)]-△H3=-437.14 kJ/mol (24)
同理,根据热力学循环以及相关数据,可以求得该产物在298.15 K时的标准摩尔熵
△fSΘm[CoOOH(s)]=-184.624 J/(mol·K) (25)
综上,可以求出
△fGΘm[CoOOH(s)]=△fHΘm[CoOOH(s)]-T△fSΘm[CoOOH(s)]=-382.099 kJ/mol. (26)
根据本方法测得在298.15 K时的CoOOH的标准摩尔吉布斯自由能与JOHN等[9]利用液相平衡法结合氧化还原电位得到的数据(-386.3678 kJ/mol)相似,虽然测定方法不同,但是所得结果相似,因此本数据具有一定的参考意义。
2.2.3 计算结果的指导意义
根据所得CoOOH的热力学数据,可以计算相关反应体系的可行性分析,如溶液中硫酸体系和盐酸体系下的臭氧氧化沉钴反应如下所示:
Co2++1/2O3+2OH-=CoOOH+1/2H2O+1/2O2 (27)
查阅相关物质298.15 K时的溶液中的热力学函 数[17-18],如表3和4所列。
表3 298.15 K时CoOOH的标准生成热力学函数
Table 3 Standard thermodynamic functions of formation CoOOH at 298.15 K

表4 标准状态下相关物质的标准摩尔吉布斯自由能
Table 4 Molar Gibbs free energy of relevant materials

通过计算可以得到反应过程的标准摩尔吉布斯自由能△rGΘm如下所示:
△rGΘm=△fGm(CoOOH)+1/2△fGm(H2O)+1/2△fGm(O2)-[△fGm(Co2+)+1/2△fGm(O3)+2△fGm(HO-)]=-233.66 kJ/mol (28)
可以看出上述反应的△rGm为负值,说明这种反应在标准状态下的热力学方面可行。类似地,通过CoOOH粉末热力学数据的研究,可以为涉及到CoOOH的反应过程提供借鉴和指导。
3 结论
1) 通过渐近法测得不同温度下CoOOH在水溶液中的伪溶解平衡常数,溶解平衡常数随着温度的增加而减少;并通过换算得到臭氧氧化体系酸性溶液中钴离子浓度溶解平衡与pH值的关系。
2) 采用差热分析仪器得到CoOOH 粉末在加热至分解反应过程中的热流,并通过三线法得到CoOOH 粉末从常温到分解温度时的摩尔定压热容数据,并结合经典热容公式对CoOOH 粉末的摩尔定压热容数据进行拟合,得到其函数曲线。
3) 利用反应过程热力学循环,计算得到CoOOH 粉末在298.15 K时的标准摩尔焓、标准摩尔熵和标准摩尔吉布斯自由能。通过得到的结果,分析臭氧氧化溶液中钴离子的可行性,由于反应方程的标准摩尔吉布斯自由能△rGΘm小于0,表明反应在理论上同样具有可行性。本研究中得到的数据可以对有关CoOOH的反应过程进行指导和借鉴。
REFERENCES
[1] 乐颂光. 钴冶金[M]. 北京: 冶金工业出版社, 1987: 2-5.
LE Song-guang. Metallurgy of cobalt[M]. Beijing: Metallurgical Industry Press, 1987: 2-5.
[2] 杨敏杰, 南俊民, 侯宪鲁, 薛建军, 崔 燕, 崔 明. 表面覆CoOOH的球形Ni(OH)2的制备及快充性能[J]. 电化学, 2006, 12(2): 205-209.
YANG Min-jie, NAN Jun-ming, HOU Xian-lu, XUE Jian-jun, CUI Yan, CUI Ming. Preparation of spherical Ni(OH)2 coated with CoOOH and its fast charge performance[J]. Electrochemistry, 2006, 12(2): 205-209.
[3] CHANG Zhao-rong, LI Hua-ji, TANG Hong-wei, YUAN Xiao-zi, WANG Hai-jiang. Synthesis of γ-CoOOH and its effects on the positive electrodes of nickel batteries[J]. International Journal of Hydrogen Energy, 2009, 34(5): 2435-2439.
[4] 侯新刚, 刘文武, 李彩霞, 王有福, 王旭峰. 表面包覆不同含量CoOOH的氢氧化镍对镍电极电化学性能的影响[J]. 兰州理工大学学报, 2013, 39(5): 10-14.
HOU Xin-gang, LIU Wen-wu, LI Cai-xia, WANG You-fu, WANG Xu-feng. Influence of nickel hydroxide coated with CoOOH of various content on electrochemical characteristics of nickel electrode[J]. Journal of Lanzhou University of Technology, 2013, 39(5): 10-14.
[5] TIAN Qing-hua, XIN Yun-tao, GUO Xue-yi, YUAN Ting-gang, WANG Heng-li. Preparation of Co3O4 from leaching solution of cobalt-rich slag by ozonation[J]. Materials Research Innovations, 2014, 18(S4): s87-s91.
[6] TIAN Qing-hua, GUO Xue-yi, YI Yu, LI Zhi-hai. Kinetics of oxidation-precipitation of cobalt(Ⅱ) from solution by ozone[J]. Transactions of Nonferrous Metals Society of China, 2010, 20(S1): s42-s45.
[7] 田庆华, 辛云涛, 姚 标, 郭学益. 锌湿法冶金过程中臭氧氧化沉淀除去微量钴[J]. 中国有色金属学报, 2013(4): 1140-1144.
TIAN Qing-hua, XIN Yun-tao, YAO Biao, GUO Xue-yi. Efficient purification of trace cobalt in zinc hydrometallurgical process by ozone oxidation[J]. The Chinese Journal of Nonferrous Metals, 2013(4): 1140-1144.
[8] AVRAMOV L K. Derivatographic study of CoOOH decomposition[J]. Thermochimica Acta, 1977, 19(2): 147-152.
[9] HEM J D, ROBERSON C E, LIND C J. Thermodynamic stability of CoOOH and its coprecipitation with manganese[J]. Geochimica et Cosmochimica Acta, 1985, 49(3): 801-810.
[10] 黄可龙. 无机化学[M]. 北京: 科学出版社, 2009.
HUANG Ke-long. Inorganic chemistry[M]. Beijing: Science Press, 2009.
[11] 尹 杏. 异极矿热力学数据的测定研究[D]. 长沙: 中南大学, 2011.
YIN Xing. Study on the measurement of thermodynamic data of hemimorphite[D]. Changsha: Central South University, 2011.
[12] 四川大学编著. 分析化学[M]. 北京: 科学出版社, 2006.
Sichuan University. Analytical chemistry[M]. Beijing: Science Press, 2006.
[13] 傅献彩, 沈文霞, 姚天扬. 物理化学[M]. 北京: 高等教育出版社, 2000: 103.
FU Xian-cai, SHEN Wen-xia, YAO Tian-yang. Physical chemistry[M]. Beijing: Higher Education Press, 2000: 103.
[14] BOSENICK A, GEIGERC A, CEMIC L. Heat capacity measurements of synthetic pyrope-grossular garnets between 320 and 1 000 K by differential scanning calorimetry[J]. Geochimica et Cosmochimica Acta, 1996, 60(17): 3215-3227.
[15] 李洪桂. 冶金原理[M]. 北京: 科学出版社, 2008.
LI Hong-gui. Theory of metallurgy[M]. Beijing: Science Press, 2008.
[16] 苏金明, 阮沈勇. Matlab实用教程[M]. 北京: 电子工业出版社, 2008: 92-131.
SU Jin-ming, RUAN Shen-yong. Matlab practical course[M]. Beijing: Publishing House of Electronics Industry, 2008: 92-131.
[17] 张平民. 工科大学化学[M]. 长沙: 湖南教育出版社, 2002.
ZHANG Ping-min. Advanced chemistry for engineering[M]. Changsha: Hunan Education Publishing House, 2002.
[18] 杨显万, 何蔼平, 袁宝州. 高温水溶液热力学数据计算手册[M]. 北京: 冶金工业出版社, 1983.
YANG Xian-wan, HE Ge-ping, YUAN Bao-zhou. Thermodynamic data reckoner of high temperature aqueous solution[M]. Beijing: Metallurgical Industry Press, 1983.
(编辑 王 超)
基金项目:国家自然科学基金资助项目(51104181)
收稿日期:2014-04-19;修订日期:2014-11-25
通信作者:郭学益,教授,博士;电话/传真:0731 88877863;E mail: xyguo@ csu.edu.cn