盐度耦合FNA对短程反硝化过程中N2O还原的影响
刘甜甜1, 2,刘牡1,王淑莹1,杨庆1,彭永臻1
(1. 北京工业大学 北京市水质科学与水环境恢复工程重点实验室,
北京市污水脱氮除磷处理与过程控制工程技术研究中心,北京,100124;
2. 中国建筑科学研究院,北京,100013)
摘要:为研究氧化亚氮(N2O)转化过程的影响因素,采用长期处理含盐垃圾渗滤液的活性污泥进行反硝化批次试验,考察不同NaCl盐度条件下,游离亚硝酸(FNA)对N2O还原的临界抑制质量浓度及N2O的积累情况。研究结果表明:不同盐度下FNA对N2O还原的临界抑制质量浓度不同,盐度越高, FNA对N2O还原的临界抑制质量浓度越低。盐度对N2O的积累产生明显影响,N2O的积累量随着盐度的增加而增高。10,20,30,35和40 g/L盐度下,反硝化过程中N2O的最大积累量分别达到进水总氮的19.1%,33.2%,39.0%,53.5%和56%。污泥通过培养驯化,可以提高其抵抗FNA抑制的能力,使FNA对N2O还原的临界抑制质量浓度得以提高,有利于减少N2O的产生。
关键词:盐度;垃圾渗滤液;反硝化;N2O还原;
中图分类号:X703.1 文献标志码:A 文章编号:1672-7207(2013)08-3561-08
Impact of salinity coupling FNA on N2O reduction during denitrification via nitrite
LIU Tiantian1, 2, LIU Mu1, WANG Shuying1, YANG Qing1, PENG Yongzhen1
(1. Key Laboratory of Beijing for Water Quality Science and Water Environment Recovery Engineering,
Engineering Research Center of Beijing, Beijing University of Technology, Beijing 100124, China;
2. China Academy of Building Research, Beijing 100013, China)
Abstract: In order to study the influencing factors during the conversion process of Nitrous oxide (N2O), batch tests were conducted with the sludge treating landfill leachate for a long time. In this study, the inhibitory effect of free nitrous acid (FNA) concentration on N2O reduction and accumulation at different salinity were investigated. The results show that: there are some differences of the minimum inhibition concentration of FNA on N2O reduction under different salinity, which gradually reduce as the increasing of salinity; the accumulation of N2O increases with the increase of salinity, implying that N2O production is bound up with the salinity; the accumulation of N2O at 10, 20, 30, 35 and 40 g/L salt account for 19.1%, 33.2%, 39.0%, 53.5% and 56% of influent total nitrogen, respectively; the acclimatization of sludge can increase the ability to resist FNA inhibition, weaken the inhibition of FNA on N2O reduction and thus reduce N2O emission.
Key words: salinity; landfill leachate; denitrification; N2O reduction
自然界中的氮循环受到人类活动的巨大影响[1],由于微生物作用使得对流层中的N2O以每年0.25%的速率增长,这是大气中移动氮的重要来源之一[2]。温室气体的过量排放,会引起气候变化,威胁地球上的生物,其中也包括人类本身,N2O作为主要的温室气体之一,N2O分子使全球变暖的能力是CO2的300倍以上,并且N2O对臭氧层存在很强的破坏力[3]。N2O是反硝化脱氮过程的中间产物,然而,在反硝化过程中,游离亚硝酸(FNA)会对N2O的还原产生抑制,阻碍N2O的还原,使得N2O的产生量增加[4]。Alinsafi等[5]研究发现,反硝化过程中N2O的释放与系统中NO2-的质量浓度呈明显的正相关性,表明NO2-的存在对N2O还原酶的活性产生抑制。Wunderlin等[6]的研究表明,向反应器内投加亚硝酸时,立刻伴有N2O的产生,当NO2-全部消耗完时,N2O的产生停止。Zhou等[4]通过对反硝化除磷系统的研究认为FNA是影响硝化细菌和反硝化细菌产生N2O的主要因素,并且揭示了FNA对N2O还原的抑制质量浓度为0.7~1.0 μg/L。同时,盐度也是影响N2O产量的重要原因[7]。短程硝化反硝化工艺由于其能耗低、节省有机碳源,反应速率快,污泥产量低等优点在众多生物脱氮工艺中脱颖而出[8-9],垃圾渗滤液高氨氮的水质特点为短程脱氮工艺的实现提供了便利。然而,由于填埋场垃圾的长年堆埋,无机盐离子在渗滤液中逐年堆积,再受到季节和雨量的影响,使得渗滤液通常都含有较高的盐度,并且盐度的波动范围广。盐度的波动给渗滤液生物处理工艺的稳定运行带来了巨大影响,因为高渗透压的条件下,会导致细胞脱水,发生质壁分离,甚至是微生物的死亡[10]。因此,在垃圾渗滤液反硝化脱氮的过程中,N2O的还原会受到盐度与FNA的双重影响,研究不同盐度下FNA对N2O还原的影响对于深入探讨N2O的产生机理及N2O的减量控制具有重要意义。基于以上研究背景,本文作者在通过不同盐度与FNA质量浓度下的反硝化批次试验,确定不同盐度下FNA对N2O还原的临界抑制质量浓度。为垃圾渗滤液等含盐工业废水短程生物脱氮工艺运行中N2O的减量和控制提供基础数据。
1 材料和方法
1.1 试验装置及方案
SBR系统按照进水、曝气、缺氧搅拌、沉淀、排水的模式运行,采用pH,DO和ORP作为实时控制参数控制各阶段反应时间,排水比为1/5, 每天运行1个周期,稳定运行18个月,在此基础上,进行批次试验。SBR装置与批次实验装置如图1所示。具体方案如下:通过在不同盐度下(0,10,20,30,35和40 g/L)设定不同的初始NO2--N质量浓度(20,40和50 mg/L)进行反硝化批次试验。采用NaNO2配制成10 mg/L NO2--N的溶液调节起始 NO2--N质量浓度,用NaCl调节盐度,乙醇作为反硝化碳源,为不使碳源投加量成为反硝化过程限制因素,C/N比控制在5~6。反应开始采用0.1 mol/L的NaOH和0.1 mol/L的HCl调节pH,以提供不同的FNA质量浓度。MLSS质量浓度为(5 300±200) mg/L,温度为(25±0.5) ℃。
1.2 试验用水及检测方法
SBR进水采用本实验室处理垃圾渗滤液的升流式厌氧污泥床(UASB)出水,UASB出水水质指标见表1。批次试验时,采用SBR反应器内具有良好短程脱氮活性的活性污泥,用自来水洗泥2~3次,使水中盐度为0 g/L,以便用NaCl调节盐度。

图1 试验装置图
Fig. 1 Experimental device
表1 UASB出水水质指标
Table 1 Characteristics of UASB effluent

DO、pH及温度采用WTW测定仪(型号:WTW Multi340,德国)及相应探头在线监测;盐度采用GMK-510AC型折光盐度计测定;COD采用快速测定法测定;N2O采用N2O微电极在线监测;氨氮、亚硝态氮、硝态氮以及污泥质量浓度均采用标准方法测定[11],FNA的计算按照文献[12]所述方法进行。
2 结果与讨论
2.1 SBR典型周期内各污染物及实时控制参数的变化
图2所示为SBR系统在一个典型周期内各污染物与实时控制参数的变化规律。从图2可以看出:pH,DO和ORP曲线的变化规律与硝化反硝化反应有着很好的相关性。硝化阶段,随着碱度的消耗、H+和NO2-的产生,pH逐渐降低,ORP逐渐升高。硝化结束时pH和ORP曲线上出现拐点,DO曲线上出现突跃点。高FA与FNA对AOB与NOB的选择性抑制,使得系统的亚硝积累率可以长期稳定在90%以上。反硝化阶段,NO2-被还原,溶液中OH-质量浓度增加,pH逐渐升高,ORP逐渐降低,在反硝化结束时,pH曲线出现平台,ORP由于NOx--N的消失而迅速下降,总氮去除率达99%以上。
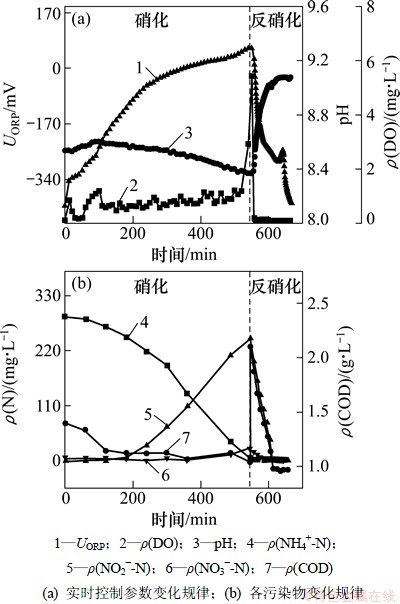
图2 SBR系统典型周期内各污染物与实时控制参数的变化
Fig. 2 Conversion of pollutants and real-time control parameters in SBR in a typical cycle
2.2 不同盐度下FNA对N2O还原的临界抑制质量浓度
微生物的反硝化作用,可以将水中的亚硝态氮转变成氮气,实现氮的彻底去除。反硝化过程中亚硝态氮首先在亚硝酸盐还原酶(NiR)的作用下还原成NO,进而在NO还原酶(NoR)作用下还原成N2O,最后通过N2O还原酶(N2OR)还原成N2,因此N2O是反硝化阶段氮还原的必经途径。N2O的产生受到很多因素的影响,例如污泥龄、有机负荷、碳源种类、DO、pH和温度等[13]。FNA能够影响酶的活性,对N2O还原产生竞争性抑制[14]。
图3所示为在0 g/L盐度下,反硝化过程中NO2--N,FNA和溶液中N2O含量的变化情况。反硝化过程中,NO2--N逐渐被还原,pH升高,FNA质量浓度逐渐降低,0 g/L盐度下的各组实验,均未在反应过程中检测到N2O的产生,表明在该组实验条件下,N2O的产生和还原并未受到FNA的明显影响,各组实验中FNA最高质量浓度达11.6 μg/L,可见,在0 g/L盐度下,FNA对N2O还原的临界抑制质量浓度高于11.6 μg/L。
图4所示为在10 g/L盐度下,反硝化过程中NO2--N,FNA和溶液中N2O含量的变化情况。在初始pH大于8.0,亚硝为20 mg/L和50 mg/L时,均未在反应过程中检测到N2O的产生。当将pH降低到7.27时,初始FNA质量浓度显著增加,达到8.7 μg/L,该试验条件下,在溶液中检测到了N2O的产生,反硝化过程中N2O的产生规律先增加后降低。从图4可以看出:溶液中N2O的积累速率与NO2--N的降解速率基本一致,这说明,反硝化过程中NO的还原在该试验条件下没有受到明显抑制,否则N2O的积累速率应明显慢于NO2--N的还原速率。另外,N2O的还原完全受到抑制,因此使得减少的亚硝酸盐全部转变成了N2O,N2O的积累速率等于NO2--N降解速率。

图3 0 g/L盐度下反硝化过程中各物质的变化
Fig. 3 Profile of pollutants during denitrification at 0 g/L salt
N2O的还原在反硝化初期受到抑制的原因是:(1) 反硝化过程中N2O还原酶N2OR的合成滞后于亚硝酸还原酶NiR,反硝化初期,由于N2OR的匮乏而使N2O不能迅速被还原成N2,造成N2O积累[15]。(2) 反硝化过程中多种还原酶存在对电子的竞争,其中以N2OR对电子的竞争力最弱[16],因此当NO2-存在时,N2O的还原受阻,造成N2O积累。
由图4可见:随着反硝化的进行,FNA质量浓度逐渐降低,N2O的积累出现下降,N2O含量下降时对应溶液中的FNA质量浓度,可以认为是FNA对N2O还原的临界抑制质量浓度,因为溶液中FNA高于此值时N2O的还原受阻,当FNA低于此值时,N2O开始还原。由此可知,10 g/L盐度下,FNA对N2O还原的临界抑制质量浓度为1.3 μg/L。
图5所示为在20 g/L盐度下,反硝化过程中NO2--N,FNA和溶液中N2O含量的变化情况。在初始pH大于8.0,亚硝质量浓度为20 mg/L和50 mg/L时,均未在反应过程中检测到N2O的产生,当pH降低到7.78时,初始FNA质量浓度大大增加,达到2.7 μg/L,该试验条件下,在溶液中检测到了N2O的产生,反硝化过程中N2O的产生规律先增加后降低,N2O积累的峰值点对应的FNA质量浓度为0.27 μg/L,即该盐度下,FNA对N2O还原的临界抑制质量浓度为0.27 μg/L。在初始pH大于8.0,亚硝质量浓度为20 mg/L和50 mg/L时,虽然初始FNA高于N2O还原的临界抑制质量浓度,但是反应过程中没有检测到N2O,因为初始FNA略高于临界抑制质量浓度,对N2O的抑制作用还不明显,随着反硝化的进行,很快降低至抑制质量浓度以下,所以全程中N2O的积累极少,以至于未检测出。
图6所示为在30 g/L盐度下,反硝化过程中NO2--N,FNA和溶液中N2O含量的变化情况。在初始pH大于8.0,亚硝质量浓度为20 mg/L和40 mg/L时,均可在反应过程中检测到N2O的产生。初始亚硝质量浓度为20 mg/L时,FNA对N2O还原的抑制质量浓度为0.23 μg/L。初始亚硝质量浓度为40 mg/L时,FNA对N2O还原的抑制质量浓度为0.2 μg/L。即30 g/L盐度下,FNA对N2O还原的临界抑制质量浓度为0.20~0.23 μg/L。
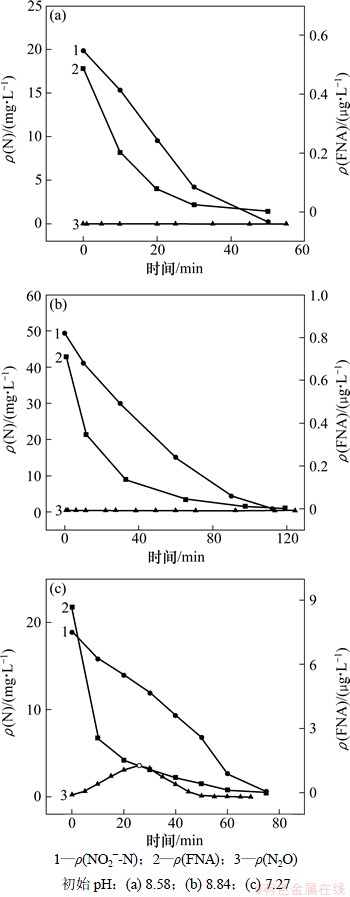
图4 10 g/L盐度下反硝化过程中各物质的变化
Fig. 4 Profile of pollutants during denitrification at 10 g/L salt
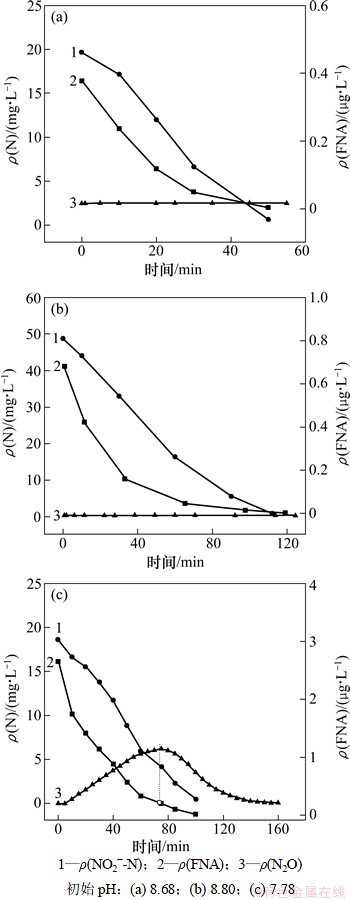
图5 20 g/L盐度下反硝化过程中各物质的变化
Fig. 5 Profile of pollutants during denitrification at 20 g/L salt
由图7和图8可知:35 g/L盐度下,FNA对N2O还原的临界抑制质量浓度为0.076~0.087 μg/L;40 g/L盐度下,FNA对N2O还原的临界抑制质量浓度为0.013~0.031 μg/L。随着盐度的增加,FNA对N2O还原的临界抑制质量浓度越低,这说明,盐度越高,N2O的还原对于FNA的存在更加敏感。
2.3 不同盐度下N2O的积累情况
各盐度下,FNA对N2O还原的临界抑制质量浓度及N2O的积累情况如表2所示。从N2O的积累情况来看,盐度越高,N2O的积累量也越大。
0 g/L盐度下,在各组试验中,未检测到N2O的积累。10,20,30,35和40 g/L盐度下,N2O的最大积累量分别达到进水总氮的19.1%,33.2%,39.0%,53.5%和56%。在高盐度下,N2O的还原受阻,积累量增加,大大增加了N2O向环境中逸出的风险。
有研究报道,自然界中来自反硝化过程的N2O有1/4~1/3都来自海洋系统[17] ,这也从侧面说明了盐度的存在对于N2O还原的巨大影响。因此,在进行含盐污水生物处理时,应密切关注N2O的产生情况,并且积极寻找高盐条件下降低N2O产量的方法。
表3所示为本研究和部分文献报道的FNA或NO2--N对N2O还原的抑制质量浓度。从表3可以看到:在本研究中,随着盐度的增加,FNA对N2O还原的临界抑制质量浓度逐渐降低,而NO2--N质量浓度的变化没有规律,可见,FNA是N2O还原的真正抑制剂。表3中文献报道的FNA与NO2--N对N2O还原的抑制质量浓度都很低,而本研究中,在低盐度下,N2O的还原并未受到FNA的明显抑制。10 g/L盐度下,FNA对N2O还原的临界抑制质量浓度为1.3 μg/L,明显高于文献[8]报道的0.7~1.0 μg/L。在 30 g/L盐度下,N2O还原时水中NO2--N质量浓度为9.4~15.1 mg/L, 这比文献中报道的NO2--N的抑制质量浓度明显要高。产生这种差异的原因是本实验所用污泥长期处理含盐高氨氮垃圾渗滤液,在硝化结束时,溶液中NO2--N质量浓度通常能达到200 mg/L以上,经过长期的培养驯化,活性污泥耐FNA抑制能力增强。另一方面,FNA是N2O还原的真正抑制剂,垃圾渗滤液本身的pH偏高,通常在8.0以上,高pH使得水中FNA偏低,所以尽管水中NO2--N质量浓度高达9.4~15.1 mg/L,但不会影响N2O的还原。由此可见,FNA对N2O还原的抑制质量浓度,可以通过对污泥的培养驯化得到提高,这为N2O的减量和控制提供可能。
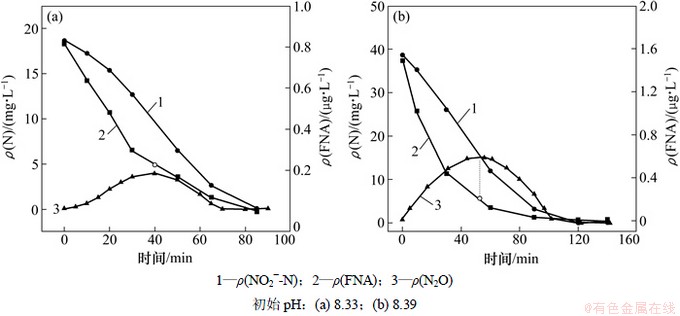
图6 30 g/L盐度下反硝化过程中各物质的变化
Fig. 6 Profile of pollutants during denitrification at 30 g/L salt
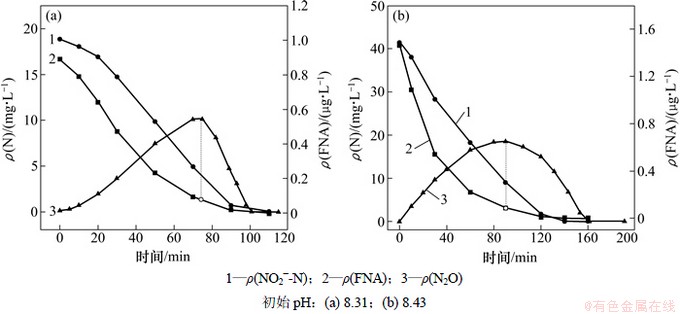
图7 35 g/L盐度下反硝化过程中各物质的变化
Fig. 7 Profile of pollutants during denitrification at 35 g/L salt

图8 40 g/L盐度下反硝化过程中各物质的变化
Fig. 8 Profile of pollutants during denitrification at 40 g/L salt
表2 实验结果汇总
Table 2 Summary of experimental results

表3 本文和文献中报道的FNA或NO2--N对N2O还原的抑制质量浓度
Table 3 Inhibitory effect of FNA or NO2-- N concentration on N2O reduction in literature and this study

3 结论
(1) 采用SBR反应器处理垃圾渗滤液,以pH,DO和ORP作为实时控制参数,可以实现稳定的短程脱氮工艺,在平均进水氨氮为1 206 mg/L的条件下,亚硝积累率和总氮去除率分别能长期稳定在90%和99%以上。
(2) 不同盐度下FNA对N2O还原的临界抑制质量浓度不同,盐度越高, FNA对N2O还原的临界抑制质量浓度越低。0,10,20,30,35和40 g/L盐度下,FNA对N2O还原的临界抑制质量浓度分别为>11.6,1.3,0.27,0.20~0.23,0.076~0.087和0.013~ 0.031 μg/L。
(3) 盐度越高,N2O的积累量越大,N2O向环境中逸出的风险越大。10 g/L盐度下,N2O的最大积累量达到进水总氮的19.1%,盐度增加至35 g/L和40 g/L时,N2O的最大积累量高达进水总氮的53.5%和56%,分别比10 g/L盐度下增加了34.4%和36.9%。
(4) FNA是N2O还原的真正抑制剂,污泥通过培养驯化,可以提高其抵抗FNA抑制的能力,使FNA对N2O还原的抑制质量浓度得以提高,有利于减少N2O的产生。
参考文献:
[1] Galloway J N. The global nitrogen cycle: Changes and consequences[J]. Environmental Pollution, 1998, 102(s1): 15-24.
[2] Battle M, Bender M, Sowers T, et al. Atmospheric gas concentrations over the past century measured in air from firn at the South Pole[J]. Nature, 1996, 383(6597): 231-235.
[3] IPCC. Climate change 1995: The science of climate change[M]. Cambridge: Ambridge University Press, 1996: 21-24.
[4] Zhou Y, Pijuan M, Zeng R J, et al. Free nitrous acid inhibition on nitrous oxide reduction by a denitrifying-enhanced biological phosphorus removal sludge[J]. Environmental Science and Technology, 2008, 42(22): 8260-8265.
[5] Alinsafi A, Adouani N, Beline F, et al. Nitrite effect on nitrous oxide emission from denitrifying activated sludge[J]. Process Biochemistry, 2008, 43(6): 683-689.
[6] Wunderlin P, Mohn J, Joss A, et al. Mechanisms of N2O production in biological wastewater treatment under nitrifying and denitrifying conditions[J]. Water Research, 2012, 46(4): 1027-1037.
[7] Tsuneda S, Mikami M, Kimochi Y, et al. Effect of salinity on nitrous oxide emission in the biological nitrogen removal process for industrial wastewater[J]. Journal of Hazardous Materials, 2005, 119(1/3): 93-98.
[8] Ganigue R, Volcke E I P, Puig S, et al. Systematic model development for partial nitrification of landfill leachate in a SBR[J]. Water Science and Technology, 2010, 61(9): 2199-2210.
[9] Chung J W, Bae W. Nitrite reduction by a mixed culture under conditions relevant to shortcut biological nitrogen removal[J]. Biodegradation, 2002, 13(3): 163-170.
[10] Kargi F, Uygur A. Biological treatment of saline wastewater in an aerated percolator unit utilizing halophilic bacteria[J]. Environmental Technology, 1996, 17(3): 325-330.
[11] State Environmental Protection Administration of China. Monitoring and analysis methods of water and wastewater[M]. 4th ed. Beijing: China Environmental Science Press, 2002: 200-281
[12] Anthonisen A C, Loehr R C, Prakasam T B S,et al.Inhibition of nitrification by free ammonia and nitrous acid[J]. Journal of Water Pollution Control Federation, 1976, 48(5): 835-852.
[13] Brenner A, Argaman Y. Effect of feed composition, aerobic volume fraction and recycle rate on nitrogen removal in the single-sludge system[J]. Water Research, 1990, 24(8): 1041-1049.
[14] Zhou Y, Oehmen A, Lim M, et al.The role of nitrite and free nitrous acid (FNA) in wastewater treatment plants[J]. Water Research, 2011, 45(15): 4672-4682.
[15] Letey J, Valoras N, Focht D D, et al. Nitrous-oxide production and reduction during denitrification as affected by redox potential[J]. Soil Science Society of America Journal, 1981, 45(4): 727-730.
[16] Schalk-Otte S, Seviour R J, Kuenen J G, et al. Nitrous oxide (N2O) production by Alcaligenes faecalis during feast and famine regimes[J]. Water Research, 2000, 34(7): 2080-2088.
[17] Houghton J T, Ding Y, Griggs D J, et al. Climate change 2001: the scientific basis: contribution of working group i to the third assessment report of the intergovernmental panel on climate change[M]. Cambridge: Cambridge University Press, 2001: 892.
(编辑 陈爱华)
收稿日期:2012-09-25;修回日期:2012-12-27
基金项目:国家自然科学基金(青年基金)资助项目(51008005);北京市教委科技创新平台项目;北京工业大学第10届研究生科技基金资助项目(ykj-2012-6916)
通信作者:彭永臻(1949-),男,黑龙江哈尔滨人,博士,教授,从事污水处理与过程控制、脱氮除磷等研究;电话:010-67392627;E-mail:pyz@bjut.edu.cn