DOI: 10.11817/j.issn.1672-7207.2017.03.010
掺Mg与接枝RGD的HAnps载体系统对MG63细胞胞吞功能的影响
陈恬1, 2,陈良建1, 3,贺惠莉1,彭静2,郭筱慧2,郑雅亦1,邵春生1
(1. 中南大学 湘雅三医院,湖南 长沙,410013;
2. 中南大学 湘雅医学院,湖南 长沙,410013;
3. 中南大学 粉末冶金国家重点实验室,湖南 长沙,410083)
摘要:采用水热合成法制备HAnps和掺镁HAnps (Mg-HAnps),通过硅烷化联合碳二亚胺法处理HAnps和Mg-HAnps后接枝黏附肽(RGD),以香豆素6(coumarin-6)为荧光探针标记HAnps,Mg-HAnps,RGD-HAnps和RGD-Mg-HAnps,并将其与人成骨肉瘤MG63细胞株(MG63)细胞共培养,研究掺Mg与接枝RGD的HAnps对MG63细胞胞吞作用的影响。研究结果表明:RGD-Mg-HAnps无细胞毒性,掺Mg与接枝RGD有利于MG63细胞胞吞HAnps颗粒,并有协同作用,RGD-Mg-HAnps具有介导胞吞的作用。
关键词:基因载体;掺Mg羟基磷灰石纳米颗粒(Mg-HAnps);黏附肽(RGD);靶向性;胞吞作用
中图分类号:R783.1 文献标志码:A 文章编号:1672-7207(2017)03-0625-10
Influence of HAnps carrier system with doping Mg and grafting RGD on endocytosis of MG63 cells
CHEN Tian1, 2, CHEN Liangjian1, 3, HE Huili1, PENG Jing2, GUO Xiaohui2,
ZHENG Yayi1, SHAO Chunsheng1
(1. Third Xiangya Hospital, Central South University, Changsha 410013, China;
2. Xiangya School of Medicine, Central South University, Changsha 410013, China;
3. State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China)
Abstract: HAnps and HAnps with doped Mg (Mg-HAnps) were prepared by hydrothermal synthesis method (HTSM), grafted adhesive peptide (RGD) after silanization combined with carbodiimide method, labeled HAnps, Mg-HAnps, RGD-HAnps, RGD-Mg-HAnps with coumarin-6 as a fluorescent label, and they were co-cultured with human osteosarcoma MG63 cell line (MG63) cells. The effects of HAnps with doping Mg and grafting RGD on endocytosis of MG63 cells were investigated. The results show that RGD-Mg-HAnps have no cytotoxicity. Mg-doped and RGD-grafted HAnps improve endocytosis of MG63 cells, which have synergistic effects. RGD-Mg-HAnps are able to promote endocytosis.
Key words: gene vector; Mg-doped Hydroxyapatite nanoparticles (Mg-HAnps); arginine-glycine-aspartic acid (RGD); targeting specificity; endocytosis
基因治疗的关键环节是寻找一种合适的载体将目的基因运输至靶细胞。以羟基磷灰石纳米颗粒(Hydroxyapatite nanoparticles,HAnps)为代表的无机(纳米)颗粒基因载体具有良好的生物可降解性、制作简单、易表面改性等优点,但HAnps仍存在转染效率不高和缺乏靶向性等不足。有研究发现纳米颗粒粒径为20~50 nm,转染效率较高[1];掺杂镁离子的HAnps(Mg-HAnps)表面带正电荷,有利于结合基因[2]。有研究发现受体-配体介导的方式可提高靶细胞的内吞纳米颗粒和颗粒内生化处理能力[3]。黏附肽(RGD)是由精氨酸-甘氨酸-天冬氨酸组成的一段短肽序列,是许多细胞表面的整合素(integrins)的特异性配体[4],已有研究发现在生物材料表面接枝RGD有利于细胞的黏附、铺展和增殖[5-7]。在Mg-HAnps表面接枝RGD,能否提高HAnps的膜靶向性和转染效率,有待于进一步研究。本文作者采用水热合成法制备HAnps和Mg-HAnps,通过硅烷化联合碳二亚胺法处理HAnps和Mg-HAnps后接枝RGD,以香豆素6(coumarin-6)为标记HAnps,Mg-HAnps,RGD-HAnps和RGD-Mg-HAnps,并将其与MG63细胞共培养,研究掺Mg与接枝RGD对HAnps的膜靶向性和胞吞作用的影响。
1 材料和方法
1.1 HAnps和Mg-HAnps的制备
通过水热合成法制备HAnps和Mg-HAnps,使(Ca+Mg)与P摩尔比为1.67、Mg与(Ca+Mg)摩尔分数分别为0和7.5%。称取适量的Ca(NO3)2·4H2O, Mg(NO 3)2·6H2O和(NH4)2HPO4分别溶于双蒸水中,配制浓度均为1 mol/L的溶液,并将适量的质量分数为2%的表面活性剂PEG2000加入Ca(NO3)2·4H2O和Mg(NO3)2·6H2O的溶液中。将(NH4)2HPO4以0.12 mL/min的速率滴入混合液中,使用SB-5200DTDN 超声波清洗机(宁波新芝生物科技股份有限公司生产)震荡反应前驱物1 h。用氨水调节混悬液至pH=10后,将混悬液转移至水热合成反应釜中,于电热鼓风干燥箱(广盈仪器有限公司生产,上海,中国)170 ℃下反应3 h,自然冷却至室温,试样用无水乙醇和双蒸水交替离心洗涤3次,1 000 r/min,每次5 min,弃上清液,保存于无水乙醇中。
1.2 HAnps和Mg-HAnps的表征
用X线衍射(XRD)技术对纳米颗粒进行物相分析,衍射角为20°<2θ<80°,采用Cu Kα射线进行X线衍射分析,工作电压和电流分别保持在40 kV和250 mA。采用JEM-2100F型场发射高分辨透射电镜(JEOL,东京,日本)检测HAnps和Mg-HAnps的形貌、粒径。
1.3 HAnps和Mg-HAnps接枝RGD
采用硅烷化联合碳二亚胺法接枝RGD时,配制EDC-MES (质量浓度为5 g/L),pH=5.5)和RGD-PBS (500 μg/mL, pH=7.2) 缓冲溶液,将形貌和分散性较佳的HAnps和Mg-HAnps试样置于以体积比为1:20的APTES的无水乙醇溶液中,超声振荡1 h后取出冷却至室温。用双蒸水、无水乙醇交替离心洗涤3~4次,弃上清,浸入EDC-MES 缓冲液中超声振荡2 h,分别用双蒸水和MES 缓冲液交替离心洗涤3~4次后,浸入RGD-PBS 缓冲溶液中反应4 h后取出。用双蒸水离心洗涤2遍后,置于真空冷冻干燥箱中冷冻干燥24 h,得到RGD-HAnps和RGD-Mg-HAnps粉末。
采用静电吸附法制备接枝RGD时,称取一定量的Mg-HAnps粉末于离心管中,加入RGD-PBS (500 μg/mL,pH=7.2)缓冲溶液,保持Mg-HAnps浓度与上述操作一致。室温下超声振荡1 h,静置4 h后,用双蒸水离心洗涤2次,置于真空冷冻干燥箱中冷冻干燥24 h。
1.4 RGD-HAnps的XPS检测
表面接枝RGD可引入Mg-HAnps本身不含的N 元素,故采用ESCALAB 250Xi XPS 光电子能谱仪检测各原子数分数和化学键,通过拟合C元素峰,检测C元素化学键存在形式,以此判断RGD是否成功接枝。
1.5 香豆素6(Coumarin-6)标记RGD-Mg-HAnps及检测
配制质量浓度为0.30 mg/mL的Coumarin-6的无水乙醇溶液,配制成质量浓度为0.05 g/mL的RGD-Mg-HAnps混悬液,在超声清洗机中超声振荡40 min(功率为100 W)后静置12 h。以1 000 r/min离心5 min,去上清,用无水乙醇、双蒸水分别离心洗涤3次,储存于双蒸水中。用巴氏管吸取少量混悬液,滴于24孔板中,于倒置荧光显微镜下观察其荧光特性。
1.6 MTT法检测RGD-Mg-HAnps的细胞毒性
1.6.1 RGD-Mg-HAnps混悬液的制备
将称量好的RGD-Mg-HAnps在等离子消毒机中消毒后,于超净工作台下用培养液(已灭活小牛血清与1640培养液体积比为1:9)配制成混悬液,质量浓度分别为0.10,0.25,0.50,0.75,1.00,1.50和2.00 mg/mL,共7组,置于EP管中,在细胞培养箱中放置浸提72 h,于4 ℃保存。
1.6.2 培养及检测
将L929细胞悬液按2.5×104个/mL接种于96孔细胞培养板中(200 μL/孔),并设阳性对照组、阴性对照组,每组6个复孔,培养24 h后使其完全贴壁。分别用200 μL的7个不同浓度浸提液的新鲜培养液交换材料实验组培养孔内原培养液,阴性和阳性对照组分别用200 μL含10%小牛血清的新鲜1640培养液和200 μL 苯酚(8 mol/L)更换原培养液。放进细胞培养箱培养48 h后取出,在倒置显微镜下观察细胞的形态。避光条件下加入20 μL MTT溶液(5 mg/mL),继续孵育4 h后终止培养,用吸水纸吸弃孔内培养上清液,每孔加入150 μL DMSO后振荡10 min,用酶联免疫检测仪在490 nm波长处检测吸光度,根据公式计算细胞的相对增殖率。

式中:R为相对增殖率;Atest为试验组平均吸光度;Af为阴性对照组平均吸光度。根据细胞的相对增殖率评定材料的细胞毒性程度分级。
表1 细胞毒性分级
Table 1 Cytotoxic grading

1.7 评价HAnps对MG63细胞胞吞的影响
1.7.1 MG63细胞的培养
MG63细胞成功复苏后置于37 ℃下体积分数5% CO 2培养箱内培养,每隔48 h更换一次培养液,培养液由已灭活的小牛血清和RPMI1640培养基按体积比1:9配置而成。于倒置显微镜下观察,培养瓶内细胞覆盖超过80%,即用0.25%胰蛋白酶液消化,将其分别接种到2个培养瓶进行传代培养。
1.7.2 不同处理方法与浓度的HAnps与MG63细胞共培养
共培养实验组设置HAnps, Mg-HAnps, RGD- Hanps,RGD-Mg-HAnps 4组,均已标记Coumarin-6,每组再设100,300和500 μg/mL等3种质量浓度,对照组为空白组。将不同方法处理的HAnps与10%胎牛血清的gibco RPMI-1640培养液配置成质量浓度为100,300和500 μg/mL的混悬液。将MG63细胞用0.25%胰酶消化,用含10%胎牛血清的gibco RPMI1640培养液终止消化,配置成5×104个/mL的细胞悬液,接种于24孔板中,每孔0.5 mL,放置在37 ℃下5% CO2细胞培养箱中培养24 h待完全贴壁后,以HAnps混悬液替代原培养液,1号板为HAnps组,设置1~3号孔,用浓度分别为100,300和500 μg /mL的HAnps混悬液100 μL替代原培养液,4号孔更换为新鲜的培养液为空白对照组,设4个复孔,完成换液后置于培养箱中继续培养24 h,取出后用PBS洗涤,在倒置显微镜下对比白光与荧光显微镜下图像,观察MG63细胞的胞吞情况。2~4号板分别为Mg-HAnps组、RGD-HAnps组和RGD-Mg-HAnps组,实验方法与1号板的相同。
2 结果
2.1 XRD及TEM检测结果
图1所示为HAnps和掺7.5%Mg-HAnps的XRD图谱。由图1可看出:HAnps和Mg-HAnps均出现了HAnps晶体的特征衍射峰(JCPDS No.9-0432);但HAnps和Mg-HAnps的主波峰和次波峰均降低、宽化,在12°,27°,32°和44°处,实验组样品均出现了新的波峰,而HAnps在这些位置则无波峰,结果表明:Mg2+掺入了HAnps中。
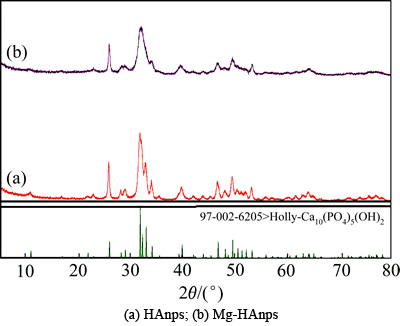
图1 HAnps和Mg-HAnps的XRD图谱
Fig. 1 XRD patterns of HAnps and Mg-HAnps
透射电镜(TEM)下观察HAnps和Mg-HAnp形貌如图2所示。从图2可看出:HAnps的颗粒形貌以杆状为主,而Mg-HAnps颗粒有杆状和细针状2种形貌,2组颗粒的粒径均在50~100 nm范围内。
2.2 RGD-Mg-HAnps 的XPS检测结果
图3所示为RGD-Mg-HAnps的C元素峰XPS拟合解析图。可见:采用硅烷化联合碳二亚胺法接枝RGD时,C元素以C—C键、C—H键、C—N键和N—C=O键等的形式存在;采用静电吸附法接枝RGD时,C元素以C—C键、C—H键、C—N键和O—C=O键等形式存在。O—C=O键为RGD多肽内固有的化学键,说明RGD与Mg-HAnps之间未形成新的化学键,而硅烷化联合碳二亚胺法接枝的RGD-Mg-HAnps中出现了N—C=O键,说明RGD与硅烷化联合碳二亚胺法处理后的Mg-HAnps表面形成化学键的结合,RGD已成功地接枝Mg-HAnps表面。

图2 HAnps和Mg-HAnps的TEM图
Fig. 2 TEM images of HAnps and Mg-HAnps
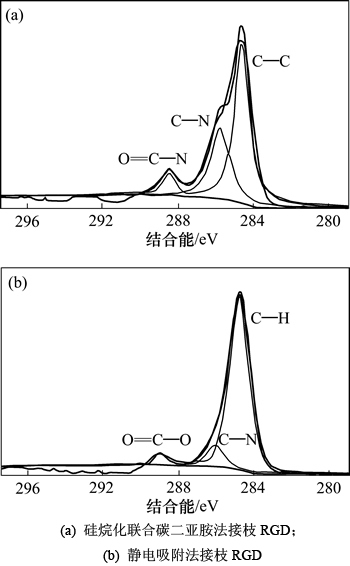
图3 RGD-Mg-HAnps中C元素峰XPS拟合解析图
Fig. 3 Fitting analytic graph of carbon element peak of RGD-Mg-HAnps prepared by XPS
2.3 RGD-Mg-HAnps的细胞毒性试验
用MTT法检测不同浓度的RGD-Mg-HAnps的细胞毒性,图4所示为RGD-Mg-HAnps与L929细胞共培养48 h后在倒置显微镜照片,(a)~(d)组为实验组,(e)为阴性对照组,(f)为阳性对照组。从图4可看出:(a)~(e)组细胞呈星形铺展,形态和贴壁良好,实验组与阴性对照组比较,在细胞数目和形态方面无明显差异,而(f)组已完全裂解,失去正常的形态和结构,呈残渣和碎片样表现。
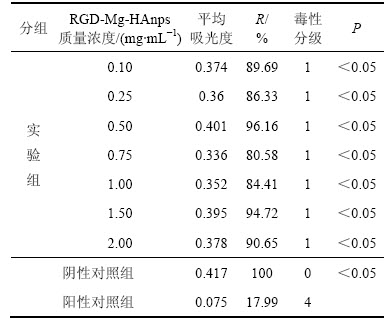
表2所示为RGD-Mg-HAnps在0.10~2.00 mg/mL对L929小鼠成纤维细胞的细胞毒性结果。由表2可知:实验组的相对增殖率与阳性对照组相比均有显著差异(P<0.05),各组细胞毒性分级均为0~1级,表明RGD-Mg-HAnps在0.10~2.00 mg/mL范围内对L929细胞均无毒性,满足GB/T 16886.5—2003“医疗器械生物学评价国家标准”中对生物材料的细胞毒性要求。
表2 RGD-Mg-HAnps的细胞毒性评价
Table 2 Cytotoxic evaluation of RGD-Mg-HAnps
2.4 不同处理方法与浓度的HAnps对MG63细胞胞吞作用的影响
Coumarin-6标记的HAnps, Mg-HAnps, RGD-HAnps和RGD-Mg-HAnps分别与MG63细胞共培养24 h后,在倒置荧光显微镜下观察胞内荧光强弱,比较不同浓度的纳米颗粒、掺Mg和接枝RGD对MG63细胞胞吞HAnps的影响。图5所示为Coumarin-6标记的HAnps与MG63共培养24 h的倒置荧光显微镜照片。从图5可以看出:不同浓度的HAnps与MG63细胞共培养,在同一时间点观察MG63细胞内的荧光强度不同,纳米颗粒浓度增加,胞内的荧光强度也有所增加,但增加不明显。图6所示为Coumarin-6标记的Mg-HAnps与MG63共培养24 h的倒置荧光显微镜照片。可见:随着Mg-HAnps的浓度增加,MG63细胞内的荧光浓度增加,在相同纳米颗粒浓度和共培养时间条件下,比较图6与图5中MG63细胞胞内荧光强度可发现,Mg-HAnps组对细胞胞吞的促进作用优于HAnps组对细胞胞吞的促进作用。图7所示为Coumarin-6 标记的RGD-HAnps与MG63共培养24 h的倒置荧光显微镜照片。可见:接枝RGD的HAnps与MG63细胞共培养24 h后观察,MG63细胞胞内有荧光的细胞数量和胞内荧光强度随纳米颗粒的浓度增加而增加。图8所示为Coumarin-6标记的RGD-Mg- HAnps与MG63细胞共培养24 h的倒置荧光显微镜照片。从图8可看出:不同浓度RGD-Mg-HAnps与MG63细胞共培养,在同一时间点观察,视野内的MG63细胞的胞浆内均有绿色荧光存在,纳米颗粒浓度增加,MG63细胞的胞浆内荧光强度增加不明显。

图4 RGD-Mg-HAnps与L929细胞共培养48 h的倒置显微镜照片
Fig. 4 Images of inverted microscope of L929 cells co-cultured with RGD-Mg-HAnps for 48 h
由此可知:在相同浓度和培养时间下,HAnps,Mg-HAnps,RGD-HAnps和RGD-Mg-HAnps组分别与MG63细胞共培养24 h后观察胞浆内有荧光的细胞数量和荧光强度明显不同,表明MG63细胞胞吞纳米颗粒的数量不同。RGD-Mg-HAnps组中MG63细胞胞浆内有荧光的细胞数量最多,荧光强度也明显优于其他3组,RGD-HAnps组对细胞胞吞的促进作用优于Mg-HAnps组和HAnps组对细胞胞吞的促进作用。结果表明,对HAnps进行掺Mg与表面接枝RGD处理均能促进MG63细胞胞吞HAnps,掺Mg后再接枝RGD的HAnps更有利于MG63细胞胞吞作用。
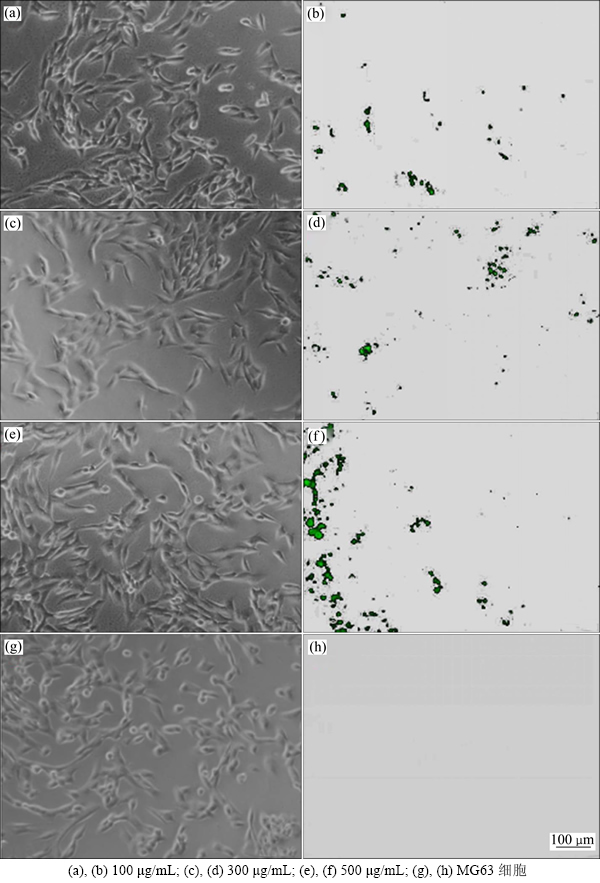
图5 Coumarin-6标记的HAnps与MG63共培养24 h的倒置荧光显微镜照片
Fig. 5 Inverted fluorescence microscope of HAnps with Coumarin-6 co-cultured with MG63 for 24 h

图6 Coumarin-6标记的Mg-HAnps与MG63共培养24 h的倒置荧光显微镜照片
Fig. 6 Inverted fluorescence microscope of Mg-HAnps with Coumarin-6 co-cultured with MG63 for 24 h
3 讨论
基因载体主要有病毒载体和非病毒载体两大类,其中病毒载体转染效率高,但存在致癌、免疫原性、细胞毒性等潜在风险[8],所以临床应用受限。与病毒载体相比,非病毒载体转染效率低,但其优势如下:毒性低、免疫反应低;所携带的基因不整合至宿主细胞基因组;材料来源广泛,化学结构可控制,便于大量制备;没有载体容量限制等。非病毒基因载体主要有阳离子多聚物、无机纳米颗粒、脂质体,树状聚合物等。其中阳离子多聚物(如PEI和PLL)表面富含正电荷,转染效率与相对分子质量成正比,但细胞毒性会随多聚物相对分子质量增加而增加[9]。脂质体为类细胞结构,易与血浆蛋白结合,易被自身免疫系统识别并清除,且具有一定的细胞毒性[10]。无机纳米颗粒是由无机材料制成的纳米结构颗粒,如HAnps、金纳米颗粒、磁性纳米颗粒、二氧化硅纳米颗粒、氧化铁纳米颗粒、量子点纳米颗粒、碳纳米管等。HAnps已被证明是基因转染的有效的非病毒载体[11-13],HA是牙齿和骨骼中天然的无机成分,具有优异的生物相容性和独特的生物功能;在pH为7.4的生理环境中不降解,而在pH低于6.5的胞吞小泡和溶酶体内降解,没有细胞毒性及免疫原性[14-17]。但HAnps还存在着转染效率不高和缺乏靶向性等不足,因而提高HAnps载体系统的转运效率和靶向性是研究热点。
HAnps的基因转染效率受粒径、表面电荷与界面形貌、Zeta电位和局部微环境等因素的影响[1]。在HAnps的结晶中掺杂能改变颗粒的理化特性[18]。有研究发现:在溶液环境中原子半径为0.09~0.13 nm的阳离子较容易取代钙离子(半径为0.1 nm),Mg2+的离子半径恰处于这范围之中,且具有抑止HAnps颗粒晶粒长大的作用,有利于控制HAnps的粒度[19-20];同时,镁元素是人体不可缺少的微量元素,掺杂Mg2+的HAnps表面带有正电荷,与DNA或RNA结构上磷酸基团的静电相互作用,有利于基因结合[21]。本研究通过控制工艺参数制备出平均粒径约为70 nm的分散性良好的Mg-HAnps,符合细胞胞吞纳米颗粒的粒径要求,掺Mg组与未掺Mg组分别与MG63细胞共培养,比较结果可知:掺Mg组MG63细胞胞浆内的荧光强度优于未掺Mg组,从而表明掺Mg的HAnps有利于MG63细胞的胞吞作用。
表面接枝改性是提高HAnps载体系统转染效率和靶向性的策略之一。有研究发现受体-配体介导能提高靶细胞的内吞纳米颗粒和颗粒内生化处理能力[3]。整合素家族是细胞表面受体的主要家族,通过募集整合素特异性配体,介导细胞与细胞、细胞与细胞外基质(ECM)之间许多重要的细胞功能,包括黏附、迁移、侵入等,并介导细胞与 ECM 之间的双向信号传导[6]。选择黏附肽(RGD)作为接枝材料,RGD是由精氨酸-甘氨酸-天冬氨酸组成的一段短肽序列,是许多细胞表面的整合素(integrins)的特异性配体,RGD能与成骨细胞胞膜上的α1β1和α5β1等整合素受体结合[22-24]。用硅烷化联合碳二亚胺法在HAnps表面接枝RGD后,选用HAnps,Mg-HAnps,RGD-HAnps和RGD-Mg-HAnps组分别与MG63细胞共培养24 h后发现,当纳米颗粒浓度和培养时间相同时,MG63细胞胞浆内有荧光的细胞数量和荧光强度明显不同,接枝RGD组的胞内有荧光的细胞数和荧光强度均优于未接枝组,提示接枝RGD可促进HAnps的胞吞作用。另外,接枝RGD组与掺Mg组也有不同,掺Mg2+和接枝RGD组的MG63细胞胞浆内有荧光的细胞数目和荧光强度明显高于仅掺Mg组或仅接枝RGD组,掺Mg和接枝RGD对促进MG63细胞胞吞HAnps有协同作用,其可能的原因如下:RGD是细胞表面整合素配体,能与细胞表面黏附分子的受体识别结合,在纳米颗粒表面接枝RGD,能通过受体-配体介导,提高纳米颗粒靶向细胞膜作用;掺Mg2+的HAnps表面带正电荷,而细胞膜表面带负电荷,两者间的静电吸引作用,有利于纳米颗粒向细胞表面迁移,通过静电吸引和受体-配体介导发挥协同作用,促进细胞对纳米颗粒的胞吞作用。

图7 Coumarin-6标记的RGD-HAnps与MG63共培养24 h的倒置荧光显微镜照片
Fig. 7 Inverted fluorescence microscope of RGD-HAnps with Coumarin-6 co-cultured with MG63 for 24 h

图8 Coumarin-6标记的RGD-Mg-HAnps与MG63共培养24 h的倒置荧光显微镜照片
Fig. 8 Inverted fluorescence microscope of RGD-Mg-HAnpswith Coumarin-6 co-cultured with MG63 for 24 h
4 结论
1) 通过控制水热合成法工艺参数和掺Mg能控制HAnps的形貌和粒径,制备杆状粒径均在50~100 nm范围的Mg-HAnps。
2) 硅烷化联合碳二亚胺法接枝的RGD-Mg- HAnps在0.10~2.00 mg/mL范围内无细胞毒性。
3) 掺Mg与表面接枝RGD均能促进MG63细胞的胞吞HAnps,掺Mg和表面接枝RGD能发挥协同作用,更有利MG63细胞胞吞HAnps。
参考文献:
[1] OLTON D, LI J, WILSON M E, et al. Nanostructured calcium phosphates (NanoCaPs) for non-viral gene delivery: influence of the synthesis parameters on transfection efficiency[J]. Biomaterials, 2007, 28(16): 1267-1279.
[2] HANIFI A, FATHI M H, SADEGHI H M, et al. Mg2+ substituted calcium phosphate nano particles synthesis for non viral gene delivery application[J]. Journal of Materials Science: Materials in Medicine, 2010, 21(8): 2393-2401.
[3] ZHANG S, LI J, LYKOTRAFITIS G, et al. Size-dependent endocytosis of nanoparticles[J]. Adv Mater, 2009, 21(4): 419-424.
[4] CHUA P H, NEOH K G, KANG E T, et al. Surface functionalization of titanium with hyaluronic acid/chitosan polyelectrolyte multilayers and RGD for promoting osteoblast functions and inhibiting bacterial adhesion[J]. Biomaterials, 2008, 29(10): 1412-1421.
[5] ZHANG Xiang, ZHOU Dali, LONG Qin, et al. Surface modification of apatite-wollastonite bioactive glass-ceramic by grafting with RGD peptides[J]. Journal of Inorganic Materials, 2013, 28(10): 1138-1142.
[6] XU S, OLENYUK B Z, OKAMOTO C T, et al. Targeting receptor-mediated endocytotic pathways with nanoparticles: rationale and advances[J]. Advanced Drug Delivery Reviews, 2013, 65(1): 121-138.
[7] AUZZAS L, ZANARDI F, BATTISTINI L, et al. Targeting v3 integrin: design and applications of mono- and multifunctional RGD-based peptides and semipeptides[J]. Cheminform, 2010, 17(13): 1255-1299.
[8] RAMAMOORTH M, NARVEKARL A. Non viral vectors in gene therapy-an overview[J]. Journal of Clinical & Diagnostic Research, 2015, 9(1): GE01-GE06.
[9] LIU C, ZHANG N. Chapter 13-nanoparticles in gene therapy: principles, prospects and challenges[J]. Progress Molecular in Biology & Translational Science, 2011, 104: 509-562.
[10] SOKOLOVA V, EPPLE M. Inorganic nanoparticles as carriers of nucleic acids into cells[J]. Angewandte Chemie, 2008, 47(8): 1382-1395.
[11] MAITRA A. Calcium phosphate nanoparticles: second- generation nonviral vectors in gene therapy[J]. Expert Review of Molecular Diagnostics, 2005, 5(6): 893-905.
[12] KUMTA P N, SFEIR C, LEE D H, et al. Nanostructured calcium phosphates for biomedical applications: novel synthesis and characterization[J]. Acta Biomaterialia, 2005, 1(1): 65-83.
[13] BISHT S, BHAKTA G, MITRA S, et al. pDNA loaded calcium phosphate nanoparticles: highly efficient non-viral vector for gene delivery[J]. International Journal of Pharmaceutics, 2005, 288(1): 157-168.
[14] LAI C, TANG S Q, WANG Y J, et al. Formation of calcium phosphate nanoparticles in reverse microemulsions[J]. Materials Letters, 2005, 59(2): 210-214.
[15] ROY I, MITRA S, MAITRA A, et al. Calcium phosphate nanoparticles as novel non-viral vectors for targeted gene delivery[J]. International Journal of Pharmaceutics, 2003, 250(1): 25-33.
[16] EPPLE M, KOVTUN A. Functionalized calcium phosphate nanoparticles for biomedical application[J]. Key Engineering Materials, 2010, 441: 299-305.
[17] MORGAN T T, MUDDANA H S, ALTINOGGLU E I, et al. Encapsulation of organic molecules in calcium phosphate nanocomposite particles for intracellular imaging and drug delivery[J]. Nano Letters, 2009, 8(12): 4108-4115.
[18] JALLOT E, NEDELEC J M, GRIMAULT A S. STEM and EDXS characterization of physico-chemical reactions at the perphery of sol-gel derived Zn-substituted hydrxyapatites during interactions with biological fluids[J]. Colloids & Surfaces Biointerfaces, 2005, 42(3/4): 205-210.
[19] SUZUKI T, HATSUSHIKA T, HAYAKAWA Y. Synthetic hydroxyapatites employed as inorganic cation-exchangers[J]. Journal of the Chemical Society Faraday Transactions, 1981, 5(5): 1059-1062.
[20] REN F, LENG Y, XIN R. Synthesis, characterization and b initio simulation of magnesium-substituted hydroxyapatite[J]. Acta Biomaterialia, 2010, 12(6): 2787-2796.
[21] KANZAKI N, ONUMA K, TREBOUX G, et al. Inhibitory effect of magnesium and zinc on crystallization kinetics of hydroxyapatite (0001) face[J]. Journal of Physical Chemistry B, 2000, 104(17): 4189-4194.
[22] CHUA P H, NEOH K G, KANG E T, et al. Surface functionalization of titanium with Hyaluronic acid/chitosan polyelectrolyte multilayers and RGD for promoting osteoblast functions and inhibiting bacterial adhesion[J]. Biomaterials, 2008, 29(10): 1412-1421.
[23] TAUBENBERGER A V,WOODRUFF M A,BAI H,et al. The effect of unlocking RGD-motifs in collagen I on pre-osteoblast adhesion and differentiation[J]. Biomaterials, 2010, 31(10): 2827-2835.
[24] BELLIS S L. Advantages of RGD peptides for directing cell association with biomaterials[J]. Biomaterials, 2011, 32(18): 4205-4210.
(编辑 赵俊)
收稿日期:2016-10-20;修回日期:2016-12-12
基金项目(Foundation item):国家自然科学基金资助项目(81571021);湖南省科技重点项目(2015WK3012);中南大学湘雅三医院新湘雅人才项目(20160301);湖南省高层次卫生人才“225”工程骨干人才项目(225);中南大学本科生自由探索计划项目(ZY2016758);中南大学粉末冶金国家重点实验室资助项目(621020094) (Project(81571021) supported by the National Natural Science Foundation of China; Project (2015WK3012) supported by the Hunan Provincial Science and Technology Department Program; Project(20160301) supported by the New Xiangya Talent Program of the Third Xiangya Hospital of Central South University; Project(225) supported by the High Level Health Personnel in Hunan Province, China; Project(ZY2016758) supported by the Undergraduate Free Exploration Program in Central South University; Project (621020094) supported by State Key Laboratory of Powder Metallurgy in Central South University)
通信作者:陈良建,博士,教授,主任医师,从事牙种植体修复、颌骨缺损的赝复体修复及新型肽种植体的研究;E-mail: jian007040@sina.com