
一种促进螺旋藻固定煤化工厂烟气CO2速率的编制网曝气器
郭王彪1,刘书政1,程军1,乔占山2,苏勇宁3,郭彩凤2,刘海军2,李玉国3
(1. 浙江大学 能源清洁利用国家重点实验室,浙江 杭州,310027;
2. 鄂尔多斯市加力螺旋藻业有限责任公司,内蒙古 鄂尔多斯,016199;
3. 内蒙古再回首生物工程有限公司,内蒙古 鄂尔多斯,016199)
摘要:在“碳中和”国家战略背景下,微藻减排烟气CO2技术以其经济可持续的特点广受关注。微藻减排烟气CO2高效、低成本和规模化发展过程中,为了提高螺旋藻过滤采收后循环液中NaHCO3质量浓度,提高螺旋藻固定煤化工厂烟气CO2速率,研制一种编制网式曝气器产生微米级CO2气泡,延长烟气CO2与循环液中Na2CO3的反应时间,促进高效生成NaHCO3;通过双指示剂法测试藻液中Na2CO3和NaHCO3质量浓度,通过显微镜测试了螺旋藻生长过程中藻丝螺距和长度变化规律,通过植物效率分析仪测试螺旋藻细胞的叶绿素OJIP荧光诱导动力学曲线。研究结果表明:烟气CO2通过编制网式曝气器反应后,跑道池中藻液的NaHCO3质量浓度比相同条件下通过传统曝气条的NaHCO3质量浓度提高43%;采用该循环液作为新鲜培养基,在跑道池中培养螺旋藻72 h后,螺旋藻的藻丝螺距和长度分别提高16%和12%,螺旋藻细胞暗适应下PSII最大量子产率和单位反应中心吸收光能分别提高21%和28%,最终导致螺旋藻生物质密度比未补充烟气CO2前提高15%。烟气CO2通过编制网式曝气器可转化为更多NaHCO3,从而促进了螺旋藻的生长固碳速率,为微藻固碳技术的高效、低成本规模化应用提供了技术设备选择。
关键词:曝气器;跑道池;螺旋藻;NaHCO3;煤化工厂烟气;CO2
中图分类号:X7 文献标志码:A 开放科学(资源服务)标识码(OSID)
文章编号:1672-7207(2021)06-1944-09
A staggered woven mesh aerator to improve CO2 fixation rate by Spirulina. sp from coal chemical plant flue gas
GUO Wangbiao1, LIU Shuzheng1, CHENG Jun1, QIAO Zhanshan2, SU Yongning3,
GUO Caifeng2, LIU Haijun2, LI Yuguo3
(1. State Key Laboratory of Clean Energy Utilization, Zhejiang University, Hangzhou 310027, China;
2. Ordos Jiali Spirulina Co. Ltd, Ordos 016199, China;
3. Inner Mongolia Rejuve Biotech Co. Ltd, Ordos 016199, China)
Abstract: In the context of national strategy of "carbon neutrality", the technology of CO2 fixation by microalgae receives much attention for its economic and sustainable characteristics. In order to increase the NaHCO3 mass concentration in the circulatory solution for improving the flue gas CO2 fixation rate from coal chemical plant by Spirulina biomass, a staggered woven mesh aerator was proposed. The circulatory solution was the residual solution after filtering and harvesting of Spirulina biomass solution. The staggered woven mesh aerator was used to produce the CO2 bubble with micrometer-grade bubble diameter, which can prolong the reaction time of CO2 bubble with Na2CO3 in the circulatory solution and produce higher NaHCO3 mass concentration. The mass concentrations of Na2CO3 and NaHCO3 in the microalgal solution were tested by the double indicator method, the changes of microalgal filament pitch and length during the growth of Spirulina were tested by microscopy, and the chlorophyll OJIP fluorescence-induced kinetic curves of Spirulina were tested by the Handy PEA. The results show that NaHCO3 mass concentration aerated to the staggered woven mesh aerator increases by 43% compared with that of the traditional rubber aerator. Taking this circulatory solution with higher NaHCO3 mass concentration generated at staggered woven mesh aerator as new culture medium and cultivating Spirulina biomass for 72 h, the trichome pitch and length of Spirulina increases by 16% and 12%, respectively. The maximum PSII quantum yield after dark adaption and the light absorption in the unit reaction center of Spirulina cells increases by 21% and 28%, respectively, which result in the increase of Spirulina biomass density by 15% compared with that before aerating coal chemical plant CO2 flue gas. Flue gas CO2 can be efficiently converted into NaHCO3 by compiling the staggered woven mesh aerator, thus promoting the CO2 fixation rate by Spirulina. It provides a technical equipment option for efficient and low-cost large-scale application of CO2 fixation by microalgae technology.
Key words: aerator; raceway pond; Spirulina; NaHCO3; coal chemical plant flue gas; CO2
2020年习近平总书记在联合国大会讲话指出:“中国CO2排放力争于2030年前达到峰值,努力争取2060年前实现碳中和”。我国CO2排放主要来源于燃煤电厂和煤化工厂烟气,其中,燃煤电厂烟气富含体积分数为10%~15%的CO2,煤化工厂烟气富含体积分数为99%的CO2[1-5]。
螺旋藻相较于其他微藻种类(例如小球藻和微拟球藻等)具有生长速率极快[6-7],采收周期短[8-9]以及主要利用碳酸氢根作为外加碳源的特点。而螺旋藻培养过程中会不断产生氢氧根到培养液中[8],因此,螺旋藻培养液中CO32-质量浓度会逐渐增高。若将含体积分数为99%的CO2的煤化工厂烟气通入螺旋藻培养液中,则可直接产生高质量浓度 ,用于螺旋藻的培养[10-12]。进一步地,将煤化工厂烟气CO2净化提纯至食品级CO2,则可生产出食品级螺旋藻藻粉,从而产生巨大经济效益。在煤化工厂烟气CO2与螺旋藻培养液反应过程中,如何延长CO2与螺旋藻培养液的反应时间,提高CO2利用效率,避免CO2回流至大气中是关键问题。
,用于螺旋藻的培养[10-12]。进一步地,将煤化工厂烟气CO2净化提纯至食品级CO2,则可生产出食品级螺旋藻藻粉,从而产生巨大经济效益。在煤化工厂烟气CO2与螺旋藻培养液反应过程中,如何延长CO2与螺旋藻培养液的反应时间,提高CO2利用效率,避免CO2回流至大气中是关键问题。
在实际应用中,通常采用曝气器在跑道池中直接曝气的方式为跑道池补充CO2[13-14],然而,该方法产生的CO2气泡的生成直径大(通常为毫米级),在藻液中的溶解与反应过程的时间短(通常为毫秒级),反应压力小(通常为常压),造成CO2利用效率低,多数CO2分子再次回流至大气中。若在进入跑道池前的循环液中通入CO2,利用循环液与CO2储罐的巨大压力(通常为0.2~0.5 MPa),辅助以微米级曝气器产生CO2微小气泡延长反应时间[15],则可显著提高CO2与Na2CO3的反应效率,将气态的碳转化为液态的碳储存于藻循环液中用于螺旋藻细胞生长,解决CO2气泡在培养液中停留时间与螺旋藻细胞CO2利用时间不匹配的难题[10]。
本文研制一种编制网式曝气器,应用于煤化工厂烟气CO2与螺旋藻循环液的反应,促进螺旋藻的规模化培养,对比煤化工厂烟气CO2补充前、传统曝气条式曝气器和编制网式曝气器反应前后的Na2CO3质量浓度、NaHCO3质量浓度、螺旋藻藻丝螺距和长度以及螺旋藻细胞光合反应效率等参数,证实了编制网式曝气器对于螺旋藻生物质密度具有显著提升作用。
1 材料与方法
1.1 微藻固定煤化工厂烟气CO2工艺流程
实验在内蒙古鄂尔多斯螺旋藻产业园开展,测试区域内布置有92个相同的跑道池,跑道池长度为110 m,宽度为6 m,平均液位深度为31.2 cm。跑道池依靠单浆轮驱动,每2个跑道池安装1个电机驱动浆轮,电机功率为1.5 kW,浆轮转速为40 r/min。浆轮每天7:00开,22:00关。为避免外界污染,在跑道池上方建有塑料大棚。
本文所用食品级CO2来源于低温甲醇洗脱碳装置回收的二氧化碳工业废气(体积分数为98%),经过预脱硫、气体压缩、有机硫水解、精脱硫、冷却除湿、分子筛吸附干燥、吸附脱醇、低温液化、低温精馏提纯和成品储存等工序流程及氨制冷等辅助工序,生产得到质量符合GB 10621—2006“食品添加剂液体二氧化碳”的食品级二氧化碳产品,所产生的CO2纯度达到99.99%,然后经罐车运输储存至螺旋藻产业园内的CO2液体储罐中。
图1所示为螺旋藻在跑道池反应器内培养、CO2利用、藻液过滤吸收和藻粉烘干收获运行模式图。由图1可见:
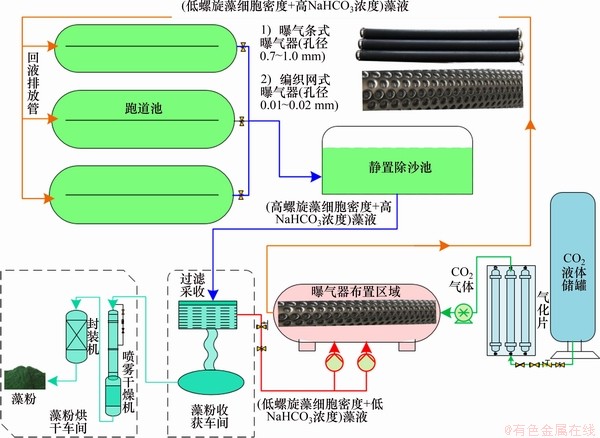
图1 螺旋藻在跑道池内固碳培养运行模式和CO2利用图
Fig. 1 Schematic diagram of Spirulina biomass cultivation and CO2 gas utilization at raceway ponds
1) 跑道池中螺旋藻藻液在第4 d培养期,将跑道池中一半体积的藻液经过静置除沙池沉降净化,然后通过过滤筛绢(孔径约40 μm)进行过滤收获,在该阶段的螺旋藻细胞密度较高,NaHCO3质量浓度较低;
2) 过滤后的(低藻细胞密度、低NaHCO3质量浓度)藻液通过管道与气化后的CO2气体在曝气器中混合反应,气化后的CO2气体具有0.2~0.3 MPa的压力,曝气器上布满微孔可降低CO2气泡直径,从而促进CO2气体与Na2CO3反应产生NaHCO3;
3) 反应后的(低藻细胞密度、高NaHCO3质量浓度)微藻循环液作为新鲜培养基进入下一轮培养周期;
4) 经筛绢过滤后的藻液通过喷雾干燥机和封装机烘干封装,得到食品级螺旋藻粉产品。
1.2 编制网式曝气器研制
为提高CO2气体与循环液中高质量浓度Na2CO3在短时间内(通常为几毫秒)的反应速率,在CO2气体与循环液混合区域布置微米曝气器产生微气泡是一种经济高效的方式。目前在螺旋藻产业园中最流行的曝气器形式是曝气条式曝气器,该曝气器为橡胶条材质,通过机械打孔控制孔径为0.7~1.0 mm。
本文研制了一种编制网式曝气器以降低CO2气泡生成直径,提高CO2吸收速率。该编制网式曝气器为不锈钢3层变孔编制网结构,其中,第1层为横向矩形编织网(孔径为300~500 μm),第2层为纵向矩形编织网(孔径为100~150 μm),第3层为圆孔曝气层(孔径为10~20 μm)。通过法兰与曝气器布置区域两侧连接。实际运行时,所有过滤后的循环液均需通过曝气器与CO2气体反应后再次回流至跑道池中。
2 藻液中无机碳浓度及螺旋藻光化学效率测试
2.1 藻液中无机碳浓度测试
藻液中Na2CO3和NaHCO3质量浓度采用双指示剂法进行测试[16-17]。测试时,吸取10 mL过滤的藻液于100 mL锥形瓶中加1滴酚酞指示剂,用0.1 mol/L的H2SO4标液滴定至无色,记此时消耗的H2SO4标液的体积为V1( +H+→
+H+→ )。再加2滴甲基橙指示剂用0.1 mol/L的H2SO4标液滴定由黄变为橙色,记此时消耗的H2SO4标液的体积为V2 (
)。再加2滴甲基橙指示剂用0.1 mol/L的H2SO4标液滴定由黄变为橙色,记此时消耗的H2SO4标液的体积为V2 ( +H+→CO2+H2O)。则藻液中Na2CO3和NaHCO3质量浓度为
+H+→CO2+H2O)。则藻液中Na2CO3和NaHCO3质量浓度为
ρ(Na2CO3)=c×V1×w/10,
ρ(NaHCO3)=c×(V2-V1)×w/10。
式中:ρ为质量浓度,g/L;c为H+浓度,即0.2 mol/L;w为质量分数,每次测试至少重复2次。
2.2 藻丝螺距和藻丝长度测试
实验过程中藻丝形态、藻丝螺距和藻丝长度通过显微镜(XSP-8CA,中国)观察。藻丝长度为螺旋藻藻丝的总长度,螺旋藻藻丝为波浪形状,具有典型的波峰波谷,藻丝螺距为相邻波峰(波谷)之间的距离。测试前通过目微尺(C1)标定显微镜的实际刻度,通过ISCaptue软件进行测试,样品选取尽可能保持大小均匀,藻丝无坏死现象,为保证数据的准确性,每组数据至少重复100次。
2.3 螺旋藻光化学效率测试
采用螺旋藻细胞暗适应下PSII的最大量子产额和单位反应中心吸收的光能表征螺旋藻细胞生长过程中光化学效率[18]。本文使用植物效率分析仪(Handy PEA,Hansatech,英国)测试螺旋藻细胞的叶绿素OJIP荧光诱导动力学曲线,每秒连续记录10万次荧光踪迹数据。根据OJIP荧光曲线可直接读出最大量子产额和单位反应中心吸收光能。测试前将螺旋藻细胞暗适应10~15 min,然后在黑暗条件下快速测试,对每个样品每种状况至少重复2次。
螺旋藻细胞生物质干重采用过滤法测试[1]。测试时,取1 L藻液用39 μm孔径筛绢过滤,用去离子水清洗3遍,于90 ℃烘干24 h至恒质量,称质量计算得到生物质质量浓度,每组测试重复2次。
3 结果与讨论
3.1 编制网曝气器提高藻循环液NaHCO3质量浓度
曝气器内所发生的反应主要为Na2CO3+CO2+H2O→2NaHCO3,该反应与反应压力、CO2气泡直径和反应时间等有直接关系。反应压力受CO2储罐罐体压力所控制,反应压力越大,反应速率越快。然而,过大反应压力会造成管道连接不稳定,因此,为提高循环液中NaHCO3质量浓度促进螺旋藻细胞生长,降低CO2气泡生成直径、延长反应时间是最经济、可行且高效的方式。本文研制的编制网式曝气器通过不锈钢三层变孔编织,使得曝气器孔径降低至10~20 μm,从而提高了循环液中NaHCO3质量浓度。
图2所示为跑道池内循环液与CO2气体在编制网曝气器和曝气条中反应后NaHCO3质量浓度,由图2可见:采用曝气条式曝气器反应后NaHCO3质量浓度从2.7 g/L升高至3.4 g/L,Na2CO3质量浓度从9.4 g/L降低至9.3 g/L,而采用编制网曝气器反应后NaHCO3质量浓度从2.7 g/L升高至3.7 g/L,Na2CO3质量浓度从9.4 g/L降低至9.2 g/L。相较于曝气条式曝气器,在编制网曝气器内NaHCO3质量浓度从0.7 g/L提高至1.0 g/L,提升了43%,而Na2CO3质量浓度从0.1 g/L提高至0.2 g/L。由此可见,编制网曝气器可有效促进CO2气体与Na2CO3的反应。其主要原因在于编制网曝气器的微小孔径大幅度降低了CO2气泡的直径(第1层提供横向剪切力,第2层提供纵向剪切力,最后圆孔曝气层提供气泡剪切作用),从而增加了CO2分子与 离子的接触时间,延长了反应时间,进而增大了反应效率。而反应后的高NaHCO3质量浓度循环液在跑道池中充分混合后,由于跑道池中仍有一半体积藻液,因此,NaHCO3质量浓度会有所下降,Na2CO3质量浓度会有所上升。
离子的接触时间,延长了反应时间,进而增大了反应效率。而反应后的高NaHCO3质量浓度循环液在跑道池中充分混合后,由于跑道池中仍有一半体积藻液,因此,NaHCO3质量浓度会有所下降,Na2CO3质量浓度会有所上升。
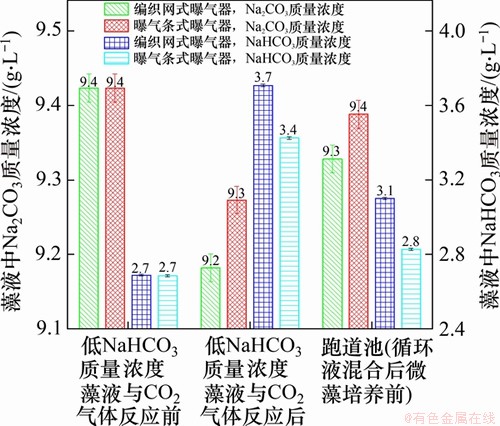
图2 跑道池内循环液与CO2气体在编制网曝气器和曝气条中反应后NaHCO3质量浓度
Fig. 2 NaHCO3 mass concentration after reaction of circulatory solution with CO2 gas at staggered woven mesh and rubber aerator
3.2 编制网曝气器对藻液NaHCO3质量浓度的影响
反应后的循环液与跑道池中保有的藻种体积的一半充分混合后开启下一周期的螺旋藻培养。在自然界的长期进化过程中,由于空气中CO2含量较低,无法满足细胞机体对碳的需求量,螺旋藻等微藻细胞体内进化出“碳浓缩机制(CCM)”[19-24],即利用细胞体外的NaHCO3或Na2CO3作为补充碳源以满足机体生长所需碳源。螺旋藻细胞通过膜上碳酸酐酶(CA)将 转运至细胞内,然后穿过类囊体膜转化为CO2分子,最后被羧酶体(carboxysomes)[23]中的Rubisco酶[22-24]固定参与到卡尔文循环中。在这一过程中,螺旋藻培养液中的
转运至细胞内,然后穿过类囊体膜转化为CO2分子,最后被羧酶体(carboxysomes)[23]中的Rubisco酶[22-24]固定参与到卡尔文循环中。在这一过程中,螺旋藻培养液中的 被源源不断吸收,同时释放出OH-(其具体机制尚有待考究),产生的OH-导致藻液中的
被源源不断吸收,同时释放出OH-(其具体机制尚有待考究),产生的OH-导致藻液中的 质量浓度逐渐增大,其主要反应式为
质量浓度逐渐增大,其主要反应式为 +OH-→
+OH-→ +H2O。
+H2O。
图3(a)所示为螺旋藻细胞接种后,跑道池培养过程中,藻液NaHCO3和Na2CO3质量浓度变化。由图3(a)可见:螺旋藻细胞在跑道池中培养过程中,藻液中NaHCO3质量浓度逐渐降低,而Na2CO3质量浓度逐渐升高。特别注意的是,在72 h培养周期内,在未补充CO2以前,NaHCO3质量浓度从2.4 g/L降低至1.7 g/L,采用曝气条曝气器补充CO2以后,NaHCO3质量浓度从2.8 g/L降低至2.1 g/L,而采用编制网曝气器补充CO2以后,NaHCO3质量浓度从3.1 g/L降低至2.0 g/L。相应地,在未补充CO2以前,Na2CO3质量浓度从9.6 g/L升高至10.2 g/L,采用曝气条曝气器补充CO2以后,Na2CO3质量浓度从9.4 g/L升高至9.8 g/L,而采用编制网曝气器补充CO2以后,Na2CO3质量浓度从9.3 g/L升高至9.6 g/L。这与图2所示结果相吻合,补充CO2以后,藻液中初始NaHCO3质量浓度上升,而更小孔径的微米级编制网曝气器有利于微米级CO2气泡的产生,从而提高接种后藻液中的初始NaHCO3质量浓度。较高的初始NaHCO3质量浓度导致螺旋藻细胞生长速率加快,进而导致藻液中NaHCO3质量浓度消耗速率加快,因而,编制网曝气器跑道池内初始NaHCO3质量浓度最高,同时,NaHCO3消耗速率也最快。
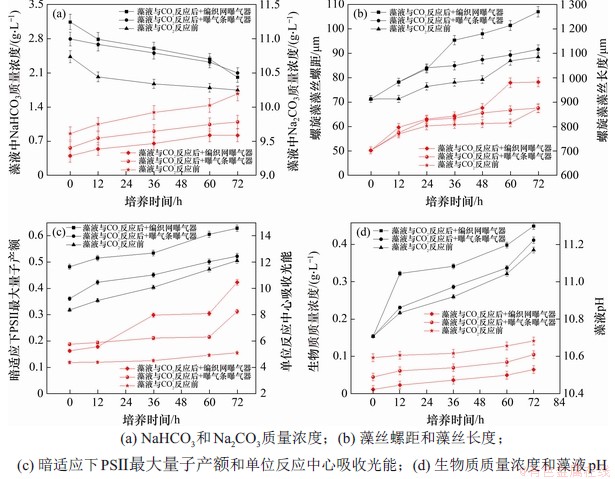
图3 跑道池内培养螺旋藻过程中藻丝生长的光合作用及营养盐消耗变化规律
Fig. 3 Law variation of photosynthesis of microalgal trichome and nutrients consumption in the Spirulina cultivation at the raceway ponds
3.3 编制网曝气器对藻丝螺距和藻丝长度的影响
螺旋藻细胞在跑道池培养过程中,编织网曝气器造成培养液中初始NaHCO3和Na2CO3质量浓度不同,从而对螺旋藻藻丝螺距和长度产生影响[25-26],如图3(b)所示。螺旋藻细胞在跑道池内培养过程中,螺旋藻藻丝螺距和藻丝长度均逐渐增大,在72 h培养周期内,在未补充CO2以前,藻丝螺距从71 μm提高至89 μm,藻丝长度从703 μm提高至875 μm。采用曝气条曝气器补充CO2以后,藻丝螺距和长度分别提高至92 μm和876 μm。而采用编制网曝气器补充CO2以后,藻丝螺距和长度分别提高至107 μm和983 μm。由此可见,相较于曝气条曝气器,采用编制网曝气器补充CO2后在跑道池中培养的螺旋藻藻丝螺距和长度在培养72 h后分别提高了16%和12%。
如前所述,编制网曝气器的微米级孔径导致CO2气泡直径减小,从而促进了CO2与Na2CO3的反应,导致藻液中初始NaHCO3质量浓度升高。充分供应碳源促进了螺旋藻细胞的暗反应,导致细胞内积累了更多的营养物质,进而加速细胞分裂,导致螺旋藻藻丝长度增加,而光合暗反应的促进引起藻细胞对于ATP和NADPH的需求增加,进而导致光反应速率增加。通过增加藻丝螺距,增大藻细胞内类囊体膜与光量子的接触面积,进而促进光反应[27]。因此,采用编制网曝气器补充CO2后,相较于曝气条曝气器,藻丝螺距和长度均有所增加。
3.4 编制网曝气器对螺旋藻细胞光合速率的影响
编制网曝气器和曝气条曝气器造成跑道池内藻液的初始NaHCO3质量浓度提升,从而提高了螺旋藻细胞光合作用能力。由如图3(c)可见:在72 h培养周期内,在未补充CO2以前,螺旋藻细胞暗适应下PSII最大量子产率从0.32增加至0.51,单位反应中心吸收光能从4.4增加至5.1。采用曝气条曝气器补充CO2以后,暗适应下PSII最大量子产率从0.36增加至0.52,单位反应中心吸收光能从5.8增加至8.2。采用编制网曝气器补充CO2后暗适应下PSII最大量子产率从0.48增加至0.63,单位反应中心吸收光能从5.3增加至10.5。相较于曝气条曝气器,采用编制网曝气器补充CO2后的循环液在跑道池中培养的螺旋藻细胞,在培养72 h后,暗适应下PSII最大量子产率和单位反应中心吸收光能分别提高了21%和28%。
最大量子产率亦称为最大PSII光能转换效率,增加藻丝螺距导致螺旋藻细胞内天线色素的受光面积增加[28-29],从而可能导致螺旋藻细胞的单位反应中心吸收光能和最大PSII光能转换效率增加。另一方面,供应充足的NaHCO3碳源导致螺旋藻细胞的卡尔文循环反应速率增加,对ATP的需求量增大,从而导致光合光反应速率增加,使单位反应中心吸收光能和最大PSII光能转换效率增加。
3.5 编制网式曝气器对螺旋藻生长速率的影响
在螺旋藻循环液中添加CO2与循环液中高质量浓度Na2CO3反应产生NaHCO3用于螺旋藻培养是一种行之有效的提高螺旋藻生长固碳速率的方式。采用编制网式微米级曝气器可进一步提高螺旋藻生长固碳速率。如图3(d)所示,在72 h培养周期内,在未补充CO2以前,螺旋藻生物质质量浓度从0.15 g/L增加至0.39 g/L,而采用曝气条曝气器和编制网曝气器补充CO2以后,螺旋藻生物质质量浓度分别增加至0.41 g/L和0.45 g/L,分别提高了5%和15%。这是由于曝气器产生的微气泡可提高CO2与Na2CO3的反应时间,从而产生更多的NaHCO3,进而提高了跑道池中接种液的碳源质量浓度,由于微藻细胞的碳浓缩机制,螺旋藻细胞可优先利用 离子,高质量浓度NaHCO3藻液促进了螺旋藻细胞的卡尔文循环,为满足光合暗反应所需的光能,螺旋藻藻丝的藻丝螺距和藻丝长度增加,螺旋藻细胞的单位反应中心吸收光能和最大PSII光能转换效率增加,从而导致螺旋藻生物质密度增加。
离子,高质量浓度NaHCO3藻液促进了螺旋藻细胞的卡尔文循环,为满足光合暗反应所需的光能,螺旋藻藻丝的藻丝螺距和藻丝长度增加,螺旋藻细胞的单位反应中心吸收光能和最大PSII光能转换效率增加,从而导致螺旋藻生物质密度增加。
藻液pH随着螺旋藻生物质质量浓度增加而升高,这主要是螺旋藻细胞生长过程中产生的OH-引起的。编制网式微米级曝气器反应后的螺旋藻液pH相较于未补充CO2前普遍偏低,这与NaHCO3质量浓度有关,NaHCO3质量浓度越大,藻液pH越低(纯NaHCO3溶液pH为8.4)。
4 应用前景展望
该编制网式曝气器在螺旋藻的规模化培养中具有广阔的应用前景。相较于通过曝气器在跑道池中直接曝气补充CO2形式,在进入跑道池前的循环液中通入CO2与Na2CO3反应,将气态的碳转化为液态的碳用于螺旋藻细胞的生长,无论从反应效率上还是从CO2利用率上均有较大提高。而传统的曝气条式曝气器受作业方式的限制,孔径最小可达0.7 mm,所产生的CO2气泡通常为1.0 mm以上,不利于CO2与Na2CO3反应。编制网式曝气器通过不锈钢钢丝的3层编制,出口孔径为10~20 μm,可使得CO2气泡受到多层剪切,大幅延长了CO2与Na2CO3的反应时间,从而提高了螺旋藻的生物质质量浓度。从实际应用看,编制网式曝气器安装简单,不易塞孔,具有广阔的应用前景。
5 结论
1) 研制了一种编制网式曝气器产生微米级CO2气泡,编制网曝气器的微小孔径大幅度降低了CO2气泡的生成直径(第1层提供横向剪切力,第2层提供纵向剪切力,最后圆孔曝气层提供气泡剪切作用),从而增加了CO2分子与 离子的反应时间,导致螺旋藻过滤采收后循环液中NaHCO3质量浓度提升,相较于传统曝气提高了43%,进而提高了螺旋藻的生长固碳速率。
离子的反应时间,导致螺旋藻过滤采收后循环液中NaHCO3质量浓度提升,相较于传统曝气提高了43%,进而提高了螺旋藻的生长固碳速率。
2) 采用在编制网曝气器补充CO2后的循环液作为新鲜培养液培养螺旋藻72 h,由于藻液中初始NaHCO3质量浓度升高,充分供应碳源促进了螺旋藻细胞的暗反应,导致细胞内积累了更多的营养物质,进而加速了细胞分裂,螺旋藻藻丝长度增加,而光合暗反应引起藻细胞对于ATP和NADPH的需求增加,进而导致光反应速率增加,从而使得螺旋藻藻丝螺距和长度分别提高了16%和12%。
3) 采用编制网曝气器补充CO2后,供应充足的NaHCO3碳源导致藻细胞的卡尔文循环反应速率增加,对ATP的需求量增大,从而导致光合光反应速率增加,螺旋藻藻细胞单位反应中心吸收光能提高了28%,螺旋藻生物质质量浓度相较于未补充CO2提高了15%。
参考文献:
[1] CHIARAMONTI D, PRUSSI M, CASINI D, et al. Review of energy balance in raceway ponds for microalgae cultivation: Re-thinking a traditional system is possible[J]. Applied Energy, 2013, 102: 101-111.
[2] CHEAH W Y, LING T C, SHOW P L, et al. Cultivation in wastewaters for energy: a microalgae platform[J]. Applied Energy, 2016, 179: 609-625.
[3] 胡自明, 夏奡, 黄云, 等. 光生物反应器内CO2传输与微藻固碳性能强化 [J]. 中国环境科学, 2018, 38(10): 3967-3974.
HU Ziming, XIA Ao, HUANG Yun, et al. Enhancement of CO2 transfer and carbon fixation by microalgae in photobioreactor[J]. China Environmental Science, 2018, 38(10): 3967-3974.
[4] 邓帅, 李双俊, 宋春风, 等. 微藻光合固碳效能研究: 进展、挑战和解决路径[J]. 化工进展, 2018, 37(3): 928-937.
DENG Shuai, LI Shuangjun, SONG Chunfeng, et al. Energy-efficiency research on photochemical-based microalgae carbon capture: progress,challenge and developing pathway[J]. Chemical Industry and Engineering Progress, 2018, 37(3): 928-937.
[5] 夏奡, 叶文帆, 富经纬, 等. 燃煤烟气微藻固碳减排技术现状与展望 [J]. 煤炭科学技术, 2020, 48(1): 108-119.
XIA Ao, YE Wenfan, FU Jingwei, et al. Current status and prospect of carbon fixation and emission reduction technology for coal-fired flue gas by microalgae[J]. Coal Science and Technology, 2020, 48(1): 108-119.
[6] HE Chang, FENG Xiao. Evaluation indicators for energy-chemical systems with multi-feed and multi-product[J]. Energy, 2012, 43(1): 344-354.
[7] CHANG Yuanyuan, WU Zucheng, BIAN Lei, et al. Cultivation of Spirulina platensis for biomass production and nutrient removal from synthetic human urine[J]. Applied Energy, 2013, 102: 427-431.
[8] CHENG Jun, LU Hongxiang, HE Xin, et al. Mutation of Spirulina sp. by nuclear irradiation to improve growth rate under 15% carbon dioxide in flue gas[J]. Bioresource Technology, 2017, 238: 650-656.
[9] DRAGONE G, FERNANDES B D, ABREU A P, et al. Nutrient limitation as a strategy for increasing starch accumulation in microalgae[J]. Applied Energy, 2011, 88(10): 3331-3335.
[10] CHENG Jun, GUO Wangbiao, AMEER ALI K, et al. Promoting helix pitch and trichome length to improve biomass harvesting efficiency and carbon dioxide fixation rate by Spirulina sp. in 660 m2 raceway ponds under purified carbon dioxide from a coal chemical flue gas[J]. Bioresource Technology, 2018, 261: 76-85.
[11] GUO Wangbiao, CHENG Jun, ALI K A, et al. Conversion of NaHCO3 to Na2CO3 with a growth of Arthrospira platensis cells in 660 m2 raceway ponds with a CO2 bicarbonation absorber[J]. Microbial Biotechnology, 2020, 13(2): 470-478.
[12] GUO Wangbiao, CHENG Jun, SONG Yanmei, et al. Developing a CO2 bicarbonation absorber for promoting microalgal growth rates with an improved photosynthesis pathway[J]. RSC Advances, 2019, 9(5): 2746-2755.
[13] RAZZAK S A, ALI S A M, HOSSAIN M M, et al. Biological CO2 fixation with production of microalgae in wastewate: a review[J]. Renewable and Sustainable Energy Reviews, 2017, 76: 379-390.
[14] CHENG Jun, SONG Yanmei, MIAO Yi, et al. Three-stage shear-serrated aerator broke CO2 bubbles to promote mass transfer and microalgal growth[J]. ACS Sustainable Chemistry & Engineering, 2020, 8(2): 939-947.
[15] 杨晓奕, 刘子钰, 刘朝宗, 等. 螺旋藻烟气固碳系统能耗及耦合因子交互关系[J]. 气候变化研究快报. 2020, 9(3): 182-191.
YANG Xiaoyi, LIU Ziyu, LIU Chaozong, et al. Interactive relationship in CO2 Spirulina-fixation system and energy consumption assessment[J]. Climate Change Research Letters, 2020, 9(3): 182-191.
[16] COUVERT O, GUEGAN S, HEZARD B, et al. Modeling carbon dioxide effect in a controlled atmosphere and its interactions with temperature and pH on the growth of L. monocytogenes and P. fluorescens[J]. Food Microbiology, 2017, 68: 89-96.
[17] JI Chunli, WANG Junfeng, LI Runzhi, et al. Modeling of carbon dioxide mass transfer behavior in attached cultivation photobioreactor using the analysis of the pH profiles[J]. Bioprocess and Biosystems Engineering, 2017, 40(7): 1079-1090.
[18] 李鹏民, 高辉远, STRASSER R J. 快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J]. 植物生理与分子生物学学报, 2005, 31(6): 559-566.
LI Pengmin, GAO Huiyuan, STRASSER R J. Application of the fast chlorophyll fluorescence induction dynamics analysis in photosynthesis study[J]. Acta Photophysiologica Sinica, 2005, 31(6): 559-566.
[19] MUKHERJEE A. CO2 concentration in chlamydomonas reinhardtii: effect of the pyrenoid starch sheath[J]. Plant Physiology, 2020, 182(4): 1796-1797.
[20] BADGER M R, PRICE G D. CO2 concentrating mechanisms in cyanobacteria: molecular components, their diversity and evolution[J]. Journal of Experimental Botany, 2003, 54(383): 609-622.
[21] ROCHAIX J D. The pyrenoid: an overlooked organelle comes out of age[J]. Cell, 2017, 171(1): 28-29.
[22] FREEMAN R E S, XU Bin, KUHN C L, et al. The eukaryotic CO2-concentrating organelle is liquid-like and exhibits dynamic reorganization[J]. Cell, 2017, 171(1): 148-162.e19.
[23] GIORDANO M, BEARDALL J, RAVEN J A. CO2 concentrating mechanisms in algae: mechanisms, environmental modulation, and evolution[J]. Annual Review of Plant Biology, 2005, 56: 99-131.
[24] MACKINDER L C M, CHEN C, LEIB R D, et al. A spatial interactome reveals the protein organization of the algal CO2-concentrating mechanism[J]. Cell, 2017, 171(1): 133-147.
[25] GAO Kunshan, MA Zengling. Photosynthesis and growth of Arthrospira (Spirulina) platensis (Cyanophyta) in response to solar UV radiation, with special reference to its minor variant[J]. Environmental and Experimental Botany, 2008, 63 (1/2/3): 123-129.
[26] OGATO T, KIFLE D. Morphological variability of Arthrospira (Spirulina) fusiformis (Cyanophyta) in relation to environmental variables in the tropical soda lake Chitu, Ethiopia[J]. Hydrobiologia, 2014, 738(1): 21-33.
[27] MA Zengling, GAO Kunshan. Photosynthetically active and UV radiation act in an antagonistic way in regulating buoyancy of Arthrospira (Spirulina) platensis(cyanobacterium)[J]. Environmental and Experimental Botany, 2009, 66(2): 265-269.
[28] LU Congming, JIANG Gaoming, WANG Baoshan, et al. Photosystem II photochemistry and photosynthetic pigment composition in salt-adapted halophyte Artimisia anethifolia grown under outdoor conditions[J]. Journal of Plant Physiology, 2003, 160(4): 403-408.
[29] TORZILLO G, ACCOLLA P, PINZANI E, et al. In situ monitoring of chlorophyll fluorescence to assess the synergistic effect of low temperature and high irradiance stresses in Spirulina cultures grown outdoors in photobioreactors[J]. Journal of Applied Phycology, 1996, 8(4/5): 283-291.
(编辑 秦明阳)
收稿日期: 2020 -11 -20; 修回日期: 2021 -01 -25
基金项目(Foundation item):国家重点研发项目(2016YFB0601003);浙江省重点研发项目(2020C04006) (Project (2016YFB0601003) supported by the National Key Research and Development Program; Project(2020C04006) supported by the Key Research and Development Program of Zhejiang Province)
通信作者:程军,博士,教授,从事CO2生物能源转化制合成燃料研究;E-mail:juncheng@zju.edu.cn
DOI: 10.11817/j.issn.1672-7207.2021.06.024
引用格式:郭王彪, 刘书政, 程军, 等. 一种促进螺旋藻固定煤化工厂烟气CO2速率的编制网曝气器[J]. 中南大学学报(自然科学版), 2021, 52(6): 1944-1952.
Citation:GUO Wangbiao, LIU Shuzheng, CHENG Jun, et al. A staggered woven mesh aerator to improve CO2 fixation rate by Spirulina. sp from coal chemical plant flue gas[J]. Journal of Central South University(Science and Technology), 2021, 52(6): 1944-1952.