网络首发时间: 2017-02-17 11:21
稀有金属 2017,41(06),613-619 DOI:10.13373/j.cnki.cjrm.xy16110038
铸态La2-xSmxMg16 Ni (x=0-0.4) 合金的气态储氢性能
冯佃臣 孙昊 王西涛 张羊换
北京科技大学新金属材料国家重点实验室
内蒙古科技大学材料与冶金学院
钢铁研究总院功能材料研究所
摘 要:
采用真空感应熔炼技术制备了La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 储氢合金。用X射线衍射 (XRD) 研究了合金吸放氢前后的相结构, 用Sievert测试了合金吸放氢动力学曲线, 采用Arrhenius法估算了合金吸放氢的活化能。结果表明, 铸态合金的主相是La2Mg17, 并存在少量的第二相SmNi和Sm5Mg41。合金吸氢后形成了氢化物LaH3和MgH2。合金的吸氢量、吸放氢动力学随Sm替代量的增加而增加, 当Sm替代量从x=0增加到x=0.4时, 最大吸氢量从4.458% (质量分数, 下同) 增加到4.925%。在3 MPa, 498 K下, 10 min的吸氢量分别为:4.308%, 4.342%, 4.488%, 4.564%, 4.787%;在真空、498 K下, 20 min的放氢量分别为1.684%, 1.521%, 1.779%, 1.666%, 2.131%。Sm替代对合金吸放氢动力学性能的改善主要归因于Sm使合金的活化能降低。随着合金中Sm替代量的增加, 合金生成焓ΔH的绝对值及吸氢平台压先减小后增加。制备合金中, La (1.7_Sm0.3Mg16Ni合金的生成焓ΔH的绝对值最小, 为-53.07 k J·mol-1。
关键词:
La-Mg-Ni合金;铸态;Sm替代;气态储氢;
中图分类号: TG139.7
作者简介:冯佃臣 (1977-) , 男, 内蒙古乌兰察布人, 博士研究生, 副教授, 研究方向:稀土储氢材料;E-mail:fdc21@imust.cn;;王西涛, 教授;电话:010-62332143;E-mail:xtwang@skl.ustb.cn;
收稿日期:2016-11-24
基金:国家自然科学基金项目 (51371094, 51471054);内蒙古科技大学材料与冶金学院青年孵化器项目 (214CY012) 资助;
Gaseous Hydrogen Storage Properties of La2-xSmxMg16Ni ( x = 0 ~ 0. 4) As-Cast Alloys
Feng Dianchen Sun Hao Wang Xitao Zhang Yanghuan
State Key Laboratory for Advanced Metals and Materials, University of Science and Technology Beijing
School of Materials and Metallurgy, Inner Mongolia University of Science and Technology
Department of Functional Material Research, Central Iron and Steel Research Institute
Abstract:
Hydrogen storage alloys of La2-xSmxMg16Ni ( x = 0, 0. 1, 0. 2, 0. 3, 0. 4) were prepared by induction melting furnace.The alloy structure was analyzed by X-ray diffraction ( XRD) before and after hydrogen absorption. The absorption/desorption hydrogen dynamics was investigated at different temperatures under pressure of 3 MPa. The activation energy of the alloy for absorption/desorption hydrogen was counted by Arrhenius means. The results showed that the main phase of the alloy was La2Mg17 when La was partially replaced by Sm, and the second phase was Sm Ni and Sm5Mg41. LaH3 and MgH2 phases were found in the alloy after hydrogen absorption. With increase of Sm content, the maximum absorption hydrogen storage capacity and the absorption/desorption hydrogen dynamics kinetics were increasing. The hydrogen absorption capacity was 4. 308%, 4. 342%, 4. 488%, 4. 564%, 4. 787% ( mass fraction, the same hereinafter) , at 3 MPa and 498 K within 10 min. However, the hydrogen desorption capacity was 1. 684%, 1. 521%, 1. 779%, 1. 666%, 2. 131% in vacuum and 498 K within 20 min. The absorption/desorption hydrogen dynamics of the alloy was improved because Sm reduced the activation energy of the alloy. With the increase of Sm content in the alloy, the absolute value of formation enthalpy ( ΔH) and hydrogen absorption platform pressure decreased firstly and then increased. The ΔH of La1.7Sm (0. 3) Mg16Ni alloys was the minimum value in prepared alloys, which was-53. 07 k J·mol-1.
Keyword:
La-Mg-Ni alloy; as-cast; Sm substitution; gaseous hydrogen storage;
Received: 2016-11-24
氢是一种理想的高能量密度且无污染的清洁能源。目前, 氢气的储存技术已成为解决氢能源利用技术的关键问题, 其对于氢燃料电池的应用具有决定性的影响[1,2,3]。在已经发现的金属基储氢材料中[4,5,6,7], La2Mg17合金由于其贮氢容量大、重量轻、资源丰富, 被认为是一种有发展潜力的储氢材料[8,9]。La2Mg17合金由于其吸放氢温度高且动力学性能差而限制了其实际应用[10]。为了克服La2Mg17合金的缺点, 研究者做了大量的研究工作。Khrussanova和Peshev[11]发现用Ni替代La2Mg17中的部分Mg, 可以提高合金的放氢速率。Liu等[12]研究了La2Mg16Ni和La2-xMxMg16Ni (M=Ca, Zr, x=0.05~0.20) 合金的储氢性能, 发现Ca或Zr对La部分取代之后, 合金的吸氢量有了显著的提高, 合金的吸放氢动力学性能也得到了改善。唐睿等[13]采用Sm, Dy部分取代La0.8Mg0.2Ni3.2Co0.6合金中的La, 改善了合金电极的循环稳定性。Li等[14]研究了La0.8-xSmxMg0.2Ni Co0.2Si0.05 (x=0~0.4) 合金的储氢性能, 发现Sm替代一定量的La可以明显提高合金的循环寿命和高倍率放电性能, 并且提高了合金的低温放电能力。
本文采用Ni部分替代Mg形成La2Mg16Ni储氢合金, 并用Sm部分替代La, 采用真空感应熔炼技术, 制备了La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 铸态储氢合金。研究了Sm对La2Mg16Ni储氢合金的吸放氢性能的影响。
1 实验
1.1 合金制备
合金的成分为La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) , 制备合金所用的原材料纯度均高于99.8%。用1 kg真空中频感应熔炼炉熔炼, 并经铜模浇铸后获得储氢合金铸锭。将储氢合金铸锭通过机械碎化并过200目的筛子后获得试验用储氢合金粉。采用了ICP微量元素分析仪 (HK-8100) 对熔炼后合金的准确成分进行了分析, 结果表明采用本文的制备方法获得的合金成分偏差很小, 本组实验的5个合金成分均在成分设计的实验误差范围之内。
1.2 结构分析
将储氢合金研磨成粒度为70μm以下的粉末, 用X射线衍射仪 (XRD, D8 ADVANCEX) 测试合金吸氢前后的相结构。测试条件为Cu Kα1靶, 管电压40 k V, 电流40 m A, 扫描速度10 (°) ·min-1, 扫描范围10°~90°。
1.3 吸放氢测试
用Sievert设备对铸态储氢合金进行活化, 并测试铸态合金在不同温度及3 MPa压力下吸放氢动力学曲线。实验称取0.5 g的储氢合金粉末, 装入样品室中, 在氢气压为3 MPa, 573 K下进行活化。储氢合金活化后, 在3 MPa下, 分别测试423, 498, 573 K下的吸氢动力学曲线;分别测试573, 593, 613, 633 K下放氢的动力学曲线。根据吸放氢动力学曲线数据, 用Arrhenius法估算了合金吸放氢的活化能。在593, 613, 633 K下测试储氢合金的PCT曲线。根据合金在不同温度下的吸放氢PCT曲线, 利用Van't Hoff方程拟合计算出储氢合金的生成焓ΔH以及生成熵ΔS。
2 结果与讨论
2.1 结构分析
用XRD分析La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 铸态合金吸氢前和吸氢后合金的相结构。结果如图1所示。由图1 (a) 可以看出, La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 铸态合金的主相是La2Mg17, 并存在少量的第二相Sm Ni和Sm5Mg41。由图1 (b) 可以看出, La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 铸态合金饱和吸氢后形成了氢化物La H3和Mg H2。合金饱和吸氢后没有探测到Sm的氢化物的特征衍射峰, 这可能是由于合金中Sm含量太少 (其最高原子含量是镁的1/40) 。

图1 铸态La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 合金的XRD图谱Fig.1 XRD patterns of as-cast La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) alloys
(a) Before hydrogen absorption; (b) After hydrogen absorption
2.2 气态吸氢的活化
在3 MPa、573 K下, La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 铸态合金进行多次活化。不同成分储氢合金的活化过程如图2所示。从图2中可以看出, 随着Sm替代量的增加, La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 铸态合金的活化性提高, 其中La1.6Sm0.4Mg16Ni第三次循环就完全被活化, 在前10 min内吸氢量达4.740%。Sm替代提高合金的活化性能可能与第二相Sm Ni和Sm5Mg41有关, 这可能是第二相对合金的吸氢具有一定的催化作用, 详细机制尚待进一步研究。
2.3 气态吸放氢动力学
经活化后的La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 铸态合金, 在3 MPa下, 423, 493, 573下测试合金的吸氢动力学, 如图3所示。在573, 593, 613, 633 K下测储氢合金的放氢动力学, 如图4所示。根据动力学曲线, 用Arrhenius法估算合金吸放氢的活化能。
从图3中可以看出, 在3 MPa下, 423, 498, 573 K吸氢, 随着Sm替代量的增加, 合金的吸氢速率增加, 改善了合金的动力学性能。在498 K时, 当Sm替代量从x=0增加到x=0.4时, 合金的最大吸氢量从4.458%增加到4.925%。Sm含量的增加微弱地降低了镁的含量, Mg H2的含量会少量下降。但是, 从图1 (b) 可以看到, Sm含量的增加使得合金的衍射峰逐渐宽化, 表明合金结构纳米化程随Sm含量的增加度逐渐加大, 产生了更多利于氢储存的晶界, 从而提高了合金的吸放氢量。因此, 随着Sm的取代量x增加, La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 合金最大吸氢量增加。在3 MPa, 498 K下, 在前10 min吸氢量分别为:4.308%, 4.342%, 4.488%, 4.564%, 4.787%。

图2 铸态La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 的活化过程Fig.2 Activation process of as-cast La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) alloys
(a) x=0; (b) x=0.1; (c) x=0.2; (d) x=0.3; (e) x=0.4; (f) The first activation process of alloys

图3 铸态La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 在不同温度下的吸氢动力学曲线Fig.3 Hydrogen absorption kinetic curves of as-cast La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) alloy at different temperature (a) 423 K; (b) 498 K; (c) 573 K
(a) 423 K; (b) 498 K; (c) 573 K

图4 铸态La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 在不同温度下放氢动力学曲线Fig.4 Desorption hydrogen dynamics curves of as-cast La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) alloy at different temperatures
(a) 573 K; (b) 593 K; (c) 613 K; (d) 633 K
从图4放氢动力学曲线可以看出, 在573, 593, 613和633 K温度下, 随着Sm元素替代量的增加, 合金的放氢速率增加。尤其在较低温度573K时, Sm的取代量对放氢速度的影响更为显著。在573 K温度下, 当Sm替代量为x=0.4时, 合金的最大放氢4.305%;而La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 合金的放氢量分别为1.684%, 1.521%, 1.779%, 1.666%, 2.131%在20 min时。但温度增加到633 K时, 不同替代量的合金的放氢动力学基本相同, 在10 min时, 都达到最大放氢量, 分别是4.628%, 4.691%, 4.808%, 4.788%, 4.814%。
为了揭示合金Sm替代对合金动力学的影响机制, 用Arrhenius法估算了合金的放氢活化能。一般认为, 活化能代表气-固反应必须克服的能垒, 是气-固反应的决定因素。对放氢反应而言, 活化能的变化代表放氢反应的真正驱动力。用Arrhenius法估算了放氢反应活化能。成核-长大的相变过程可以用JMAK模型[15,16]拟合。JMAK模型的公式为:

式中α为在时间t时合金转化为氢化物的分数 (即:每个时间点的吸氢量和该温度下最大吸氢量的比值) , k为动力学参数, η是指数或者反应级数。将ln[-ln (1-α) ]作为纵坐标, lnt作为成横坐标, 作ln[-ln (1-α) ]vs.lnt曲线图并进行线性拟合, 拟合后得到每一种合金的吸氢和放氢的线性关系式为

式中经a, b的值和JMAK模型对比可知, 所得每条线的斜率为a=η, 截距为b=ηlnk, 每种合金lnk的值为b比a的值, 再根据Arrhenius公式为:

式中Ea为活化能, R为气态常数, T为测试样品时的开尔文温度, k0为一个独立的温度系数, 由上述拟合得到的不同lnk值, 以lnk为纵坐标, 1000/RT为横坐标的lnk vs.1000/RT的标曲线图并进行线性拟合, 拟合后得到的方程为

由Arrhenius公式可以看出, 拟合得到的直线斜率的绝对值即为合金估算出的活化能值, 即合金的吸氢活化能Ea等于c的绝对值。
通过表1数据可以看出放氢的活化能大于吸氢的活化能, 放氢活化能几乎是吸氢活化能的5倍左右。在吸氢时, 活化的合金在423 K下有较快的反应速率, 时间约为1 min就基本能达到饱和吸氢。而在放氢时, 当放氢温度为573 K时放氢缓慢且放出的氢量远小于吸收的氢量。当放氢温度为593 K时, 放氢的时间较573 K时有着明显的缩短, 时间约为40 min能够完全将氢放出。
2.4 气态吸氢放氢热力学
为了研究La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 铸态合金气态吸放氢热力学性能, 在593, 613, 633 K下测试了合金的PCT曲线, 如图5所示。根据图5可以看出不同温度下的最大吸氢量, 列于表2。随着Sm的取代量的增加, La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 合金最大吸氢量增加。其中, 613 K下La1.6Sm0.4Mg16Ni吸氢量最大, 达到4.60%。吸放氢平台压随Sm替代量的增加, 呈现先降低后升高, 当x=0.3吸氢平台压最低。从表3可以看出随着Sm的取代量x增加, La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 合金最大吸氢量增加, 且随着温度升高, 吸放氢滞后增加。
表1 铸态La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 在3 MPa下吸放氢活化能Table 1Activation energy of as-cast La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) alloy for absorp-tion/desorption hydrogen at 3 MPa (k J·mol-1) 下载原图

表1 铸态La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 在3 MPa下吸放氢活化能Table 1Activation energy of as-cast La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) alloy for absorp-tion/desorption hydrogen at 3 MPa (k J·mol-1)
表2 La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0. 4) 铸态合金不同温度下最大吸氢量Table 2 Maximum hydrogen absorption capacity of ascast La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0. 4) alloy at different temperatures (%, mass fraction) 下载原图

表2 La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0. 4) 铸态合金不同温度下最大吸氢量Table 2 Maximum hydrogen absorption capacity of ascast La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0. 4) alloy at different temperatures (%, mass fraction)
表3 La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 铸态合金的热力学参数Table 3Thermodynamic parameters of as-cast La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) alloy 下载原图
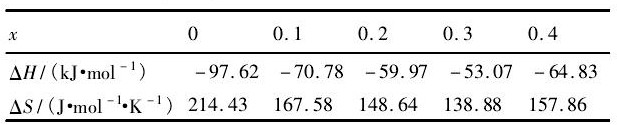
表3 La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 铸态合金的热力学参数Table 3Thermodynamic parameters of as-cast La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) alloy

图5 铸态La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 在不同温度下PCT曲线Fig.5 PCT curves of as-cast La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) alloy at different temperatures
(a) 573 K; (b) 593 K; (c) 613 K; (d) 633 K
合金的热力学参数直接反映了合金氢化物的热稳定性。生成焓ΔH数值越小, 生成的氢化物越稳定, 越不容易分解[17]。根据合金在不同温度下的吸放氢PCT曲线 (图5) , 可以建立和T-1关系曲线, 通过Van't Hoff方程见式 (5) 计算出合金的生成焓ΔH以及生成熵ΔS, PH2为吸放氢平台压强, P0为标准大气压强。

其计算结果列于表3中。从表3可以看出, 随着La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 合金中Sm的取代量x增加, 生成焓ΔH的绝对值先减小后增加。其当x=0.3时, La1.7Sm0.3Mg16Ni储氢合金的生成焓ΔH的绝对值最小, 为-53.07 k J·mol-1, 表明Sm的取代对氢化物的稳定性有影响。
3 结论
1.Sm部分代替La后, 铸态合金的主相是La2Mg17, 并存在少量的第二相Sm Ni和Sm5Mg41, Sm部分替代La对La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 合金的主相没有影响。合金吸氢后形成氢化物La H3, Mg H2。
2.Sm部分替代La改善了La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 合金的活化性, 且随着Sm取代La量的增加合金活化性能增加。
3.La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 合金的吸氢量及吸放氢动力学随Sm替代量的增加而增加, 当Sm替代量从x=0增加到x=0.4时, 合金的最大吸氢量从4.458%增加到4.925%。在3 MPa、498 K下, 10 min的吸氢量分别为:4.308%, 4.342%, 4.488%, 4.564%, 4.787%。在真空、498 K下, 20 min的放氢量分别为1.684%, 1.521%, 1.779%, 1.666%, 2.131%。Sm替代对合金吸放氢动力学性能的改善主要归因于Sm使合金的活化能降低。
4.随着La2-xSmxMg16Ni (x=0, 0.1, 0.2, 0.3, 0.4) 合金中Sm的取代量增加, 合金生成焓ΔH的绝对值及吸氢平台压先减小后增加。La1.7Sm0.3Mg16Ni储氢合金的生成焓ΔH的绝对值最小, 为ΔH为-53.07 k J·mol-1。
参考文献
[1] Schlapbach L, Zǘttel A.Hydrogen-storage materials for mobile applications[J].Nature, 2001, 414 (6861) :353.
[2] Jain I P.Hydrogen the fuel for 21st century[J].Int.J.Hydrogen Energy, 2009, 34 (17) :7368.
[3] Acar C, Dincer I.Comparative assessment of hydrogen production methods from renewable and non-renewable sources[J].Int.J.Hydrogen Energy, 2013, 39 (1-2) :1.
[4] Ouyang L Z, Xu Y J, Dong H W.Production of hydrogen via hydrolysis of hydrides in Mg-La system[J].Int.J.Hydrogen Energy, 2009, 34 (24) :9671.
[5] Slattery D K.The hydriding-dehydriding characteristics of La2Mg17[J].Int.J.Hydrogen Energy, 2012, 43 (20) :2828.
[6] Zhang Y H, Yang T, Wu Z Y, Yuan Z M, Guo S H, Zhao D L.Electrochemical hydrogen storage performance of A2B7-type electrode alloys with partial substitution of RE (RE=Nd, Sm, Pr) for La[J].Chinese Journal of Rare Metals, 2015, 39 (1) :7. (张羊换, 杨泰, 吴征洋, 袁泽明, 郭世海, 赵栋梁.RE (RE=Nd, Sm, Pr) 部分替代La对A2B7型合金电化学贮氢性能的影响[J].稀有金属, 2015, 39 (1) :7.)
[7] Yuan Z M, Yang T, Bu W G, Shang H W, Zhang Y H.Structure, hydrogen storage kinetics and thermodynamics of Mg-base Sm5Mg41alloy[J].Int.J.Hydrogen Energy, 2016, 41 (14) :5994.
[8] Dutta K, Srivastava O N.Investigation on synthesis, characterization and hydrogenation behaviour of the La2Mg17intermetallic[J].Int.J.Hydrogen Energy, 1990, 15 (5) :341.
[9] Liu J, Li Q.Hydriding/dehydriding behaviors of La2Mg17-10%Ni composite prepared by mechanical milling[J].Journal of Rare Earths, 2013, 31 (1) :73.
[10] Li L, Fan Y P, Liu B Z, Liu B L.Electrochemical performance study of the La0.8Mg0.2 (Ni2.7Co0.6Al0.1Mn0.1) xhydrogen storage alloy[J].Chinese Rare Earths, 2012, 33 (3) :45. (李琳, 范燕平, 刘宝忠, 刘宝林.La0.8Mg0.2 (Ni2.7Co0.6Al0.1Mn0.1) x贮氢合金的电化学性能分析[J].稀土, 2012, 33 (3) :45.)
[11] Khrussanova M, Peshev P.Effect of the partial re-place-ment of magnesium by nickel on the properties of some lanthanum-magnesium alloys for hydrogen storage[J].Mater.Res.Bull., 1987, 22 (12) :1653.
[12] Liu B H, Chen C P, Li Z P, Wu J, Wang Q D.The hydriding and dehydriding properties of some multi-component rare earth-magnesium alloys[J].Z.Phys.Chem.N.F., 1993, 181 (Part-1-2) :251.
[13] Tang R, Liu L Q, Liu Y N, Yu G, Zhu J W, Liu X D.Structure and electrochemical properties of La0.8-x RExMg0.2Ni3.2Co0.6hydrogen storage alloys[J].The Chinese Journal of Nonferrous Metals, 2005, 15 (7) :1057. (唐睿, 刘丽琴, 柳永宁, 于光, 朱杰武, 刘晓东.La0.8-xRExMg0.2Ni3.2Co0.6储氢合金的结构及电化学性能[J].中国有色金属学报, 2005, 15 (7) :1057.)
[14] Li P, Hou Z H, Yang T.Structure and electrochemical hydrogen storage characteristics of the as-cast and annealed La0.8-xSmxMg0.2Ni Co0.2Si0.05 (x=0~0.4) alloys[J].J.Rare Earth., 2012, 30 (7) :696.
[15] Muthukumara P, Satheesha A, Linderb M, Mertzb R, Groll M.Studies on hydriding kinetics of some Labased metal hydride alloys[J].Int.J.Hydrogen Energy, 2009, 34 (17) :7253.
[16] Hua L, Yang F S, Meng X Y, Bao Z W, Zhang Z X.Progress in kinetic models for hydrogenation/dehydrogenation of metal hydrides[J].Chemical Industry and Engineering Progress, 2010, 29 (3) :413. (花磊, 杨福胜, 孟翔宇, 鲍泽威, 张早校.金属氢化物氢化/脱氢反应动力学模型研究进展[J].化工进展, 2010, 29 (3) :413.)
[17] Cao X X, Yuan F S, Wu Z, Bao Z W, Zhang Z X.Experimental study on hydriding kinetics of mechanical alloying Mg2Ni alloy[J].Journal of Xi'an Jiaotong University, 2013, 47 (5) :44. (曹鑫鑫, 杨福胜, 吴震, 鲍泽威, 张早校.机械合金化Mg2Ni储氢材料的吸氢动力学实验研究[J].西安交通大学学报, 2013, 47 (5) :44.)