文章编号:1004-0609(2013)06-1732-07
熔融态氯化镁直接热解制备氧化镁粉体及表征
牛丽萍1, 2,张廷安1, 2,周爱平1, 2,吕国志1, 2,赫冀成1, 2
(1. 东北大学 材料与冶金学院,沈阳 110819;
2. 多金属共生矿生态化利用教育部重点实验室,沈阳 110819)
摘 要:利用Kroll法冶炼钛过程中还原蒸馏产生的熔融氯化镁,在通氧条件下,直接热解制备出超细的氧化镁粉体。考察热解温度、热解时间、氧气分压对熔融氯化镁热解效率的影响。通过单因素实验确定的最佳工艺条件如下:热解温度1 000 ℃,输入氧分压0.08 MPa,热解时间50 min。优化条件下氯化镁的热解率达93.5%。实验制备的样品氧化镁经X射线衍射和扫描电镜分析:其平均粒径为80~100 nm,粒度分布均匀,分散性好,纯度很高,获得的氧化镁颗粒为不规则六面体形。热解反应的动力学研究表明:氯化镁热解过程的初始阶段受化学反应控制,表观活化能为93.7 kJ/mol;反应后期受扩散与化学反应混合控制,表观活化能为26.3 kJ/mol。
关键词:氧化镁;直接热解;熔融氯化镁;动力学
中图分类号:TQ132.2 文献标志码:A
Preparation and characterization of magnesia powder by direct pyrolysis process of molten magnesium chloride
NIU Li-ping1, 2, ZHANG Ting-an1, 2, ZHOU Ai-ping1, 2,  Guo-zhi1, 2, HE Ji-cheng1, 2
Guo-zhi1, 2, HE Ji-cheng1, 2
(1. School of Materials and Metallurgy, Northeastern University, Shenyang 110819, China;
2. Key Laboratory for Ecological Utilization of Multimetallic Mineral, Ministry of Education, Shenyang 110819, China)
Abstract: The molten magnesium chloride, from reduction-distillation process in Kroll method of titanium metallurgy, was used to produce ultra fine magnesia powder under the condition of oxygen by direct pyrolysis. The effects of pyrolysis temperature, pyrolysis time and oxygen pressure on the pyrolysis efficiency of molten MgCl2 were investigated. The single factor experiments show that the optimum reaction conditions are as follows: pyrolysis temperature 1 000 ℃, pyrolysis oxygen partial pressure 0.08 MPa and pyrolysis time 50 min. The pyrolysis rate of molten MgCl2 can reach 93.5% under the optimum conditions. The obtained MgO powder was analyzed by XRD and SEM. These MgO powders, showing an irregular hexahedral shape, have an average diameter of 80-100 nm with uniform size distribution, good dispersity and high purity. The dynamic study of pyrolysis reaction show that this reaction is controlled by chemical reaction at the initial stage of reaction, with the apparent activation energy Ea=93.7 kJ/mol. At the later reaction stage, both diffusion and chemical reaction become the restricting factors with the apparent activation energy Ea=26.3 kJ/mol.
Key words: MgO; direct pyrolysis; molten state MgCl2; dynamics
氧化镁作为一种重要的无机化工产品,由于其具有光、电、磁等方面的特殊性能,在制药、电子、荧光显示器、铁电材料等领域均有潜在应用价值。氧化镁还应用于超导膜材料的基板和锂离子电池。除此之外,超细氧化镁还广泛用于杀菌剂、吸附剂和催化剂。
目前,对超细氧化镁的制备的研究较多,也取得了一定的进展。制备超细氧化镁粉体的方法主要是以喷雾热解等新方法为代表的物理法,生产的氧化镁晶粒存在粒子形状难以控制及夹杂等问题,近些年溶胶-凝胶法发展迅速,但该法的氧化镁易发生不均匀形核,原料成本高;激光气相法、化学气相沉积法反应条件、反应气氛容易控制,易于得到均匀、高纯的纳米颗粒,但工艺技术复杂,能耗高。处于研究中的还有利用硫酸镁还原热解制备氧化镁的研究[1-6],在实验室制备出纯度达到99%以上,平均粒径为40 nm的单分子氧化镁颗粒。最新的研究主要集中在氧化镁形态和表面活性等方面[7-8]。
尽管制备纳米氧化镁的方法和采用的原料多种多样,而实际能够应用于工业生产的并不多,主要是成本投资方面的问题;另一些尚处于实验室研究阶段,工艺稳定性和纯度和粒度的调控还处在探索阶段。我国高纯氧化镁粉体产品薄弱,急需进行开发研究,近期资料报道,中国高纯氧化镁粉体市场需求量近10万t,而国内产量仅1万t左右,缺口相当大。
基于低成本原料和面向工业化前景的制备高纯氧化镁粉体技术的开发,将对电子、国防、航天和高级陶瓷以及其他相关行业的发展起到促进作用[9]。
目前,工业上生产海绵钛一般采用Kroll法,但该方法是采用氯化镁电解的方式实现镁和氯的循环的,电解氯化镁设备投资高、能量消耗大。因此,我国相当一部分海绵钛的生产企业,直接购买四氯化钛作为原料,镁还原四氯化钛制取海绵钛,氯化镁作为副产品,往往成为废弃物,且熔融MgCl2携带的热能也白白浪费。
本文作者基于一种利用海绵钛生产过程中蒸馏工序段产生的熔融氯化镁热态直接热解反应,制备高附加值的超细氧化镁和副产物氯气的新工艺。该方法实现了短流程、低成本制备超细氧化镁。对于全流程生产海绵钛的企业,副产品氯气可用于加碳沸腾氯化工序。而对于外购TiCl4原料的企业,制备的超细氧化镁粉体可作为产品直接销售,提高经济效益,氯气也可直接液化形成氯产品。该工艺原料来源丰富,成本低廉、工艺简单,特点是可充分利用熔融氯化镁的余热资源,工业化前景广阔[10-11]。
1 实验
1.1 实验试剂、仪器和装置
试剂:纯度为99.9%无水氯化镁(分析纯试剂)、工业用氧气和氮气,纯度>99.999%。
仪器设备:GSL-1700X-V80型管式热解炉,ZK-82B型真空干燥箱,JA2103型电子天平等。
实验装置如图1所示。
分析与检测设备:Prodigy XP型全谱直读型等离子发射光谱仪(美国利曼Leeman公司),PW3040/60型X射线衍射仪(荷兰帕纳克PANALYTICAL公司),JSM-6360LA型扫描电子显微镜和能谱仪(日本电子)。
1.2 实验方法
1.2.1 熔融MgCl2直接热解实验
首先将管式热解炉温度升至预定值,然后将盛有无水氯化镁的刚玉瓷舟置于管式炉恒温带处,待温度稳定后(约1 min)再向管内通入氧气和氮气,待达到预定热解时间后,取出刚玉瓷舟并收集炉管中气相反应的产物进行对比分析。将产物经水化除去水溶性杂质-未反应完全的MgCl2后,经过滤得到MgO粉末放入马弗炉中低温焙烧,得到w(MgO)>99.0%的高纯氧化镁。分析检测过程中应严格注意样品的防潮性,以防止未热解的MgCl2吸潮影响实验结果的准确性。
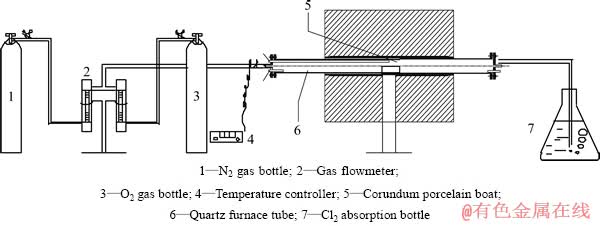
图1 熔融态氯化镁热解的实验装置图
Fig. 1 Schematic diagram of pyrolysis experimental set-up for molten magnesium chloride
熔融MgCl2热解的主要反应式如下:
MgCl2+O2→MgO+Cl2↑ (1)
1.2.2 热解效率的计算
氯离子含量的测定:本实验中氯含量采用滴定法检测,首先使用硝酸溶液溶解热解产物,而后使用蒸馏水将1 mL溶解液定容至20 mL,滴入(0.1%)酚酞指示剂2~3滴以及(5%)K2CrO4溶液2~3滴,而后使用0.05 mol/L的AgNO3滴定溶液至砖红色,读取AgNO3用量(mL);根据使用的硝酸银量计算产物中的氯离子含量。
利用分析得到的不同条件下熔融MgCl2热解效率,热解效率计算式如下:


 (2)
(2)
即
 (3)
(3)
式中:η为氯化镁热解率,%;m(Cl)为产物中氯离子质量,g; 和
和 分别为未反应和已反应的MgCl2的质量分数,%,
分别为未反应和已反应的MgCl2的质量分数,%, +
+ =1;MCl2和MMgCl2分别为Cl2和MgCl2的相对分子质量,g。
=1;MCl2和MMgCl2分别为Cl2和MgCl2的相对分子质量,g。
1.3 分析及表征
产物中MgO样品的相、晶体结构和微粒大小和形貌,采用荷兰帕纳克PANALYTICAL公司的PW3040/60型X射线衍射仪与日本电子的JSM-6360LA型扫描电子显微镜进行表征。
2 热力学计算
2.1 标准状态下的吉布斯自由能变与平衡常数
对反应式(1)在标态下进行热力学计算(见图2),得出结论:当温度高于800 K时,无水氯化镁直接热解反应的标准吉布斯自由能呈现先下降后上升的趋势,最小值出现在1 000 K附近,在该温度附近反应的平衡常数达到最大,ln K为3.4左右。
2.2 非标准状态下的平衡氯气分压与温度和氧势的关系
反应过程中反应物O2、产物Cl2是以气态存在的,因此气体分压对氯化镁热解也会造成一定的影响,本文作者计算了不同温度、不同氧气分压下的氯化镁热解过程平衡的起始反应氯气分压(见图3)。

图2 氯化镁热解反应的标准吉布斯自由能变和平衡常数与温度变化关系曲线
Fig. 2 Relationships among standard Gibbs free energy, equilibrium constant and temperature

图3 不同温度及氧分压条件下氯化镁热解过程平衡的氯气分压曲线
Fig. 3 Curves of equilibrated chlorine partial pressure during magnesium chloride pyrolysis under conditions of different temperatures and oxygen partial pressures
由此可以得出结论:与热力学计算的结果一致,即随着输入氧分压的增加和产物Cl2分压的降低,反应向生成MgO方向移动。
3 结果与讨论
3.1 热解温度对熔融氯化镁热解率的影响
考察在输入氧分压为0.08 MPa、反应时间为30 min条件下不同热解温度对熔融态氯化镁热解率的影响,实验结果见图4。

图4 反应温度对熔融氯化镁热解率的影响
Fig. 4 Effect of reaction temperature on pyrolysis rate of molten MgCl2
反应温度对熔融氯化镁热解率影响的分析表明:当输入氧气分压和反应时间一定时,随着反应温度的升高,氯化镁的热解率明显增高。
3.2 热解时间对熔融氯化镁热解率的影响
图5所示为反应温度1 000 ℃,输入氧分压为0.08 MPa条件下热解时间对熔融氯化镁热解率的影响。
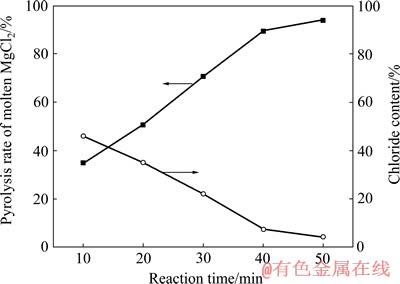
图5 反应时间对无水氯化镁热解率的影响
Fig. 5 Effect of reaction time on pyrolysis rate of molten MgCl2
实验结果表明,随着热解时间由10 min增加到50 min,产物中的氯含量逐渐减小,熔融MgCl2热解率逐渐升高,但是到了反应后期,无水氯化镁的热解率无明显提高。从化学反应动力学分析可知:随着反应时间的增加,化学反应的进行程度增加;但是当反应进行到一定程度时,再增加反应时间,化学反应的进行程度增加的趋势变缓。
3.3 输入氧气分压对熔融氯化镁热解率的影响
图6所示为输入氧气分压对熔融氯化镁热解率的影响(反应温度1 000 ℃,反应时间50 min)。

图6 氧气分压对熔融氯化镁热解效率的影响
Fig. 6 Effect of oxygen partial pressure on pyrolysis rate of molten MgCl2
反应过程中控制总的气流量为2 L/min,氧气相对于反应物化学计量是过量的,随着输入氧分压的增大,熔融氯化镁的热解率增加,但趋势不十分明显。与热力学计算的结果一致,即在反应过程中适当增加O2的分压,并及时排除反应产生的Cl2来降低Cl2的分压,可以在一定程度上促进反应向正向进行。
综合考虑熔融氯化镁的热解率,获得熔融MgCl2热解适宜的工艺条件如下:热解温度为1 000 ℃,热解时间为50 min,热解输入氧分压为0.08 MPa,此时,氯化镁的热解率可达93.5%。
3.4 样品表征
3.4.1 XRD表征
不同输入氧分压条件下热解产物的XRD分析谱线如图7所示。由图7可以看出,不同输入氧分压下热解产物的XRD峰位置与MgO标准谱的峰位置(2θ=37.0°、43.0°、62.4°、74.8°、78.7°)[4]完全吻合,说明通氧直接热解后生成了立方面心晶体结构的MgO晶体,α=β=γ=90°。且随着输入氧分压的提高、MgCl2衍射峰逐渐消失,氧化镁相的衍射峰不断增强。在1 000 ℃、反应时间为50 min,输入氧分压为0.08 MPa条件下,XRD谱线上未发现其他物质的衍射峰,表明制备的氧化镁纯度很高,没有其他杂质晶体形成。

图7 1 100 ℃、50 min和不同输入氧分压条件下热解产物的XRD谱
Fig. 7 XRD patterns of pyrolysis product at 1 000 ℃, 50 min and different oxygen partial pressures
衍射峰峰型尖锐,基底平滑,峰宽很窄,在2θ=43.04°时氧化镁的特征峰相对强度很高,说明其晶形完整。
3.4.2 SEM表征
图8(a)显示在热解温度1 000 ℃、热解时间为50 min、输入氧分压为0.08 MPa条件下得到的刚玉瓷舟中的氧化镁粉体的SEM像。氯化镁在1 573 K的温度下,饱和蒸气压就可达到48.9 kPa,近似等于大气压的一半。表明在氯化镁沸点以下,就可能发生氯化镁与氧气的气相反应。将热解反应中气相反应的产物收集,并采用SEM进行表征(见图8(b))。能谱分析表明:图 8(a)产物中含有极少量未反应完全的MgCl2,生成物MgO粉末颗粒的粒径大小分布较宽,平均粒径为2~3 μm,粒子团聚严重。由于热解过程中,在MgCl2熔体表层和内部反应动力学条件不同,造成晶粒形核和长大条件难以调控。未反应完全的MgCl2具有很强的吸湿性,短时暴露在空气中即会凝聚成块。
图8(b)中气相反应制备的MgO产物在高倍下颗粒均匀细小,由亚晶构成,平均粒径为80~100 nm,为不规则六面体形状,且结晶较完善、分散性好。
本研究为采用熔融MgCl2制备纳米级MgO粉末提供了新思路,通过对反应器的改进和对反应条件的优化,可进一步提高纯度和减小颗粒的平均粒径,制备出高纯纳米MgO粉体。

图8 刚玉瓷舟中和气相反应产物的SEM像
Fig. 8 SEM images of product in corundum boat(a) and by gas phase reaction(b)
4 热解过程的动力学分析
4.1 输入氧分压的影响
输入氧分压对热解效率影响的实验结果如图9所示。

图9 不同氧气分压下无水氯化镁的热解效率
Fig. 9 Pyrolysis rate of molten MgCl2 at different oxygen partial pressures
气体流量为2 L/min、反应温度为1 000 ℃条件下氧气分压增加,热解效率明显提高。熔融MgCl2中热解速率表达式为
 (4)
(4)
式中:k为反应速率常数;p(O2)为氧气的分压;a(MgCl2)为熔体中MgCl2的活度;n、m为待定指数。图10表明,在不同的输入氧分压下,热解效率与时间成直线关系,即dn/dt为常数。每次试验,p(O2)为一定值,而熔融MgCl2的量则随着反应的进行不断地减少,熔融MgCl2为分析纯试剂,质量总量变化,但活度系数并不随时间而改变,上式可简化为
 (5)
(5)
根据图9中数据以式 回归得
回归得
 (6)
(6)
从式(5)可知,对于熔融MgCl2热解反应,可认为对输入氧分压p(O2)为零级反应[12-13]。

图10 不同温度下无水氯化镁的热解效率与反应时间的拟合曲线
Fig. 10 Fitting curves of pyrolysis rate of molten MgCl2 and reaction time at different temperatures
4.2 温度的影响
温度对热解效率速率影响的实验结果如图10所示。温度升高,热解效率提高。根据图10中的数据和式 ,可求得各温度下的反应速率常数值,根据Arrhenius公式:
,可求得各温度下的反应速率常数值,根据Arrhenius公式:
 (7)
(7)
式中:Ea为反应表观活化能;A为指前因子;R为气体常数;T为反应温度。
对式(7)两侧分别取对数,可得
 (8)
(8)
根据不同温度下反应速率常数与对应的1/T作图,进行线性回归,不同的阶段,反应的速度常数与温度的关系式分别为
反应前期: ,由该式得热解反应表观活化能为93.7 kJ/mol;
,由该式得热解反应表观活化能为93.7 kJ/mol;
反应后期: ;由该式得该阶段热解反应表观活化能为26.3 kJ/mol[6];
;由该式得该阶段热解反应表观活化能为26.3 kJ/mol[6];
不同的阶段,反应的速度常数k与温度的关系式分别为
 (9)
(9)
 (10)
(10)
计算不同控制阶段的表观活化能和频率因子,将其列入表1中。
表1 动力学方程相关参数的计算结果
Table 1 Calculation results of relevant parameters for kinetic equation

热解反应分为不同控制阶段,反应初期为化学反应速度控制,10 min后转为由化学反应速度和扩散速度混合因素控制。表明随着时间的推移,多相反应从一个速率范围转变到另一个速率范围,同一反应过程前期、中期和后期的反应机理和表观活化能的改变是样品特性的变化所致[14]。
5 结论
1) 熔融MgCl2通氧直接热解可以制备出高纯氧化镁。氧化镁粉体粒度均匀,平均粒径在80~100 nm,为不规则六面体形状。提高热解温度、延长热解时间和增大输入氧分压对热解率提高均能起到强化作用,使MgCl2热解率的进一步提高成为可能。
2) 动力学研究表明:熔融MgCl2直接热解反应分为不同的控制阶段,化学反应控制阶段表观活化能为93.98 kJ/mol,扩散与化学反应混合控制表观活化能为26.4 kJ/mol。
REFERENCES
[1] 宋 彬, 杨保俊, 郝建文. 蛇纹石尾矿制备高纯氧化镁工艺条件的研究[J]. 合肥工业大学学报: 自然科学版, 2008, 31(1): 150-153.
SONG Bin, YANG Bao-jun, HAO Jian-wen. Preparation of high-purity magnesium oxide from serpentine[J]. Journal of Hefei University of Technology: Natural Science, 2008, 31(1): 150-153.
[2] 董声雄, 崔静磊, 陈 峰. 用蛇纹石制取高纯度活性氧化镁的工艺研究[J]. 化工矿物与加工, 2011(11): 5-8.
DONG Sheng-xiong, CUI Jing-lei, CHEN Feng. Studies on production of high-purity activated magnesium oxide from serpentine[J]. Industrial Minerals and Processing, 2011(11): 5-8.
[3] 张 萍, 冯雅丽, 李浩然, 田京雷, 汪 平, 刘欣伟. 一氧化碳还原热解硫酸镁制备高纯氧化镁[J]. 中国有色金属学报, 2012, 22(2): 572-578.
ZHANG Ping, FENG Ya-li, LI Hao-ran, TIAN Jing-lei, WANG Ping, LIU Xin-wei. Preparation of high-purity magnesia by carbon monoxide reduction pyrolysis of magnesium sulfate[J]. The Chinese Journal of Nonferrous Metals, 2012, 22(2): 572-578.
[4] ALVARADO E, TORRESMARTINEZ L M, FUENTES A F, QUINTANA P. Preparation and characterization of MgO powders obtained from different magnesium salts and the mineral dolomite[J]. Polyhedron, 2000, 19(22/23): 2345-2351.
[5] 张京京, 冯雅丽, 李浩然. 硫酸镁直接热解制备氧化镁的研究[J]. 无机盐工业, 2010(5): 11-14.
ZHANG Jing-jing. FENG Ya-li, LI Hao-ran. Preparation of magnesia by solid phase direct decomposition of magnesium sulfate[J]. Inorganic Chemicals Industry, 2010(5): 11-14.
[6] 肖国光. 熔盐法制备氧化镁的反应机理及其动力学研究[D]. 南昌: 南昌大学, 2010: 10-16.
XIAO Guo-guang. The study on reaction mechanism and dynamics of MgO preparation with molten salt[D]. Nanchang: Nanchang University, 2010: 10-16.
[7] MESHKANI F, REZAEI M. Effect of process parameters on the synthesis of nanocrystalline magnesium oxide with high surface area and plate-like shape by surfactant assisted precipitation method[J]. Powder Technology, 2010, 199: 144-148.
[8] SHARMA M, JEEVANANDAM P. Synthesis of magnesium oxide particles with stacks of plates morphology[J]. Journal of Alloys and Compounds, 2011, 509: 7881-7885.
[9] WEI Zhong-qing, QI Hua, MA Pei-hua, BAO Ji-qing. A new route to prepare magnesium oxide whisker[J]. Inorg Chem Commun, 2002(5): 147-149.
[10] 张廷安, 豆志河, 刘 燕, 吕国志, 牛丽萍, 赵秋月, 赫冀成. 采用海绵钛副产品熔融氯化镁制备高纯氧化镁的方法: 中国, CN 201110103279.2[P]. 2011-04-25.
ZHANG Ting-an, DOU Zhi-he, LIU Yan,  Guo-zhi, NIU Li-ping, ZHAO Qiu-yue, HE Ji-cheng. Method of preparation high-purity magnesia using titanium sponge by-product-molten magnesium chloride: China, CN 201110103279.2[P]. 2011-04-25.
Guo-zhi, NIU Li-ping, ZHAO Qiu-yue, HE Ji-cheng. Method of preparation high-purity magnesia using titanium sponge by-product-molten magnesium chloride: China, CN 201110103279.2[P]. 2011-04-25.
[11] 张廷安, 豆志河, 刘 燕, 吕国志, 牛丽萍, 赵秋月, 赫冀成. 一种镁氯循环利用制备海绵钛的方法: 中国, CN 201110104639[P]. 2011-04-25.
ZHANG Ting-an, DOU Zhi-he, LIU Yan,  Guo-zhi, NIU Li-ping, ZHAO Qiu-yue, HE Ji-cheng. A magnesium and chlorine recycling method of preparation of titanium sponge: China, CN 201110104639[P]. 2011-04-25.
Guo-zhi, NIU Li-ping, ZHAO Qiu-yue, HE Ji-cheng. A magnesium and chlorine recycling method of preparation of titanium sponge: China, CN 201110104639[P]. 2011-04-25.
[12] 郭先健. Cu2S-FeS-SiO2-CaO系熔体氧化动力学及机理[J]. 有色金属, 1993, 45(2): 63-67.
GUO Xian-jian. Oxidation kinetics and mechanism of melts in Cu2S-FeS-SiO2-CaO system[J]. Nonferrous Metals, 1993, 45(2): 63-67.
[13] 赵 博, 曹 萌, 冯武军, 李 彦, 糕玉群, 陈昌和. 亚硫酸盐氧化气液反应过程模型研究[J]. 工程热物理学报, 2011, 32(10): 1753-1756.
ZHAO Bo, CAO Meng, FENG Wu-jun, LI Yan, ZHUO Yu-qun, CHEN Chang-he. Modelling study of sulfite oxidation gas-liquid reaction[J]. Journal of Engineering Thermaphysics, 2011, 32(10): 1753-1756.
[14] LVOV B V. The physical approach to the interpretation of the kinetics and mechanisms of thermal decomposition of solids: the state of the art[J]. Thermochimica Acta, 2001, 373(2): 97-124.
(编辑 李艳红)
基金项目:国家自然科学基金资助项目(51004033,51074044);中央高校基本科研业务费专项资金(N100302005,N100402013)
收稿日期:2012-08-09;修订日期:2012-11-20
通信作者:张廷安,教授,博士;电话:024-83686283;E-mail: niulp@smm.neu.edu.cn