文章编号:1004-0609(2016)-03-0673-08
窑渣铁精矿综合利用新工艺
王红军,张文海,刘志宏,李启厚,李玉虎,刘智勇,何仕超
(中南大学 冶金与环境学院,长沙 410083)
摘 要:提出并研究盐酸浸出-铁粉置换-硫化沉淀-喷雾热解综合利用窑渣铁精矿的新工艺。结果表明:当盐酸浓度为6 mol/L,浸出温度为60 ℃时,Ag、Pb、Cu、Fe和Zn的浸出率分别达到99.95%、99.34%、95.07%、89.44%和57.92%。所得盐酸浸出液中加入理论量1.25倍的铁粉,Cu和Ag的脱除率均可达到98%以上。当硫化亚铁用量为理论量的3倍时,铁粉置换后液中Pb、Zn的脱除率可达96%以上,净化后液中杂质总量低于500 mg/L。以硫化沉淀后的液体为原料进行喷雾热解,在温度高于700℃时,可制得平均粒度(D50)为12μm、纯度>99%的类球形Fe2O3粉末。利用这一工艺,不仅可高效回收窑渣铁精矿中的有价金属,还可将铁资源转化为具有较高附加值的氧化铁产品,从而实现窑渣铁精矿的综合利用。
关键词:湿法炼锌;窑渣;浸出;喷雾热解;硫化沉淀
中图分类号:TF813; JTF09 文献标志码:A
炼锌窑渣是采用威尔兹法回转窑还原挥发,回收湿法炼锌低酸浸出渣中Pb、Zn的残渣,通常含有12%~18%焦粉和数量较为可观的有价金属[1-2],具有较高的回收价值,然而由于窑渣的成分和物相十分复杂,有价金属多以固溶体或网状结构的细粒嵌布形式赋存[3-4],这使得窑渣的处理十分棘手,其综合利用工艺的开发一直是湿法炼锌工业的研究热点[5-6]。
已报道的窑渣处理工艺大体分为火法和选矿两种方法。典型的火法工艺包括强化熔炼法、熔融氯化挥发法、鼓风炉熔炼法及还原硫化法[7-9]。由于存在能耗高、有价金属分离效果不佳等原因,使得火法工艺未能得到普遍认可。目前,国内湿法炼锌企业主要采用磁选-重选相结合的方法对窑渣进行回收处理[3-5]。利用这一方法,可获得焦粉、银精矿、铁精矿和尾渣4种产物,其中焦粉可返回使用,铁精矿用作炼铁原料,银精矿用于银的回收,尾渣用于水泥配料。因而,这一工艺已初步实现窑渣的综合利用。尽管窑渣铁精矿含Fe较高,通常可达65%以上,但其还含有一定数量的Cu、Ag、Pb、Zn等有价金属和5%左右的硫,这使得其作为炼铁原料时不仅效果较差,难以被钢铁厂接受,还造成了大量宝贵资源的浪费。由于窑渣铁精矿铁高、其余有价金属低的特点,且各有价金属的热行为差异较大,采用火法回收工艺效果不佳,因而,宜采用湿法工艺处理[10-11]。TURAN等[12]开展从锌浸出渣中回收锌和铅的研究,利用硫酸化焙烧-氯化钠浸出工艺可将86%的锌、89%的铅浸出。PENG等[13]研究了以硫酸溶液从锌-铁渣中选择性浸出锌的工艺,采用170 g/L 硫酸在65 ℃浸出1 h,锌、铁浸出率分别为91.20%和1.35%。已有的二次锌资源湿法处理工艺,大多集中在对浸出工艺研究,特别是浸出剂的选择,鲜有关注有价金属的分离和铁资源的利用[2, 14-15]。针对这一现状,本研究提出以盐酸浸出-铁粉置换-硫化亚铁深度除杂-喷雾热解法处理窑渣铁精矿的新工艺,利用盐酸浸出体系下Cu+、Ag+、Pb2+、Zn2+与氯离子配位作用,强化浸出效果;在此基础上,分别以铁粉和硫化亚铁选择性置换浸出液中的有价金属,以实现有价金属的高效选择性富集;最后采用喷雾热解工艺处理置换后液,获得高纯度的氧化铁产品,HCl尾气经吸收后返回浸出工序,由此实现窑渣铁精矿资源的高效综合利用。
1 实验
1.1 实验原料
本实验中所用窑渣铁精矿取自陕西商洛锌厂,其化学成分和物相分析结果分别如表1和图1所示。由表1可知,实验所用窑渣铁精矿的主要成分为Fe,其含量高达56.4%。此外,还含有一定量的Zn、Cu、Pb、Ag。图1所示的窑渣铁精矿XRD谱表明,本实验中所用窑渣铁精矿主要物相为Fe3O4、CuFe2O4、Fe2O3和SiO2,其他物相由于含量较低或结晶度较差未能检出。湿筛分析结果表明,实验所用的窑渣铁精矿粒度较细,其中80%的颗粒粒度小于74 μm,无需进一步磨细处理,可直接用于浸出。
表1 实验所用铁精矿的主要化学成分
Table 1 Main chemical composition of iron concentrate used in experiment (mass fraction, %)
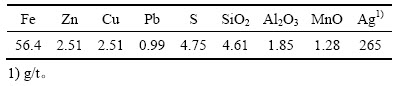

图1 实验所用铁精矿的XRD谱
Fig. 1 XRD pattern of iron concentrate used in experiment
1.2 实验流程与原理
本实验中拟采用的原则工艺流程图如图2所示。以盐酸溶液为浸出剂,利用Cl-与Cu+、Ag+、Pb2+、Zn2+的配位作用,使有价金属尽可能被浸出;随后,采用铁粉置换富集浸出液中Cu和Ag,获得铜银渣;然后,采用硫化亚铁对置换后液进行深度净化处理,获得铅锌渣;最后,采用喷雾热解工艺处理硫化沉淀后液,获得氧化铁产品,尾气吸收所获盐酸返回浸出工序。
1.3 实验方法
1.3.1 盐酸浸出实验
量取1000 mL一定浓度的盐酸溶液于1 L的三口瓶中,连接好实验装置,开启搅拌,并升温至预定温度。称取100 g窑渣铁精矿加入到上述三口瓶中,开始浸出反应。浸出过程中,每隔30 min取样一次,分析溶液成分。反应120 min后,停止浸出实验,液固分离,收集浸出液和浸出渣,并取样分析。
1.3.2 浸出液处理实验
首先,量取500 mL浸出液于1 L三口瓶中,开启搅拌,并升温至60 ℃后,加入一定量还原铁粉,反应一定时间,过滤收集铁粉置换后液和置换渣,并取样分析。最后,将所得置换后液加入到三口瓶中,搅拌升温至目标温度后,加入一定量硫化亚铁,反应一定时间,过滤收集硫化沉淀后液和硫化渣,并取样分析。

图2 铁精矿综合利用原则流程图
Fig. 2 Process scheme for comprehensive utilization of iron concentrate
1.3.3 喷雾热解实验
喷雾热解实验主要装置为自制的超声雾化喷雾热解炉[16],实验步骤如下:1) 将热分解炉升温至500~900 ℃,开启载流空气,并保温30 min,以确保热场均匀性。2) 将硫化沉淀后液超声雾化,使雾化后的液滴随载流空气进入炉内反应,于集料器中收集反应产物,并取样分析。实验所用雾化功率为2.0 W,载流空气流量125 L/h。
1.4 分析与表征方法
采用重铬酸钾滴定法测定溶液中总铁和亚铁含量;采用ICP-AES法测定盐酸浸出液及净化液中Ag、Cu、Pb、Zn、Si的含量。采用X射线衍射(RIGAKU-TTRIII,Cu/Kα,λ=1.5406  )分析窑渣铁精矿、浸出渣、喷雾热解产物的物相组成;采用差热-热重分析仪(SDTQ600V8.0Build95)表征FeCl2·4H2O在空气气氛中的物理化学变化及热效应。
)分析窑渣铁精矿、浸出渣、喷雾热解产物的物相组成;采用差热-热重分析仪(SDTQ600V8.0Build95)表征FeCl2·4H2O在空气气氛中的物理化学变化及热效应。
2 结果与讨论
2.1 盐酸浸出
由图1可知,窑渣铁精矿的主要物相为金属Fe、铁氧化物及少量硫化物。就溶解性而言,窑渣中的Zn和Fe在盐酸溶液中能够较好地浸出,而Ag、Cu和Pb由于存在AgCl(Ksp=1.77×10-10)、CuCl (Ksp= 1.72×10-7)和PbCl2(Ksp=1.70×10-5)沉淀的可能,其在盐酸溶液中的溶解有待验证。为此,考察了盐酸浓度和浸出温度对浸出效果的影响,其结果如图3和4所示。
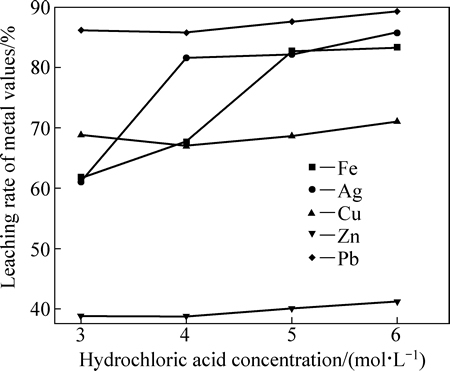
图3 30 ℃下盐酸浓度对铁精矿主要组分浸出率的影响
Fig. 3 Effect of hydrochloric acid concentration on leaching rate of main metal in iron comentrate at 30 ℃

图4 HCl浓度6 mol/L下浸出温度对铁精矿主要组分浸出率的影响
Fig. 4 Effect of temperature on leaching rate of main metal in iron comentrate at 6 mol/L HCl
由图3和4可知,Fe和Ag的浸出率随盐酸浓度和浸出温度的增加而增加,而盐酸浓度在3~6 mol/L变化时,其对Cu、Zn和Pb的浸出率影响不大。在盐酸浸出体系中,各元素除以阳离子形式存在外,还可与Cl-形成不同的配离子,如AgCl(aq)、AgCl2-和AgCl42-。也就是说,Cu、Ag、Zn和Pb在盐酸中的溶解度会有所增大,这点也可从MClx-Cl--H2O系溶解组分的lgcT-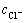 曲线得到证实(见图5)。由图5可知,除Pb以外,随着氯离子浓度增加,溶液中溶解态的金属离子浓度迅速提高,同时氯化物的稳定区相应地减小。由于窑渣铁精矿物相较为复杂,其中锌可能主要以硅酸盐、硫化物形式存在,这使得锌的浸出率不高。另一方面,当浸出温度增加时,各元素的浸出率均迅速提高。当盐酸浓度为6 mol/L,浸出温度为60 ℃时,Ag、Pb、Cu、Fe和Zn的浸出率分别可达到99.95%、99.34%、95.07%、89.44%和57.92%。图6所示为浸出渣的XRD谱。由图6可知,浸出渣的主要物相为FeS、ZnS和SiO2,这正是窑渣铁精矿中Fe和Zn浸出率不高的原因所在。但是,考虑到浸出后渣率较低(8%~15%),锌已在浸出渣中相对富集,可返回硫化锌焙烧系统中进一步回收处理。综合考虑,在盐酸初始浓度为6 mol/L、反应温度为60 ℃、液固比为10 mL:1 g条件下浸出120 min可确保窑渣铁精矿中有价金属的高效浸出。
曲线得到证实(见图5)。由图5可知,除Pb以外,随着氯离子浓度增加,溶液中溶解态的金属离子浓度迅速提高,同时氯化物的稳定区相应地减小。由于窑渣铁精矿物相较为复杂,其中锌可能主要以硅酸盐、硫化物形式存在,这使得锌的浸出率不高。另一方面,当浸出温度增加时,各元素的浸出率均迅速提高。当盐酸浓度为6 mol/L,浸出温度为60 ℃时,Ag、Pb、Cu、Fe和Zn的浸出率分别可达到99.95%、99.34%、95.07%、89.44%和57.92%。图6所示为浸出渣的XRD谱。由图6可知,浸出渣的主要物相为FeS、ZnS和SiO2,这正是窑渣铁精矿中Fe和Zn浸出率不高的原因所在。但是,考虑到浸出后渣率较低(8%~15%),锌已在浸出渣中相对富集,可返回硫化锌焙烧系统中进一步回收处理。综合考虑,在盐酸初始浓度为6 mol/L、反应温度为60 ℃、液固比为10 mL:1 g条件下浸出120 min可确保窑渣铁精矿中有价金属的高效浸出。

图5 298.15 K时MClx-Cl--H2O系溶解组分lgc-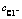 曲线
曲线
Fig. 5 lgc-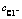 curves in MClx-Cl--H2O system at 298.15 K
curves in MClx-Cl--H2O system at 298.15 K
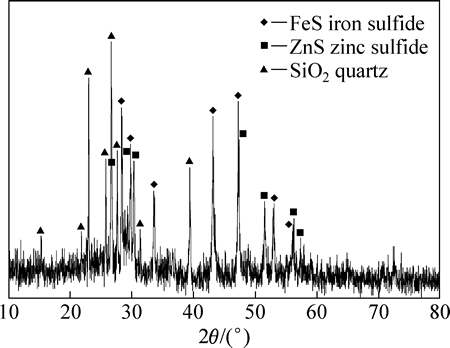
图6 60 ℃下6 mol/L盐酸浸出渣的XRD谱
Fig. 6 XRD pattern of leaching residue obtained by leaching with 6 mol/L hydrochloric acid at 60 ℃
2.2 浸出液有价成分提取与分离
在浸出过程中,除了有价金属被浸出外,硅也被大量浸出,这使得浸出液成分进一步复杂化。考虑到后续产物回收,首先需对浸出液进行脱硅处理,而后再进行有价浸出分离。
2.2.1 陈化脱Si
DIETZEL[17]根据硅酸盐溶解平衡计算得出,当pH小于7时,溶液中存在的硅几乎全部以单硅酸分子形式存在。然而,由硅在酸性溶液的行为可知,初始态的H2SiO3并不稳定,会发生聚合沉淀,并以无定型SiO2的形式析出。因此,为验证这一现象,首先开展了窑渣铁精矿盐酸浸出液陈化脱硅试验,结果如图7和8所示。
由图7可知,当陈化时间小于48h时,浸出液中SiO2几乎未有变化,而当陈化时间超过48 h后,浸出液中的硅浓度迅速降低,陈化96 h后浸出液中的硅浓度仅为0.23 g/L;从图8可知,随着陈化时间的延长,浸出液中Ag、Cu等的浓度变化并不明显,未随二氧化硅的析出而发生共沉淀现象。上述结果表明,采用陈化的方法可有效降低浸出液中硅浓度。
2.2.2 铁粉置换
根据标准还原电势可知,除Zn2+以外,浸出液中的Cu2+、Ag+、Pb2+、H+均可与金属铁粉发生置换反应。本实验中所用浸出液pH较高,为1.5左右,因而析氢反应并不明显。此外,根据图9所示的铁粉与浸出液中主要离子反应的热力学计算可知,铁粉与浸出液中主要离子的反应顺序由先至后为Ag+、Cu2+、H+、Pb2+,且Ag+和Cu2+与Fe的置换反应趋势更大一些。因此,从理论上讲,采用铁粉置换工艺,控制铁粉用量,可选择性地富集Cu、Ag。
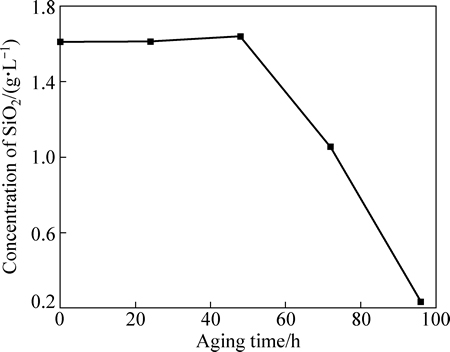
图7 陈化脱硅过程中浸出液中硅的浓度变化
Fig. 7 Concentration variation of Si in aging desilication of leach liquor
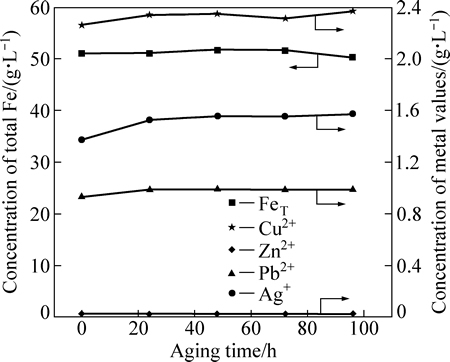
图8 陈化脱硅过程中浸出液中主要金属离子的浓度变化
Fig. 8 Concentration variation of main metal ions in aging desilication of leaching liquor
为此,在反应温度为30 ℃,搅拌速率为300 r/min,溶液初始pH值为1.5、铁粉过量系数为1.25条件下,考察了反应时间对Ag、Cu、Pb置换效率的影响,结果如图10所示。由图10可知,当铁粉过量系数为1.25、反应时间为20 min时, Ag和Cu的置换率均达到98%以上;继续增加反应时间对Cu、Ag置换率影响不大,但当时间超过45 min时,Cu的置换率有所降低,这可能是铜返溶造成的。此外,铁粉对铅有一定的置换效果,但置换率较低,仅为5%左右。考虑到Ag、Cu的回收,铁粉置换时间宜控制在30 min左右。
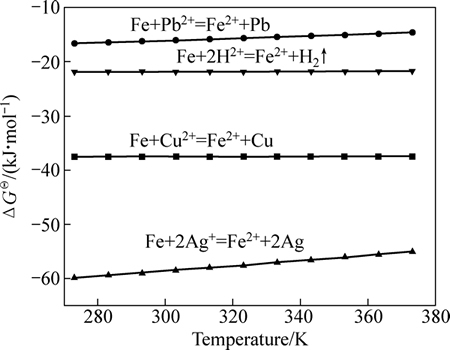
图9 铁粉置换过程中主要化学反应的热力学计算
Fig. 9 Thermodynamics calculation results of main chemical reactions during displacement reaction of Fe
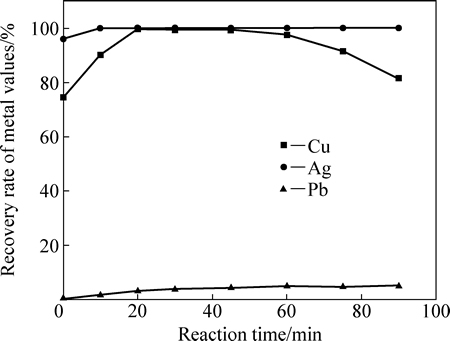
图10 铁粉过量系数为1.25时反应时间对Cu、Ag和Pb置换率的影响
Fig. 10 Effect of reaction time on recovery rates of Cu, Ag and Pb at stoichiometric ratio of iron powder of 1.25
2.2.3 FeS提Pb、Zn
铁粉置换几乎可以脱除全部的Cu、Ag及少量的Pb,但其对溶液中的Zn几乎没有脱除效果。考虑到硫化物的溶度积较小,采用硫化沉淀的方法可对溶液进行深度净化。本反应体系中涉及的主要硫化物溶解组份的lgc-pH关系如图11所示。由图11可知,在酸性溶液中,FeS的稳定区远小于ZnS、PbS、Ag2S和CuS的稳定区。当pH<-0.18时,反应体系中硫化物沉淀由先至后的顺序为Ag2S、CuS、PbS、ZnS、FeS;当-0.18<pH<4.38时,反应体系中硫化物沉淀由先至后的顺序为CuS、Ag2S、PbS、ZnS、FeS;当pH>4.38时,反应体系中硫化物沉淀由先至后的顺序为: CuS、Ag2S、ZnS、PbS、FeS;也就是说,在酸性溶液中加入FeS,可将溶液中的Cu、Ag、Pb、Zn深度脱除。基于这一原理,考察了硫化亚铁对铁粉置换后液中Cu、Ag、Pb、Zn的脱除效果,其结果如图12所示。
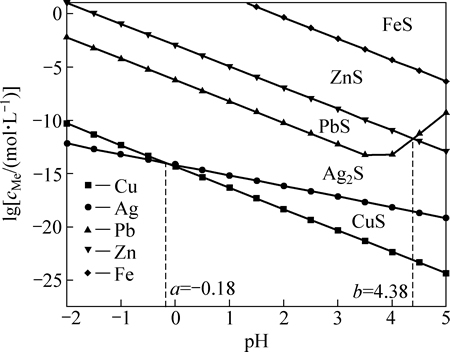
图11 298.15 K时MxSy-H2O系溶解组分lgc-pH图
Fig. 11 lgc-pH curves in MxSy-H2O system at 298.15 K
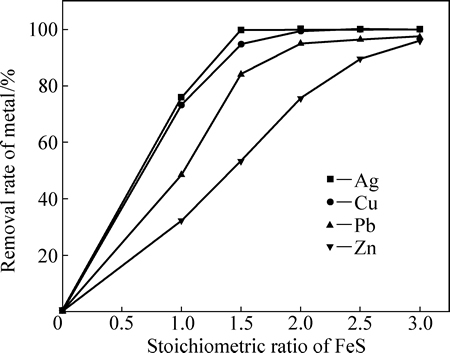
图12 FeS用量对铁粉置换后液中Cu、Ag、Pb、Zn脱除率的影响
Fig. 12 Effect of stoichiometric ratio of FeS on removal rates of Cu, Ag, Pb and Zn
由图12可知,添加FeS对铁粉置换后液中Cu、Ag、Pb、Zn的脱除效果十分显著,其脱除顺序由先至后依次为Ag、Cu、Pb、Zn,这点与图9中的理论计算一致。当FeS用量为理论用量的1.5倍时,Cu和Ag的脱除率可达到96%以上,净化后的溶液中的Cu、Ag的浓度低于1×10-6。当FeS用量超过理论用量的3倍时,Pb和Zn的脱除率可达到96%以上。净化后液的ICP-AES结果表明,溶液纯度较高,杂质含量小于500 mg/L,这一结果对后续氧化铁产品的制备奠定了良好基础。
2.3 喷雾热解
经脱硅、铁粉置换、FeS深度净化处理后,可获得高纯度的FeCl2溶液。利用喷雾热解工艺,可将FeCl2转化为纯度较高的氧化铁,所得HCl尾气经吸收后返回浸出使用,主要反应为
4FeCl2+O2+4H2O=2Fe2O3+8HCl↑ (1)
图13所示为FeCl2·4H2O在空气中的TGA-DSC分析曲线。图中DSC曲线上有4个吸热峰1个放热峰:

图13 FeCl2·4H2O在空气中的TGA-DSC谱
Fig. 13 TGA-DSC pattern of FeCl2·4H2O characterized in air atmosphere
在温度81.47 ℃出现第一个吸热峰,为FeCl2·4H2O失去两个结晶水所致。接着在131.25 ℃出现第二个吸热峰,为FeCl2·4H2O失去第三个结晶水所致。然后在179.91 ℃出现第三个吸热峰,为是FeCl2·4H2O失去第四个结晶水所致。随后在404.13 ℃出现一个小的放热
峰,FeCl2被转化为Fe3O4。紧接着在415.42 ℃出现第四个的吸热峰,此时Fe3O4进一步被氧化生成Fe2O3。因此,由以上分析可知,喷雾热解实验所需温度不能低于415 ℃,但考虑到物料在喷雾热场中停留时间较短,喷雾热解温度应选择不低于500 ℃为宜。
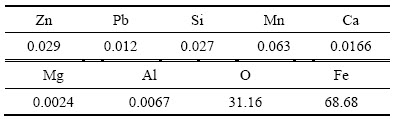
图14和15所示分别为500~900 ℃条件下喷雾热解所得产物的SEM像和XRD谱。由图14可知,喷雾热解温度对产物的颗粒形貌和粒度影响较大。当温度低于700℃时,所得产物形貌较为杂乱,颗粒表面较为粗糙,粒度分布较宽,除了部分类球体颗粒外,还存在一些不规则形的小粒子。当温度高于700℃时,所得产物形貌以类球体为主,颗粒表面较为光洁,且粒度较为均匀。图15所示的喷雾热解产物的XRD结果表明,在试验所考察的温度范围内(500~900 ℃),所得产物均为氧化铁粉,但随着喷雾热解温度的提高,衍射峰趋于尖锐,峰的强度也越高,所得Fe2O3结晶度越好。表3所列为700 ℃下所得Fe2O3样品的化学成分分析结果。由表3可知,700 ℃下所得Fe2O3纯度较高,杂质含量低于0.5%,可满足防锈漆颜料和磁性材料的生产。

图14 不同喷雾热解温度下制备的氧化铁粉SEM像
Fig. 14 SEM images of Fe2O3 obtained at different pyrolysis temperatures

图15 不同喷雾热解温度下制备的氧化铁粉XRD谱
Fig. 15 XRD patterns of Fe2O3 obtained at different pyrolysis temperatures
表3 氧化铁产品的化学成分
Table 3 Chemical composition of Fe2O3 products (mass fraction, %)
4 结论
1) 由于氯离子的配位作用,窑渣铁精矿在盐酸溶液中的浸出效果较好。当盐酸浓度为6 mol/L,浸出温度为60 ℃时,Ag、Pb、Cu、Fe和Zn的浸出率分别可达到99.95%、99.34%、95.07%、89.44%和57.92%。
2) 浸出液中的Si处于亚稳状态,当陈化时间超过48 h后,浸出液中的CSi迅速降低;陈化96 h后,浸出液中CSi降至0.23 g/L。
3) 采用铁粉置换可有效富集浸出液中的Cu和Ag,但对铅和锌的脱除效果较差。当铁粉加入量为理论量的1.25倍时,Cu和Ag的脱除率均可达到99%以上。
4) 加入硫化亚铁可实现置换后液的深度净化。当硫化亚铁用量为理论用量的3倍时,Pb、Zn的脱除率可达96%以上,净化后液中杂质总量低于500 mg/L。
5) 当喷雾热解温度为高于700℃时,可制得平均粒度为12 μm的类球形Fe2O3粉末,其纯度>99%。
REFERENCES
[1] 马 娇, 焦红光, 潘兰英, 张传祥, 张宏方. 干法磁选在锌挥发窑窑渣综合利用中的应用研究[J]. 河南理工大学学报(自然科学版), 2009, 28(6): 788-791.
MA Jiao, JIAO Hong-guang, PAN Lan-ying, ZHANG Chuan-xiang, ZHANG Hong-fang. Research on recycle and reuse zinc volatile kiln slag by magnetic separation[J]. Journal of Hennan Polytechnic University (Natural Science), 2009, 28(6): 788-791.
[2] BARNA R, BAE H R,  J, van der SLOOT H, MOSZKOWICZ P, DENOYERS C. Assessment of chemical sensitivity of Waelz slag[J]. Waste Manage, 2000, 20: 115-124.
J, van der SLOOT H, MOSZKOWICZ P, DENOYERS C. Assessment of chemical sensitivity of Waelz slag[J]. Waste Manage, 2000, 20: 115-124.
[3] 傅作健. 湿法炼锌挥发窑渣处理方法讨论[J]. 有色金属(冶炼部分), 1988(1): 41-46.
FU Zuo-jian. The discussion on the treatment processes of volatilizing kiln slag produced in zinc hydrometallurgy[J]. Nonferrous Metals (Extractive Metallurgy), 1988(1): 41-46.
[4] 王 辉. 湿法炼锌工业挥发窑窑渣资源化综合循环利用[J]. 中国有色冶金, 2007(6): 46-50.
WANG Hui. Intergraded cycling during utilization of volatilizing kiln slag zinc hydrometallurgy[J]. China Nonferrous Metallurgy, 2007(6): 46-50.
[5] 李 静, 牛 皓, 彭金辉, 张世敏, 张利波, 魏 昶, 范兴祥, 黄孟阳. 锌窑渣综合回收利用研究现状及展望[J]. 矿产综合利用, 2008(6): 44-48.
LI Jing, NIU Hao, PENG Jin-hui, ZHANG Shi-min, ZHANG Li-bo1, WEI Chang, FAN Xing-xiang, HUANG Meng-yang. Present situation and prospect about comprehensive utilization of zinc kiln slags[J]. Multipurpose Utilization of Mineral Resources, 2008(6): 44-48.
[6] 卢安贤, 黎文献, 谢佑卿, 卢仁伟, 曾 军, 赵金才, 舒毓章, 谢汉生, 傅作健. 锌挥发窑渣在玻璃工业中的应用[J]. 中国有色金属学报, 1994, 4(3): 48-51.
LU An-xian, LI Wen-xian, XIE You-qing, LU Ren-wei, ZENG Jun, ZHAO Jin-cai, SHU Yu-zhang, XIE Han-sheng, FU Zuo-jian. The application of volatilizing kiln slag of zinc hydrometallurgy in glass industry[J]. The Chinese Journal of Nonferrous Metals, 1994, 4(3): 48-51.
[7] 陈炳炎. 简述我厂锌挥发窑渣的浸没熔炼技术处理[J]. 株治科技, 1993, 21(4): 60-66.
CHEN Bing-yan. The introduction of volatilizing kiln slag of zinc hydrometallurgy by Submerged smelting technology[J]. Zhuzhou Smelter Technology, 1993, 21(4): 60-66.
[8] 李昌福. 凡口窑渣冶炼工艺试验研究[J]. 矿冶, 2002, 11(3): 56-59.
LI Chang-fu. Study on smelting technology of kiln slag of Fankou Mine[J]. Mining & Metallurgy, 2002, 11(3): 56-59.
[9] 刘志宏, 文 剑, 李玉虎, 李启厚, 艾 侃. 熔融氯化挥发工艺处理凡口窑渣综合回收有价金属的研究[J].有色金属(冶炼部分), 2005(3): 14-15.
LIU Zhi-hong, WEN Jian, LI Yu-hu, LI Qi-hou, AI Kan. Study on comprehensive utilization of value metal enriched in fankou kiln by using molten chlorination volatilization process[J]. Nonferrous Metals (Extractive Metallurgy), 2005(3): 14-15.
[10] JHA M K, KUMAR V, SINGH R J. Review of hydrometallurgical recovery of zinc from industrial wastes. Resources[J]. Conservation and Recycling, 2001, 33: 1-22.
[11] QUIJORNA N, PEDRO D M, ROMERO M,  A. Characterization of the sintering behavior of Waelz slag from electric arc furnace (EAF) dust recycling for use in the clay ceramics industry[J]. Journal of Environmental Management, 2014, 132: 278-286.
A. Characterization of the sintering behavior of Waelz slag from electric arc furnace (EAF) dust recycling for use in the clay ceramics industry[J]. Journal of Environmental Management, 2014, 132: 278-286.
[12] TURAN M D,  , TQMEN F. Recovery of zinc and lead from zinc plant residue[J]. Hydrometallurgy, 2004, 75: 169-176.
, TQMEN F. Recovery of zinc and lead from zinc plant residue[J]. Hydrometallurgy, 2004, 75: 169-176.
[13] PENG B, GAO H, CHAI L, SHU Y. Leaching and recycling of zinc from liquid waste sediments[J]. Transactions of Nonferrous Metals Society of China, 2008, 18:1269-1274.
[14] MASUD A, ABDEL L. Fundamentals of zinc recovery from metallurgical wastes in the Enviroplas process[J]. Minerals Engineering, 2002, 15: 945-952.
[15] 何仕超, 刘志宏, 刘智勇, 李玉虎, 李启厚. 湿法炼锌窑渣铁精矿综合利用研究—浸出热力学[J]. 中国有色金属学报, 2013, 23(12): 3430-3439.
HE Shi-chao, LIU Zhi-hong, LIU Zhi-yong, LI Yu-hu, LI Qi-hou. Thermodynamic analysis of leaching of iron concentrate separated from kiln slag in zinc hydrometallurgy[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(12): 3430-3439.
[16] 刘志宏, 刘智勇, 李启厚, 吴厚平, 张多默. 喷雾热分解法制备超细银粉及其形貌控制[J]. 中国有色金属学报, 2007, 17(1): 149-155.
LIU Zhi-hong, LIU Zhi-yong, LI Qi-hou, WU Hou-ping, ZHANG Duo-mo. Morphology control of micro-sized spherical silver powder prepared by spray pyrolysis[J]. The Chinese Journal of Nonferrous Metals, 2007, 17(1): 149-155.
[17] DIETZEL M. Dissolution of silicates and the stability of polysilicic acid[J]. Geochim Cosmchim Acta, 2000, 64(19): 3275-3281.
Novel process for comprehensive utilization of iron concentrate recovered from zinc kiln slag
WANG Hong-jun, ZHANG Wen-hai, LIU Zhi-hong, LI Qi-hou, LI Yu-hu, LIU Zhi-yong, HE Shi-chao
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
Abstract: A novel process, including hydrochloric acid leaching, iron powder replacing, sulphide precipitation and spray pyrolysis, was proposed to treat iron concentrate recovered from zinc kiln slag for comprehensive utilization. Treated by solution of 6 mol/L hydrochloric acid at 60 ℃, the leaching rates of Ag, Pb, Cu, Fe and Zn reach 99.95%, 99.34%, 95.07%, 89.44% and 57.92%, respectively. More than 98% Cu and Ag are recovered from the leach liquor when stoichiometric ratio of iron powder is 1.25 times of the theoretical value. More than 96% Pb and Zn is removed with three times of theoretical consumption of FeS, and the concentration of impurities of the final solution is less than 500 mg/L. Fe2O3 powder, which is spherical with mean size of 12 um and purity of 99%, is prepared with final solution at above 700 ℃. By this process, not only the metal values can be recovered effectively, but also the iron resources of zinc kiln slag can be converted into Fe2O3 with high purity, thus, the comprehensive utilization of iron concentrate recovered from zinc kiln slag can be realized.
Key words: zinc hydrometallurgy; kiln slag; leaching; spray pyrolysis; sulphide precipitation
Foundation item: Projects (51574285, 51404307) supported by the National Natural Science Foundation of China
Received date: 2015-01-12; Accepted date: 2015-10-09
Corresponding author: LIU Zhi-hong; Tel: +86-731-88830478; E-mail: zhliu@csu.edu.cn
(编辑 龙怀中)
基金项目:国家自然科学基金资助项目(51574285,51404307)
收稿日期:2015-01-12;修订日期:2015-10-09
通信作者:刘志宏,教授,博士;电话:0731-88830478;E-mail:zhliu@csu.edu.cn