文章编号:1004-0609(2014)04-0993-08
电解浸出废旧锂电池中钴的热力学和动力学
张 建1, 2,满瑞林1, 2,徐筱群1, 2,贺 凤1, 2,吴 奇1, 2,尹晓莹1, 2
(1. 中南大学 化学化工学院,长沙 410083;
2. 中南大学 有色金属资源化学教育部重点实验室,长沙 410083)
摘 要:以废旧锂电池正极条为阴极,以铅板作阳极,在稀硫酸溶液中,电解浸出正极材料中的钴,从热力学和动力学两方面对钴的电解浸出过程进行研究。实验及热力学数据分析表明:LiCoO2主要通过Co(OH)3还原浸出得到Co2+,考查浸出温度和时间表明在电解前期5~30 min电解浸出由缩核模型的化学反应过程控制,浸出率α与时间t满足未反应核收缩模型1-(1-α)1/3=Kt,其表观活化能为7.32 kJ/mol;中期是混合控制;后期75~180 min符合内扩散控制模型1-2α/3-(1-α)2/3=Kt,表观活化能17.05 kJ/mol。浸出液中的铝主要是铝箔表面氧化铝层不受阴极保护而溶于硫酸溶液,正极材料从铝箔上剥离与氧化铝层的溶解有关,剥离时间影响钴的浸出率。
关键词:废旧锂电池;电解浸出;热力学;动力学
中图分类号:TM912.9 文献标志码:A
Thermodynamic and kinetic of electrolytic leaching cobalt from waste lithium-ion battery
ZHANG Jian1, 2, MAN Rui-lin1, 2, XU Xiao-qun1, 2, HE Feng1, 2, WU Qi1, 2, YIN Xiao-ying1, 2
(1. College of Chemistry and Chemical Engineering, Central South University, Changsha 410083, China;
2. Key Laboratory of Nonferrous Metal Resource Chemistry, Ministry of Education Hunan,
Central South University, Changsha 410083, China)
Abstract: Cobalt in spent lithium-ion battery was leached out in sulfuric acid using the cathode bar as cathode and lead plate as anode. And the process was studied in thermodynamics and dynamics two aspects. The results show that LiCoO2 is reductive leached Co2+ by Co(OH)3 through compared experiments and thermodynamic data. Through theoretical analysis and experimental research, the process is controlled by chemical reaction process of shrinking core model in the early 5-30 min, leaching rate α and time t satisfy inner diffusion the unreacted core shrinking model equation 1-(1-α)1/3=Kt, apparent activation energy is 7.32 kJ/mol. The middle stage is hybrid control. And the last conforms with the internal diffusion model, where α and t suit to 1-2α/3-(1-α)2/3=Kt, and the apparent activation energy is 17.05 kJ/mol. Al3+ in leach solutions comes from aluminium oxide dissolved in liquid without protection. The cathode material peeled from aluminum foil is related to the dissolution of aluminium oxide, which affects the leaching rate of cobalt.
Key words: spent lithium-ion battery; electrolytic leaching; thermodynamics; kinetics
锂离子电池是目前广泛应用于手机、手提电脑、玩具等各种便携式电器中的可充电动力电池,随着这些电池或电器的报废将产生大量废旧锂离子电池。常规的锂电池一般含10%~15%(质量分数)的钴,10%~15%(质量分数)的铜,3%~7%(质量分数)的铝,20%~25%(质量分数)的铁以及0.1%~0.3%(质量分数)的锂等有价金属[1-2],研究这些废旧锂电池的综合回收处理具有较大的经济和环保价值。ZHANG等[3]研究 浸出剂种类、浸出液浓度、温度及液固比对钴浸出的影响,发现盐酸的浸出效果最好,但在生产中产生的Cl2[4]会污染环境、腐蚀设备。更多的学者采用硫酸+双氧水体系[5-6]作为浸出液。无论盐酸还是硫酸体系,铝箔和钴都能浸出,造成后期铝钴分离难的麻烦。为避免铝的浸出,CONTESTABILE等[7]采用有机溶剂从铝箔上剥离活性物质,完整回收铝箔,但是有机溶剂有毒,对工人健康造成严重威胁。卢毅屏等[8]通过稀酸溶解-搅拌擦洗联合作用处理正极条,只有少量的铝进入浸出液中。SUN等[9]采用高温真空热解粘合剂的方法,实现铝箔与活性物质LiCoO2的分离。本研究小组提出电解分离活性物质LiCoO2与铝箔的剥离浸出新工艺[10]。该工艺以正极材料为阴极,铅板为阳极,在较低硫酸浓度下进行电解,由于铝箔受到阴极保护,外加电流提供电子用于钴的还原溶解,在铝箔不被或尽可能少被溶解的同时,实现正极材料LiCoO2中钴还原浸出。与硫酸+双氧水浸出体系相比,可不用双氧水,其酸度和温度较低,经济、环保。
许多学者对钴资源酸浸过程的热力学、动力学两方面已有研究报道。张永禄等[11]研究H2SO4+H2O2的浸出体系的动力学,发现阿夫拉米方程比未反应核收缩模型更符合浸出过程。冯其明等[12]发现内扩散模型控制更适合模拟硫酸从钴镍浸出渣中回收钴。张阳等[13]从电荷平衡的角度解释了单用硫酸不能将LiCoO2中的Co3+还原为Co2+,且在有还原剂条件下浸出过程前期受化学反应的控制,后期由内扩散模型控制。袁文辉等[14]根据热力学数据计算相关反应的吉布斯自由能,通过溶液标准平衡pH值与温度的关系发现,当pH<0.65时,Co3+才能被Cl-还原为Co2+。
本研究小组提出的电解浸出工艺,有关理论研究较为薄弱,因此,本文作者将从热力学和动力学两方面对电解浸出废旧锂电池中钴的过程进行研究。通过热力学数据计算找出电解浸出过程路径,建立合理的动力学模型找出控制浸出率高低的因素,以期提高钴的浸出率,为废旧锂电池正极材料中钴的电解浸出提供理论依据,为该工艺的工业化应用提供依据。
1 实验
本研究所用的废旧锂电池为手机锂离子电池,来自湖南某电池回收公司。实验中所使用的试剂H2SO4、柠檬酸均为分析纯。手工解剖废旧锂电池,分离出正负电极条,本文作者以负载活性物质LiCoO2的正极条为研究对象。
研究中使用电解装置如图1所示。电解过程中,将尺寸为2.5 cm×5 cm的正极条4和0.5 cm×0.5 cm的铅板2置于电解池3中。电解液5的组成为浓度20~150 g/L的硫酸和36 g/L柠檬酸溶液。电解池底部放置一磁搅拌子,置于恒温水浴磁力搅拌锅(DF-101S, 巩义产),控制反应温度25~80 ℃,电流密度控制为20~140 A/m2,溶液体积在100~500 mL,反应时间为1~3 h。
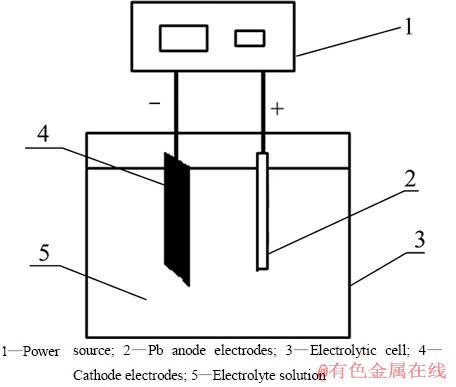
图1 电解浸出电池条中钴的装置示意图
Fig. 1 Illustrations of electrolytic leaching device
2 热力学研究
2.1 可行性分析
锂离子电池正极材料是正极活性物质附着在铝箔上。将铝箔与电源阴极相接触,以硫酸溶液为电解液,铅板为阳极进行电解,发现溶液变红,少许电池粉从铝箔上脱落,经检测溶液中含有Co2+。各电极的电极反应式如下。
阴极:CoO2-+e+4H+→Co2++2H2O
2H++2e→H2
阳极:2H2O-4e→4H++O2
由以上可知,LiCoO2与H+的放电过程是一对竞争反应。钴酸锂中的钴放电后变为Co2+,实现了钴的浸出。同时,铝在阴极受到保护,以铝箔的形式得到回收。为进一步考察电解浸出的效果,设计两组实验进行对比。
两个装有300 mL浓度为40 g/L硫酸溶液的烧杯A、B中,A中的电极条在0.5 A恒电流下电解,B中电极条直接放于溶液中。反应2.5 h后,A中钴的浸出率达到85.3%,铝溶入溶液中的量为3.57%。而B中钴的浸出率仅为41.1%,铝损耗则达到16.7%(质量分数)。通过上述对比发现,电解可以实现钴的浸出,而且阴极保护大大减少了铝的溶解。
2.2 钴浸出途径
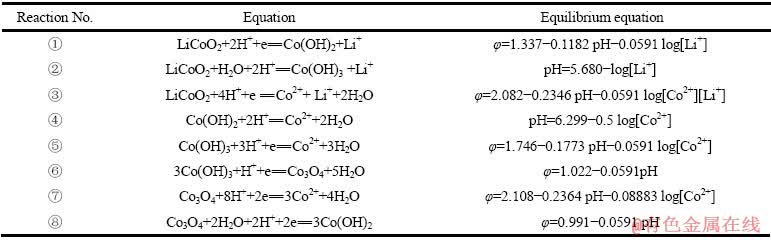
298 K时,Co-H2O与Li-Co-H2O体系可能发生的平衡反应式和通过基础热力学数据计算出各φ—pH关系式如表1所列。
由表1可以看出,LiCoO2浸出的途径如下图2所示。
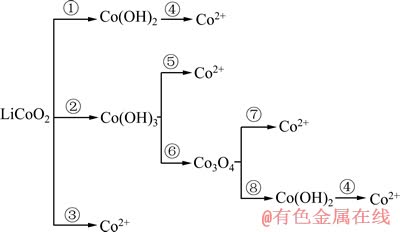
图2 LiCoO2还原转化图
Fig. 2 LiCoO2 reductive conversion
由图2可看出,在电解浸出中,将电解液的pH值调节至6左右,其他条件与2.1节中实验条件一致,2.5 h后钴的浸出率仅为10.16%。LiCoO2浸出的3个过程中,反应②的pH值达不到反应的条件,只发生①、③两个反应。在阴极,电势高者优先发生反应。从Li-Co-H2O体系φ—pH图(见图3)中亦可以看出,LiCoO2生成Co2+所需pH值较生成Co(OH)2的要低。故pH=6时按图2中反应③的过程发生反应。与上述浸出率85.3%相比,说明浸出液pH值对钴的浸出有
很大的影响,即LiCoO2电解浸出主要按图2中的反应②途径进行,先转化生成Co(OH)3。反应⑤比⑥的电势高,且直接得到Co2+。所以,LiCoO2电解得到Co2+主要按照图2中的反应②和⑤步骤反应,少部分LiCoO2可直接电解浸出得到Co2+。
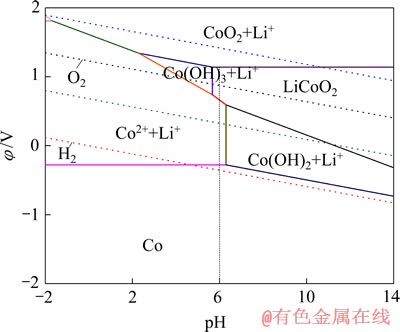
图3 Li-Co-H2O体系φ—pH图
Fig. 3 φ—pH plots of Li-Co-H2O system
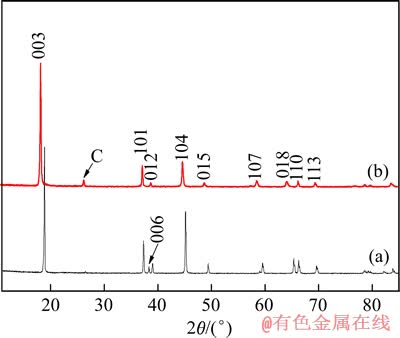
图4 电解前后正极粉的XRD谱
Fig. 4 XRD patterns of positive powder before(a) and after(b) electrolysis
表1 图2中Co-H2O和Li-Co-H2O体系中的主要反应式和平衡方程式
Table 1 Main equilibrium equations in system of Co-H2O and Li-Co-H2O in Fig. 2
通过XRD(见图4)的对比发现,电解前后无新相出现,未发现Co(OH)2及Co3O4的峰,佐证了上述的分析。然而未发现Co(OH)3的谱峰,但本文作者认为Co(OH)3具有强氧化性,在酸性及供电子条件极不稳定,很容易被还原为Co2+。因此,电解废旧锂电池正极条,其阴极发生的所有反应如下:
CoO2-+e+4H+→Co2++2H2O
CoO2-+H2O+H+→Co(OH)3
Co(OH)3+e+3H+→Co2++3H2O
2H++2e→H2
3 动力学研究
从热力学角度对电解浸出进行研究,发现电解方法不仅可以实现钴的浸出,同时减少铝的溶解,使得更多的铝以铝箔形式得以回收。本文作者将从动力学方面对整个电解过程进行研究,把握电解浸出方法的本质,实现废旧锂电池的高效回收。
3.1 模型的建立
锂电池正极材料中含有LiCoO2(90%,质量分数)、乙炔黑导电剂(7%~8%,质量分数),钴酸锂为R3m[15]层状晶体结构,粒度较小,可视为致密颗粒。在浸出初期,乙炔黑可视为嵌入LiCoO2材料中,当反应不断进行时,浸出过程无固体产物生成,未反应的核心块逐渐缩小,推断为未反应核收缩模型,如图5所示。由图5可看出,随着LiCoO2的逐渐减小,乙炔黑的量相对较多,形成均匀的松散层,LiCoO2镶嵌在乙炔黑中,且LiCoO2的量较少,本研究溶液中Co2+的浓度变化不大,假设为内扩散控制模型。在未反应核收缩模型中,浸出率α与时间存在一定的等式关系,即1-(1-α)1/3=Kt;内扩散控制模型中,浸出率α与时间的关系为1-2α/3-(1-α)2/3=Kt,其中,K为表观速率常数,t为浸出时间。
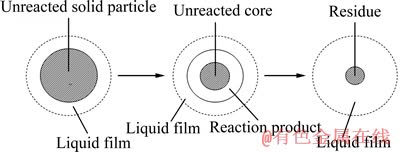
图5 颗粒收缩的液-固相反应示意图
Fig. 5 Schematic diagram of liquid-solid reaction of particle shrinkage
为了验证上述假设,研究了不同温度下的浸出过程。以40 g/LH2SO4、36 g/L柠檬酸为电解液,电流密度400 A/m2,分别在15、30、40、45、60 ℃下恒温电解,实验结果如图6所示。
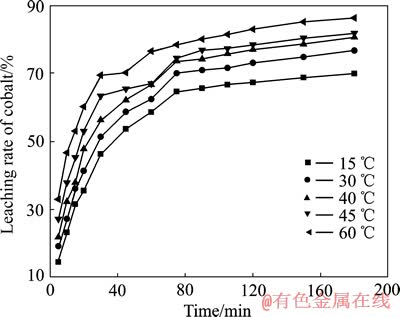
图6 温度对钴浸出率的影响
Fig. 6 Influence of temperature on cobalt leaching rate
从图6中可以看出,随着时间的延长,钴的浸出速率先是较快,随后逐渐变慢直至平衡。温度越高,钴的浸出越完全。由图6中可看出,结合前面假设的浸出过程动力学模型,作浸出初期(5~30 min)的未反应核收缩模型阶段以及在浸出反应后期(75~180 min)的LiCoO2粉末浸出过程的不同温度下动力学曲线,分别见图7和8,其拟合方程列入表2和3。
由图7、8和表2、3可以看出,浸出反应前和浸出反应后实验数据分别吻合未反应核收缩模型1-(1-α)1/3=Kt以及内扩散控制模型1-2α/3-(1-α)2/3= Kt,其线性相关性良好。
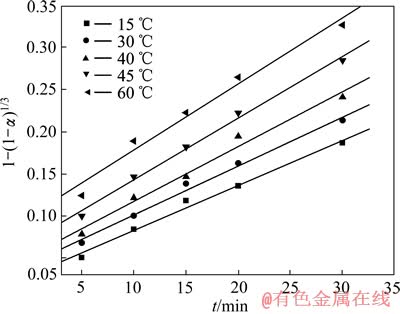
图7 不同温度下钴的电解浸出前期[1-(1-α)1/3]—t曲线
Fig. 7 [1-(1-α)1/3]—t curves of early period of electrolytic leaching cobalt at different temperatures
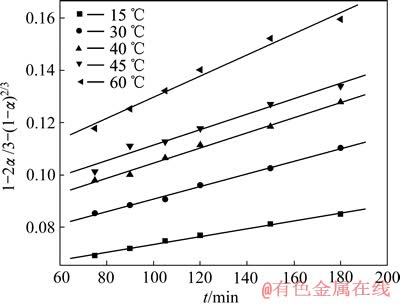
图8 不同温度下钴电解浸出后的[1-2α/3-(1-α)2/3]—t曲线
Fig. 8 [1-2α/3-(1-α)2/3]—t curves of late period of electrolytic leaching cobalt at different temperatures
表2 反应前期钴浸出过程的动力学方程
Table 2 Reaction dynamics equations of leaching cobalt in early reaction
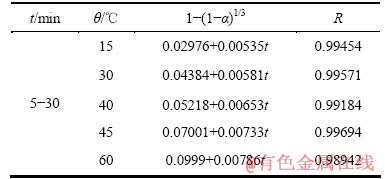
表3 反应后期钴浸出过程的动力学方程
Table 3 Reaction dynamics equations of leaching cobalt at late reaction

根据阿累尼乌斯定理(见式(1)),一定温度下,表观速率常数K均近似为常数,且其与绝对温度T的关系可表示如下:
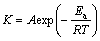 (1)
(1)
式中:A为频率因数;Ea为反应表观活化能;R为理想气体通用常数
反应表观活化能Ea反映了某一化学反应过程对温度依赖性的大小。活化能越小,反应温度的变化对速率常数的变化影响就越小;反之,则越大。将式(1)两边取对数,得到
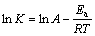 (2)
(2)
将表2和3中数据按式(2)计算得到一系列不同温度下的ln K对1000/T关系图(如图9所示),拟合直线的斜率为-Ea/R,由此可以算出不同阶段反应表观活化能Ea的大小(如表4所列)。
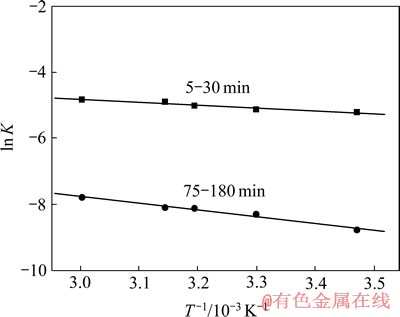
图9 钴浸出的ln K—T -1关系曲线
Fig. 9 Relation curves of ln K—T -1 in leaching cobalt
从表4中可以看出,在浸出开始的30 min,浸出过程以未反应核收缩模型中表面化学反应控制,表观活化能为7.32 kJ/mol左右,而传统的碱溶酸浸法处理工艺在浸出的反应控制步骤和扩散控制步骤活化能大约为12~15 kJ/mol[13]。相比之下,电解浸出更容易发生,通过调节反应条件(如提高温度、增加浸出剂用量等)以提高浸出率。在后期,反应受扩散和化学反应混合控制(15~45 kJ/mol),又以扩散控制为主,且浸出率的大小受温度的影响较大,因此,适当的升高温度及增加搅拌强度以提高浸出率。
表4 钴浸出过程的动力学参数
Table 4 Kinetic parameters of leaching cobalt

3.2 条件试验
依据上述动力学理论,以2.5 cm×5 cm锂电池正极条为研究对象,浸出液体积100~500 mL,电流0.1~0.7 A,硫酸浓度20~150 g/L,温度20~80 ℃,电解浸出2 h。研究浸出液体积、硫酸浓度、电流密度以及温度对钴浸出率的影响,其结果如图10所示。
图10(a)所示为浸出液体积对钴浸出的影响,可以看出,随着浸出液的增加,浸出率逐渐增大;当浸出液体积为200 mL时,浸出率不再增大。图10(b)所示为电流密度对浸出率的影响,可以看出,随着电流的增大,浸出率先增大后降低,当电流密度为480 A/m2时,浸出率达到最大值,其原因主要是由于随着电流的增大,集流体上的活性物质易于脱落,导致电解浸出率的降低,具体原因将在下节中详细解释。图10(c)所示为硫酸浓度对浸出的影响,可以看出,当硫酸浓度为40 g/L时,浸出率最大;再增大硫酸浓度,浸出率反而降低,这也是由于活性物质随酸度的增加而易于脱落。图10(d)所示为温度对浸出的影响,可以看出,随着温度的增大,浸出率逐渐增加。
其中,电流密度、硫酸浓度以及温度主要是调节化学反应控制过程以提高浸出率;液固比主要是调节内扩散控制过程,适当的增强搅拌也能强化扩散过程。
3.3 活性物质的剥离
从电流与硫酸的条件实验结果发现,只有适当的电流大小与酸用量才能起到最佳的浸出效果。活性物质从铝箔上剥离后失去电解浸出的能力,即钴浸出率高低与活性物质从铝箔上剥离时间的早晚有关。
阴极电解发生两个反应,即2H++2e→H2,LiCoO2+e+4H+→Li++Co2++H2O,H+与Co3+放电是一对竞争反应。在反应开始的30 min内,电极条上气泡较少,主要以电解浸出钴为主,随着反应的进行,电极上气泡增多,钴的浸出减弱。由图6亦可证明,反应开始时,钴的浸出较强;随后,逐渐减弱。
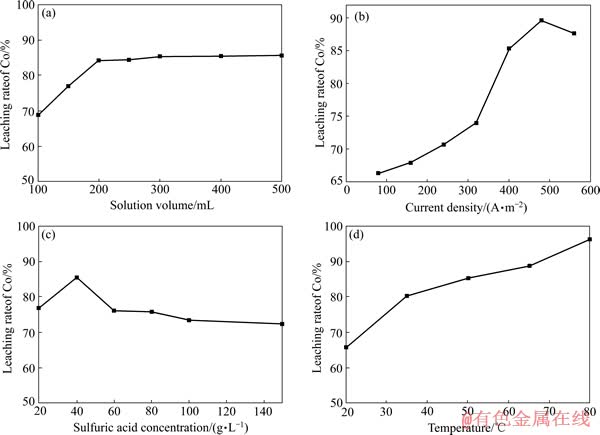
图10 不同条件对电解浸出过程中钴浸出率的影响
Fig. 10 Influence of different conditions on cobalt leaching rate of elecrolytic process
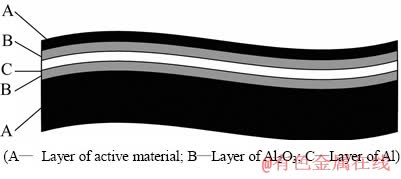
图11 电极条结构示意图
Fig. 11 Schematic diagram of structure of electrode
正极集流体是钴酸锂活性物质(A层)附着在铝箔(C层)上,由于铝箔易于氧化,在铝箔与活性物质层之间形成了Al2O3层(B层)。活性层从铝箔上剥离的原因存在两种情况:一种是AB之间发生剥离,如形成的氢气泡将活性层“吹掉”;另一种为Al2O3层溶解,活性层与铝箔完整分离。
在电解过程中,将溶液的pH值调为1~1.5时,集流体产生大量气泡,溶液中溶解了微量的铝,活性层与铝箔发生了剥离;将溶液的pH值调为7左右时,集流体亦产生大量气泡,而溶液中仅含有极低浓度的铝,活性层未从铝箔上剥离。两个实验对比发现,活性物质从铝箔上剥离与Al2O3的溶解有关,气泡为辅助作用。
4 结论
1) 热力学研究表明,绝大部分LiCoO2在酸性条件下转化为Co(OH)3后,Co(OH)3电解还原为Co2+,少部分LiCoO2可直接还原浸出为Co2+。
2) 通过动力学分析,提出相关模型,研究表明:电解前期(5~30 min),其浸出过程由缩核模型的化学反应过程控制,浸出率α与时间t满足模型1-(1-α)1/3=Kt,其表观活化能为7.32 kJ/mol;电解中期是混合控制;电解后期(75~180 min)符合内扩散控制模型1-2α/3-(1-α)2/3= Kt,表观活化能17.05 kJ/mol。
3) 对溶液中铝的来源进行研究,发现铝箔与活性层之间的Al2O3是溶液中铝的主要来源,并且活性层与铝箔分离时间的长短对电解浸出有直接的影响。
REFERENCES
[1] FOUAD O A, FARGHALY F I, BAHGAT M. A novel approach for synthesis of nanocrystalline γ-LiAlO2 from spent lithium-ion batteries[J]. Journal of Analytical and Applied Pyrolysis, 2007, 78: 65-69.
[2] LEE C K, RHEE K I. Preparation of LiCoO2 from spent lithium-ion batteries[J]. Journal of Power Sources, 2002, 109: 17-21.
[3] ZHANG Ping-wei, YOKOYAMA T, ITABASHI O. Hydrometallurgical process for recovery of metal values from spent lithium-ion secondary batteries[J]. Hydrometallurgy, 1998, 47: 259-271.
[4] 吴 芳. 从废旧锂离子二次电池中回收钴和锂[J]. 中国有色金属学报, 2004, 14(4): 697-701.
WU Fang. Recovery of cobalt and lithium from spent lithium-ion secondary batteries[J]. The Chinese Journal of Nonferrous Metals, 2004, 14(4): 697-701.
[5] SHIN S M, KIM N H. Development of a metal recovery process from Li-ion battery wastes[J]. Hydrometallurgy, 2005, 79: 172-181.
[6] LUPI C, PASQUALI M, DELL’ERA A. Nickel and cobalt recycling from lithium-ion batteries by electrochemical processes[J]. Waste Management, 2005, 25: 215-220.
[7] CONTESTABILE M, PANERO S, SCROSATI B. A laboratory-scale lithium-ion battery recycling process[J]. Journal of Power Sources, 2001, 92: 65-69.
[8] 卢毅屏, 夏自发, 冯其明, 龙 涛, 欧乐明, 张国范. 废锂离子电池中集流体与活性物质的分离[J]. 中国有色金属学报, 2007, 17(6): 997-101.
LU Yi-ping, XIA Zi-fa, FENG Qi-ming, LONG Tao, OU Le-ming, ZHANG Guo-fan. Separation of current collectors and active materials from spent lithium-ion secondary batteries[J]. The Chinese Journal of Nonferrous Metals, 2007, 17(6): 997-101.
[9] SUN Liang, QIU Ke-qiang. Vacuum pyrolysis and hydrometallurgical process for the recovery of valuable metals from spent lithium-ion batteries[J]. Journal of Hazardous Materials, 2011, 194: 378-384.
[10] 满瑞林. 一种废旧锂电池正极材料电解处理方法.中国: CN102965508A[P]. 2013-03-13.
MAN Rui-lin. An electrolytic process in dealing anode materials of waste lithium batteries battery. China: CN102965508A[P]. 2013-03-13.
[11] 张永禄, 王成彦, 杨 卜, 杨永强. 废旧锂离子电池LiCoO2电极中钴的浸出动力学[J]. 有色金属: 冶炼部分, 2012(8): 4-6, 36.
ZHANG Yong-lu, WANG Cheng-yan, YANG Bu, YANG Yong-qiang. Leaching kinetics of cobalt from LiCoO2 cathode in spent lithium-ion batteries[J]. Nonferrous Metals: Extractive Metallurgy, 2012(8): 4-6, 36.
[12] 冯其明, 邵延海, 欧乐明, 张国范, 卢毅屏. 废催化剂焙烧水浸渣中硫酸浸取钴的动力学研究[J]. 中南大学学报: 自然科学版, 2010, 41(1): 21-26.
FENG Qi-ming, SHAO Yan-hai, OU Le-ming, ZHANG Guo-fan, LU Yi-ping. Leaching kinetics of cobalt from roasting-dissolving residue of spent catalyst with sulfuric acid[J]. Journal of Central South University: Science and Technology, 2010, 41(1): 21-26.
[13] 张 阳, 满瑞林, 王 辉, 陈 亮. 废旧锂离子电池中钴的酸浸过程研究[J]. 电池工业, 2010, 15(1): 41-45.
ZHANG Yang, MAN Rui-lin, WANG Hui, CHEN Liang. Study on cobalt recovery by acid leaching from wasted Li-ion batteries[J]. Chinese Battery Industry, 2010, 15(1): 41-45.
[14] 袁文辉, 定 蕃, 王成彦. 从锂离子电池回收钴铜物料盐酸浸出机理研究[J]. 化学工程, 2010, 38(3): 76-79.
YUAN Wen-hui, QIU Ding-fan, WANG Cheng-yan. Hydrochloric acid leaching mechanism of recycling cobalt and copper material from lithium-ion battery[J]. Chemical Engineering, 2010, 38(3): 76-79.
[15] KIM D S, SOHN J S, LEE C K, LEE J H, HAN K S, LEE Y I. Simultaneous separation and renovation of lithium cobalt oxide from the cathode of spent lithium ion rechargeable batteries[J]. Journal of Power Sources, 2004, 132: 145-149.
(编辑 李艳红)
基金项目:国家自然科学基金资助项目(21046007)
收稿日期:2013-07-10;修订日期:2013-10-15
通信作者:满瑞林,教授,博士;电话:0731-8836273;E-mail: rlman@mail.csu.edu.cn