粗结晶硫酸铜脱除砷、锑和铋研究
陈胜利1, 2,郭学益1,梁永宣1
(1. 中南大学 冶金科学与工程学院,湖南 长沙,410083;
2. 金川有色金属公司,甘肃 金昌,737100)
摘 要:用氧化-中和-共沉淀方法脱除粗硫酸铜中的砷、锑、铋,使之达到电积铜粉用硫酸铜溶液的质量要求。结果表明:在200 mL 硫酸铜溶液中,当Cu2+质量浓度为60 g/L,质量分数为3%的H2O2加入量为4 mL,质量分数为20%的聚合硫酸铁加入量为3 mL,氧化时间为10 min,过滤后滤液中加入Na2CO3调节pH至3.80,反应60 min时,除杂综合效果最好,As脱除率达94.17%,Sb脱除率达45.95%,Bi脱除率达88.64%,原液中Fe脱除率达98.83%。
关键词:硫酸铜;砷;锑;铋;脱除
中图分类号:TF804 文献标志码:A 文章编号:1672-7207(2010)04-1251-05
Remove of arsenic, antimony and bismuth from crude crystal copper sulfate
CHEN Sheng-li1, 2, GUO Xue-yi1, LIANG Yong-xuan1
(1. School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China;
2. Jinchuan Nonferrous Metals Company, Jinchang 737100, China)
Abstract: Arsenic, antimony and bismuth in crude copper sulfate were removed by oxidization-neutralization- coprecipitation method to meet the quality requirement of copper sulfate for electrowinning copper powder. The results show that, under the following experimental conditions, such as 3% H2O2 of 4 mL and 20% polymerized ferric sulfate of 3 mL are added into 200 mL solution with Cu2+ concentration of 60 g/L and oxidation time is controlled to be 10 min, after being filtrated, the pH of filtrate is adjusted to be 3.80 by Na2CO3 and reaction time is confirmed to be 60 min, the comprehensive result of impurities elimination is the best, the removal rate of As, Sb, Bi, Fe are 94.17%, 45.95%, 88.64% and 98.83% respectively.
Key words: copper sulfate; arsenic; antimony; bismuth; removal
在铜电解精炼过程中,为了使电解液中的铜、酸含量及杂质浓度在规定范围内,就必须对电解液进行净化和调整,以保证电解过程的正常进行。抽取一定量的电解液,用加铜中和法或直接浓缩法[1],使电解液中的硫酸铜浓度达到饱和状态,通过冷却结晶,使大部分铜以结晶硫酸铜形态产出。工业粗硫酸铜主要用于农药和化工方面,其As,Sb,Bi,Pb和Fe 等杂质含量比较高(见表1)。目前,人们对粗硫酸铜通过除杂提纯,制备饲料级硫酸铜或试剂硫酸铜[2-6]以及电镀用硫酸铜[7-8]已有研究,而在粗硫酸铜提纯过程中脱除As,Sb和Bi的研究还很少。国内某公司利用粗硫酸铜生产电积铜粉申请了专利[9],形成了一定的生产能力,但产品中As,Sb和Bi达不到国家GB 5246—2007标准FTD1及FTD2(w(As)≤0.005%,w(Sb)≤0.01%,w(Bi)≤0.002%)规定的要求[10]。在此,本文作者着重对粗硫酸铜中As,Sb和Bi的脱除进行探讨,将粗结晶硫酸铜经溶解、脱杂、过滤处理,得到纯净的硫酸铜溶液,用于生产电积铜粉。
1 实验
1.1 原料
实验原料为国内某公司铜电解净化产出粗硫酸铜,其主要成分(质量分数)见表1。
表1 粗硫酸铜主要成分
Table 1 Main components of crude copper sulphate %

1.2 仪器与试剂
仪器有电热恒温水浴锅(DK-2000-IIIL)、酸度计(PHS-3C)、直流广调电动搅拌器(Y008112)等;试剂有96%(质量分数)的聚合Fe2(SO4)3,工业纯;99.8%的无水Na2CO3,分析纯;3%的H2O2,分析纯;36%的盐酸,分析纯。
1.3 实验原理
硫酸铜中的砷主要以亚砷酸盐形式存在,而FeAsO4的溶度积很小,为5.7×10-21,因此,可将粗硫酸铜溶于水,加入适当氧化剂,待H2O2将As3+氧化为As5+后,在适当浓度的Fe3+作用下,使之生成FeAsO4沉淀,从而达到除砷目的。主要反应如下:
 +H2O2+ 3H+→H3AsO4+ H2O
+H2O2+ 3H+→H3AsO4+ H2O
H3AsO4+ Fe3+→ FeAsO4 ↓+3H+
研究发现[11]:只有不同价态的砷和锑结合才会形成溶解度很小的化合物,即As5+和Sb3+结合生成SbAsO4,As3+和Sb5+结合生成AsSbO4。不同价态的砷、锑和铋形成SbAsO4和BiAsO4等化合物,其溶解度分别为1.8 g/L和0.8 g/L。可见,这2种盐的溶解度很小[12]。
由于Fe(OH)3的溶度积很小,仅为4×10-38[12],溶液中过量的Fe3+可通过水解除去。根据离子在水溶液中的PMe′-pH图,在pH为3~4时,Fe3+水解的氢氧络离子lg[Me′]=-6~-7,而Cu2+的lg[Me′]>0(其中,[Me′]为金属离子浓度,mol/L),此时BiOOH和SbOOH等也随铁进入沉淀[13]。因此,可用一定浓度的Na2CO3将溶液pH调至3.8,在此pH下,Fe3+以Fe(OH)3形式沉淀完全,达到除去硫酸铜中Fe3+的目的。而 Cu2+在pH为4.4时才开始水解生成Cu(OH)2沉淀。选择Na2CO3作中和剂,在脱除Pb,Zn,Ni和Ca等杂质离子方面起重要作用[14-16]。
1.4 实验方法
先将粗硫酸铜溶解在去离子水中,实验溶液质量分数为31.62%,其化学成分(质量浓度)见表2。每次取200 mL溶液,加入质量分数为3%的H2O2进行氧化,同时加入质量分数为20%的聚合硫酸铁,氧化一定时间后用浓度为1 mol/L的碳酸钠调溶液pH,到反应结束后测终点pH,随后进行液固分离。
表2 硫酸铜溶液成分
Table 2 Components of copper sulphate solution g/L

1.5 分析方法
铜的分析用硫代硫酸钠标准溶液滴定,铁、锑和铋用原子吸收分光光度计(3510)进行分析,砷用ICP进行分析。
2 结果与讨论
2.1 pH对除杂效果的影响
在Cu2+质量浓度为60 g/L的200 mL硫酸铜溶液中先加入3 mL H2O2,再加入3 mL聚合硫酸铁,氧化10 min后,调节pH,反应1 h,过滤后分析溶液中As,Sb,Bi和Fe的脱除率。pH(3.4,3.6,3.8,4.0和4.2)对杂质脱除率的影响如图1所示。

图1 pH对除杂效果的影响
Fig.1 Effect of pH on eliminating impurities
由图1可知:随着pH的升高,Fe脱除率变化不大。说明过量Fe含量在pH大于3.4时易形成Fe(OH)3沉淀,而净化后液中Fe含量随pH升高没有明显变化;As的脱除率随pH的升高逐渐增加,在3.8~4.0时达到94.81%;同样,Sb的脱除率随pH的升高迅速增加,说明Sb的脱除率与pH关系较大;而Bi的脱除率随pH的升高先增加后降低,在PH为3.8时达到最高。可见:当pH为3.8时,Fe,As,Sb和Bi的脱除率分别为97.77%,94.81%,51.61%和90.91%,杂质脱除效果最佳。
2.2 聚合硫酸铁加入量对除杂效果的影响
在Cu2+质量浓度为60 g/L的200 mL硫酸铜溶液中加入4 mL H2O2,再加入一定量的聚合硫酸铁,氧化10 min后,调节pH到3.8,反应1 h,过滤后分析溶液中As,Sb,Bi和Fe的脱除率。聚合硫酸铁加入量(1,3,5,7,9 mL)对杂质脱除率的影响如图2所示。

图2 聚合硫酸铁加入量对除杂效果的影响
Fig.2 Effect of addition of polymerized ferric sulfate on eliminating impurities
由图2可知:当增加聚合硫酸铁的加入量后,净化后溶液中铁含量也随之增加,脱除率降低,但变化较小,Fe脱除率大于93%;As的除脱率随聚合硫酸铁加入量的增加先增加后减少,说明As的脱除必须补充过量Fe;Sb的脱除率随聚合硫酸铁加入量增加先增加后减少,说明除杂过程形成砷酸盐的量大于锑酸盐;Bi的脱除率随聚合硫酸铁加入量的增加先增加后降低,说明生成氢氧化铁比氢氧化铋容易。
因此,铁盐的加入量不能过量,否则会带入过量的Fe,影响除杂效果。当聚合硫酸铁加入量为3 mL时,Fe,As,Sb和Bi的脱除率分别为97.77%,94.17%,59.46%和90.91%,杂质脱除效果最好。
2.3 H2O2加入量对除杂效果的影响
在Cu2+质量浓度为60 g/L的200 mL硫酸铜溶液中加入一定量H2O2,然后加入3 mL聚合硫酸铁,氧化10 min后,调节pH到3.8,反应1 h,过滤后分析溶液中As,Sb,Bi和Fe的脱除率。H2O2加入量(2,4,6,8和10 mL)对杂质脱除率的影响如图3所示。

图3 H2O2加入量对除杂效果的影响
Fig.3 Effect of addition of H2O2 on eliminating impurities
由图3可知:增加H2O2量对除Fe和As效果影响不大,说明溶液中Fe2+和As3+含量一定,加入较少的H2O2就可以达到除Fe和As的效果;Sb的脱除率随H2O2量增加先增加后降低,说明生成砷酸锑的含量远远大于生成锑酸砷的含量;Bi的脱除率与H2O2加入量关系也不大。加入H2O2主要是为了氧化溶液中的Fe2+,As3+和Sb3+,使之变为氢氧化铁、砷酸盐和锑酸盐沉淀被除去。因此,当H2O2加入量为4 mL时,Fe,As,Sb和Bi的脱除率分别为98.94%,94.17%,59.46%和85.45%,杂质脱除效果最好。
2.4 氧化时间对除杂效果的影响
在Cu2+质量浓度为60 g/L的200 mL硫酸铜溶液中加入4 mL H2O2,再加入3 mL聚合硫酸铁,氧化一定时间后,调节pH到3.8,反应1 h,过滤后分析溶液中As,Sb,Bi和Fe的脱除率。不同氧化时间(5,10,15,20和25 min)对杂质脱除率的影响如图4所示。
由图4可知:氧化时间对Fe,As,Sb和Bi的除杂效果影响不大,说明H2O2作为一种强氧化剂,反应速度较快,短时间就能使Fe2+,As3+和Sb3+氧化达到平衡。因此,当氧化时间为10 min时,Fe,As,Sb和Bi的脱除率分别为97.34%,95.65%,54.29%和89.47%,除杂效果最好。

图4 氧化时间对除杂效果的影响
Fig.4 Effect of oxidation time on eliminating impurities
2.5 反应时间对除杂效果的影响
在Cu2+质量浓度为60 g/L的200 mL硫酸铜溶液中加入4 mL H2O2,再加入3 mL聚合硫酸铁,氧化10 min后,调节pH到3.8,反应一定时间后过滤,分析滤液中As,Sb,Bi和Fe的脱除率。不同反应时间(0.5,1.0,1.5,2.0,2.5 h)对杂质脱除率的影响如图5所示。
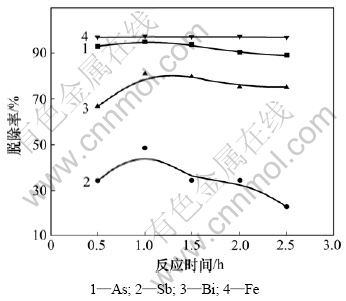
图5 反应时间对除杂效果的影响
Fig.5 Effect of reaction time on eliminating impurities
由图5可知:反应时间对Fe的除杂效果影响不大,说明除Fe比较容易;而As的脱除率随时间延长有一个小的下降过程,说明反应时间延长对除As是不利的;Sb的脱除率随反应时间的增加而降低,说明锑酸盐沉淀物存在反溶现象;Bi的脱除率随反应时间延长先增加,后逐渐保持平衡;当反应时间为1.0 h时,Fe,As,Sb和Bi的脱除率分别为97.34%,95.22%,48.57%和81.05%,除杂效果最好。
2.6 Cu2+质量浓度对除杂过程的影响
在200 mL硫酸铜溶液中加入4 mL H2O2,再加入3 mL聚合硫酸铁,氧化10 min后,调节pH值到3.8,反应1 h,过滤后分析溶液中As,Sb,Bi和Fe。Cu2+质量浓度(40,50,60,70和80 g/L)对杂质脱除率的影响如图6所示。

图6 Cu2+质量浓度对除杂效果的影响
Fig.6 Effect of concentration of Cu2+ on eliminating impurities
由图6可知:随着Cu2+质量浓度升高,Fe脱除率略有上升,但并不明显,而As的除去率随着Cu2+质量浓度的增加逐渐降低;Sb的脱除率随着Cu2+质量浓度的升高先升高,后有一个缓慢降低趋势;Bi的脱除率与Cu2+质量浓度变化影响不大。此外,由于硫酸铜在25 ℃的溶解度为23.05 g,质量浓度过高容易结晶析出硫酸铜,而质量浓度过低影响到除杂的经济性。当硫酸铜净化前溶液Cu2+质量浓度为60 g/L时,Fe,As,Sb和Bi的脱除率分别为99.09%,95.92%,31.04%和81.05%,除杂效果较好。
综合以上条件实验结果,确定优化条件为:Cu2+质量浓度为60 g/L,加入质量分数为96%的聚合硫酸铁3 mL,加入质量分数为3%的H2O2 4 mL,氧化时间为10 min,pH为3.80,反应时间为1 h。实验结果见表3。
表3 优化条件实验结果
Table 3 Experimental result at optimum condition

3 结论
(1) 用H2O2作氧化剂,可以有效地氧化As3+,Sb3+和Fe2+,加入一定量聚合硫酸铁,使砷以FeAsO4形式被除去,同时,锑铋以砷酸盐和锑酸盐沉淀;用Na2CO3调整溶液pH,可以使过量Fe3+以Fe(OH)3沉淀形式除去,还可使部分杂质以碳酸盐沉淀除去。
(2) 实验优化条件为:Cu2+质量浓度为60 g/L,质量分数为96%的聚合硫酸铁加入量为3 mL,质量分数为3%的H2O2 加入量为4 mL,氧化时间为10min,随后过滤后滤液pH为3.80,反应时间为1 h。在此,优化条件下的实验结果如下:As脱除率为94.17%,Sb脱除率为45.95%,Bi脱除率为88.64%,原液中Fe脱除率为98.83%。
参考文献:
[1] 彭容秋. 铜冶金[M]. 长沙: 中南大学出版社, 2004: 224-249.
PENG Rong-qiu. Copper metallurgy[M]. Changsha: Central South University Press, 2004: 224-249.
[2] 秦海燕, 张立娟, 孙家寿, 等. 废电解液净化除杂制取硫酸铜研究[J]. 化工进展, 2003, 22(5): 506-508.
QIN Hai-yan, ZHANG Li-juan, SUN Jia-shou, et al. Experiment on producing copper sulphate from impurity-removed waste electrolyte[J]. Chemical Industry and Engineering Progress, 2003, 22(5): 506-508.
[3] 杨长江. 金川海绵铜处理工艺及机理研究[D]. 昆明: 昆明理工大学材料与冶金工程学院, 2004: 21-27.
YANG Chang-jiang. Research on the technology and mechanism of treatment process to JNMC sponge copper[D]. Kunming: University of Kunming of Science and Technology. Faculty of Materials and Metallurgical Engineering, 2004: 21-27.
[4] 刘彬, 张业明, 刘桥阳. 利用电解铜废液除杂制硫酸铜的研究[J]. 黄石高等专科学校学报, 2003, 19(6): 18-21.
LIU Bin, ZHANG Ye-ming, LIU Qiao-yang. Research on eliminating impurities in copper sulfate by using waste electrolyte[J]. Journal of Huangshi Polytechnic College, 2003, 19(6): 18-21.
[5] 姜润田, 张振伟, 袁美龙, 等. 硫酸铜除铁工艺的研究[J]. 济南大学学报: 自然科学版, 2003, 17(3): 289-291.
JIANG Run-tian, ZHANG Zhen-wei, YUAN Mei-long, et al. Study on technology of iron removal from acid leaching liquid of copper sulfate[J]. Journal of Jinan University: Science and Technology, 2003, 17(3): 289-291.
[6] 唐映红, 葛文, 杨祥. 从酸性硫酸盐镀铜废水中回收硫酸铜的研究[J]. 安徽化工, 2008, 34(5): 31-33.
TANG Ying-hong, GE Wen, YANG Xiang. Recycling of copper sulfate from acid copper sulfate of electroplating wastewater[J]. Anhui Chemical Industry, 2008, 34(5): 31-33.
[7] 龚竹青, 李景升, 杨喜云. 硫酸铜脱除砷、铁的工艺研究[J]. 中南工业大学学报: 自然科学版, 2000, 31(3): 222-224.
GONG Zhu-qing, LI Jing-sheng, YANG Xi-yun. Process research of removing arsenic and iron in copper sulfate[J]. Journal of Central South University: Natural Science, 2000, 31(3): 222-224.
[8] 杨喜云, 李景升, 龚竹青, 等. 硫酸铜杂质脱除工艺[J]. 中南大学学报: 自然科学版, 2001, 32(4): 376-378.
YANG Xi-yun, LI Jing-sheng, GONG Zhu-qing, et al. Removing process of copper sulfate[J]. Journal of Central South University: Natural Science, 2001, 32(4): 376-378.
[9] 王贵平. 一种电积生产铜粉的方法: 中国, CN200510007317.9[P]. 2005-09-21.
WANG Gui-ping. One method for copper powder production by electro-winning: China. CN200510007317.9[P]. 2005-09-21.
[10] GB/T 5246—2007, 电解铜粉国家标准[S].
GB/T 5246—2007, National standard of electrolytic copper powder[S].
[11] 王学文. 铜电解液自净化机理及工艺研究[D]. 长沙: 中南大学冶金科学与工程学院, 2003.
WANG Xue-wen. Study on the mechanism of the formation and action of arsenato antimonic acid in copper electrorefining[D]. Changsha: Central South University. School of Metallurgical Science and Engineering, 2003.
[12] 刘纯鹏. 铜的湿法冶金物理化学[M]. 北京: 中国科学技术出版社, 1991: 180-206.
LIU Chun-peng. Physical chemistry of copper hydrometallurgy [M]. Beijing: Chinese Science and Technology Press, 1991: 180-206.
[13] 廖平婴, 尹周澜. 盐酸体系萃取分离砷的研究[J]. 中南工业大学学报: 自然科学版, 1990, 21(6): 673.
LIAO Ping-ying, YIN Zhou-lan. The extraction and separation of arsenic in the solution of hydrochloric acid[J]. Journal of Central South University of Technology: Natural Science, 1990, 21(6): 673.
[14] 姚允斌. 物理化学手册[M]. 上海: 上海科学技术出版社, 1985: 508-523.
YAO Yun-bin. Physical chemistry manual[M]. Shanghai: Shanghai Science and Technology Press, 1985: 508-523.
[15] 天津化工研究院. 无机盐工业手册: 下册[M]. 北京: 化学工业出版社, 1995: 671-684, 1112-1120.
Tianjin Chemical Institute. Manual of inorganic salt industry: Volume 2[M]. Beijing: Chemical Industry Press, 1995: 671-684, 1112-1120.
[16] 傅崇说. 冶金溶液热力学原理与计算[M]. 北京: 冶金工业出版社, 1989: 236-264.
FU Chong-yue. Principle and analysis of metallurgical solution thermodynamic[M]. Beijing: Metallurgical Industry Press, 1989:236-264.
收稿日期:2009?07?26;修回日期:2009?11?05
基金项目:国家自然科学基金资助项目(50774100)
通信作者:郭学益(1966?),男,湖南长沙人,教授,博士生导师,从事资源循环与环境材料研究;电话:0731-88877655;E-mail: xyguo@mail.csu.edu.cn
(编辑 任楚威)