文章编号:1004-0609(2010)10-2045-06
非接触式熔融还原法制备金属镍
孙长余,郭兴敏,李 菲
(北京科技大学 冶金与生态工程学院, 北京 100083)
摘 要:采用非接触式熔融还原法,以氧化镁部分稳定的氧化锆管作为氧离子渗透膜,将阴极与阳极分隔开,分批向阴极一侧(熔渣)加入氧化亚镍,在阳极(碳饱和铁水)补充碳还原剂,进行连续制备无碳金属镍的实验研究。结果表明:金属镍沉积在液态阴极上面,以金属单质形式存在,可以通过机械或熔分方法来分离;升高反应温度和增大金属氧化物加入量有利于还原反应的进行,按加入1 gNiO外电路电流降至100 mA通过电量计算,反应温度从1 743 K升高到1 773 K,加入1 g和2 g NiO还原时间分别缩短54 min和18 min,而两个温度下NiO加入量增加后,还原时间缩短近一半。
关键词:镍;氧化亚镍;非接触式熔融还原;氧离子渗透膜
中图分类号:TF111.15 文献标志码:A
Preparation of nickel by non-contacting smelting reduction method
SUN Chang-yu, GUO Xing-min, LI Fei
(School of Metallurgical and Ecological Engineering,
University of Science and Technology Beijing, Beijing 100083, China)
Abstract: A non-contacting carbothermic smelting reduction method was used to investigate reduction of nickel oxide to nickel by adding nickel oxide into cathode and carbon into anode respectively under changing conditions of reaction temperature and quantity added. The results show that pure nickel is obtained on a melt of silver as the cathode, which can be separated with silver by a machinery method or re-melting method, and the deposited rate of the pure nickel increase with increases of the reaction temperature and the quantity added to the cathode,in which it can be obtained according to calculate the accumulated electric quantity of ex-circuit for reduction of 1 g NiO until the current lowered down to 100 mA that the reduction time of 1 g NiO and 2 g NiO decreased 54 min and 18 min respectively from 1 743 K to 1 773 K, and decreased about half after added 2 g comparing with 1 g at same temperature.
Key words: nickel; nickel oxide; no-contacting smelting reduction; oxygen ion-permeable membrane
镍是一种银白色金属,具有良好的机械强度和延展性、高熔点、耐高温等特性,并且在空气中不易氧化,化学稳定性较高,是一种十分重要的有色金属原料。镍金属可制造不锈钢、高镍合金钢和合金结构钢,广泛应用于飞机、雷达、导弹、坦克、舰艇、宇宙飞船、原子反应堆等各种军工制造业。
镍金属的生产工艺[1-2]主要有火法工艺、湿法工艺和火湿法结合。其中,火法工艺[3-4]分为还原熔炼生产镍或镍铁和还原硫化熔炼生产镍锍;湿法工艺[5-8]可分为氨浸工艺和酸浸工艺;火湿法结合工艺是指氧化镍矿经还原焙烧后采用选矿方法选出有用产品。由于湿法处理氧化镍矿工艺复杂、流程长、工艺条件对设备要求高;相对而言,火法工艺处理氧化镍矿生产镍铁合金具有流程短、效率高等优点,越来越受到人们的青睐。但是,后者能耗较高,再加上其使用煤或焦粉作还原剂,很难得到纯的金属镍,受碳、硫等元素的污染,大大地降低其使用价值。
本文作者采用一种非接触式熔融还原方法[9],以氧化亚镍为研究对象,用碳作为还原剂,利用它属于一次资源的优势,使用氧离子渗透膜为“隔离层”,阻止碳在还原过程中进入还原产物,进而制备出无碳金属镍,达到合理利用自然资源和减少环境污染的目的。
1 实验
非接触式氧化物直接还原反应基于短路氧浓差电池原理[10-13],如图1所示。图1中MSZ为(MgO部分稳定的ZrO2)氧离子导体电解质隔膜,其一侧为饱和碳的铁水(Fe-C melt),另一侧为含氧化亚镍的熔渣(Molten slag)。由于MSZ两侧的氧分压(或氧活度)不同,氧离子(O2-)会从熔渣一侧穿过MSZ向含碳熔体一侧扩散,平衡时在Slag/MSZ界面和Melt/MSZ界面分别形成双电层,即构成氧浓差电池。如果开路,其电动势将阻碍氧离子扩散,当把阴极与阳极间用金属导线连结起来,使氧浓差电池短路,这样就打破了平衡,消除了MSZ两侧的电势梯度,使氧离子继续扩散,直至MSZ层两侧建立起新的平衡。

图1 短路氧浓差电池原理
Fig.1 Principle of short-circuit oxygen concentration cell
上述短路阳离子浓差电池的表达式及其电池反应如下:阳极,[C](melt)|MSZ|(NiO)(slag),阴极。
阳极(anode)反应:
O2-+[C]→CO+2e (1)
阴极(cathode)反应:
Ni2++2e→Ni (2)
电池反应:
NiO+[C]→Ni+CO (3)
电池反应结果与传统的金属氧化物碳热还原反应是一致的,不同之处在于金属阳离子的还原反应与碳原子的氧化反应在不同区域进行;因而,碳不会进入作为还原产物的金属镍内,避免了碳对金属镍的污染。
实验中熔渣的母渣由分析纯的CaCO3、SiO2、Al2O3、MgO试剂熔融制成,其含量分别如下:CaO 25%(质量分数),SiO2 58%,Al2O3 10%,MgO 7%,熔点约为1 220 ℃。饱和碳生铁用工业纯铁(含铁99.9%以上)和光谱纯碳粉为原料,在1 450 ℃于石墨坩埚内熔化而成。
实验装置示意图如图2 所示。采用MSZ管(2.18%MgO)作为氧离子渗透膜,其一端封闭(圆底),一端敞开,如文献[14-15]所述工艺烧制而成,外径为14 mm、内径为12 mm、长为58 mm。在MSZ管内加入7.5 g铁碳合金(碳过量)作为阳极,采用石墨棒(d=6 mm)作为阳极引线,延伸至炉膛外部与电化学分析仪相连。坩埚内银液作为阴极,钼丝作为阴极引线,与外部电化学分析仪相连。
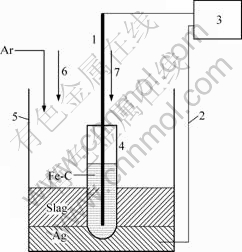
图2 实验装置示意图
Fig.2 Schematic diagram of experimental apparatus: 1—Graphite rod; 2—Molybdenum wire; 3—Electrochemical instrument; 4—MSZ tube; 5—Alumina crucible; 6—Charging- up of nickel oxide; 7—Charging-up of carbon
通过电化学分析仪测定电流—时间曲线,记录外电路电流来考察氧化镍还原过程的变化及还原终点。由氧化锆渗透膜内部存在电子导电[16],如图3实验装置的等效电路图所示。因此,氧离子通过MSZ层携带总电量Qt为
 (4)
(4)
式中:Iion为氧化锆管内氧离子迁移的总电流;Ie为氧

图3 还原过程的等效电路图
Fig.3 Equivalent circuit in process of reduction
化锆内电子迁移的电流;Iex为外电路电子迁移的电流。
在冷态下,从高温炉底部持续通入高纯氩气 (1 000 mL/min)作为保护气体,屏蔽住反应器。高温炉升温至实验温度并且恒定,通过加料管向坩埚内加入33.5 g母渣,测定电流—时间曲线,待达到初始电流并且恒定后,向坩埚内加入氧化亚镍;电流降至100 mA后第2次加入等量氧化亚镍;电流再降至100 mA后第3次加入同量氧化亚镍,电流恒定至初始电流后结束实验。 实验温度分别为1 743和1 773 K;氧化亚镍加入量分别为每次加入1和2 g,共加入3次。最后,取出坩埚,对坩埚内还原产物进行断面研磨,观察断面结构和通过扫描电镜的EDS进行成分分析。
2 结果与讨论
2.1 金属镍的形成
图4所示为还原实验结束后还原产物的SEM像以及能谱分析结果。可以看出,由于镍的密度小于银的,且两者不互溶,镍主要沉积在银的表面,与银有一个明显的分界线;仅有少量的镍嵌入到银内部,但仍然以单质镍形式存在,银仅起到辅助阴极的作用,可以通过机械分离或熔融分离得到高纯镍。
2.2 氧化锆管与熔渣断面情况
图5所示为MSZ管与熔渣断面的SEM像和EDS谱线扫描曲线。由图5可以发现,MSZ管与熔渣接触处形成了单质镍颗粒,说明氧离子渗透膜内部具有电子导电,势必减少外电路的传导电量,即:
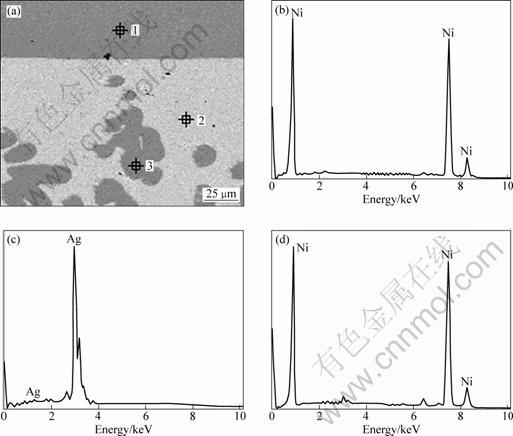
图4 还原产物的SEM像与相应区域的EDS谱
Fig.4 SEM image and EDS patterns of reduction product: (a) SEM image; EDS pattern of zone 1 (b), zone 2(c) and zone 3(d)
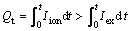 (5)
(5)
该内部电子导电的产生,虽然会减少外电路的传导电量,但有利于熔渣中的氧离子通过氧离子渗透膜向铁碳熔体内迁移,即有利于还原反应的进行。
2.3 温度和浓度对还原的影响
图6所示为不同温度下每次加入1 g NiO或2 g NiO时的4组外电路电流与时间的关系曲线。可以看出,同一个实验中3次加入等量的氧化亚镍时所引起的最大电流强度逐渐降低,同时持续时间缩短;另外,

图5 MSZ管与熔渣断面的SEM像和EDS谱线扫描曲线
Fig.5 SEM image and EDS elemental line scanning curves of element cross-section between MSZ tube and slag: (a) SEM image of cross-section; (b) EDS elemental line scanning analysis

图6 不同温度和浓度下还原过程中外电路电流与时间的关系
Fig.6 Curves of external circuit vs time in process of reduction at different temperatures and concentrations (Positions 1, 2 and 3 are number of NiO charging): (a) Temperature of 1 743 K, quantity of NiO charging of 1 g per charging; (b) Temperature of 1 743 K, quantity of NiO charging of 2 g per charging; (c) Temperature of 1 773 K, quantity of NiO charging of 1 g per charging; (d) Temperature of 1 773 K, quantity of NiO charging of 2 g per charging
第一次加料前母渣中无氧化亚镍,后两次加料前母渣中含有少量前次残余的氧化亚镍,则后两次加料后母渣内含氧化亚镍的量比第一次加料后的多,但后2次加料后电流强度低于第一次加料后的。说明随着反应时间的延长,一方面,由于氧化铝坩埚部分被熔渣侵蚀,致使熔渣黏度增大,熔渣中Ni—O亲和力增大,降低了熔渣中氧离子的迁移速率;另一方面,随着氧化锆固体电解质使用时间的延长,氧离子渗透膜电子传导阻力降低,氧离子渗透膜内传导电子数量增大,而外电路传导电量减少。这一现象促进了熔渣中NiO的电化学还原。从图5(a)也可以看出,氧离子渗透膜高温下晶界聚合、晶粒长大比较明显。
温度升高,外电路最大电流强度增大和还原时间缩短,说明温度升高增大了氧离子渗透膜内氧离子电导[8]。同时,由于温度升高,熔渣中Ni—O亲和力减小,这也有助于氧离子的迁移,促进还原反应的进行。
氧化亚镍含量增大,外电路最大电流强度增大。可以认为,氧化亚镍含量增大,熔渣中氧离子浓度升高,氧浓度梯度增大,引起氧离子渗透膜内氧离子迁移速率增大,相对而言电子电导没有变化,外电路最大电流强度增大。
在不同温度下,第一次加入1 g NiO和2 g NiO外电路电流恒定至100 mA时总还原电量与时间的关系曲线如图7所示。由图7可以看出,在1 743和1 773 K

图7 第一次加入NiO外电流恒定至100 mA总还原电量 变化
Fig.7 Total electric quantity of reduction when external current arriving at 100 mA after NiO being charged at first time: (a) Temperature of 1 743 K, quantity of NiO charging of 1 g per charging; (b) Temperature of 1 743 K, quantity of NiO charging of 2 g per charging; (c) Temperature of 1 773 K, quantity of NiO charging of 1 g per charging; (d) Temperature of 1 773 K, quantity of NiO charging of 2 g per charging
温度下,加入1 g NiO、外电流恒定至100 mA,还原的总电量分别为1 840 C和1 814 C, 时间分别为168和114 min;当加入2 g NiO时,与加入1 g NiO还原相同的电量所需要的时间分别为84和66 min。一方面,在金属氧化物浓度增加1倍的情况下,还原相同电量所需要的时间几乎缩短了一半,表明熔渣中金属氧化物含量对还原速率影响较大;另一方面,在温度仅增加30 K的情况下,还原相同的电量所需要的时间也明显减少,说明温度对还原速率影响也很大。因而,可以从提高温度和增加熔渣中金属氧化物的含量来增大还原反应速率,从图7中还原电量与时间曲线斜率也可以看出,这样在很大程度上提高了还原效率。
3 结论
1) 采用银作为引导阴极,由于金属镍与银不互溶,镍主要沉积在银表面,虽有少量嵌入银内部,但仍然以单质镍形式存在,可以通过机械分离或熔融分离,获得无碳金属镍。
2) 氧化锆固体电解质内部存在电子电导,该电子电导有利于还原反应的进行。
3) 升高温度可以提高氧化锆固体电解质内部氧离子电导率,降低熔渣中Ni—O之间的亲和力,提高还原速率。
4) 增加每次氧化镍加入量,增加了氧离子浓度,使氧化锆固体电解质两侧氧势梯度增大,促进了还原反应的进行,提高了还原速率。
REFERENCES
[1] 李小明, 唐 琳, 刘仕良. 红土镍矿处理工艺探讨[J]. 铁合金, 2007(4): 24-28.
LI Xiao-ming, TANG Lin, LIU Shi-liang. Technology of treating nickel-bearing laterite[J]. Ferro-Alloys, 2007(4): 24-28.
[2] 陈庆根. 氧化镍矿资源开发与利用现状[J]. 湿法冶金, 2008, 27(1): 7-9.
CHEN Qing-gen. Development and utilization of nickel oxide mineral resources[J]. Hydrometallurgy of China, 2008, 27(1): 7-9.
[3] VALIX M, CHEUNG W H. Effect of sulfur on the mineral phases of laterite ores at high temperature reduction[J]. Minerals Engineering, 2002, 15: 523-530.
[4] KOTZE I J. Pilot plant production of ferronickel from nickel oxide ores and dusts in a DC arc furnace[J]. Minerals Engineering, 2002, 15: 1017-1022.
[5] XU Yan-bin, XIE Yan-ting, YAN Lan, YANG Ru-dong. A new method for recovering valuable metals from low-grade nickeliferous oxide ores[J]. Hydrometallurgy, 2005, 80: 280-285.
[6] LIU Kui, CHEN Qi-yuan, HU Hui-ping. Comparative leaching of minerals by sulphuric acid in a Chinese ferruginous nickel laterite ore[J]. Hydrometallurgy, 2009, 98: 281-286.
[7] LANDERS M, GILKES R J, WELLS M. Dissolution kinetics of dehydroxylated nickeliferous goethite from limonitic lateritic nickel ore[J]. Applied Clay Science, 2009, 42: 615-624.
[8] 尹 飞, 阮书峰, 江培海, 王成彦, 陈永强. 低品位红土镍矿还原焙砂氨浸试验研究[J]. 矿冶, 2007, 16(3): 29-32.
YIN Fei, RUAN Shu-feng, JIANG Pei-hai, WANG Cheng-yan, CHEN Yong-qiang. Experimental study on roasted ore of poor nickeliferous laterite ore with ammonia leaching technology[J]. Mining &Metallurgy, 2007, 16(3): 29-32.
[9] 郭兴敏, 高运明, 周国治. 一种非接触式金属元素碳热熔融还原方法: 中国专利 ZL03121189.5[P]. 2003.
GUO Xing-min, GAO Yun-ming, CHOU Kuo-chi. A non-contacting carbon-heat smelting reduction method of metal element. CN ZL03121189.5[P]. 2003.
[10] 高运明, 郭兴敏, 周国治. 氧化物熔渣的电化学还原[J].钢铁研究学报, 2005, 17(2): 19-23.
GAO Yun-ming, GUO Xin-min, GAN S, CHOU Kuo-chi. Electrochemical reduction of molten oxide slags[J]. Journal of Iron and Steel Research, 2005, 17(2): 19-23.
[11] 高运明, 郭兴敏, 周国治. 短路还原法提取铁的研究[J]. 金属学报, 2006, 42(1): 87-92.
GAO Yun-ming, GUO Xing-min, CHOU Kuo-chi. Study on extraction of iron by the short circuit reduction method[J]. Acta Metallurgica Sinica, 2006, 42(1): 87-92.
[12] 高运明, 郭兴敏, 周国治. 熔渣无污染短路电化学还原分析[J]. 中国有色金属学报, 2006, 16(3): 530-535.
GAO Yun-ming, GUO Xing-min, CHOU Kuo-chi. Unpolluted short circuit electrochemical reduction analysis of molten oxide slags[J]. The Chinese Journal of Nonferrous Metals, 2006, 16(3): 530-535.
[13] GAO Y M, CHOU K C, GUO X M, WANG W. Electroreduction kinetics for molten oxide slags[J]. Journal of Iron and Steel Research, International, 2007, 14(1): 16-20.
[14] 高运明, 郭兴敏, 周国治. 利用阻抗谱测定氧化锆试样的电导率[J]. 武汉科技大学学报: 自然科学版, 2005, 28(3): 237-240.
GAO Yun-ming, GUO Xing-min, CHOU Kuo-chi. Measurement of conductivity of MgO-stabilized zirconia by impedance spectroscopy[J]. Journal of Wuhan University of Science &Technology: Natural Science Edition, 2005, 28(3): 237-240.
[15] 王常珍. 冶金物理化学研究方法[M]. 北京: 冶金工业出版社, 1982: 173-175.
WANG Chang-zhen. Metallurgical physical chemistry research methods[M]. Beijing: Metallurgical Industry Press, 1982: 173-175.
[16] 高运明, 郭兴敏, 周国治. 氧化锆试样电子导电特征氧分压的测定[J]. 武汉科技大学学报: 自然科学版, 2005, 28(4): 333-335.
GAO Yun-ming, GUO Xing-min, CHOU Kuo-chi. Measurement of parameter of partial electronic conductivity of ZrO2 sample[J]. Journal of Wuhan University of Science &Technology: Natural Science Edition, 2005, 28(4): 333-33.
(编辑 龙怀中)
基金项目:国家高技术研究发展计划资助项目(2006AA06Z125);国家自然科学基金资助项目(50574011)
收稿日期:2009-11-13;修订日期:2010-01-20
通信作者:郭兴敏,教授;电话:010-62334957;E-mail:guoxm@metall.ustb.edu.cn