文章编号:1004-0609(2017)-01-0145-10
从低品位铀尾矿中氧化浸出铀
李 密1, 2,张 彪1,张晓文1, 2,黄 婧1,丁德馨3,叶勇军3
(1. 南华大学 环境保护与安全工程学院,衡阳 421001;
2. 南华大学 放射性三废处理与处置重点实验室,衡阳421001;
3. 南华大学 铀矿冶生物技术国防重点学科实验室,衡阳 421001)
摘 要:针对低品位铀尾矿因脉石含量高、物相赋存状态复杂而造成的铀浸出率低的问题,提出添加辅助氧化剂破坏脉石结构而实现强化浸出铀的思路。采用单因素实验法对比常规酸浸和3种氧化剂(H2O2、MnO2 和Fe3+)强化酸浸对铀浸出率的影响。结果表明:当浸出温度、硫酸浓度和液固比分别为30 ℃、1 mol/L和20:1时,采用常规酸浸6 h后铀的浸出率仅为78%,而在相同的浸出条件下,强化酸浸1.5 h铀的浸出率可达到95%。浸出渣的XRD及SEM-EDS分析结果表明,H2O2及MnO2均能破坏脉石晶体结构,减少颗粒团聚,但添加MnO2后生成新的硅酸锰盐晶体,Fe3+不能破坏脉石结构,但其氧化作用在一定程度上能加快铀的浸出。
关键词:铀尾矿;浸出;氧化;脉石
中图分类号:TD983 文献标志码:A
随着核电工业的不断发展,我国对铀的需求量将持续增加,预计到2020年,为满足核电发展所需要的铀将达到6000 t左右[1]。目前,我国铀矿开采方法主要有常规搅拌浸出、堆浸、原地爆破浸出以及CO2地浸等[2]。在原地爆破浸出以及CO2地浸等工艺被开发出来之前,常规搅拌浸出及堆浸一直是我国铀矿开采的主要方法。然而,该工艺却不可避免地产生了大量铀尾矿。据估计,我国铀尾矿堆存量已达到240亿t[3]。因铀尾矿中含有0.005%~0.03%的铀,尽管铀平均品位极低,但其含铀总量却不可忽视,长期堆存不仅会对周边环境造成严重的放射性污染[4-5],也会造成铀资源的严重浪费[6]。
由于我国铀原矿具有铀品位低、伴生元素多、矿性复杂的特点,为了提高铀矿的浸出率,尽管已经开发出浓酸熟化高铁淋滤堆浸技术、低渗透性矿石制粒堆浸技术、细粒级矿石堆浸技术、串联堆浸技术等一系列的铀矿强化浸出手段[7-9],但由于铀物相的存在形态、铀在脉石矿物中的赋存状态、浸出动力学等各种因素的影响,导致铀原矿的浸出尾砂中常残存有一定含量的铀。由于这部分铀已经是在强化浸出后残留下来的,从而导致这部分铀采用常规的浸出方法难以进一步回收,但就目前我国的铀资源储量现状而言,该尾矿可看作是一种极贫难冶铀矿资源。
国内外针对极贫难冶铀矿资源中铀的浸出开展了大量的研究,概括起来主要有两种思路:其中最常用的方式是通过改变浸出剂的组成来实现铀的高效浸出,如HCl浸出、HNO3浸出、碳酸盐浸出等[10-11],或者添加各种氧化剂如O2、Na2O2、Fe3+等将难溶的四价铀转化为易溶的U6+[12-14]。其次是采用外场强化手段提高铀的浸出率,LEI等[15]研究了氯化钙焙烧-硝酸浸出两段工艺从粉煤灰中回收铀,LADOLA等[16]探讨了超声波辅助对铀浸出的影响,杨雨山等[17]采用微波加热预处理堆浸铀矿石来改善铀的浸出条件。 然而,由于极贫铀矿石主要成分为硅酸盐脉石,其中铀含量极低,且以微细粒的形式分散于脉石矿物中。因此,如何破坏脉石结构而实现铀的解离可能是提高铀浸出率的另一种新思路。
本文作者以低品位铀尾矿为研究对象,拟通过常规酸浸及氧化浸出的对比研究,探讨脉石-溶浸剂之间的微反应对铀浸出率的影响,考察了H2O2、MnO2和Fe3+作为氧化剂时铀尾矿中的脉石在浸出过程中的微观结构的变化。
1 实验
1.1 实验原料
本研究中所用铀尾矿来自于湖南某铀尾矿库,该铀尾矿主要产生于传统的铀矿堆浸工艺,样品取回后首先经四分法充分混匀,然后在105 ℃的烘箱中保持24 h,待自然冷却后,取少量原尾矿用于粒径分级及形貌分析,其余尾矿采用振动磨样机磨细至一定粒度,待进行粒径分级后保存于干燥器皿中,以备后续实验使用。
1.2 主要实验设备
振动磨样机(ZM-200B型);拍击式标准振筛机(XSBP-A型);微控数显电热板(EH45B型);恒温水浴摇床(SWB-2000型);电子天平(BSA224S型);电热鼓风干燥箱(HG101-4A型);X射线衍射仪(Rigaku Ultima-IV型);扫描电镜(Hitach S4800型);电感耦合等离子体原子发射光谱仪(PS-6真空型)。
1.3 实验原理
一般铀尾矿中主要存在U4+与U6+两种价态,而将难溶的四价铀转化为易溶的U6+是提高铀浸出率的前提。常规酸浸过程中未添加任何氧化剂时,则主要利用空气中的氧作为氧化剂,若浸出过程中添加氧化剂,则能加速铀的氧化,浸出过程中可能发生的化学反应如下所示:
2UO2+O2→2UO3 (1)
UO3+2H+→UO22++H2O (2)
UO22++nSO42-→UO2(SO4)n2-2n (3)
UO2+H2O2→UO3+H2O (4)
UO2+2Fe3+→UO22+ +2Fe2+ (5)
4Fe2++O2+4H+→4Fe3++2H2O (6)
2Fe2++MnO2+4H+→2Fe3++Mn2++2H2O (7)
1.4 实验方法
1) 粒径分级方法
准确称取100 g烘干后的铀尾矿样品,放入已按照筛网孔径从小到大的顺序排列的直径200 mm的标准筛中(筛网孔径425、250、150、74和55 μm),将标准筛置于拍击式标准振筛机上筛分30 min,分别称取每个目数下铀尾矿的质量,并同时分析该目数下铀尾矿中铀的品位。根据实验结果,确定最佳的粒径后,采用振动磨样机将铀尾矿进行磨细,待全部颗粒通过该粒径的标准筛后,将磨细的样品充分混匀后用于后续浸出实验研究。
2) 浸出方法
准确称取一定量的铀尾矿样品,置于250 mL的紧口锥形瓶中,按照一定的液固比添加预设浓度的浸出液及氧化剂,轻轻摇晃后在锥形瓶口盖上透气橡胶塞防止浸出过程中液体蒸发,将锥形瓶置于恒温水浴摇床中,采用回旋震荡方式浸出,回旋速度保持为200 r/min,浸出结束后采用快速定性滤纸对浸出液进行过滤,取过滤液进行铀含量分析,并计算铀的浸出率,浸出渣直接烘干后保留,用于XRD、SEM等分析。
3) 分析方法
铀尾矿的化学成分采用电感耦合等离子体原子发射光谱仪分析;铀尾矿的物相组成采用X射线衍射仪进行分析;形貌特征采用扫描电镜进行分析;铀尾矿及浸出液中铀的含量采用钒酸铵滴定法进行分析。铀尾矿中铀的浸出率采用式(8)计算:
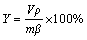 (8)
(8)
式中:Y为铀尾矿中铀的浸出率,%;V为浸出液体积,L; 为浸出液中铀的浓度,g/L;m为浸出前铀尾矿的质量,g;β为浸出前铀尾矿中铀的含量,%。
为浸出液中铀的浓度,g/L;m为浸出前铀尾矿的质量,g;β为浸出前铀尾矿中铀的含量,%。
2 结果与讨论
2.1 铀尾矿性质分析
采用ICP对铀尾矿的的化学组成进行了分析,分析结果如表1所列。铀尾矿中铀含量很低,约为0.008%(质量分数),属于低品位铀尾矿;铁元素含量高,在浸出过程中可起到一定的催化氧化作用;铝含量较多,而钙、镁含量相对较少,另外尾矿样中含有一定的硫元素,在浸出过程中为了较少酸的消耗,宜选用硫酸作为浸出剂。
铀尾矿粒径的分布以及不同粒径下铀的含量是决定铀尾矿中铀浸出效果的主要因素之一,通过对原始铀尾矿不同粒径下铀的含量分析,可以初步判断原铀矿在浸出过程中需要的较适宜的粒径范围,从而为尾矿强化浸出中粒径的控制提供依据。因此,本实验中采用筛分法分析了铀尾矿的粒径分布,通过标准筛将铀尾矿分成大于425、425~250、250~150、150~74、74~55以及小于55 μm的6个不同粒径的样品,铀尾矿的粒径分布率及铀含量分析结果如表2所列。
表1 铀尾矿的 ICP分析结果
Table 1 ICP results of uranium tailings

表2 铀尾矿粒径筛分实验结果
Table 2 Results on particle size distribution of uranium tailings
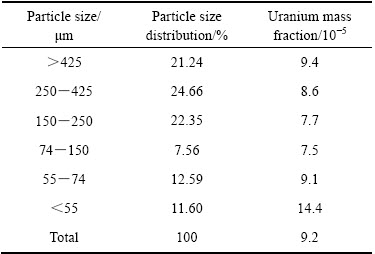
由表2可知,铀尾矿的粒径分布基本均匀,但总体颗粒粒径偏大,其中粒径大于150 μm的颗粒占总量的75%以上,这主要是由原矿堆浸过程中颗粒尺寸所决定的。从各粒径范围内铀含量的分析结果可知,铀含量在不同粒径下的分布差别较大,其中55 μm以下的小粒径中铀含量最高,达到0.014%,已超过铀尾矿的平均铀含量0.008%,随着颗粒粒径的增大,铀含量也逐渐降低,但粒径超过74 μm以上,铀含量又开始显著增加。造成铀在不同粒径下的含量差异主要与原铀矿的堆浸工艺有关[18]。堆浸过程中若颗粒较小,不仅阻滞浸出液的渗流,导致浸出液无法与颗粒中的铀物相接触,从而直接降低了细颗粒中铀的浸出效果[19];除此之外,粒径较小的颗粒在浸出过程中容易产生泥化现象,从而对浸出液中的铀产生逆吸附作用,在一定程度上也降低了铀的浸出效果,最终表现为细粒径级别的铀尾矿中铀含量偏高;若堆浸过程中铀矿粒径较大,由于铀矿中铀的品位一般较低,堆浸过程中会影响铀在浸出液中的暴露率,导致浸出尾矿中大粒径级别的颗粒中铀含量显著增加。综合以上分析可知,为了获得较高的铀浸出率,必须将铀尾矿的粒径控制在74 μm左右的范围内。
铀尾矿的XRD谱如图1所示。铀尾矿的主要物相有SiO2、铁硅酸盐(Fe3FeSiO4(OH)5)和铝硅酸盐(BaAl2Si2O8),但铀的含量极低,因而未检测到铀的物相。由于铀尾矿的主要成分为脉石矿物,为了尽可能提高铀的浸出率,必须破坏脉石结构,将铀物相从脉石矿物中解离出来[20]。一般而言,由于SiO2性质稳定,在酸性条件下难以直接破坏,因此,本研究中拟通过添加氧化剂来破坏铁硅酸盐及铝硅酸盐等脉石结构,在一定程度上将铀解离出来,从而提高铀的浸出率。

图1 铀尾矿的XRD谱
Fig. 1 XRD pattern of uranium tailings
铀尾矿的形貌及能谱分析结果见图2所示。铀尾矿的颗粒粒径分布在10~400 μm左右,呈不规则的形状,在浸出前可考虑采用磨矿法减小颗粒粒径。其能谱分析结果表明,铀尾矿的主要元素为Si、Al、Fe,与XRD分析结果基本一致。

图2 铀尾矿的SEM像及EDS分析结果
Fig. 2 SEM image(a) and EDS results(b) of uranium tailings
2.2 铀尾矿常规酸浸实验结果
1) 粒径对铀浸出的影响
在浸出温度为30 ℃、转速200 r/m、液固比为20:1,硫酸浓度为1 mol/L、浸出时间为6 h的条件下,考察粒度对铀浸出率的影响,实验结果如图3所示。从图3可以看出,随着粒径的增大,铀的浸出率逐渐减小。当浸出粒径小于55 μm时,铀浸出率为80%,当粒径在55~74 μm范围内时,浸出率降低至73%,进一步增大粒径,铀浸出率将显著降低。尽管粒径在55 μm以下时可获得较高的浸出率,但尾矿从74 μm磨细至55 μm其磨矿时间及能耗将显著增加,同时也考虑到浸出后的过滤堵塞问题。因此,本研究中后续浸出实验均将尾矿磨细至小于74 μm。

图3 粒径对铀浸出率的影响
Fig. 3 Effects of particle size on uranium extraction ratio
2) 硫酸浓度对铀浸出的影响
在浸出温度为30 ℃、转速为200 r/m、液固比为20:1、浸出时间为6 h的条件下,考察硫酸浓度对铀浸出的影响。

图4 硫酸浓度对铀浸出率的影响
Fig. 4 Effects of H2SO4 concentration on uranium extraction ratio
由图4可知,硫酸浓度低于0.5 mol/L时,铀的浸出率随硫酸浓度的增大而显著增加,当硫酸浓度超过0.5 mol/L后,硫酸浓度的增加对铀浸出率的影响逐渐降低。这是由于在硫酸浓度较低的情况下,当液固比一定时,矿样表面发生化学反应时硫酸量处于短缺的状态,因此增加硫酸的浓度有利于铀的浸出;而当硫酸浓度达到一定程度时,硫酸处于过量状态,但由于硫酸无法破坏尾矿中的脉石结构,导致部分铀无法解离,因此继续增加硫酸浓度对铀浸出率的影响不大。
3) 液固比对铀浸出的影响
在浸出温度为30 ℃、转速为200 r/m、硫酸浓度为1 mol/L、浸出时间为6 h的条件下,考察液固比对铀浸出率的影响,实验结果如图5所示。由图5可知,液固比对铀的浸出率有显著影响,随着液固比的逐渐增大,铀的浸出率显著提高。但液固比超过20以后,铀的浸出率仅从78%增加至82%,因此,后续实验的液固比均固定在20。

图5 液固比对铀浸出率的影响
Fig. 5 Effects of liquid to solid ratio on uranium extraction ratio
4) 浸出时间对铀浸出的影响
在浸出温度为30 ℃、转速为200 r/m、硫酸浓度为1 mol/L、液固比为20的条件下,考察浸出时间对铀浸出率的影响,实验结果如图6所示。从图6可以看出,在浸出时间为1 h内,铀的浸出率仅45%左右,该阶段可能主要为硫酸缓慢侵蚀脉石的过程;随着反应时间的延长,较易解离的部分铀逐渐从脉石矿物中剥离,因而铀的浸出率逐渐提高;当时间超过4 h后,铀的浸出率变化不明显,但最高铀浸出率也仅78%左右,说明了铀的浸出受到了阻碍。
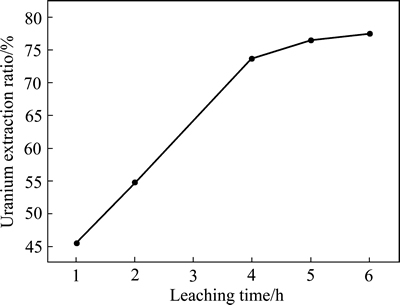
图6 浸出时间对铀浸出率的影响
Fig. 6 Effects of reaction time on uranium extraction ratio
2.3 氧化浸出实验结果
在常规酸浸工艺中即使浸出时间长达6 h,铀的浸出率仅78%左右,为了提高铀的浸出率及缩短浸出时间,本实验中在常规酸浸的基础上,拟通过强化氧化浸出的方式改善铀的浸出效果,分别选取了3种具有代表性的氧化剂(H2O2,MnO2以及Fe2(SO)3),在浸出温度为30 ℃、转速为200 r/m、H2SO4浓度为1 mol/L和液固比为20:1的条件下,分别考察氧化剂的添加量及浸出时间对铀浸出率的影响,实验结果如图7所示。

图7 氧化剂添加量对铀浸出率的影响
Fig. 7 Effects of oxidant concentration on uranium extraction ratio
与常规酸浸工艺相比,氧化剂对增强铀的浸出率具有显著的效果,在1.5 h内,铀的浸出率即可达到峰值,且最大铀浸出率可提高至95%。但氧化剂的添加量对铀的浸出具有较大的影响。在氧化剂添加量较低时,MnO2的强化效果最佳,但随着MnO2添加量的增加,其强化效果明显下降,这主要是因为二氧化锰本身是铀的良好吸附剂[21-22],少量添加有助于其对脉石结构的破坏,过量添加将导致已浸出的铀再次吸附到二氧化锰表面,造成铀总体浸出率的降低。对于H2O2而言,随着其添加量的增加,铀的浸出率显著增加,说明其对促进铀的解离具有积极效果,这与LASHEEN等的实验结果一致[23]。Fe3+对铀的浸出无明显影响。
浸出时间对铀的浸出率也有较大的影响,当氧化剂为H2O2和MnO2时,在反应开始的1.5 h内,铀的浸出率快速提高,当反应时间在1.5~3 h之间时,铀的浸出率均有非常明显的下降趋势,这可能是因为H2O2和MnO2在反应初始阶段主要以破坏硅酸盐脉石结构为主,促进了铀的解离,但同时脉石结构的破坏,必然导致铀尾矿比表面积及孔隙率的增加,从而加强了脉石矿物对铀的吸附作用,另外,氧化剂的添加可能会促使新的硅酸盐矿物的产生,而硅酸盐矿物也是铀的良好吸附剂[24]。因此,在该阶段铀的浸出率呈现下降趋势。当浸出时间继续延长时,铀的浸出率呈现缓慢上升或趋于平衡。而Fe3+的强化作用规律与H2O2和MnO2有明显差异。当Fe3+添加量较低时,浸出过程中没有出现浸出率下降的趋势,这也说明Fe3+的氧化作用机理并非直接破坏硅酸盐脉石结构,而是将铀尾矿中难溶的低价铀氧化为高价铀,才会导致Fe3+的氧化效果显著低于H2O2和MnO2。但Fe3+添加量达到0.5 mol/L时,反应2 h后铀的浸出率呈现快速下降趋势,这可能是因为高浓度的Fe3+在长时间反应后极易生成具有高效絮凝作用的聚合硫酸铁或氢氧化铁胶 体[25],致使浸出液中的铀被吸附到尾矿颗粒表面。
2.4 氧化剂对铀尾矿强化浸出的作用机理分析
为了进一步查明氧化剂在铀尾矿浸出过程中的作用机理,采用XRD及SEM-EDS分别分析了相同浸出条件下(浸出温度30 ℃、转速200 r/m、H2SO4浓度1 mol/L、液固比20:1,氧化剂添加量0.5 mol/L,浸出时间6 h)不同氧化剂种类强化浸出铀尾矿后的尾渣,分析结果分别见图8、图9和图10所示。
图8所示为浸出尾渣的XRD谱。由图8可知,当浸出过程中未添加氧化剂时,浸出渣的XRD谱与原铀尾矿的XRD谱基本相同。以MnO2作为氧化剂时,硅酸铁盐(Fe3FeSiO4(OH)5)的特征峰明显降低,说明MnO2具有破坏硅酸铁盐的作用,同时生成了新的硅酸锰盐(Mn8Si6O15(OH)10),这是导致浸出1.5 h后铀浸出率显著下降的主要原因。除此之外,尾渣中还发现了MnO2的特征峰,而MnO2是铀的高效吸附剂,这也进一步证实了MnO2添加过多容易导致铀浸出率显著降低的现象。添加Fe3+盐后的XRD谱与未添加氧化剂的XRD谱无明显变化,从而证实了Fe3+对硅酸盐无破坏作用,这与浸出实验中Fe3+的强化效果明显低于MnO2相一致。添加H2O2的尾渣XRD谱中硅酸铁盐(Fe3FeSiO4(OH)5)的特征峰有一定的降低,尽管其破坏硅酸盐的能力略差于MnO2,但反应后不会生成新的硅酸盐矿物,从而降低了浸出液中铀再次被吸附的概率,因此,最终铀的浸出率与H2O2的添加量成正比,这与图7中的实验结果一致。

图8 浸出渣的XRD谱
Fig. 8 XRD patterns of uranium leaching residue
添加不同氧化剂后浸出尾渣的SEM像如图9所示。由图9可知,添加不同氧化剂后的浸出尾渣形貌具有较大的差异。没有添加任何氧化剂的浸出尾渣以团聚的大颗粒形式存在,说明浸出过程中仅靠浸出液(硫酸)无法破坏其本身的脉石结构,这是导致常规酸浸中浸出时间长、浸出效率低的主要原因。添加氧化剂MnO2和H2O2后,团聚的大颗粒明显变成较小尺寸的颗粒,这也再次证明了MnO2和H2O2对脉石结构的破坏作用,但二者之间又有一定的差别。添加MnO2的浸出尾渣颗粒尺寸明显大于添加H2O2的浸出尾渣颗粒尺寸,这是因为再次形成硅酸锰盐(Mn8Si6O15(OH)10)后晶体尺寸长大的原因,同时也发现了少量未完全反应的MnO2晶体。而添加H2O2后的尾渣中,除少量未完全被破坏的大颗粒外,由于反应过程中不会再生成其他的硅酸盐晶体,导致颗粒的平均尺寸均较小,因此促进了铀的解离,这也是当H2O2添加量足够时,其强化效果优于MnO2的主要原因。添加Fe3+作为氧化剂时,尾渣的颗粒尺寸依旧较大,这也再次说明了Fe3+对脉石结构无明显的破坏作用。除此之外,与未添加氧化剂的尾渣相比,颗粒表面还出现了条状的晶体覆盖在颗粒表面,会对铀会产生吸附作用(见图10 EDS分析结果),这是图7(c)中反应后期铀浸出率显著降低的主要原因。

图9 浸出尾渣的SEM像
Fig. 9 SEM images of uranium leaching residue

图10 添加不同氧化剂后浸出后尾渣的EDS分析结果
Fig. 10 EDS results of uranium leaching residue
浸出尾渣的EDS分析结果如图10所示。浸出尾渣表面的能谱元素组成基本一致,但添加Fe3+作为氧化剂的尾渣中铀含量明显较其他尾渣偏高,这也证明了Fe3+作为氧化剂添加量如果过多,将会在后期对浸出液中的铀进行吸附。综上分析可知,对于3种氧化剂而言,强化浸出效果最好的为H2O2,其次为MnO2,最后为Fe3+。然而,H2O2及MnO2破坏脉石结构的微观机理还有待于深入研究。
3 结论
1) 铀尾矿的主要成分为各类硅酸盐,铀含量仅为0.008%左右,必须破坏硅酸盐结构才能实现铀的解离。
2) 采用常规硫酸浸出工艺铀的浸出率较低,而且浸出时间长达6h后,铀的浸出率仅为78%左右。
3) 通过添加氧化剂后,铀的浸出率及浸出速度显著提高,在1.5h内铀的浸出率可达95%,氧化剂的强化效果优先顺序依次为H2O2、MnO2和Fe3+。
4) H2O2和MnO2在浸出过程中的强化作用主要是靠破坏硅酸盐结构或生成新的硅酸盐晶体而实现的,Fe3+对硅酸盐没有明显的破坏作用,仅能通过氧化低价铀至高价铀来提高铀的浸出率。
REFERENCES
[1] 姜 巍, 高卫东. 低碳压力下中国核电产业发展及铀资源保障[J]. 长江流域资源与环境, 2011, 20(8): 938-943.
JIANG Wei, GAO Wei-dong. Analysis of China nuclear power industry development and its uranium resource safeguard[J]. Resources and Environment in the Yangtze Basin, 2011, 20(8): 938-943.
[2] 牛学军, 谭亚辉, 苏艳茹, 苏学斌, 陈 昊. 我国铀矿采冶技术发展方向和重点任务[J]. 铀矿冶, 2013(1): 22-26.
NIU Xue-jun, TAN Ya-hui, SU Yan-ru, SU Xue-bin, CHEN Hao. Development direction and key task of uranium mining and metallurgy techniques in China[J]. Uranium Mining and Metallurgy, 2013(1): 22-26.
[3] 徐 磊, 钱建平, 唐专武. 我国铀矿废渣石污染特点及治理方法[J]. 中国矿业, 2013, 22(1): 61-64.
XU Lei, QIAN Jian-ping, TANG Zhuan-wu. A study of features and methodology of waste treatment in uranium mines of China[J]. China Mining Magazine, 2013, 22(1): 61-64.
[4] LIU Jin-xiang, XIE Shui-bo, WANG Yong-hua, LIU Ying-jiu, CAI Ping-li, XIONG Fen, WANG Wen-tao. U(Ⅵ) reduction by Shewanella oneidensis mediated by anthraquinone-2-sulfonate[J]. Transactions of Nonferrous Metals Society of China, 2015, 25(12): 4144-4150.
[5] 邓文静, 周书葵, 刘迎九, 曾光明, 江海浩, 康 丽, 方 良. 木屑季铵螯合吸附剂的制备及其吸附铀矿酸法废水中U(Ⅵ)[J]. 中国有色金属学报, 2015, 25(9): 2604-2611.
DENG Wen-jing, ZHOU Shu-kui, LIU Ying-jiu, ZENG Guang-ming, JIANG Hai-hao, KANG Li, FANG Liang. Preparation of quaternary ammonium salt modified sawdust chelate adsorbent and its U(Ⅵ) adsorption in wastewater from uranium milling plant[J]. The Chinese Journal of Nonferrous Metals, 2015, 25(9): 2604-2611.
[6] KHALED S M, AZAM S. Depositional characteristics of uranium tailings from Saskatchewan, Canada[J]. Environmental Earth Sciences, 2014, 72(11): 4393-4400.
[7] RAO K A, SREENIVAS T, VINJAMUR M, SURI A K. Continuous leaching of uranium from an Indian ore: Residence time scale up and heat effects[J]. Hydrometallurgy, 2014, 146: 119-127.
[8] IBRAHIM M E, LASHEEN T A, HASSIB H B, HELAL A S. Oxidative leaching kinetics of U(Ⅳ) deposit under acidic oxidizing conditions[J]. Journal of Environmental Chemical Engineering, 2013, 1(4): 1194-1198.
[9] COSTINE A, NIKOLOSKI A N, DA COSTA M, CHONG K F, HACKL R. Uranium extraction from a pure natural brannerite mineral by acidic ferric sulphate leaching[J]. Minerals Engineering, 2013, 53: 84-90.
[10] ZAKRZEWSKA K G, HERDZIK K I, COJOCARU C, CHAJDUK E. Experimental design and optimization of leaching process for recovery of valuable chemical elements (U, La, V, Mo, Yb and Th) from low-grade uranium ore[J]. Journal of Hazardous Materials, 2014, 275: 136-145.
[11] SANTOS E A, LADEIRA A C Q. Recovery of uranium from mine waste by leaching with carbonate-based reagents[J]. Environmental Science and Technology, 2011, 45(8): 3591-3597.
[12] OHASHI Y, MURASHITA S, NOMURA M. Extraction of uranium from solid waste containing uranium and fluorine[J]. Minerals Engineering, 2014, 61: 32-39.
[13] TOCINO F, SZENKNECT S, MESBAH A, CLAVIER N, DACHEUX N. Dissolution of uranium mixed oxides: The role of oxygen vacancies vs the redox reactions[J]. Progress in Nuclear Energy, 2014, 72: 101-106.
[14] CHARALAMBOUS F A, RAM R, MCMASTER S, POWNCEBY M I, TARDIO J, BHARGAVA S K. Leaching behaviour of natural and heat-treated brannerite-containing uranium ores in sulphate solutions with iron (Ⅲ)[J]. Minerals Engineering, 2014, 57: 25-35.
[15] LEI Xue-fei, QI Guang-xia, SUN Ying-dong, XU Hui, WANG Yi. Removal of uranium and gross radioactivity from coal bottom ash by CaCl2 roasting followed by HNO3 leaching[J]. Journal of Hazardous Materials, 2014, 276: 346-352.
[16] LADOLA Y S, CHOWDHURY S, ROY S B, PANDIT A B. Application of cavitation in uranium leaching[J]. Desalination and Water Treatment, 2014, 52(1/3): 407-414.
[17] 杨雨山, 喻 清, 胡 南, 丁德馨. 微波加热预处理堆浸铀矿石[J]. 稀有金属, 2016, 40(3): 280- 286.
YANG Yu-shan, YU Qing, HU Nan, DING De-xin. Heap leaching uranium ore pretreated by microwave radiation[J]. Chinese Journal of Rare Metals, 2016, 40(3): 280- 286.
[18] 叶勇军, 丁德馨, 李广悦, 扶海鹰, 宋键斌, 胡 南. 不同粒径分布分维数铀矿石的浸出规律[J]. 中国有色金属学报, 2013, 23(10): 2921-2927.
YE Yong-jun, DING De-xin, LI Guang-yue, FU Hai-ying, SONG Jian-bin, HU Nan. Leaching behavior of uranium ore with different fractal dimensions of particle size distribution[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(10): 2921-2927.
[19] GAO Jia-cheng, WANG Liang-fen, WANG Yong, WU Shu-fang. High-temperature creep properties of uranium dioxide pellet[J]. Transactions of Nonferrous Metals Society of China, 2010, 20(2): 238-242.
[20] YOULTON B J, KINNAIRD J A. Gangue–reagent interactions during acid leaching of uranium[J]. Minerals Engineering, 2013, 52: 62-73.
[21] 樊耀亭, 吕秉玲, 徐 杰, 蒋永贵, 张琳萍. 水溶液中二氧化锰对铀的吸附[J]. 环境科学学报, 1999, 19(1): 42-46.
FAN Yao-ting,  Bing-ling, XU Jie, JIANG Yong-gui, ZHANG Lin-ping. Adsorption of uranium on manganese dioxide in aqueous solution[J]. Acta Scientiae Circumstantiae, 1999, 19(1): 42-46.
Bing-ling, XU Jie, JIANG Yong-gui, ZHANG Lin-ping. Adsorption of uranium on manganese dioxide in aqueous solution[J]. Acta Scientiae Circumstantiae, 1999, 19(1): 42-46.
[22] WANG Z, LEE S W, CATALANO J G, LEZAMA-PACHECO J S, BARGAR J R, TEBO B M, GIAMMAR D E. Adsorption of uranium (VI) to manganese oxides: X-ray absorption spectroscopy and surface complexation modeling[J]. Environmental Science and Technology, 2012, 47(2): 850-858.
[23] LASHEEN T A, EL-AHMADY M E, HASSIB H B, HELAL A S. Oxidative leaching kinetics of molybdenum-uranium ore in H2SO4 using H2O2 as an oxidizing agent[J]. Frontiers of Chemical Science and Engineering, 2013, 7(1): 95-102.
[24] FAN Fang-li, DING Hua-jie, BAI Jing, WU Xiao-lei, LEI Fuan, TIAN Wei, WANG Yang, QIN Zhi. Sorption of uranium (VI) from aqueous solution onto magnesium silicate hollow spheres[J]. Journal of Radioanalytical and Nuclear Chemistry, 2011, 289(2): 367-374.
[25] WANG Jing-song, BAO Zheng-lei, CHEN Si-guang, YANG Jin-hui. Removal of uranium from aqueous solution by chitosan and ferrous ions[J]. Journal of Engineering for Gas Turbines and Power, 2011, 133(8): 21-23.
Oxidizing leaching of uranium from low-grade uranium tailings
LI Mi1, 2, ZHANG Biao1, ZHANG Xiao-wen1, 2, HUANG Jing1, DING De-xin3, YE Yong-jun3
(1. School of Environment Protection and Safety Engineering, University of South China, Hengyang 421001, China;
2. Key Laboratory of Radioactive Waste Treatment and Disposal, University of South China, Hengyang 421001, China;
3. Key Discipline Laboratory for National Defense for Biotechnology in Uranium Mining and Hydrometallurgy, University of South China, Hengyang 421001, China)
Abstract: In view of low extraction rate of uranium caused by high gangue content and complex occurrence state of phases existing in low-grade uranium tailings, adding suitable oxidants in leaching process to destroy the gangue crystal structure were proposed to enhance the uranium extraction. The effects of traditional acid leaching and intensified leaching with three oxidants (H2O2, MnO2 and Fe3+) on uranium extraction were investigated using single-factor experiments. The results show that uranium extraction ratio is only 78% after 6 h in traditional leaching at temperature, sulfuric acid concentration and liquid-solid ratio of 30 ℃, 1 mol/L and 20:1, respectively, while the extraction ratio reaches 95% after 1.5 h in intensified leaching under the same leaching conditions. H2O2 and MnO2 can decompose the gangue crystal structure and reduce the particle agglomeration. However, manganous silicate forms when MnO2 is used as oxidants. The ferric iron has no effect on destroying the gangue crystal structure, but it can improve the uranium extraction ratio depending on its oxidation influence.
Key words: uranium tailing; leaching; oxidization; gangue
Foundation item: Project(51404141) supported by the National Natural Science Foundation of China; Project (2015RS4039) supported by the Science and Technology Project of Hunan Province, China; Project (2015M572255) supported by China Postdoctoral Science Foundation; Project(2014KS32) supported by the Science and Technology Project of Hengyang, China
Received date: 2015-09-09; Accepted date: 2016-03-15
Corresponding author: DING De-xin; Tel: +86-734-8282562; E-mail: dingdxzzz@163.com
(编辑 龙怀中)
基金项目:国家自然科学基金资助项目(51404141);湖南省创新人才计划资助项目(2015RS4039);中国博士后科学基金资助项目(2015M572255);衡阳市科学技术发展计划项目(2014KS32)
收稿日期:2015-09-09;修订日期:2016-03-15
通信作者:丁德馨,教授,博士;电话:0734-8282562;E-mail: dingdxzzz@163.com