镍钼矿冶炼渣酸浸液的萃取净化及氧化亚镍的制备
楚广,赵思佳,杨天足
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
摘要:用溶剂萃取的方法从镍钼矿冶炼渣酸浸液中回收镍并制备氧化亚镍粉末。研究结果表明:有机相中萃取剂2-乙基己基膦酸-单-2-乙基己基酯(PC-88A)的添加量、相比(即水与油的体积比)、萃取时间、料液的pH对镍萃取有显著的影响,温度对镍的萃取影响很小。最佳萃取工艺条件如下:萃取剂(PC-88A)体积分数为30%,相比为3:1,料液的pH为6.7,萃取时间为3 min,萃取温度为30 ℃,在此最佳条件下进行二级错流萃取,镍的萃取率为99.6%。反萃的最佳条件如下:相比为1:3,盐酸的浓度为2 mol/L,反萃时间为3 min,在此最佳条件下,一级镍的反萃率为99.3%。用反萃得到氯化镍先制备草酸镍,然后煅烧,得到纯度达99 %氧化亚镍粉末。
关键词:萃取;反萃;PC-88A;回收镍
中图分类号:TF804.2 文献标志码:A 文章编号:1672-7207(2011)05-1195-07
Solvent extraction and purification of acid leach liquor of metalliferous black shale smelter slag and preparation of NiO powder
CHU Guang, ZHAO Si-jia, YANG Tian-zu
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: Nickel was recovered by solvent extraction from the acid leach liquor of metalliferous black shale smelter slag and NiO powder was produced from nickel oxalate prepared. The results show that the addition amount of the extractant (PC-88A), phase ratio volume ratio of water to oil, extraction time, pH of the feed solution have significant effect on nickel extraction and extraction temperature has a marginal effect on nickel extraction. Optimum process operating parameters are as follows: volume fraction of addition PC-88A of 30%, volume ratio of water to oil of 3:1, pH of feed solution 6.7 for 3 min at 30 ℃. Under the optimum condition, the two-step cross-current extraction is carried out to extract nickel and the extraction efficiencies of nickel is 99.6%. The nickel stripping efficiencies in the examined conditions are about 99.3% under conditions of phase ratio of 1:3, hydrochloric acid 2 mol/L for 3 min. Then, the purged nickel chloride is used to produce nickel oxalate and NiO powder with purity of above 99% is obtained.
Key words: solvent extraction; stripping; PC-88A; nickel recovery
镍是位居元素周期表第Ⅷ族的金属元素,被称为“钢铁工业的维生素”,广泛应用于石油化工、国防、冶金、机械、电镀、电子、电池、建材等行业[1]。镍也广泛用于制备耐热合金、磁性材料、电子及电气材料、触媒、储氢金属、形态记忆合金、颜料及染料等功能材料[2]。随着镍中高品位硫化矿物、氧化矿物的不断减少,以及工业和生活的含镍废品的不断增加,从含镍的废料以及废液中回收镍以及其他有价金属十分必要。而含镍废料的浸出液或废液中镍的含量低,若采用浓缩蒸馏,则费用较高。此外,镍钼矿经过焙烧脱硫-碳酸钠焙烧回收钼后,镍钼矿冶炼渣中钠离子含量高,酸浸后得到的溶液中钠离子质量浓度达30 g/L以上,而镍离子质量浓度仅为3 g/L左右,故实验选择溶剂萃取方法从高钠溶液中回收镍。对镍钼矿的冶炼和资源综合利用具有重要的现实意义。溶剂萃取用于无机物的分离、富集始于19世纪中叶。直到20世纪40年代后期,金属的溶剂萃取才得到迅速发展。自20世纪60年代以后,金属溶剂萃取技术在核燃料、有色金属、稀土、稀有金属以及贵金属的提取、分离等方面得到工业应用[3],特别是在稀土以及铜、镍、钴、贵金属、稀散金属的分离和提纯中均得到工业化应用[4-7]。PC-88A的性质稳定,萃取效果好,其在硫酸介质中萃取金属能力基本上与P204的类似,但钴镍萃取曲线之间的距离大一些[8-9],因此,工业上主要用于分离钴镍。童长钿等[10]研究了制备草酸镍粉末时的形状以及粒度的控制,并对草酸镍形貌和粒度控制在理论上进行了分析,得到针状、球状、片状的草酸镍粉末。Liu等[11]用草酸盐沉淀-焙烧方法制备氧化亚镍粉末,此工艺简单易控制。邓祥义等[12]用氨水单相沉淀法制备得到纳米氧化亚镍,此工艺操作简单,易于实现工业化。在此,本文作者对用PC-88A从镍钼矿冶炼渣硫酸浸出液中回收镍的萃取工艺进行研究,并制备氧化亚镍粉末。
1 实验
1.1 主要实验原料与仪器
(1) 原料与试剂:镍钼矿冶炼渣硫酸浸出的含镍溶液(镍钼矿冶炼渣来自湖南省张家界市);PC-88A(上海莱雅仕化工有限公司生产)、煤油,均为试剂级产品;硫酸与氢氧化钠以及氨水,均为分析纯。
(2) 仪器:IRIS INTREPID ⅡXSP型等离子发射光谱仪(美国Thermo Electron公司制造);WFX120型原子吸收分光光度计(北京瑞丽公司制造);JSM-6360LV扫描电子显微镜(日本电子株式会社制造);X线衍射仪(日本Rigaku公司制造);DF-Ⅱ集热式磁力加热搅拌器;125 mL分液漏斗;DELTA-320型pH计。
将镍钼矿冶炼渣浸出液以及将其净化得到的溶液进行等离子发射光谱分析。此外,在萃取实验中,溶液的镍含量用原子吸收分光光度法进行分析。
1.2 实验原理
1.2.1 含镍浸出液净化
含镍浸出液净化处理前溶液中金属离子质量浓度见表1。由表1可知:含镍浸出液的主要杂质为Fe,Zn,Mg,Ca,Pb和Cu等。针对此溶液的特点,选择了氧化中和水解2步除铁、硫化钠沉淀除铅铜、氟化钠沉淀除钙镁、萃取法除锌的净化工艺。
表1 浸出液中金属质量浓度
Table 1 Mass concentration of leach liquor g/L

(1) 氧化中和水解除铁。部分金属氢氧化物沉淀的pH如表2所示[13]。要去除镍溶液中的铁,就需要将二价铁氧化成三价铁从而形成氢氧化铁沉淀。氧化中和水解的优点是除铁效果好,除铁后溶液中铁质量浓度小于3 mg/L。但若浸出液中铁的质量浓度高,则沉淀过滤速度慢,渣量大。在浸出液中加入一定量的pH=3.5~4.0的乙酸-乙酸钠缓冲液,滴加一定量的30% H2O2, 用氢氧化钠调节溶液的pH=3.0~3.5,在90 ℃水解2 h,搅拌速度为700 r/min,过滤后得到的溶液铁质量浓度小于6 mg/L,同时也可以附带除去一部分硅。反应如下:
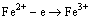 (1)
(1)
 (2)
(2)
表2 25 ℃时部分金属氢氧化物沉淀的最低pH
Table 2 The lowest pH of some metals hydroxides precipitation at 25 ℃

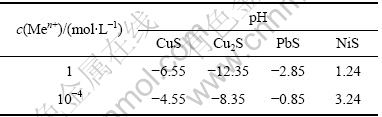
(2) 硫化物除铜铅。根据金属元素Ni,Cu和Pb硫化物的溶解度的差异,将pH控制在一定范围内,铜、铅以硫化物的形式沉淀出来,而镍仍然保留在溶液中。铜、铅、镍硫化物的溶度积以及pH见表3与表4。由于浸出液中镍的浓度约为0.06 mol/L,所以,控制溶液的pH为3.0左右,搅拌速度为700 r/min,在85 ℃反应1.5 h。硫化钠的添加量为理论量的4倍。铜、铅与硫化钠反应生成不溶黑色沉淀,过滤得到的溶液铜、铅的脱除率大于99.9%。
用硫化物除铜,铅的反应如下:
Cu2++S2-=CuS↓ (3)
Pb2++S2-=PbS↓ (4)
(3) 氟化钠法除钙、镁。根据热力学数据,CaF2和MgF2的溶度积(Ksp)都较小,而NiF2的溶解度较大,所以,氟化物是一种很好的脱除钙、镁的沉淀剂。实验条件如下:pH=4.5,搅拌速度为700 r/min,温度为
表3 18~25 ℃时铜、铅、镍的硫化物的溶度积
Table 3 Solubility product of copper sulphide, lead sulphide and nickel sulphide at 18-25 ℃

表4 25 ℃时硫化物形成的平衡pH
Table 4 Balance pH of sulfide formation at 25 ℃
85 ℃,反应1.5 h,静置4 h。其中氟化物的添加量为理论量的6倍,钙镁的净化率达95%以上。
Ca2++2F-=CaF2↓ Ksp=2.7×10-11 (5)
Mg2++2F-=MgF2↓ Ksp=6.5×10-9 (6)
(4) 萃取法除锌。在pH=3.5条件下,按体积比添加20%的PC-88A,磺化煤油为稀释剂。净化液与有机相以相比(即水与油的体积比)3:1在室温下混合,摇3 min,静置0.5 min 分层。一级萃取锌的净化率为99.8%。含镍浸出液净化后金属离子质量浓度见表5。
表5 净化液中金属质量浓度
Table 5 Mass concentration of purged liquor mg/L

1.2.2 萃取和反萃原理
在实验中选取PC-88A为萃取剂,磺化煤油为稀释剂。PC-88A的皂化率一般控制在70%~75%为宜,金属过高会导致黏度过大;负荷过低,则萃取剂利用率太低[13]。由于含镍净化液中含有少量锌,用PC-88A萃取除锌,然后,用二级错流萃取回收镍。
有机磷酸萃取镍的总反应式可以写为:
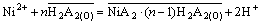 (7)
(7)
镍的反萃反应式可以写为:
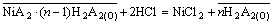 (8)
(8)
2 结果与讨论
萃取和反萃是决定氯化镍质量以及镍的回收率的关键步骤,因此,必须研究各因素对镍萃取以及反萃的影响。影响萃取的因素有:萃取剂的添加量、相比、料液的pH、萃取时间和萃取温度等。影响反萃的因素有:反萃剂的浓度、相比和反萃时间等。分别对它们进行单因素实验,实验结果如图1~8 所示。
2.1 萃取
2.1.1 萃取剂体积分数对镍萃取率的影响
萃取条件如下:相比为3:1,取60 mL料液,料液的pH调整为6.0,萃取时间为3 min。萃取剂PC-88A的添加量对镍的萃取的影响如图1所示。

图1 PC-88A的添加量对镍萃取率的影响
Fig.1 Effect of addition amount of PC-88A on nickel extraction efficiencies
由图1可知:随着萃取剂PC-88A的添加量的增加,镍的一级萃取率呈逐渐上升趋势;当萃取剂PC-88A的体积分数小于30%时,镍的二级萃取率随着PC-88A的体积分数的增加不断增加;当萃取剂PC-88A的体积分数大于30%时,镍的二级萃取率基本保持不变,可达99.5%。这是因为有机相中PC-88A含量低会使得有机相中负载的镍离子含量小。当有机相中PC-88A体积分数太大时,不仅不会促进镍萃取率提高,而且会消耗过多的萃取剂;所以,选取有机相中PC-88A的体积分数为30%。
2.1.2 相比对镍萃取率的影响
萃取条件为:有机相中PC-88A的添加量为30%,料液的pH调整为6.0,萃取时间为3 min。萃取时相比对镍的萃取的影响如图2所示。
由图2可以看出:随着料液与有机相的相比的增加,镍的一级萃取率呈逐渐下降趋势;当料液与有机相的相比大于3:1时,镍的二级萃取率随着相比的增加而不断减少;当料液与有机相的相比小于3:1时,镍的二级萃取率基本保持不变,可达99.2%。这是因为当有机相体积不变时,增加料液的体积后,镍离子含量增加,萃取剂总量不变,使得镍的萃取率下降;减少料液的体积后,料液中镍离子含量减少,使得镍的萃取率增加。所以,后续实验选取料液与有机相的相比为3:1。
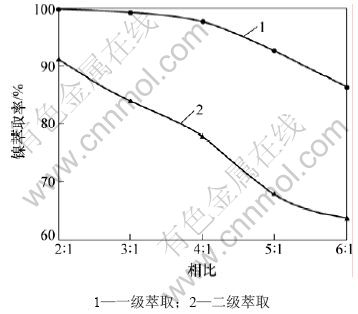
图2 萃取相比对镍萃取率的影响
Fig.2 Effect of phase ratio of aqueous phase to organic phases on nickel extraction efficiencies
2.1.3 溶液pH对镍萃取率的影响
萃取条件如下:有机相中PC-88A的体积分数为30%,取60 mL料液,料液与有机相的相比为3:1,平衡时间为3 min。萃取时料液的pH对镍的萃取的影响如图3所示。从图3可以看出:随着料液的pH的增加,镍的一级萃取率呈逐渐增加,并在pH=6.7时达到最大值86.7%;随着料液的pH的增加,镍的二级萃取率逐渐增加,并在pH=6.7时达到最大值99.4%。这是因为萃取剂PC-88A在较高的pH下对镍的萃取能力最强。所以,后续实验选取料液的pH为6.7。
2.1.4 萃取时间对镍萃取率的影响
萃取条件如下:有机相中PC-88A的体积分数为30%,取60 mL料液,料液与有机相的相比为3:1,料液的pH调整为6.7。萃取时间对镍的萃取率的影响如图4所示。从图4可以看出:当萃取时间为10 s时镍的一级萃取率为43.6%,二级萃取率为89.3%;随着萃取时间的增加,镍的一、二级萃取率逐渐增加并在3 min时镍的一级萃取率最大值可达83.7%。镍的二级萃取率最大值可达99.6%。这是因为随着萃取时间的增加,有机相从料液中萃取镍越接近平衡;当萃取时间大于3 min时,镍的萃取率基本保持不变。
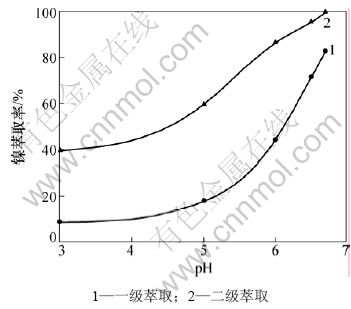
图3 萃取料液的pH对镍萃取率的影响
Fig.3 Effect of pH of feed solution on nickel extraction efficiencies
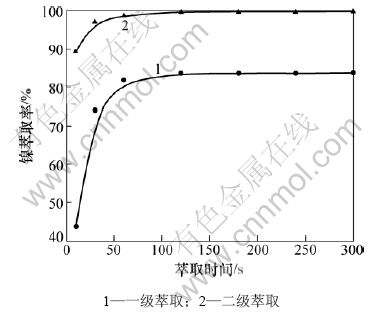
图4 萃取时间对镍萃取率的影响
Fig.4 Effect of extraction time on nickel extraction efficiencies
2.1.5 温度对镍萃取率的影响
萃取条件如下:有机相中PC-88A的体积分数为30%,取60 mL料液,料液与有机相的相比为3:1,料液的pH调整为6.7,萃取时间为3 min。萃取温度对镍的萃取的影响如图5所示。
从图5可以看出:随着萃取温度的升高,镍的一级萃取率从30 ℃到40 ℃有略微升高后便随着温度的升高二逐渐减低;镍的二级萃取率从99.6%(30 ℃)逐渐减低到95.8%(70 ℃),可以看出温度对镍的萃取率的影响较小。故选取萃取温度为25~30 ℃。
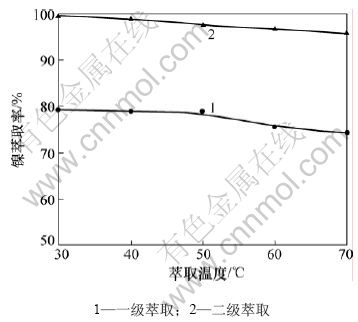
图5 萃取温度对镍萃取率的影响
Fig.5 Effect of extraction temperature on nickel extraction efficiencies
2.2 反萃
2.2.1 反萃剂浓度对镍反萃取率的影响
反萃条件如下:在常温(25 ℃)时,反萃时间为3 min,有机相与盐酸的相比为4:1,静置2 min。采用盐酸作为镍的反萃剂。盐酸的浓度对镍反萃率的影响如图6所示。
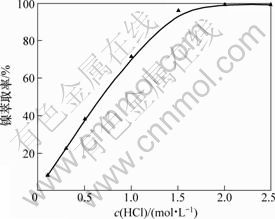
图6 盐酸的浓度对镍反萃率的影响
Fig.6 Effect of concentration of hydrochloric acid on nickel stripping efficiencies
由图6可知:当盐酸的浓度小于2.0 mol/L时,随着盐酸的浓度的增加镍的反萃率不断增加。这是因为当体积不变时,随着盐酸浓度的增加,反萃剂中氢离子总量增加,对有机相中镍的反萃取能力不断增强;当盐酸的浓度等于或大于2.0 mol/L时,镍的反萃率基本不变,此时镍的反萃率可达99.3%。
2.2.2 相比对镍反萃取率的影响
反萃条件为:在常温(25 ℃)下,用2.0 mol/L盐酸反萃取含镍有机相,反萃3 min,静置2 min,反萃相比对镍反萃率的影响如图7所示。
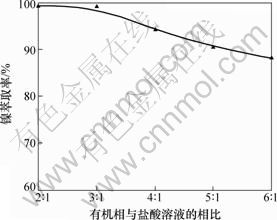
图7 有机相与盐酸溶液的相比对镍反萃率的影响
Fig.7 Effect of ratio of hydrochloric acid-organic phase on nickel stripping efficiencies
由图7可知:在反萃相比2:1到6:1的范围内,随着反萃相比的增加,反萃率下降很大。这是因为有机相中镍的含量也很大,而盐酸含量较低,不能将有机相中的镍完全反萃,导致反萃率下降。
2.2.3 反萃时间对镍反萃取率的影响
反萃条件如下:在常温(25 ℃)下,用2.0 mol/L的盐酸反萃取含镍有机相,有机相与盐酸的相比为3:1,静置2 min。相比对镍反萃率的影响如图8所示。
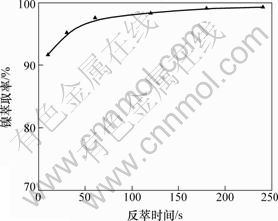
图8 反萃时间对镍反萃率的影响
Fig.8 Effect of time of reverse extraction on nickel stripping efficiencies
由图8可知:盐酸对镍的反萃取率高,且萃取时间短;当反萃时间为10 s时,镍的反萃取率为91.7%;随着反萃时间的增加,镍的反萃率也不断增加,反萃3 min时,镍的反萃率为99.2%,这是因为反萃时间越长,盐酸与有机相接触时间越长,两相反应越充分。但是,在这个过程中,镍的反萃率增加很缓慢。
2.3 草酸镍的制备
反萃得到的氯化镍溶液中镍质量浓度约32 g/L。用活性炭除去氯化镍溶液中的有机物,取该溶液60 mL。实验中使用的是饱和的草酸溶液,并用氨水、氢氧化钠调节溶液的pH。
草酸镍的制备方法分为2种[10]:
(1) 将氯化镍溶液与氨水以及适量的氢氧化钠混合制备成氨镍络合物溶液,在水浴中加热到一定温度,保持一定的搅拌速度,把室温下饱和的草酸溶液缓慢滴加到溶液中。恒温反应一段时间后,停止滴加草酸,继续保温陈化一段时间。
(2) 将氯化镍溶液与氨水以及适量的氢氧化钠混合制备成氨镍络合溶液,再将一定量的草酸溶液与氨镍络合溶液混合均匀,保持一定搅拌速度,从室温下开始升温到一定温度后,保温陈化一段时间,最后过滤、洗涤、干燥。
由上述2种方法制备得到的草酸镍粉末形貌如图 9所示。由图9可知:草酸以液体的形式加入到氨镍络合溶液中,当氨镍络合溶液初始pH小于8.0时,得到球形或类球形团聚颗粒;当氨镍络合溶液初始pH大于8.0时,得到纤维状颗粒。温度增加有利于颗粒长大;加料速度快时,颗粒团聚加重。
2.4 氧化亚镍的制备
将制备得到的蓝色草酸镍(图9(d))在700 ℃焙烧 4 h,得到灰绿色的氧化亚镍。X线衍射分析结果如图10所示。对照PDF(Powder diffraction file)卡片可 知:得到的颗粒是2种晶型结构不同的氧化亚镍混合物。图11所示为制备得到的片状氧化亚镍SEM 图,颗粒度都小于3 μm。制备的氧化亚镍符合国家一级品指标,其化学成分(质量分数)如表6所示。
表6 氧化亚镍成分(质量分数)
Table 6 Chemical composition of nickel monoxide %


图9 不同条件下制备的草酸镍粉末的SEM形貌
Fig.9 SEM images of nickel oxalate particles under different conditions
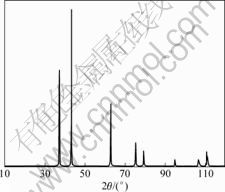
图10 氧化亚镍粉末的X线衍射图谱
Fig.10 XRD pattern of nickel monoxide particles

图11 氧化亚镍粉末的SEM形貌
Fig.11 SEM image of nickel monoxide particles
3 结论
(1) 萃取最佳条件如下:有机相中PC-88A的体积分数为30%,萃取时料液与有机相的相比为3:1,料液的pH为6.7,萃取时间为3 min,萃取温度为 30 ℃。
(2) 反萃最佳条件如下:盐酸的浓度为2 mol/L,盐酸与有机相的相比为1:3,反萃时间为3 min。
(3) 在以上2种最佳工艺条件下,镍的萃取率为99.6%,反萃率为99. 3%。制备得到纯度为99%以上的氧化亚镍粉末。
参考文献:
[1] 田福祯, 王平, 李晓丽, 等. 从镍-铝废催化剂中回收镍[J]. 化学世界, 1996(5): 270-272.
TIAN Fu-zhen, WANG Ping, LI Xiao-li, et al. Recovery of nickel from spent Ni-Al catalyst[J]. Chemistry World, 1996(5): 270-272.
[2] 任鸿九, 王立川. 有色金属提取冶金手册: 铜镍[M]. 北京: 冶金工业出版社, 2000: 499.
REN Hong-jiu, WANG Li-chuan. Extractive metallurgy handbook of nonferrous metallurgy: Copper and nickel[M]. Beijing: Metallurgical Industry Press, 2000: 499.
[3] 王开毅, 成本诚, 舒万银. 溶剂萃取化学[M]. 长沙: 中南工业大学出版社, 1991: 1-5.
WANG Kai-yi, CHENG Ben-cheng, SHU Wan-yin. Solvent extraction chemistry[M]. Changsha: Central South University of Technology Press, 1991: 1-5.
[4] 刘大星. 国内外钴的生产、消费与技术进展[J]. 有色金属, 2000, 29(5): 4-20.
LIU Da-xing. Cobalt production, consumption and technical development at home and abroad[J]. Nonferrous Metal, 2000, 29(5): 4-20.
[5] 刘大星. 我国湿法冶金技术的进展[J]. 有色金属: 矿山部分, 2002, 54(3): 6-10.
LIU Da-xing. Progress of hydrometallurgy process[J]. Nonferrous Metallurgy: Mine, 2002, 54(3): 6-10.
[6] 严纯华, 吴声, 廖春生, 等. 稀土分离理论及其实践的新进展[J]. 无机化学学报, 2008, 24(8): 1200-1205.
YAN Chun-hua, WU Sheng, LIAO Chun-sheng, et al. Development of the theory of countercurrent extraction and its industrial applications[J]. Chinese Journal of Inorganic Chemistry, 2008, 24(8): 1200-1205.
[7] 蔡旭麒. 二异戊基硫醚萃取分离贵金属[J]. 有色金属: 冶炼部分, 1996(5): 42-48.
CAI Xu-qi. Solvent extraction and separation of precious metals by diisoamyl sulphide[J]. Nonferrous Metallurgy: Smelting, 1996(5): 42-48.
[8] 杨佼庸, 刘大星. 萃取[M]. 北京: 冶金工业出版社, 1988: 112-113.
YANG Jiao-yong, LIU Da-xing. Solvent extraction[M]. Beijing: Metallurgical Industry Press, 1988: 112-113.
[9] 彭容秋. 镍冶金[M]. 长沙: 中南大学出版社, 2005: 191-192.
PENG Rong-qiu. Nickel metallurgy[M]. Changsha: Central South University Press, 2005: 191-192.
[10] 童长钿, 李启厚, 赖复兴, 等. 超细草酸镍粒子的制备以及形状和粒度的控制[J]. 湿法冶金, 2003, 22(1): 22-27.
TONG Chang-dian, LI Qi-hou, LAI Fu-xing, et al. Preparation of ultrafine nickel oxalate and control of the particle shape and size[J]. Hydrometallurgy, 2003, 22(1): 22-27.
[11] LIU Song, GU Guo-bang. Preparation of fine nickel oxide powder[J]. Journal of South China University of Technology, 2000, 28(3): 74-78.
[12] 邓祥义, 向兰, 金涌. 氨水单相沉淀法制备纳米NiO的研究[J]. 化学工程, 2002, 30(4): 39-40.
DENG Xiang-yi, XIANG Lan, JIN Yong. Preparation of nano-NiO particles via ammonia single-phase precipitation[J]. Chemical Engineering, 2002, 30(4): 39-40.
[13] 朱屯. 萃取与离子交换[M]. 北京: 冶金工业出版社, 2005: 289.
ZHU Tun. Solvent extraction and ion exchange[M]. Beijing: Metallurgical Industry Press, 2005: 289.
(编辑 陈灿华)
收稿日期:2010-05-08;修回日期:2010-08-08
基金项目:国家重点基础研究发展计划(“973”计划)项目(2007CB613604)
通信作者:楚广(1958-),男,湖南长沙人,博士,教授,从事有色金属冶金和功能材料研究;电话:0731-88836791;E-mail:chuguang2006@163.com