异极矿的标准生成热力学函数
尹杏,刘常青,陈启元,张平民
(中南大学 化学化工学院,湖南 长沙,410083)
摘要:采用PE公司的Diamond差式扫描量热仪(DSC)测定异极矿脱去1个水分子所生成的产物Zn4Si2O7(OH)2和异极矿Zn4Si2O7(OH)2·H2O在363~563 K温度范围内的恒压比热容;测定恒压条件下,在573.15 ~ 998.15 K温度范围内异极矿加热脱水过程的DSC曲线。将比热容换算成摩尔热容,用最小二乘法分别拟合Zn4Si2O7(OH)2和Zn4Si2O7(OH)2·H2O的摩尔热容与温度的函数关系式;利用相关物质的已知热力学参数,设计热力学循环,计算在标准压强和温度298.15 K时Zn4Si2O7(OH)2和Zn4Si2O7(OH)2·H2O的标准生成热力学函数ΔfHmΘ,ΔfSmΘ和ΔfGmΘ。
关键词:异极矿;标准生成热力学函数;热容
中图分类号:O642 文献标志码:A 文章编号:1672-7207(2012)06-2054-05
Standard thermodynamic functions for formation of hemimorphite
YIN Xing, LIU Chang-qing, CHEN Qi-yuan, ZHANG Ping-min
(School of Chemistry and Chemical Engineering, Central South University, Changsha 410083, China)
Abstract: It temperature of 363-563 K, the isobaric specific heat capacities Cp of dehydrated hemimorphite Zn4Si2O7(OH)2 and hemimorphite Zn4Si2O7(OH)2·H2O were measured with Perkin Elmer Diamond DSC. Under constant pressure, the DSC curves of the heating and dehydrating process in 573.15-998.15 K were obtained. Converting the specific heat capacities Cp to the molar heat capacities Cp,m , the molar heat capacities as a function of temperature were fitted with least square methods. Based on concerned thermodynamic data, a thermodynamic cycle was designed, and the standard molar thermodynamic functions of formation ΔfHmΘ , ΔfSmΘ and Gibbs free energy ΔfGmΘ of Zn4Si2O7(OH)2 and Zn4Si2O7(OH)2·H2O under standard pressure and at temperature of 298.15 K were calculated.
Key words: hemimorphite; standard thermodynamic functions of formation; heat capacity
异极矿Zn4Si2O7(OH)2·H2O是锌的硫化矿床氧化带的一种常见矿物。在我国云南、湘西、新疆等地都有丰富的异极矿,按照其结构和物理性质,可以分为以下几种级别:宝石级、观赏石级、标本级和工业 级[1]。随着锌的硫化矿资源的日益减少,因而需从含锌氧化矿中提取锌。但是,从锌的氧化矿中提取锌的难度远比从锌的硫化矿提取锌难度大,要解决这一难题,有必要进行相关的热力学基础研究。异极矿是锌氧化矿的重要组成部分,这些研究离不开异极矿的相关热力学参数。目前,对异极矿的研究主要集中在以下几个方面:异极矿的加热过程的研究[2]、异极矿的合成[3]、异极矿的选矿研究[4]、异极矿的矿物学及其成因[5-6]、异极矿的谱学特征和颜色成因[7]、异极矿的宝石学特征[1,8-9]等。而关于其热力学性质方面的研究,目前只见有关其在加热过程中失水历程研究的TG和DTA测定的报道[1-2],异极矿的热力学参数还较少,在此,本文作者对脱一水异极矿Zn4Si2O7(OH)2和异极矿Zn4Si2O7(OH)2·H2O的等压摩尔热容Cp,m,标准摩尔生成焓ΔfHmΘ,标准摩尔生成熵ΔfSmΘ和标准摩尔生成吉布斯自由能ΔfGmΘ等热力学参数进行测定和研究。
1 热力学循环设计及热力学计算关系式
1.1 热力学循环设计
刘琰等[2,8]研究了异极矿的加热过程,认为在这个加热过程中,异极矿的脱水可分为以下3个步骤:
Zn4Si2O7(OH)2·H2O(s)
Zn4Si2O7(OH)2(s)+H2O(g) (a)
Zn4Si2O7(OH)2(s) 2β-Zn2SiO4(s)+H2O(g) (b)
2β-Zn2SiO4(s)+H2O(g) (b)
β-Zn2SiO4(s) α-Zn2SiO4(s)(硅锌矿) (c)
α-Zn2SiO4(s)(硅锌矿) (c)
β-Zn2SiO4(s),H2O(g),Zn4Si2O7(OH)2·H2O(s)和Zn4Si2O7(OH)2(s)的生成反应及Zn4Si2O7(OH)2·H2O(s)和Zn4Si2O7(OH)2(s)的脱水反应为:
2Zn(s)+Si(s)+2O2(g)=β-Zn2SiO4(s) (1)
H2(g)+0.5O2(g)=H2O(g) (2)
4Zn(s)+2Si(s)+2H2(g)+5O2(g)=Zn4Si2O7(OH)2·H2O(s)(3)
4Zn(s)+2Si(s)+H2(g)+4.5O2(g)=Zn4Si2O7(OH)2(s) (4)
Zn4Si2O7(OH)2·H2O(s)=Zn4Si2O7(OH)2(s)+H2O(g) (5)
Zn4Si2O7(OH)2(s)=2β-Zn2SiO4(s)+H2O(g) (6)
根据HESS定律(Hess’s Law)[10]设计如图1和图2所示的热力学循环。
1.2 热力学计算关系式
反应(1)~(6)之间存在下列关系:
反应(3)=反应(2)+反应(4)-反应(5)
反应(4)=2×反应(1)+反应(2)-反应(6)
由于β-Zn2Si1O4(s) 和H2O(g)在298.15 K时ΔfHmΘ,SmΘ和Cp,m等热力学参数[1-12]已知,因此,根据热力学循环图2和图1,利用实验直接测得等温等压条件下反应(b)和反应(a) 的焓变,及Zn4Si2O7(OH)2和Zn4Si2O7(OH)2·H2O的摩尔热容与温度的函数关系,计算出反应(6)和(5)的热力学参数,从而得出反应(4)和反应(3)的热力学参数,即可以获得脱一水异极矿Zn4Si2O7(OH)2和异极矿Zn4Si2O7(OH)2·H2O在298.15 K时的ΔfHmΘ。同理,可以求出298.15 K时它们的ΔfSmΘ。再根据关系式:
ΔfGmΘ=ΔfHmΘ-TΔfSmΘ
可以得到298.15 K时它们的ΔfGmΘ。
2 实验
2.1 实验原料
实验所用异极矿取自云南金顶,物相分析其纯度为98%(由湖南矿冶研究院全化学分析测定)。将异极矿在马弗炉中773.15 K下恒温90 min制得脱水异极矿,经X线衍射分析其成分为脱一水异极矿Zn4Si2O7(OH)2。
2.2 实验仪器与条件
采用PE公司的Diamond DSC(Differential scanning calorimeter,以下简称DSC)测定异极矿的脱水反应焓变和脱水反应温度。测量温度范围为573.15~998.15 K,升温速率为10 ℃/min;以空坩埚作参比,样品质量为6.40 mg;实验参数精度为±3%;样品保护气为高纯氮气,气体流速为20 mL/min;炉盖吹扫气为高纯氮气。

图1 不同温度下反应Zn4Si2O7(OH)2·H2O(s)=Zn4Si2O7(OH)2(s)+H2O(g)热力学关系图
Fig.1 Thermodynamic diagram of reaction Zn4Si2O7(OH)2·H2O(s)=Zn4Si2O7(OH)2(s)+H2O(g) at different temperatures

图2 不同温度下反应Zn4Si2O7(OH)2(s)=2β-Zn2SiO4(s)+H2O(g) 热力学关系图
Fig.2 Thermodynamic diagram of reaction Zn4Si2O7(OH)2(s)=2β-Zn2SiO4(s)+H2O(g) at different temperatures
将试样从340.15 K加热至563.15 K,并在340.15 K和563.15 K各恒温3 min,升温速率为10 ℃/min;以空坩埚作参比,异极矿样品的质量为5.29 mg,脱一水异极矿样品的质量为4.43 mg。
3 计算结果及分析
3.1 试样的摩尔热容
在343~563 K范围内,采用PE公司的Diamond DSC分别对Zn4Si2O7(OH)2和Zn4Si2O7(OH)2·H2O进行比热容测定[13]实验,并将比热容转化为摩尔热容。表1所示为实验测定所得到的Zn4Si2O7(OH)2在不同温度T下的Cp,m,依表1作出Cp,m-T如图3所示。表2所示为实验测定所得的Zn4Si2O7(OH)2·H2O在不同温度T下的Cp,m,依表2作出的Cp,m-T图如图4所示。
由图3和图4可见:在测量温度为343~563 K时,Zn4Si2O7(OH)2和Zn4Si2O7(OH)2·H2O的摩尔热容随温度的变化大致表现为1条平滑的曲线,没有相变和任何热异常现象发生。
表1 Zn4Si2O7(OH)2的摩尔热容参数实验测定值
Table 1 Experimental molar heat capacity of Zn4Si2O7(OH)2
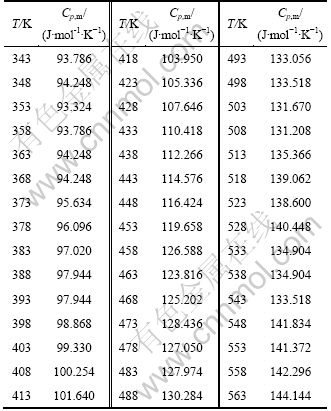

图3 Zn4Si2O7(OH)2的摩尔热容与温度的关系
Fig.3 Relationship between Cp,m of Zn4Si2O7(OH)2 and temperature
表2 Zn4Si2O7(OH)2·H2O的摩尔热容参数实验测定值
Table 2 Experimental molar heat capacity of Zn4Si2O7(OH)2·H2O

采用最小二乘法[14]分别对Zn4Si2O7(OH)2和Zn4Si2O7(OH)2·H2O的摩尔热容与温度的实验参数进行多种方程形式的拟合。并采用温度回代的方法检验不同拟合方程式与实验参数吻合程度,最终确定Zn4Si2O7(OH)2的摩尔热容与温度(363~563 K时)的函数关系式为:
Cp,m(Zn4Si2O7(OH)2(s))=-1 444.257+5.667×104T-0.5-
3.717×108T-2+6.620×1010T-3

图4 Zn4Si2O7(OH)2·H2O的摩尔热容与温度的关系
Fig.4 Relationship between Cp,m of Zn4Si2O7(OH)2·H2O and temperature
Zn4Si2O7(OH)2·H2O的摩尔热容与温度(363~563 K)的函数关系式为:
Cp,m(Zn4Si2O7(OH)2·H2O(s))=4266.234-1.175×
105T-0.5+4.772×108T-2-6.668×1010T-3
3.2 试样脱水反应热效应及脱水反应平衡温度
在等压变温条件下,573.15~998.15 K时,采用PE公司的Diamond DSC测得异极矿Zn4Si2O7(OH)2·H2O的DSC曲线如图5所示。为保障等压条件,装试样的坩埚加盖1个盖子,坩埚与盖子之间有1条微小狭缝,维持坩埚内的固态试样的饱和水蒸气压始终等于外压(Diamond DSC内部系统压力),而且为1×105 Pa。
由图5可见:Zn4Si2O7(OH)2·H2O在795 K(T1)有1个吸热峰(所用仪器规定DSC曲线峰向上为吸热峰),此时应该是发生脱水反应(a),对应的热效应值就是Zn4Si2O7(OH)2·H2O脱去1个结晶水的脱水反应焓变,ΔHa=88.370 kJ/mol;在967 K(T2)有另一个吸热峰,此时发生脱水反应(b),反应焓变ΔHb=171.630 kJ/mol。本实验中,Zn4Si2O7(OH)2·H2O在加热过程中的脱水反应热效应参数与文献[2,8]中的基本一致;但在热力学循环计算中所采用的Zn4Si2O7(OH)2·H2O脱水反应平衡温度分别为795 K和967 K,是根据本实验测定的DSC曲线确定的,与文献值773.15 K和973.15 K有些差别。这是由于本实验测得的DSC曲线脱水过程的吸热峰温度跨度较大,因此,选择DSC曲线峰值温度作为脱水反应平衡温度。这种确定脱水反应平衡温度的方法可能与文献给出的脱水反应平衡温度确定方法不同(与测量方法有关),但本文采用的方法也符合热力学研究规则,且本文进行热力学参数计算时,由此温度差所引入的焓变计算差异与总焓变相比很小。
通常在等温等压、接近平衡条件下进行的脱水反应(a)和(b)均可视为是可逆反应,因此,脱水反应(a)和(b)的焓变和脱水反应平衡温度可直接用于计算脱水反应的熵变化。

图5 异极矿Zn4Si2O7(OH)2·H2O的DSC曲线
Fig.5 DSC curve of Zn4Si2O7(OH)2·H2O
3.3 生成热、生成熵变及生成吉布斯自由能的计算
根据所设计的热力学循环和热力学计算关系得:
ΔHⅣ+ΔHb=ΔHⅤ+ΔHⅥ+ΔH(6)
其中:ΔHb由实验直接测得;ΔHⅣ,ΔHⅤ和ΔHⅥ通过利用本实验值Cp,m(Zn4Si2O7(OH)2(s)) 以及文献值Cp,m(H2O(g))和Cp,m(β-Zn2SiO4(s))计算求得,可以得到:
ΔH(6)=12.037 kJ/mol
再由ΔH(6)=2ΔfHm(β-Zn2SiO4(s))+ΔfHm(H2O(g))- ΔfHm(Zn4Si2O7(OH)2(s))经过计算求得:
ΔfHm(Zn4Si2O7(OH)2(s),298.15 K)=-3 527.397 kJ/mol
同理,由热力学计算关系得:
ΔHⅠ+ΔHa=ΔHⅡ+ΔHⅢ+ΔH(5)
ΔHa通过实验直接测得,ΔH(5)通过计算求得,ΔHⅠ,ΔHⅡ和ΔHⅢ 通过利用本实验值 Cp,m(Zn4Si2O7(OH)2·H2O(s))和Cp,m(Zn4Si2O7(OH)2(s)),以及文献值Cp,m (H2O(g))经计算求得,可以得到:
ΔH(5)=237.967 kJ/mol
再由ΔH(5)=ΔfHm(Zn4Si2O7(OH)2(s))+ΔfHm(H2O(g)) -ΔfHm(Zn4Si2O7(OH)2·H2O(s)) 经计算求得:
ΔfHm(Zn4Si2O7(OH)2·H2O(s),298.15 K)=
-4 007.244 kJ/mol
同理,根据前面设计的热力学循环和热力学计算关系,利用本实验测定的比热参数以及相关物质的热力学参数文献值,可以求得Zn4Si2O7(OH)2和Zn4Si2O7(OH)2·H2O在298.15 K时的标准摩尔生成熵和标准摩尔生成吉布斯自由能。Zn4Si2O7(OH)2和Zn4Si2O7(OH)2·H2O在298.15 K时的标准生成热力学函数见表3。
表3 Zn4Si2O7(OH)2和Zn4Si2O7(OH)2·H2O的标准生成热力学函数
Table 3 Standard thermodynamic functions of formation of Zn4Si2O7(OH)2 and Zn4Si2O7(OH)2·H2O

4 结论
(1) 测定了Zn4Si2O7(OH)2和Zn4Si2O7(OH)2·H2O的比热容,换算成摩尔热容并拟合成关于摩尔热容与热力学温度T的函数关系式,Zn4Si2O7(OH)2的摩尔热容为(363~563 K)时:
Cp,m(Zn4Si2O7(OH)2,s)=-1 444.257+5.667×104T -0.3-
3.717×108T -2+6.620×1010T -3
Zn4Si2O7(OH)2·H2O的摩尔热容为(363~563 K)时:
Cp,m(Zn4Si2O7(OH)2·H2O,s)=4 266.234-1.175×
105T -0.5+4.772×108T -2-6.668×1010T -3
(2) 计算Zn4Si2O7(OH)2和Zn4Si2O7(OH)2·H2O在298.15 K时的标准摩尔生成焓、标准摩尔生成熵和标准摩尔生成吉布斯自由能。
参考文献:
[1] 梁婷, 谢星. 云南异极矿的宝石学特征[J]. 宝石和宝石学杂志, 2003, 5(4): 34-36.
LIANG Ting, XIE Xing. Gemmological characteristics of hemimorphite from Yunnan province[J]. Journal of Gems and Gemmology, 2003, 5(4): 34-36.
[2] 刘琰, 邓军, 杨立强, 等. 异极矿加热过程的研究[J]. 岩石学报, 2005, 21(3): 993-998.
LIU Yan, DENG Jun, YANG Li-qiang, et al. The dehydration of hemimorphite[J]. Acta Petrologica Sinica, 2005, 21(3): 993-998.
[3] Yoon C, Kang S. Synthesis of Zn2-xMnxSiO4 phosphors using a hydrothermal technique[J]. Journal of Materials Research, 2001, 16(4): 1210-1216.
[4] 彭贵熊. 西藏查孜铅锌矿选矿工艺流程试验研究[J]. 甘肃冶金, 2007, 29(4): 36-39.
PENG Gui-xiong. Test research on the beneficiation process for the Cazê Pb-Zn deposit in Tibet Province[J]. Gansu Metallurgy, 2007, 29(4): 36-39.
[5] 黄典豪. 云南乐红铅锌矿床氧化带中异极矿的矿物学特征及其意义[J]. 岩石矿物学杂志, 2000, 19(4): 349-354.
HUANG Dian-hao. Mineralogical character of hemimorphite from the oxidized zone of the Lehong Pb-Zn deposit in Yunnan Province and its significance[J]. Acta Petrologica et Mineralogica, 2000, 19(4): 349-354.
[6] 张健, 喻学惠, 谢俊, 等. 异极矿热相变过程的高温原位拉曼光谱[J]. 现代地质, 2009, 23(6): 1064-1069.
ZHANG Jian, YU Xue-hui, XIE Jun, et al. In-situ test and study on the hemimorphite and it’s thermal phase transformation by technology of high temperature raman spectra[J]. Geoscience, 2009, 23(6): 1064-1069.
[7] 刘琰, 邓军, 王庆飞, 等. 云南金顶异极矿晶体化学特征与颜色成因探讨[J]. 高校地质学报, 2005, 11(3): 434-441.
LIU Yan, DENG Jun, WANG Qing-fei, et al. Crystal chemistry and color genesis of hemimorphite from Jinding Pb-Zn deposit, Yunnan Province[J]. Geological Journal of China Universities, 2005, 11(3): 434-441.
[8] 李金洪, 余晓艳. 新疆某地宝石级异极矿的发现及其特征[J]. 现代地质, 1998, 12(1): 149-150.
LI Jin-hong, YU Xiao-yan. Study on gemology of newfound gem grade hemimorphite in Xinjiang[J]. Geoscience, 1998, 12(1): 149-150.
[9] 刘琰, 喻学惠, 何明跃, 等. 云南兰坪富锶文石玉石的宝石学特征[J]. 宝石和宝石学杂志, 2002, 4(4): 24-27.
LIU Yan, YU Xue-hui, HE Ming-yue, et al. Gem-mological study on Sr-rich aragonite jade from Lanping, Yunnan Province[J]. Journal of Gems and Gemmology, 2002, 4(4): 24-27.
[10] 傅献彩, 沈文霞, 姚天扬. 物理化学[M]. 北京: 高等教育出版社, 2000: 103.
FU Xian-cai, SHEN Wen-xia, YAO Tian-yang. Physical chemistry[M]. Beijing: Higher Education Press, 2000: 103.
[11] 梁英教, 车荫昌. 无机物热力学数据手册[M]. 沈阳: 东北大学出版社, 1993: 173.
LIANG Ying-jiao, CHE Yin-chang. Handbook of thermodynamic data for inorganic material[M]. Shenyang: Northeastern University Press. 1993: 173.
[12] Wagman D D, Evans W H, Parker V B, et al. The NBS tables of chemical thermodynamic properties (Selected values for inorganic and C1 and C2 organic substances in SI units )[M]. Washington D C: American Chemical Society and American Institute of Physics for the NBS, 1982:143.
[13] Bosenick A, Geiger Charles A, Cemic L. Heat capacity measurements on synthetic pyrope-grossular garnets between 350 and 1 000 K as determined by differential scanning calorimetry[J] Geochim et Cosmochimica Acta, 1996, 60(17), 3215-3227.
[14] 苏金明, 阮沈勇. MATLAB实用教程[M]. 北京: 电子工业出版社, 2005: 92-131.
SU Jin-ming, RUAN Shen-yong. Matlab practical tutorial[M]. Beijing: Electronic Industry Press, 2005: 92-131.
(编辑 陈灿华)
收稿日期:2011-06-03;修回日期:2011-08-06
基金项目:国家重点基础研究发展规划(“973”计划)项目(2007CB613601)
通信作者:刘常青(1960-),女,辽宁辽阳人,教授,硕士生导师,从事化学热力学研究;电话:13875988650;E-mail:greenlcq@163.com