文章编号:1004-0609(2008)02-0336-06
源自硫化矿区的Acidiphilium属菌的分离及其浸矿性能
邹俐宏1, 2,钱 林1,张燕飞1,万民熙1,邱冠周1, 2,杨 宇1, 2
(1. 中南大学 资源加工与生物工程学院,长沙 410083;
2. 中南大学 生物冶金教育部重点实验室,长沙410083)
摘 要:从湖北大冶铜矿的铜山口硫化矿矿坑水中分离得到了一株嗜酸兼性异养细菌,暂命名为DY。该菌株为革兰氏阴性细菌,短杆状,菌体大小为(0.4±0.1)μm×(1.2±0.2)μm,最适生长温度为30 ℃,最适初始生长pH值为3.5,能利用葡萄糖、乳糖、蔗糖和单质硫生长,不能利用FeSO4进行生长。其系统发育树结果表明,菌株DY与Acidiphilium cryptum(Y18446)位于系统发育树的同一分支中,相似度为99.69%。黄铜矿(CuFeS2)摇瓶细菌浸出实验显示,DY菌株单独浸出黄铜矿的能力较弱,但和嗜酸自养的氧化亚铁硫杆菌ATCC 23270混合浸矿时,与氧化亚铁硫杆菌单独浸矿相比,30 d后黄铜矿的浸出率提高了35.98%。
关键词:酸性矿坑废水;Acidiphilium;黄铜矿;生物浸出
中图分类号:Q 939 文献标识码:A
Isolation and identification of Acidiphilium strain DY from complex sulfide mines and its bioleaching characterization
ZOU Li-hong1, 2, QIAN Lin1, ZHANG Yan-fei1, WAN Min-xi1, QIU Guan-zhou1, 2, YANG Yu 1, 2
(1. School of Minerals Processing and Bioengineering, Changsha 410083, China;
2. Key Laboratory of Biometallurgy of Ministry of Education, Central South University, Changsha 410083, China)
Abstract: An Acidiphilium strain DY was isolated from acid mine drainage of Daye mine, Hubei Province, China. The cell of DY strain is Gram negative and rod-shaped in (0.4±0.1)μm×(1.2±0.2)μm. The optimum growth temperature is 30 ℃, and the optimum growth pH is 3.5. It can grow facultative heterotrophically by using glucose, lactose, sucrose and elemental sulfur as sole energy sources, but can not grow with FeSO4. A phylogenetic tree was constructed with the published 16SrRNA gene sequences of the relative bacteria species. In the phylogenetic tree, the DY strain has the closest relative to the Acidiphilium cryptum (Y18446) with 99.69% sequence similarity. The bioleaching experiment of chalcopyrite revealed that the DY strain has little efficiency of leaching chalcopyrite, but when it is coupled with acidophilic autotrophilic bacteria Acidithiobacillus ferrooxidans ATCC 23270, it can increase the chalcopyrite leaching efficiency by 35.98% after 30 d, compared with Acidithiobacillus ferrooxidans ATCC 23270 leaching efficiency.
Key words: acid mine drainage; Acidiphilium; chalcopyrite; bioleaching
生物湿法冶金是以微生物对矿石的直接、间接以及两者的共同作用浸出矿石中有用金属的一种新工艺,现已成为矿冶工程研究和应用的重点之一。与其他工艺相比,其最大特点是适用于传统工艺难以处理的矿石,并具有流程短、工艺简单、易操作、投资少、能耗少、成本低和对环境友好等优点[1]。我国所开采的铜矿物多为难浸的黄铜矿[2-3],且低品位的铜矿资源尤为丰富[4]。随着我国高品位铜矿资源的日益减少,低品位黄铜矿的细菌浸出已成为人们研究的重点。
酸性矿坑废水(Acid Mine Drainage,简称AMD)中,广泛存在着多种具有浸矿作用的嗜酸自养菌和异养菌。嗜酸氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans,简称A.f)、氧化亚铁钩端螺旋菌(Leptospirillum ferrooxidans)和嗜酸杆菌属(Acidiphilium sp.)分别是其中的典型代表[5]。嗜酸杆菌属(Acidiphilium sp.)由HARRISON[6]于1981年首次提出,并描述了该属的第一个成员—隐性嗜酸杆菌(Acidiphilium cryptum)。该菌能够进行铁呼吸作用,利用有机物或者H2还原Fe3+而获得能量进行化能异养生长,但不能利用元素硫或Fe2+作为能源生长[6],并且在好氧生长条件下细菌胞内含有细菌叶绿素a[7]。HIRAISHI等[8]报道的Acidiphilium acidophilum能够参与硫的代谢。其独特的生理学特征以及在AMD微生物群落中的显著生态地位,使得它成为具有吸引力的微生物模型,受到越来越多的关注[9-11]。目前对于生物浸矿反应过程中嗜酸氧化亚铁硫杆菌和氧化亚铁钩端螺旋菌的作用已经进行了大量的研究[12-14],但对嗜酸杆菌属在生物冶金过程中的研究则很少。本文作者从湖北大冶铜矿的酸性矿坑水中,分离得到一株既能以葡萄糖为能源异养生长、又能以单质硫为能源自养生长的兼性细菌,对其进行初步的鉴定及浸矿性能的研究,并探讨其与其他浸矿微生物之间的协同作用,以期为进一步的冶金应用提供依据。
1 实验
1.1 菌种来源
菌株分离自本实验室在2005年7月采集于湖北大冶铜矿坑矿区的矿坑水,取样时矿坑水温度为25 ℃,pH值为2.1。AMD水样元素分析如表1所列。
表1 AMD水样元素分析
Table 1 Element analysis of AMD(mg/L)

1.2 富集与纯化
1.2.1 培养基
采用9 K基础培养基[15],配方如下:(NH4)2SO4 3 g/L,KCl 0.1 g/L,K2HPO4 0.5 g/L,MgSO4?7H2O 0.5 g/L,Ca(NO3)2 0.01 g/L。分离培养基采用9 K-葡萄糖固体培养基:9 K基础培养基+1%葡萄糖+1.5%琼脂粉,pH 3.5。
1.2.2 菌种的分离纯化
对菌种的分离纯化采用适应分离法,先适应性富集,再选择性培养。利用可以进行化能异养这个特点,逐步改变培养基中FeSO4?7H2O和葡萄糖的比例,使之成为优势菌种。重复液体培养和固体平板分离4次。最终从固体平板中挑选出1个单菌落,经9 K葡萄糖液体培养基扩大培养,命名为DY,随后对其开展了一系列研究。
1.3 生理生化特性
1.3.1 最适生长温度的测定
将相同数量的DY菌株接种到多份9 K葡萄糖液体培养基中,分别置于不同温度条件下,经170 r/min振荡培养,第72 h时,在显微镜下直接计数,确定不同温度下菌株的生长情况。
1.3.2 最适初始pH值的测定
将相同数量的DY菌株接种到不同初始pH值的9 K葡萄糖液体培养基中,经30 ℃、170 r/min振荡培养,第72 h时于显微镜下直接计数,确定不同pH条件下细菌的生长情况。
1.3.3 底物利用特性研究
无机底物利用方面,采用9 K基础培养基中分别加入FeSO4?7H2O、单质硫、黄铁矿、黄铜矿各1%(w/v);有机底物利用方面,采用9 K基础培养基中分别加入葡萄糖、乳糖、蔗糖各1%。将一定数量的DY菌株接种到含上述底物的9 K基础培养基中,经30 ℃、170 r/min振荡培养,3 d传代1次。连续传代3次时,在显微镜下观察菌株的生长情况。
1.4 菌株形态观察
在30 ℃液体中培养细菌至对数生长期,离心收集菌体,经革兰氏染色后在光学显微镜下观察。用无菌水反复清洗菌体,用4%戊二醛固定,经制样处理后在扫描电子显微镜下进行观察。
1.5 硫氧化活性的测定
将DY 菌株接种到含5%(w/v)单质硫的9 K 基础培养基中,经30 ℃、170 r/min振荡培养,通过改变培养基pH值及菌浓度来考察DY菌株的硫氧化活性。
1.6 浸矿实验
矿样为湖北大冶矿山的黄铜矿,矿石样品的粒度≤0.075 mm。矿样化学成分分析结果如表2所列。
表2 黄铜矿的矿样成分
Table 2 Component analysis of chalcopyrite (mass fraction, %)

接种量为10%,调节初始菌浓度为1.0×107 cell/mL,浸矿条件:250 mL摇瓶装液100 mL,矿样量5%,170 r/min,30 ℃。同时进行4组对比实验,分别是:样品1为DY菌株单独浸矿,样品2为A.f 标准菌株ATCC 23270(登记序列号AF465604)单独浸矿,样品3为上述两种菌株按1?1比例混合浸矿,样品4为空白对照。
1.7 基因组提取及16SrRNA基因扩增
对纯化后培养的菌株使用Sangon公司的UNIQ-10柱式基因组DNA抽提试剂盒提取基因组DNA。扩增体系50 μL组成为:33 μL无菌水、10×PCR buffer 5 μL、dNTPs 5 μL、引物63F(5’-CAG GCC TAA CAC ATG CAA GTC-3’)和1387R(5’-GGG CGG WGT GTA CAA GGC-3’)[16]各2 μL (5 pmol/μL)、Taq DNA聚合酶 1 μL、DY菌株的基因组DNA 2 μL。
扩增程序:94 ℃ 5 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 1 min(共30个循环);72 ℃,10 min。
1.8 16S rRNA基因测序及分析
PCR 产物用E.Z.N.ATM Gel Extraction Kit (OMEGA)回收,后用PBS-T载体(BBI)连接后转入大肠杆菌DH5α感受态细胞中,经蓝白筛选后挑阳性克隆子送北京三博远志生物技术生物有限公司测序。序列已经提交到GenBank(登录号:EF585285),并将菌株DY的16S rRNA基因序列在GenBank 核酸序列数据库中进行序列比较,用clustalx1.8软件进行全序列比对[17],并用MEGA 3.1构建系统发育树[18]。
2 结果与讨论
2.1 菌株形态与生理生化特性
革兰氏染色结果表明,菌株DY为革兰氏阴性;扫描电子显微镜显示,该菌为短杆状,菌体大小为(0.4±0.1) μm×(1.2±0.2) μm,如图1(a)所示;在9 K固体培养基上,菌落呈圆形,乳白色半透明,直径约为0.6~1.0 mm,表面光滑,如图1(b)所示。

图1 DY菌株的SEM像和菌落形态
Fig.1 SEM image and colony of DY
2.2 最适生长温度和最适初始pH值
图2所示为DY菌株的生长温度曲线,该菌可在20~40 ℃间进行生长,其中最适生长温度约为30 ℃。图3所示为该菌的pH适应情况,该菌可在初始pH2.0~6.0之间进行生长,最适生长初始pH值约为3.5。
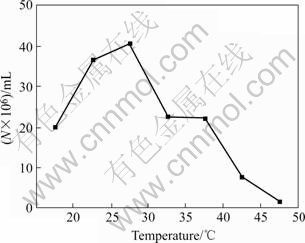
图2 DY菌株在不同温度下的生长曲线
Fig.2 Curve of cell destinies in stable phase at different temperatures
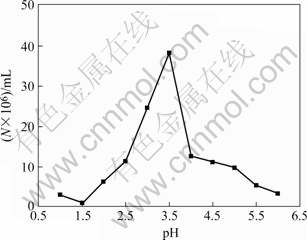
图3 DY菌株在不同pH值时的生长曲线
Fig.3 Curve of cell destinies at different initial pH values
2.3 能源利用特性
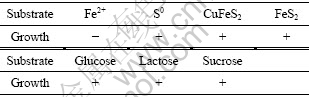
如表3所列,菌株DY能利用单质硫、黄铜矿、黄铁矿、葡萄糖、乳糖、 蔗糖,进行生长,但不能利用FeSO4进行生长。这些数据表明该菌具有一定的无机底物适应性,在自养环境中既可以氧化硫获得能量进行生长,也可以利用多种硫化矿进行生长。同时该菌也可以利用多种有机物进行异养生长。
表3 DY菌株能源利用特性
Table 3 Characteristics of DY strain with different substrates
2.4 硫氧化活性
图4所示为DY菌株在接种了5%(w/v)单质硫的9 K基础培养基中菌株生长曲线和培养基pH值的变化曲线。将DY菌株接种到只含单质硫的9 K基础培养基的前3 d时间里,细菌的生长处于迟滞期,pH持续下降比较缓慢;从第3 d到第15 d中,菌株的生长处于对数生长期,pH下降的很快;18 d到21 d间,pH变化趋于平缓,此时菌株的生长处于平稳期中,17 d以后pH下降到1.0以下。这说明在单质硫的9 K基础培养基中,菌株在生长过程中不断地把硫氧化为硫酸,导致培养基的pH值不断下降,由初始的pH 3.5降到pH 0.9。因此,该DY菌株具有较强的硫氧化活性。

图4 DY菌株硫氧化过程中的生长曲线及培养基pH值的变化曲线
Fig.4 Growth curve and pH value curve in sulfur oxidation by DY strain
2.5 菌株DY的16SrRNA基因序列分析
采用PCR技术,成功扩增出16S rRNA基因,然后克隆和测序,测定的序列长度为1307bp,在GenBank 中的序列登记号为EF585285。以16S rRNA基因序列同源性为基础构建系统发育树,如图5所示。菌株DY与Acidiphilium cryptum(Y18446)最为相似,相似度为99.69%。

图5 DY菌株的16S rRNA基因序列系统发育树
Fig.5 Phylogenetic tree derived from 16S rRNA gene sequence of DY strain
2.6 浸矿实验
黄铜矿的细菌浸出实验结果如图6所示,在最初的4 d之内,Cu2+的浸出主要是浸矿液为酸性所造成的化学作用。此后,细菌对Cu2+的浸出作用占主导地位。在黄铜矿浸出30 d之后,DY菌株单独浸出黄铜矿的Cu2+浓度仅为0.51 g/L,A.f 标准菌株ATCC 23270单独浸出黄铜矿的Cu2+浓度为1.82 g/L,而DY和A.f 标准菌株ATCC 23270混合浸矿的Cu2+浓度则达到2.47 g/L。数据表明两种细菌混合浸矿的效果要大大高于两种细菌单独浸矿的效果。

图6 DY菌株对黄铜矿中的Cu2+浸出作用
Fig.6 Copper extraction from chalcopyrite by DY strain
在细菌浸出黄铜矿的过程中,细菌首先将Fe2+氧化成Fe3+:
2CuFeS2+8.5O2+H2SO4→2CuSO4+Fe2(SO4)3+H2O
(bacterially mediated) (1)
Fe3+离子是一种很有效的金属离子氧化剂和浸出剂,在酸性条件下,可以将黄铜矿氧化:
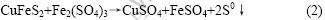
在酸性条件下,生成的Fe2+和S0被细菌再次氧化,生成Fe3+和H2SO4:

当A.f 标准菌株ATCC 23270单独浸出黄铜矿时,由于该菌可以氧化Fe2+和S0,因此理论上可以促进上述4个反应循环进行,直到黄铜矿被全部氧化。然而,实际浸矿数据显示:浸出反应初期Cu2+浓度增长较快,随着反应的进行,Cu2+浓度增长速度减慢。其原因可能是:第一在黄铜矿的浸出过程中,由于一些沉淀物质如单质硫、黄钾铁矾和黄胺铁矾等逐渐覆盖于黄铜矿表面形成一层致密的钝化膜[19-21],使得细菌本身和氧化剂Fe3+难以吸附到黄铜矿的表面,阻碍了反应的进一步发生;第二A.f菌生理代谢所产生的一些有机废物积累到了较高浓度,对于自身的生长会产生显著的抑制作用[22-24],从而影响了对矿物的进一步浸出。而DY菌株单独浸出黄铜矿的时,由于它不具备氧化Fe2+的能力,仅具有氧化S0的能力,只能催化反应(4)、并进而促进反应(2)进行,实验数据也证实了其单独浸出黄铜矿的能力较弱。而当DY菌株和A.f 标准菌株ATCC 23270混合浸矿时,DY菌株能促进S0氧化为硫酸,分解浸矿体系中的黄钾铁矾和黄胺铁 矾[22-24],从而阻止或延缓黄铜矿表面钝化膜的形成,使得细菌和Fe3+不断的吸附到黄铜矿的表面,从而促进反应不断进行。另外,DY菌株在生长过程中还原Fe3+生成Fe2+,一方面为氧化亚铁硫杆菌的生长提供能源,一方面消除了浸矿体系中对氧化亚铁硫杆菌的生长有抑制和毒害作用的有机物[21, 25],促进了氧化亚铁硫杆菌的生长,从而有效地提高了氧化亚铁硫杆菌对黄铜矿的浸出水平。
3 结论
1) 从湖北大冶矿坑水中分离得到了一株细菌DY,为革兰氏阴性细菌,短杆状,菌体大小为(0.45±0.05) μm×(1.5±0.4) μm。最适生长温度为30 ℃,最适pH值为3.5。16SrRNA基因测定及系统发育分析显示该菌应归为Acidiphilium属。
2) 该菌株为兼性异养菌,能单独利用葡萄糖、乳糖、蔗糖和单质硫作为能源生长,不能以FeSO4作为能源单独生长,并能利用多种硫化矿进行生长。
3) DY菌株单独浸出黄铜矿的能力较弱,但在同A.f 标准菌株ATCC 23270混合浸出黄铜矿时,与A.f 标准菌株ATCC 23270单独浸矿相比,30天的浸出率提高了35.98%。
4) 在混合菌浸矿的过程中,自养菌和异养菌之间对矿物存在协同效应,一方面减缓了在浸矿过程中黄铜矿表面钝化膜的形成,另一方面阻止了有机化合物质的积累,从而提高了浸出效果。
REFERENCES
[1] 王淀佐. 生物工程与矿物提取技术[M]. 北京: 高等教育出版社, 1999: 155.
WANG Dian-zuo. Bioengineering and extraction technology of minerals[M]. Beijing: Higher Education Press, 1999: 155.
[2] RAWLINGS D E. Mesophilic, autotrophilic bioleaching bacteria: Description, physiology and role[M]//Biomining: Theory, Microbes and Industrial Processes. Springer-Verlag and Landes Bioscience, 1997: 229-245.
[3] OLSON G J, BRIERLEY J A, BRIERLEY C L. Bioleaching review part B: Progress in bioleaching: applications of microbial processes by the minerals industries[J]. Applied Microbiology Biotechnology, 2003, 63: 249-257.
[4] YANG Song-rong, XIE Ji-yuan, QIU Guan-zhou, HU Yue-hua. Research and application of bioleaching and biooxidation technologies in China[J]. Minerals Engineering, 2002, 15: 361-363.
[5] YANG Yu, WAN Min-xi, SHI Wu-yang, PENG Hong, QIU Guan-zhou, ZHOU Ji-zhong, LIU Xue-duan. Bacterial diversity and community structure in acid mine drainage from Dabaoshan Mine, China[J]. Aquatic Microbial Ecology, 2007, 47(2): 141-151.
[6] HARRISON A P Jr. Acidiphilium cryptum gen. nov., sp. nov., heterotrophic bacterium from acidic mineral environments[J]. Int J Syst Bacterial, 1981, 31: 327-332.
[7] WAKAO N, SHIBA T, HIRAISHI A, ITO M, SAKURAI Y. Distribution of bacteriochlorophyll a in species of the genus Acidiphilium[J]. Current Microbiology, 1993, 27: 277-279.
[8] HIRAISHI A, KENJI V, NAGASHIMA P, MATSUURA K, SHIMADA K, TAKAICHI S, WAKAO N, KATAYAMA Y. Phylogeny and photosynthetic features of Thiobacillus acidophilus and related acidophilic bacteria: Its transfer to the genus Acidiphilium as Acidiphilium acidophilum comb. nov[J]. International Journal of Systematic Bacteriology, 1998, 48: 1389-1398.
[9] KUSEL K, DORSCH T, ACKER G, STACKEBRANDT E. Microbial reduction of Fe(Ⅲ) in acidic sediments: Isolation of Acidiphilium crytum JF-5 capable of coupling the reduction of Fe(Ⅲ) to the oxidation of glucose[J]. Applied and Environmental Microbiology, 1999, 65: 3633-3640.
[10] JOHNSON D B, BRIDGE T A M. Reduction of ferric iron by acidophiclic heterotrophic bacteria: Evidence for constitutive and inducible enzyme systems in Acidiphilium spp[J] . Journal of Applied Microbiology, 2002, 92: 315-321.
[11] BAKER B J, BANFIELD J F. Microbial communities in acid mine drainage[J]. FEMS Microbiology Ecology, 2003, 44: 139-152.
[12] RAWLINGS D E. Heavy metal mining using microbes[J]. Annual Review Microbiology, 2002, 56: 65-91.
[13] BRIERLEY J A, BRIERLEY C L. Present and future commercial applications of biohydrometallurgy[J]. Hydrometallurgy, 2001, 59: 233-239.
[14] RAWLINGS D E, TRIBUTSCH H, HANSFORD G S. Reasons why ‘Leptospirillum’ like species rather than Thiobacillus ferrooxidans are the dominant iron-oxidizing bacteria in many commercial processes for the biooxidation of pyrite and related ores[J]. Microbiology, 1999, 145: 5-13.
[15] SILVERMAN M P, LUNDGREN D C. Study on the chemoautotrophic iron bacterium Ferrobacillus ferrooxidans: I. An improved medium and harvesting procedure for securing high cell yield[J]. Journal of Bacteriology, 1959, 77: 642-647.
[16] LANE D J. 16S/23S rRNA sequencing[M]. STACKEBRANDT E, GOODFELLOW M, eds. Nucleic Acid Techniques in Bacterial Systematics, 1991: 115-175.
[17] THOMPSON J D, GIBSON T J, PLEWNIAK F, JEANMOUGIN F, HIGGINS D G. The Clustal X windows interface: Flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Research, 1997, 24: 4876-4882.
[18] KUMAR S, TAMURA K, NEI M. MEGA3: Integrated software for molecular evolutionary genetics analysis and sequence alignment[J]. Briefings in Bioinformatics, 2004, 5: 150-163.
[19] MCGUIRE M M, EDWARDS K J, BANFIELD J F, HAMERS R J. Kinetics, surface chemistry and structural evolution of microbially mediated sulfide mineral dissolution[J]. Geochimica et Cosmochimica Acta, 2001, 65(8): 1243-1258.
[20] FOWLER T A, CRUNDWELL F K. Leaching of zinc sulfide by Thiobacillus ferrooxidans: Bacterial oxidation of the sulfur product layer increases the rate of zinc sulfide dissolution at high concentrations of ferrous ions[J]. Appl Environ Microbiol, 1999, 65: 5285-5292.
[21] WATLING H R. The bioleaching of sulphide minerals with emphasis on copper sulphides—A review[J]. Hydrometallurgy, 2006, 84: 81-108.
[22] PAIMENT A, LEDUC L G, FERRONI G D. The effect of the facultative chemolithotrophic bacterium Thiobacillus acidophilus on the leaching of low-grade Cu-Ni sulfide ore[J]. Geomicrobiology Journal, 2001, 8: 157-165.
[23] BACELAR-NICOLAU P, JOHSON D B. Leaching of pyrite by acidophilic heterotrophic iron-oxidizing bacteria in pure and mixed cultures[J]. Applied and Environmental Microbiology, 1999, 5: 585-590.
[24] WICHLACZ P L, THOMPSON D L. The effect of acidophilic heterotrophic bacteria on the leaching of cobalt by Thiobacillus ferrooxidans[C]//Biohydrometallurgy, Proceedings of the 1987 International Symposium, Kew, UK, 1987: 77-88.
[25] 刘艳阳, 陈志伟, 姜成英, 刘双江. 一株嗜酸化能异养菌Acidiphilium sp.的分离鉴定及其对Fe(Ⅲ)代谢的研究[J]. 微生物学报, 2007, 47(2): 350-354.
LIU Yan-yang, CHEN Zhi-wei, JIANG Cheng-ying, LIU Shuang-jiang. Isolation and characterization of Acidiphilium strain Teng-A and its metabolism of Fe(Ⅲ)during pure- and mixed cultivation[J]. Acta Microbiologica Sinica, 2007, 47(2): 350-354.
基金项目:国家创新研究群体科学基金资助项目(50621063);国家重点基础研究发展计划资助项目(2004CB619201)
收稿日期:2007-06-13;修订日期:2007-10-12
通讯作者:杨 宇,副教授,博士;电话:0731-8877216; E-mail: csyangyu@gmail.com
(编辑 何学锋)