DOI:10.19476/j.ysxb.1004.0609.2018.02.12
镍基析氢电极在碱性溶液中析氢行为
吴 靓1, 2, 3,郭小花1, 2, 3,徐 阳1, 2, 3,肖逸锋1, 2, 3,许艳飞1, 2, 3,钱锦文1, 2, 3,管 卓1, 2, 3,贺跃辉4
(1. 湘潭大学 机械工程学院,湘潭 411105;
2. 湘潭大学 焊接机器人及应用技术湖南省重点实验室,湘潭 411105;
3. 湘潭大学 复杂轨迹加工工艺及装备教育部工程研究中心,湘潭 411105;
4. 中南大学 粉末冶金国家重点实验室,长沙 410083)
摘 要:采用元素粉末反应合成法制备多孔Ni3Al-Mo电极。采用扫描电镜(SEM)和X射线衍射(XRD)对多孔Ni3Al-Mo电极的孔结构进行表征,通过极化曲线和电化学阻抗技术表征多孔Ni3Al-Mo电极的电解析氢行为。结果表明:多孔Ni3Al-Mo电极孔隙率为47%,最大孔隙为2.7 μm,平均孔隙约2.1 μm。与多孔Ni3Al电极和多孔Ni电极相比,多孔Ni3Al-Mo电极具有较低的析氢过电位和较高的交换电流密度,表明多孔Ni3Al-Mo电极具有较高的析氢活性;经过阳极处理后,多孔Ni3Al-Mo电极的析氢活性可以恢复到原来的大小,且连续电解120 h后,析氢过电位变化不大,表明多孔Ni3Al-Mo电极具有优异的电化学稳定性。
关键词:反应合成法;多孔Ni3Al-Mo电极;极化曲线;阻抗谱;稳定性
文章编号:1004-0609(2018)-02-0309-10 中图分类号:TG146 文献标志码:A
氢能源作为高效洁净的二次能源,被视为未来最有潜力的新能源[1-3]。氢能源的大规模使用将使人类进入一个可持续发展的绿色时代,而大规模、廉价的生产氢气是开发和利用氢能的重要前提[4-5]。然而,要实现大规模廉价制取氢气必须要降低能耗,而减少能量损耗最有效的方法就是在电解过程中,降低阴极的析氢过电位[5-9]。所以寻求具有低过电位的新型阴极材料一直是本研究领域的热点。在目前的水电解领域,碱性水电解技术是最主要的方式[10]。
近年来,多孔材料已成为材料科学中一个十分活跃的前沿领域,是目前工业领域中应用最广的一种新型材料[11-13],尤其是镍基电解水析氢阴极材料得到了很高的关注度,取得了快速发展,各种合金材料相继问世,如Ni-Al 多孔金属间化合物结合了多孔材料及金属间化合物的优点[14-15]。镍电极的发展主要有两个方向:1) 多孔电极。通过各种方法增加电极的粗糙度,从而提高电极的真实表面积,使得催化活性中心增多,提高电极的表观催化活性。在这类电极中,Raney Ni 是典型代表[16],它具备较低的析氢过电位并且能够保持电解10000 h析氢活性不变。但是这种电极最大的缺点是在析氢过程中的断电间隙,特别是断电较长时间后,析氢活性随着活性组分的氧化溶解很容易丧失,而多孔合金电极即使在断电较长时间后,其析氢活性变化不大。另外,研究表明微米级的孔隙能有效避免氢气堵塞孔道,更易于氢气的溢出[17]。2) 合金电极,包括Ni-金属以及Ni-非金属合金。根据Engel-Brewer的“火山”理论,d 轨道未充满或半充满的过渡系左边的金属(如Fe,Co,Ni) 同具有成对的但在纯金属中不适合成键的d电子的过渡系右边的金属熔成合金时,如Ni-W[18]、Ni-S[19]、Ni(42.2)W(19.2)Fe(18.9)B(19.7)[20]、Ni-Mo-La[21]和Ni-Mo-Mn(Co)[22],对析氢反应可以产生非常明显的电催化协同作用 [23-25]。
制备析氢活性更高、稳定性更好的析氢电极是实现大规模电解水制氢面临的挑战和发展趋势。通过多种元素的合金化,设计适宜的孔结构,既利于形成气体通道,又可以提高材料的比表面积,从而增加催化反应的活性中心。将这几种因素结合起来,就有可能获得优异析氢催化活性和稳定性的催化电极。本文作者以粒径均为3~5 μm元素Ni、Al、Mo粉末为原料,按照m(Ni):m(Al):m(Mo)的质量比为76:14:10进行粉末配制,采用元素粉末反应合成法制备Ni3Al-Mo多孔电极,通过阴极极化曲线和电化学阻抗谱研究其在碱性介质中的电催化析氢性能和稳定性。
1 实验
将商业用的羰基Ni粉(3~5 μm)、雾化Al粉(3~5 μm)和Mo粉(3~5 μm)按照质量比为m(Ni):m(Al): m(Mo)=74:16:10比例配制,混合10 h后,在200 MPa压力下压制成5 mm×45 mm×1 mm的长方块。把压坯置于真空度为1×10-3 Pa的烧结炉中,烧结温度为900 ℃,保温1 h。通过XRD和SEM来表征多孔Ni3Al-Mo电极的物相结构和显微组织形貌。孔隙度采用Archimedes法测定。最大孔径采用泡压法测定。透气度是指在单位压差下,通过单位面积多孔材料的气体流量。透气度的测定与泡压法中的干膜压差流量测定方法相同。电极材料的电化学测试采用电化学测试工作站(CHI660D,上海辰华仪器公司)进行测试,测试过程为三电极体系,其中铂片为辅助电极,Hg/HgO电极作为参比电极,电极的工作面积为1 cm2,电解液为6 mol/L KOH。阴极极化曲线的测量范围为-0.9~ -1.5 V,扫描速率为1 mV/s。电化学阻抗实验其温度范围为313~333 K,电位范围为-0.95~-1.05 V,频率范围:10 kHz~0.01 Hz,φ(A.V)=5 mV,极化图经过阳极处理后即刻测得的。在长期电解实验中,电解电极在两种电解条件下测得:一种是在恒电流密度为-0.1 A/cm2下连续电解;一种是在恒电流密度为-0.1 A/cm2下短时间断电下电解。
2 结果和讨论
2.1 多孔Ni3Al-Mo电极的表面形貌
图1所示为烧结后的多孔Ni3Al-Mo电极的XRD谱。在样品的衍射谱上有25°、37.5°、44°、51°、57.5°、75° 6个峰,分别对应多孔Ni3Al-Mo电极 (100),(110),(111),(200),(210)和(220) 6个晶面,表示的是Ni3Al合金;而40.5°,58.6°和73.6° 3个峰分别对应多孔Ni3Al-Mo电极(110),(200)和(211) 3个晶面,表示的是Mo元素,由此表明Ni3Al-Mo电极中只有Mo 和Ni3Al,没有其他的合金生成。
图2所示为多孔Ni3Al-Mo电极的微观表面形貌图(SEM)和能谱图(EDS)。由SEM可以看出,多孔Ni3Al-Mo电极表面拥有丰富的孔隙,孔隙形状不规则且相互贯通,具有较大的比表面积。EDS结果表明在多孔Ni3Al-Mo电极有Ni,Al和Mo 3种元素的存在。
图3所示为多孔Ni3Al-Mo电极中的EPMA线扫描结果。图3中的深色部分主要为Ni和Al元素,白色部分为Mo元素。灰色部分为均匀分布的Ni、Al和Mo元素的混合区。元素的分布体现出了Mo元素向Ni3Al中的扩散固溶过程。
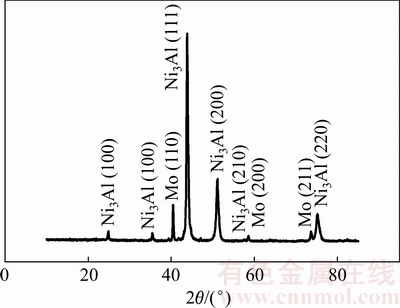
图1 多孔Ni3Al-Mo电极的XRD谱
Fig. 1 XRD pattern for porous Ni3Al-Mo electrode

图2 多孔Ni3Al-Mo电极的SEM和EDS谱
Fig. 2 SEM image(a) and EDS spectrum(b) of porous Ni3Al-Mo electrode
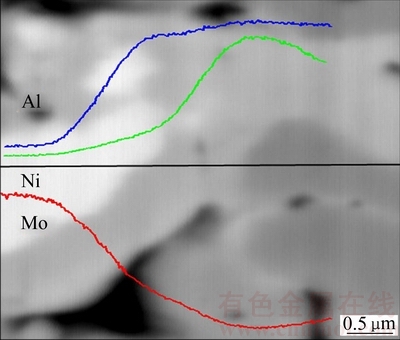
图3 多孔Ni3Al-Mo电极的EPMA线扫描照片
Fig. 3 Line scans analysis of porous Ni3Al-Mo electrode by EPMA
表1所列为多孔Ni3Al-Mo电极、多孔Ni3Al电极及多孔Ni电极的孔结构参数。由表1 可知,多孔Ni3Al-Mo电极的孔隙率为47%,多孔Ni3Al电极的孔隙率为40%,而多孔Ni电极的孔隙率为18%。多孔Ni3Al-Mo电极的最大孔径为2.7 μm,比多孔Ni3Al电极的稍大。多孔Ni3Al-Mo电极的平均孔径约2.1 μm,与多孔Ni3Al电极的相差不大,但均比多孔Ni电极的大。这是因为Al元素的本征扩散系数远远大于Ni元素的本征扩散系数[26],A1元素向Ni元素扩散的同时会导致在A1的原位形成空位,产生 Kirkendall 孔隙。Mo元素在多孔Ni3Al-Mo电极中以两种不同形式存在,有些Mo元素扩散进Ni3Al合金并溶解其中会导致在Mo的原位形成空位,因此多孔Ni3Al-Mo电极的孔隙率是比较高的,但Mo元素溶解于Ni3Al合金的含量很少,所以其孔隙率增加少许。还有一些Mo元素以单质形式存在且颗粒很小,这种形式存在的Mo颗粒可以提高多孔Ni3Al-Mo电极的表面粗糙度。
表1 多孔Ni3Al-Mo电极、多孔Ni3Al电极及多孔Ni电极的孔隙结构参数
Table 1 Pore structure parameters of porous Ni3Al-Mo electrode and porous Ni3Al and porous Ni

2.2 多孔Ni3Al-Mo电极的电解析氢活性
图4所示为多孔Ni3Al-Mo电极不同扫面速率下的循环伏安图。平均电流密度Jdl,ave=(Jc+Ja)/2与扫描速率的关系如下:
Jdl,ave=Cdl(dE/dt) (1)
式中:Cdl是电极的双电层电容;Jc和Ja分别是阴极和阳极的电流密度。电极的表面粗糙度是用双电层电容值除以20 μF/cm2(一般选择平滑的汞电极的双电层电容值20 μF/cm2作为电极粗糙度的基准)。本实验中,工作电极的几何面积为1 cm2,因此粗糙度的值等于电极的真实工作电极。不同扫描速率下的交换电流密度为扫描区间的中间值[27],交换电流密度与扫描速率的关系如图4(b)所示。

图4 多孔Ni3Al-Mo电极不同扫描速率下的循环伏安以及电流密度和扫描速率的关系
Fig. 4 Cyclic voltammograms in double layer region of porous Ni3Al-Mo electrode at scan rates ranging from 1 to 40 mV/s(a) and mean current density as a function of scan rate for electrodes(b)
表2 多孔电极电化学析氢参数
Table 2 Electrochemical properties of porousNi3Al-Mo cathode materials, porous Ni3Al and porous Ni materials observed at potentials close to limits of studied domain

表2所列为多孔Ni3Al-Mo电极、多孔Ni3Al电极及多孔Ni电极的电化学析氢参数。从表2中可以看出,多孔Ni3Al-Mo电极的本征催化活性只有Ni3Al电极的1.5倍左右,而表观催化活性却是Ni3Al电极的7倍。这表明多孔Ni3Al-Mo电极的催化活性不仅仅来自于本征催化活性的提高,也得益于真实表面积的增大。
图5(a)所示为多孔Ni、多孔Ni3Al和多孔Ni3Al-Mo电极在298 K温度下的阴极极化曲线。由图5(a)可知,3组多孔材料电极的电流密度都随着电位的增加而增加;当电位为-1.4 V时,多孔Ni的电流密度为-0.025 A/cm2,多孔Ni3Al的电流密度为-0.125 A/cm2,多孔Ni3Al-Mo的电流密度为-0.2250 A/cm2,可见多孔Ni3Al-Mo电极的电流密度明显高于多孔Ni电极和多孔Ni3Al电极的。通过对比可以发现,多孔Ni3Al-Mo电极在较低的过电位下就表现出较好的析氢性能,且具有较高的电流密度,说明多孔Ni3Al-Mo电极有较高的析氢活性。图5(b)所示为多孔Ni3Al-Mo电极和Pt片在298 K温度下的阴极极化曲线。由图5(b)可知,多孔Ni3Al-Mo电极和Pt片有相似的析氢行为,且析氢活性比Pt片的略低。
图6所示为多孔Ni3Al-Mo电极在298 K时-0.1 A/cm2的电流密度下电解不同时间后的阴极极化曲线。可看出,在相同的电流密度下,随着电解时间的延长,多孔Ni3Al-Mo电极析氢电位发生正移,也就是说在相同的析氢反应速率下,经过长时间电解的多孔Ni3Al-Mo电极的过电位比较低。在相同的电极电位下,经过长时间电解的多孔Ni3Al-Mo电极的电流密度更大,表明在电解过程中,多孔Ni3Al-Mo电极的催化活性有所提高。
图7所示为多孔Ni3Al-Mo电极在6 mol/L KOH溶液中的Nyquist和等效电路图。在Nyquist图中,圆弧半径越小,表明测试样品某段阻抗值越小,阻碍作用也就越小,析氢活性越高。由图7(a)~(c)可知,在高频段的半圆弧随着电极过电位的变化没有发生明显的变化,而低频段,当温度不变时,随着过电位的减小,阻抗谱的圆弧半径减小,说明当温度不变时,减小过电位有利于多孔Ni3Al-Mo电极进行析氢反应。另外,随着温度的升高,阻抗谱的圆弧半径也减小,说明当过电位不变时,温度的升高有利于多孔Ni3Al-Mo电极析氢活性的提高。由图7(d)可知,当温度为333 K时,半圆容抗弧最小,表明其阻抗效应最小,说明在较高温度下多孔Ni3Al-Mo电极仍具有较高的催化活性。

图5 多孔材料在298 K、6 mol/L KOH溶液中的阴极极化曲线以及多孔Ni3Al-Mo电极与Pt在298 K、6 mol/L KOH溶液中的阴极极化曲线
Fig. 5 Polarization curves of porous electrode recorded in 6 mol/L KOH at 298 K(a) and polarization curves of porous Ni3Al-Mo electrode and Pt recorded in 6 mol/L KOH at 298 K(b)

图6 多孔Ni3Al-Mo电极在298 K、-0.1 A/cm2的电流下电解不同时间后的阴极极化曲线
Fig. 6 Polarization curves for porous Ni3Al-Mo electrode recorded at 298 K after different time of hydrogen evolution at -0.1 A/cm2
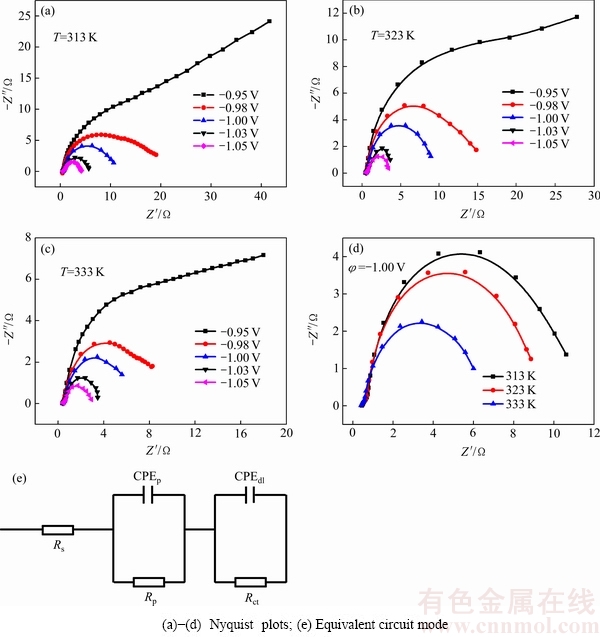
图7 多孔Ni3Al-Mo电极在6 mol/L KOH溶液中的Nyquist图
Fig. 7 Nyquist plots for HER at porous Ni3Al-Mo electrode in 6 mol/L KOH
表3 研究电极的等效电路拟合参数
Table 3 Fitted parameters values of equivalent for hydrogen evolution reaction on different temperatures and different potentials
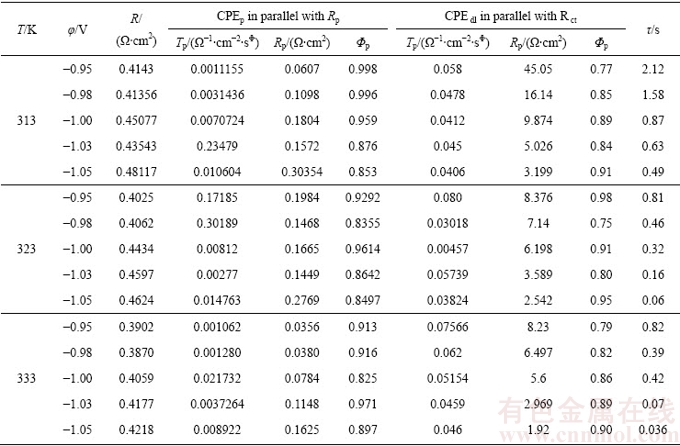
对应于此交流阻抗图谱的结果,采用ZVIEW软件进行拟合,等效电路如图7(e)所示,电路各元件的拟合数据列于表3。在等效电路中,R为测试电解液电阻,Rct为析氢反应的电荷转移电阻,Rp为非法拉第扩散电阻,CPE为常相位元件,表示和电容相似的程度,CPE的值越大,表示其电极表面越光滑,真实表面积就越小。根据等效电路模型和拟合参数,得到电容参数Tdl与Cdl的关系:Cdl={Tdl/[(Rs+Rp)-1+Rct-1]· (1-Φ)}1/Φ(Φ是均匀度),时间常数由τ=RctCdl计算得到,表征的是电位变化时的阴极弛豫速率。表3所列为等效电路中各元件数值。根据这个模拟电路分析,高频区的时间常数与电位无关,表述为Rp与CPEp并联,相应的在Nyquist图中,高频段圆弧对应的电阻是与电极本身的特性(孔隙率)有关而与析氢反应中各种动力学无关;低频区的时间常数则与析氢动力学有关,用Rct和CPEdl表征,而在Nyquist图中,低频段圆弧与电化学反应相关,它反映的是反应过程中的电荷转移电阻,并且这个电阻的大小随着析氢反应的各个条件的变化而变化。由表3可知,随着过电位的升高,电荷转移电阻Rct减小,这与Nyquist图中表现出来的规律是一致的,而且在高过电位下(-1.05 V)析氢反应模拟出的电荷转移电阻(Rct)较低,在这个电极电位下,反应进行的阻力较小,说明极化电位的升高有利于提高其电化学反应速率。对于多孔Ni3Al-Mo电极析氢电极,由图7(e)可知,在析氢反应过程中存在非法拉第扩散过程,而非法拉第扩散过程认为是Heyrovsky过程中所产生的氢气从电极本体向溶液中扩散而产生的浓差极化阻力[28]。通过拟合计算出的动力学参数还可以看出,相同极化电位条件下非法拉第过程电阻均小于电荷转移过程电阻,说明多孔Ni3Al-Mo电极对于析氢电极而言,电荷转移过程与扩散过程共同控制其析氢反应过程,但电荷转移过程是析氢反应过程的速率控制步骤。τ值随着过电位的增加而减小,τ值越小,表明多孔Ni3Al-Mo电极的电催化活性越好。此外,随着温度的增加,不管是析氢反应的电荷转移电阻(Rct)、时间常数(τ),还是非法拉第扩散电阻(Rp)均减小,表明温度的升高有利于多孔Ni3Al-Mo电极催化活性的提高。
2.3 多孔Ni3Al-Mo电极的稳定性
在工业应用中,电极经过长时间工作,催化活性会降低,导致其工作效率降低。若遇到紧急情况关闭电源时,电极可能会发生反向极化,将引起电极的电化学行为发生明显的改变,若断电时间较长,电极的析氢活性很容易丧失,所以在电解水制氢工业中,电极必须要有较好的稳定性。
图8所示为多孔Ni3Al-Mo电极在298 K的温度下阳极处理前后的极化曲线。在室温下,将样品置于6 mol/L KOH溶液于在0.5 V的电位下阳极极化1000 s,然后在-0.1 A/cm2的电流密度下电解析氢1000 s后,研究多孔Ni3Al-Mo电极的抗阳极极化性能。由图8可知,经阳极处理后的电极析氢过电位明显大于未经阳极处理的电极析氢过电位,说明在阳极处理过程中电极表面发生氧化,使得电极的极化性能改变。将电极经阳极处理后再电解析氢一段时间,其极化曲线与未经阳极处理极化曲线几乎相同,析氢过电位恢复到原来的大小,且其氧化层可以完全被去除,由此表明多孔Ni3Al-Mo电极能够保持很好的稳定性。
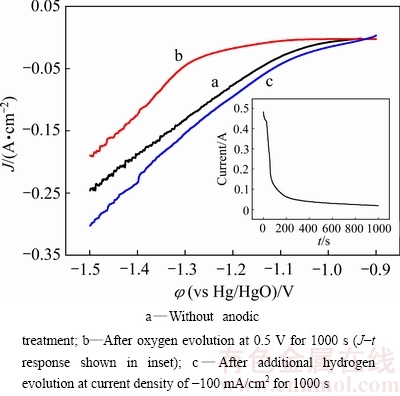
图8 多孔Ni3Al-Mo电极在298 K的温度下阳极处理前后的极化曲线图
Fig. 8 Polarization curves for porous Ni3Al electrode before and after anodic treatment at 298 K

图9 多孔Ni3Al-Mo电极连续电解时的稳定性以及多孔Ni3Al-Mo电极电解电流中断时的稳定性
Fig. 9 Stability of porous Ni3Al-Mo electrode during continuous electrolysis(a) and electrolysis with some current interruptions(b)
图9所示为表征多孔Ni3Al-Mo电极连续电解时的稳定性以及电流中断时的稳定性图谱。将多孔Ni3Al-Mo电极置于6 mol/L KOH溶液中进行120 h长时间连续电解,其中电流密度为-0.1 A/cm2,温度为333 K。由图8中的曲线a可知,电解120 h后曲线比较稳定,析氢过电位从95 mV变化到105 mV,变化幅度不大,表明多孔Ni3Al-Mo电极具有良好的析氢稳定性。为进一步验证多孔Ni3Al-Mo电极的抗断电能力,将样品极置于在6 mol/L KOH溶液中进行间断性电解测试,测试条件电流密度J=-0.1 A/cm2,温度T=333 K。由图7(b)可知,多孔Ni3Al-Mo电极在断电后电解曲线基本稳定,过电位维持在-0.1V 左右,催化活性变化不大,所以多孔Ni3Al-Mo电极具有良好的抗断电稳定性。实验结果表明,多孔Ni3Al-Mo电极不仅在长期连续电解时有良好的稳定性,在间歇性电解时也有良好的稳定性。
2.4 多孔Ni3Al-Mo电极的析氢机理
电极材料的催化活性来自于本征催化活性和比表面积活性。若催化活性来源于材料的表面结构和化学组成,这就是本征催化活性;若催化活性来源于真实表面积的增加,则是比表面积活性。
—般认为在碱性或中性介质中的电极反应基本过程为
H2O+M+e=MHad+OH- (2)
MHad+H2O+e=M+H2+OH- (3)
MHad+MHad=2M+H2 (4)
根据Engel-Brewer价键理论,多孔Ni3Al-Mo电极中因为Ni、Mo元素的加入,多孔Ni3Al-Mo电极因具有适中的M—H键能,表现为较高的反应速率,具有较好的电催化性能。在析氢反应过程中,电化学吸附阶段需要双d电子轨道(Ni 3d84s2),使得水分子的电子迁移和接下来的O—H键的裂解更加便利。为了实现M—H的吸附,需要半空的d电子轨道(Mo 4d55s1),由此可知,多孔Ni3Al-Mo电极的析氢活性得益于Ni的d8电子轨道和Mo的d5电子轨道。由于Mo的半空d电子轨道加速了水分子的裂解和MHads的形成,电化学吸附阶段的速率得以提高。另一方面,对于多孔Ni3Al-Mo电极,当加入Mo元素时,Mo元素逐渐向Ni原子扩散,由于Ni、Mo之间的协同作用,在多孔Ni3Al-Mo电极内部形成大量的孔洞,使得多孔Ni3Al-Mo电极样品具有较高的真实反应面积。因此,多孔Ni3Al-Mo电极的催化活性不仅来自于真实表面积的增大,同时来自于元素间的协同作用。
3 结论
1) 以粒径均为3~5 μm的羰基Ni粉,雾化Al粉和Mo粉作为原料,按照m(Ni):m(Al):m(Mo)质量比为76:14:10进行粉末配制,采用元素粉末反应合成法制备多孔Ni3Al-Mo电极,其孔隙率为47%,最大孔隙为2.7 μm,平均孔隙约2.1 μm,由于Ni和Al的互扩散,在多孔Ni3Al-Mo电极内部形成大量的孔洞,使得多孔Ni3Al-Mo电极样品具有很高的表面粗糙度。
2) 阴极极化曲线表明,在电位为-1.4 V时,多孔Ni3Al-Mo电极的电流密度为-0.2250 A/cm2,和多孔Ni3Al以及多孔Ni电极相比,表明多孔Ni3Al-Mo电极具有较高的析氢活性。
3) 多孔Ni3Al-Mo电极经过阳极处理后,多孔Ni3Al-Mo电极析氢活性可以恢复。多孔Ni3Al-Mo电极连续电解120 h,析氢过电位变化不大,表明多孔电极有优异的稳定性。多孔Ni3Al-Mo电极在间歇式电解时也保持良好的稳定性。
REFERENCES
[1] SOLMAZ R, KARDAS G. Fabrication and characterization of NiCoZn-M (M: Ag,Pd and Pt) electrocatalysts as cathode materials for electrochemical hydrogen production[J]. International Journal of Hydrogen Energy, 2011, 36: 12079-12087.
[2] SANTOS D M F, SLJUKIC B, SEQUEIRA C A C, MACCIO D, SACCONE A, FIGUEIREDO J L. Electrocatalytic approach for the efficiency increase of electrolytic hydrogen production: Proof-of-concept using platinum-dysprosium alloys[J]. Energy, 2013, 50: 486-492.
[3] METIKOS-HUKOVIC M, GRUBAC Z, RADIC N, TONEJC A. Sputter deposited nanocrystalline Ni and Ni-W films as catalysts for hydrogen evolution[J]. Journal of Molecular Catalysis A Chemical, 2006, 249(1/2): 172-180.
[4] ZHAO Z, CHEN X, HAO M. Hydrogen generation by splitting water with Al-Ca alloy[J]. Fuel & Energy Abstracts, 2011, 36(36): 2782-2787.
[5]  N, TONEJC A. Sputter deposited nanocrystalline Ni and Ni-W films as catalysts for hydrogen evolution[J]. Journal of Molecular Catalysis A Chemical, 2006, 249(1/2): 172-180.
N, TONEJC A. Sputter deposited nanocrystalline Ni and Ni-W films as catalysts for hydrogen evolution[J]. Journal of Molecular Catalysis A Chemical, 2006, 249(1/2): 172-180.
[6] LASIA A. Study of electrode activities towards the hydrogen evolution reaction by a.c. impedance spectroscopy[J]. International Journal of Hydrogen Energy, 1993, 18(7): 557-560.
[7] SHERVEDANI R K, MADRAM A R. Electrocatalytic activities of nanocomposite Ni81 P16 C3, electrode for hydrogen evolution reaction in alkaline solution by electrochemical impedance spectroscopy[J]. International Journal of Hydrogen Energy, 2008, 33(10): 2468-2476.
[8] KEDZIERZAWSKI P, OLESZAK D, JANIK-CZACHOR M. Hydrogen evolution on hot and cold consolidated Ni-Mo alloys produced by mechanical alloying[J]. Materials Science & Engineering A, 2001, 300(300): 105-112.
[9] ROSALBINO F, DELSANTE S, BORZONE G, ANGELINI E. Electrocatalytic behaviour of Co-Ni-R (R = Rare earth metal) crystalline alloys as electrode materials for hydrogen evolution reaction in alkaline medium[J]. International Journal of Hydrogen Energy, 2008, 33(22): 6696-6703.
[10] ZHAO Z, CHEN X, HAO M. Hydrogen generation by splitting water with Al-Ca alloy[J]. Fuel & Energy Abstracts, 2011, 36(36): 2782-2787.
[11] 吴 靓, 董虹星, 贺跃辉. Ni3Al 金属间化合物多孔材料的制备及抗腐蚀性能[J]. 材料研究学报, 2011, 25: 118-123.
WU Liang, DONG Hong-xing, HE Yue-hui. Preparation andcorrosion resistance in KOH solution of porous Ni3Al intermetallics[J]. Journal of Materials Research, 2011, 25: 118-123.
[12] 吴 靓, 董虹星, 贺跃辉. Ni3Al金属间化合物多孔材料的抗盐酸腐蚀性能[J]. 中国有色金属学报, 2010, 20(8): 1558-1565.
WU Liang, DONG Hong-xing, HE Yue-hui. Corrosion resistanceof porous Ni3Al intermetallics in hydrochloric acid solution[J]. Chinese Journal of Nonferrous Metals, 2010, 20(8): 1558-1565.
[13] DONG Hong-xing, HE Yue-hui, JIANG Yang, WU Liang, ZOU Jin, XU Nan-ping, HUANG Bo-yun, LIU Chain-tsuan. Effect of Al content on porous Ni-Al alloys[J]. Materials Science & Engineering A, 2011, 528(13): 4849-4855.
[14] 吴 靓, 贺跃辉, 董虹星. Ni-Al金属间化合物多孔材料的制备[J]. 粉末冶金材料科学与工程, 2009, 14: 52-56.
WU Liang, HE Yue-hui, DONG Hong-xing. Fabrication of porous Ni-Al intermetallic compounds[J]. Materials Science & Engineering of Powder Metallurgy, 2009, 14: 52-56.
[15] 董虹星, 刘秋平, 贺跃辉, 吴 靓. 多孔NiAl金属间化合物的造孔机理[J]. 中国有色金属学报, 2013, 23(2): 474-479.
DONG Hong-xing, LIU Qiu-ping, HE Yue-hui, WU Liang. Pore formation mechanism of porous NiAl intermetallics[J]. Chinese Journal of Nonferrous Metals, 2013, 23(2): 474-479.
[16] MIAO H J, PIRON D L. Composite-coating electrodes for hydrogen evolution reaction[J]. Electrochimica Acta, 1993, 38(8): 1079-1085.
[17] WENDT H, KREYSA G. Electrochemical reaction engineering[J]. Berlin: Springer, 1999: 128-152.
[18] 姚素薇, 姚颖悟, 张卫国, 王宏智, 赵 越. Ni-W/ZrO2纳米复合镀层耐高温氧化性能分析[J]. 天津大学学报, 2007, 40(3): 308-311.
YAO Su-wei, YAO Ying-wu, ZHANG Wei-guo, WANG Hong-zhi, ZHAO Yue. High temperature of oxidation resistance of Ni-W/ZrO2 nano-composite coating[J]. Journal of Tianjin University, 2007, 40(3): 308-311.
[19] 王森林, 段钱花. 电沉积Ni-S/LaNi5多孔复合电极的电催化析氢性能[J]. 中国有色金属学报, 2013, 23(8): 2221-2228.
WANG Sen-lin, DUAN Qian-hua. Electrocatalytic hydrogen evolution characters of electrodeposited Ni-S/LaNi5 porous composite electrode[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(8): 2221-2228.
[20] 刘文胜, 吴亚瑜, 马运柱, 张佳佳, 叶晓珊, 天海官. Ni42.2W19.2Fe18.9B19.7非晶合金的电化学腐蚀行为[J].中国有色金属学报, 2015, 25(8): 2123-2130.
LIU Wen-sheng, WU Ya-yu, MA Yun-zhu, ZHANG Jia-jia, YE Xiao-shan, TIAN Hai-guan. Electrochemical corrosion behavior of amorphous Ni42.2W19.2Fe18.9B19.7 alloy[J]. The Chinese Journal of Nonferrous Metals, 2015, 25(8): 2123-2130.
[21] 高诚辉, 李 凝. 电沉积非晶/纳米晶Ni-Mo-La合金电极的析氢性能[J]. 中国有色金属学报, 2011, 21(11): 2819-2824.
GAO Chenghui, LI Ning, Hydrogen evolution reaction activity of electrodeposited amorphous/nanocrystalline Ni-Mo-La alloy electrode[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(11): 2819-2824.
[22] 奚小波, 缪 宏, 金亦富, 郑再象, 程吉林, 张瑞宏. Ni-Co-Mn合金的电镀工艺优化及与金刚石复合镀的摩擦磨损性能[J]. 中国有色金属学报, 2015, 25(9): 2523-2530.
XI Xiao-bo, LIAO Hong, JIN Yi-fu, ZHENG Zai-xiang, CHENG Ji-lin, ZHANG Rui-hong. Electroplating process optimization of Ni-Co-Mn alloy and tribological wear performance of composition plating with diamond[J]. The Chinese Journal of Nonferrous Metals, 2015, 25(9): 2523-2530.
[23] WANG M, WANG Z, GUO Z, LI Z. The enhanced electrocatalytic activity and stability of NiW films electrodeposited under super gravity field for hydrogen evolution reaction[J]. International Journal of Hydrogen Energy, 2011, 36(5): 3305-3312.
[24] ROSALBINO F,  D, SACCONE A, ANGELINI E, DELFINO S. Fe-Mo-R (R=rare earth metal) crystalline alloys as a cathode material for hydrogen evolution reaction in alkaline solution[J]. International Journal of Hydrogen Energy, 2011, 36(3): 1965-1973.
D, SACCONE A, ANGELINI E, DELFINO S. Fe-Mo-R (R=rare earth metal) crystalline alloys as a cathode material for hydrogen evolution reaction in alkaline solution[J]. International Journal of Hydrogen Energy, 2011, 36(3): 1965-1973.
[25] CONWAY B E, BAI L. H2 evolution kinetics at high activity Ni-Mo-Cd electrocoated cathodes and its relation to potential dependence of sorption of H[J]. International Journal of Hydrogen Energy, 1986, 11(8): 533-540.
[26] CAMPBELL C E, BOETTINGER W J, KATTNER U R. Development of a diffusion mobility database for Ni-base superalloys[J]. Acta Materialia, 2002, 50(4): 775-792.
[27] CUI Bai, LIN Hong, LI Lian-Bao, LI Xin, YANG Jun, TAO Jie. Core-ring structured NiCo2O4 nanoplatelets: Synthesis, characterization, and electrocatalytic applications[J]. Advanced Functional Materials, 2010, 18(9): 1440-1447.
[28] 张鉴清. 电化学测试技术[M]. 北京: 化学工业出版社, 2010: 204-237.
ZHANG Jian-qing. Electrochemical measurement technology[M]. Beijing: Chemical Industry Press, 2010: 204-237.
Electrochemical performance of porous Ni-based electrodes for hydrogen evolution reaction in alkaline solution
WU Liang1, 2, 3, GUO Xiao-hua1, 2, 3, XU Yang1, 2, 3, XIAO Yi-feng1, 2, 3, XU Yan-fei1, 2, 3, QIAN Jin-wen1, 2, 3, GUAN Zhuo1, 2, 3, HE Yue-hui4
(1. School of Mechanical Engineering, Xiangtan University, Xiangtan 411105, China;
2. Key Laboratory of Welding Robot and Application Technology of Hunan Province, Xiangtan University, Xiangtan 411105, China;
3. Engineering Research Center of Complex Tracks Processing Technology and Equipment, Ministry of Education, Xiangtan University, Xiangtan 411105, China;
4. State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China)
Abstract: Objective of this work was to investigate the electrochemical performance of porous Ni3Al-Mo electrodes for hydrogen evolution reaction using cathodic polarization and impedance spectroscopy techniques. The morphology of the porous Ni3Al-Mo electrode was characterized by scanning electron mircosope(SEM) and X ray diffration(XRD). The results show that Ni3Al-Mo electrode has a large porosity of 47%, the maximum pore size of 2.7 μm, the mean pore size of 2.1 μm and lower overpotential, higher exchange current density comparing to the porous Ni3Al and porous Ni electrodes. After anodic treatment, the polarization curve becomes almost the same as the one recorded before the anodic treatment. The activity of the porous Ni3Al-Mo electrode does not change much after the current interruptions, even after 120 h, which indicates that porous Ni3Al-Mo electrode has higher hydrogen evolution activity and better electrocatalytic performance.
Key words: hydrogen evolution reaction; porous Ni3Al-Mo electrodes; cathodic polarization; impedance spectroscopy; stability
Foundation item: Projects(51504213, 51401175, 51271158) supported by the National Natural Science Foundation of China; Project(2015WK3021) supported by Major Project of Hunan Province for Researcher and Development, China; Project(2015JJ3123) supported by the Natural Science Foundation of Hunan Province, China; Project(17B250) supported by the Outstanding Youth Project of the Hunan Provincial Education Department, China
Received date: 2016-11-02; Accepted date: 2017-04-26
Corresponding author: XIAO Yi-feng; Tel: +86-13107322821; E-mail: sanyxyf@163.com
(编辑 王 超)
基金项目:国家自然科学基金资助项目(51504213,51401175,51271158);湖南省重点研发计划项目(2015WK3021);湖南省自然科学基金资助项目(2015JJ3123);湖南省教育厅优秀青年项目(17B250)
收稿日期:2016-11-02;修订日期:2017-04-26
通信作者:肖逸锋,教授,博士;电话:13107322821;E-mail: sanyxyf@163.com