DOI: 10.11817/j.ysxb.1004.0609.2021-37927
Vx-Mn0.8Fe0.2O2催化剂的制备及其抗硫脱硝性能研究
何汉兵1, 2, 3,张业林1,曾 婧1,张 丽1,郑雅杰1,马 英4
(1. 中南大学 冶金与环境学院,长沙 410083;
2. 国家环境保护矿冶资源利用与污染控制重点实验室,武汉科技大学,武汉 430081;
3. 冶金减排与资源综合利用教育部重点实验室(安徽工业大学),安徽马鞍山 243002;
4. 永清环保股份有限公司,长沙 410001)
摘 要:为了更好地适应工业化脱硝需求,本文选用廉价的黑色金属Mn,Fe作为催化剂主要原料,通过V掺杂极大地提升了锰铁催化剂的低温脱硝性能和抗硫性能。论文采用共沉淀法制备了Vx-Mn0.8Fe0.2O2催化剂,运用X射线衍射仪(XRD)、扫描电子显微镜(SEM)和X射线光电子能谱分析(XPS)考察了V2O5添加量对Mn0.8Fe0.2O2催化剂的结构、形貌及其抗硫脱硝性能的影响。结果表明,Vx-Mn0.8Fe0.2O2催化剂主要物相为Mn2O3,样品颗粒尺寸小且分散均匀。V0.3-Mn0.8Fe0.2O2催化剂具有较多的活性位点及较好的抗硫脱硝性能,在300 ℃时脱硝率可达90.36%,相比于Mn0.8Fe0.2O2催化剂脱硝性能达到90%的温度约降低100 ℃;同时在CO:NO:SO2为3:1:1的反应条件下催化剂的脱硝率仍能保持在80%以上。
关键词:锰铁催化剂;V2O5 掺杂;催化脱硝;CO-SCR;一氧化氮
文章编号:1004-0609(2021)-xx-- 中图分类号:TB333 文献标志码:A
引文格式:何汉兵, 张业林, 曾 婧, 等. Vx-Mn0.8Fe0.2O2催化剂的制备及其抗硫脱硝性能研究[J]. 中国有色金属学报, 2021, 31(x): xxxx-xxxx. DOI: 10.11817/j.ysxb.1004.0609.2021-37927
HE Han-bing, ZHANG Ye-lin, ZENG Jing, et al. Preparation of Vx-Mn0.8Fe0.2O2 catalyst and its anti-sulfur denitration performance[J]. The Chinese Journal of Nonferrous Metals, 2021, 31(x): xxxx-xxxx. DOI: 10.11817/j.ysxb.1004.0609.2021-37927
氮氧化物(NOx)和 SO2 是大气的主要污染物。氮氧化物的大量排放不仅会对人体健康造成威胁,还会破坏环境甚至危及整个生态系统。选择性催化还原技术(SCR)是脱硝的主流途径,而且核心是催化剂及还原剂的选择。NH3作为还原剂在工业上应用广泛,但是在存储、运输过程中存在高危险和易泄露等安全问题,并且烟气中SO2在较高温度下会与NH3反应生成硫酸铵盐腐蚀设备,所以选择新的还原剂势在必行。CO 是一种典型的还原剂[1-2],被广泛用于选择性催化还原 NO(CO-SCR),同时,广泛存在于汽车尾气及工业废气中,可达到以废治废的目的[3],此外CO、NOx和 SO2[4]之间可以很好地相互作用,从而可用于同时脱硫脱硝[5]。目前,研究最多的脱硝催化剂主要包括 Pt、Pd、Ir 等贵金属催化剂,以及 Fe、Ni[6]、 Co[7]、Mn、Cu[8-9]、Ce[10]等过渡金属氧化物催化剂。贵金属资源有限,成本过高,发展受到限制。因此,低价环保型催化剂的开发受到越来越多的关注。
锰氧化物催化剂因为其多重价态及强氧化还原能力,低温脱硝性能好,是近年来的研究热点。
前期研究主要集中于掺杂其他金属来提高催化剂性能和抗性[11]。比如氧化铁作为助剂不但能够促使活性组分均匀分散,还能提高NO转化率和N2的选择性[12]。课题组在对Mn/ETS-10负载Fe的前期工作中发现锰和铁之间的协调作用能有效地产生表面协同氧空位活性中心,表面协同氧空位只会在双金属催化剂中生成,而不会在单金属或单金属的机械混合物中生成,这也是Fe-Mn 双金属催化剂活性提高的主要原因[13]。WU[14]等将Fe掺杂到MnOx/TiO2催化剂中,结果表明Fe的引入可以减弱催化剂的烧结,显著提高MnOx的分散性。由于Fe2O3和Mn2O3等活性组分易被硫酸化,通常采用双金属掺杂对其进行改性以提高其抗硫性。
V是一种过渡金属元素,凭借独特的结构常被用于化工、钢铁以及航空等行业。对于V作为活性组分负载到其他催化剂上以提高其抗硫脱硝性能已有一定的研究。崔晶等[15]采用了浸渍法制备了V2O5-WO3-CeO2/TiO2催化剂,在300 ℃含SO2气氛下反应48h催化剂脱硝率仍能维持在90%以上,催化剂具有较强的抗SO2中毒能力。YANG等[16]制备的V2O5-Fe2O3/AC,在200 ℃,SO2存在时,NO x转化效率保持在90%左右。贾勇等[17]以TiO2为载体负载性能组分V2O5进行抗硫检测,FT-IR图谱显示抗硫测试后的V2O5/TiO2表面未发现有硫酸根生成,V2O5/TiO2表现出较强的抗硫性能。说明V作为组元能改善催化剂氧化还原和不易被硫酸化等特性。
因此本文选用廉价金属元素Mn、Fe作为催化剂的主要成分,在其基础上利用金属元素V对锰铁催化剂进行改性。采用多种物理化学手段考察了催化剂在模拟气氛下的选择催化还原的反应性能,以及催化剂的结构、表面性质与反应性能之间的关系。
1 实验
1.1 催化剂的制备
采用共沉淀法制备Vx-Mn0.8Fe0.2O2催化剂。实验前期已完成Mn,Fe摩尔比例探索实验,得到摩尔比Mn:Fe=8:2时催化剂具有最佳脱硝性能。因此选择在Mn0.8Fe0.2O2催化剂基础上分别掺杂不同比例的V,摩尔比设定为Vx-Mn0.8Fe0.2O2(x=0.05、0.1、0.2、0.3、0.4,其中x为V与Mn的摩尔比)。
催化剂具体制备过程如下:1) 准确称取1.96 g CH3(COO)3Mn·4H2O、0.808 g Fe(NO3)3·9H2O以及x g V2O5(x=0.091、0.182、0.363、0.545、0.726 g),放于40 mL的超纯水中充分搅拌1 h;2) 充分溶解后边搅拌边滴加质量分数为25%的氨水溶液,控制终点pH=10,继续搅拌5 h,将搅拌好的沉淀混合物进行洗涤后离心至上清液pH=7;3) 得到的固体在80 ℃下干燥10 h,研磨成粉末放入马弗炉,以5 ℃/min的升温速率升到600 ℃(此最佳温度由前期烧结温度条件实验确定),保温5 h,自然降温至室温即可得到目标产物。
1.2 催化剂结构与形貌表征
采用JSM-6360LV型电子扫描显微镜(SEM)对材料进行表面微观形貌观察和能谱面扫描元素成分分析。扫描电镜工作条件为:电子加速电压20.0 kV,放大倍数0~100000倍,采用日本Rigaku D公司TTR Ⅲ型X射线衍射仪(XRD)对所合成的材料进行物相结构的检测,Cu靶(λ=1.5406 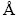 ),工作电压40.0 kV,扫描范围2θ为10°~80°,扫描速度为10 (°)/min,采用Thermo Fisher公司ESCALABXi+测定固体表面的电子结构和表面组成的化学成分。
),工作电压40.0 kV,扫描范围2θ为10°~80°,扫描速度为10 (°)/min,采用Thermo Fisher公司ESCALABXi+测定固体表面的电子结构和表面组成的化学成分。
1.3 催化剂催化性能表征
通过实验室自制装置对合成的催化剂进行脱硝性能检测实验。实验体系由配气系统、催化系统、检测系统3个部分组成,配气系统由装有CO、NO标准气的钢瓶和配气仪组成,催化系统由固定反应器和管式电阻炉组成,检测系统为德国MRU公司VARIO PLUS型增强型烟气分析仪。
1.3.1 催化剂脱硝性能表征
采用抗高温石英棉将 0.5 g 催化剂固定于石英管中部,放置于程序控温的管式电阻炉中进行反应。然后通入反应气体:w(CO)=500×10-6,w(NO)=500×10-6,平衡气氛为氮气,再经过程序性升温控制以5 ℃/min的速度从50 ℃升至400 ℃进行脱硝率测试。利用烟气分析仪检测并实时记录出口处NO浓度脱硝率η,(η)计算公式如下:
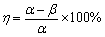 (1)
(1)
式中: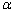 为进口处NO浓度;β为出口处 NOx浓度,包括NO和NO2。
为进口处NO浓度;β为出口处 NOx浓度,包括NO和NO2。
1.3.2 催化剂抗硫脱硝性能表征
采用抗高温石英棉将 0.5 g 催化剂固定于石英管中部,放置于程序控温的管式电阻炉中进行反应。然后通入反应气体:w(CO)=500×10-6,w(NO)= 500×10-6,平衡气氛为氮气,再经过程序性升温控制以 5 ℃/min 的速度从 50 ℃升至 400 ℃进行脱硝率测试。待脱硝率在400 ℃稳定后再以CO:SO2= 2:1(w(SO2)=200×10-6,400×10-6,500×10-6,600×10-6)的浓度比通入CO和SO2,考察催化剂在400 ℃,不同浓度SO2气氛下脱硝率的变化。利用烟气分析仪检测并实时记录出口处NO浓度脱硝率η,(η)计算公式如下:
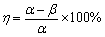 (1)
(1)
式中: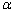 为进口处NO浓度;β为出口处 NOx浓度,包括NO和NO2。
为进口处NO浓度;β为出口处 NOx浓度,包括NO和NO2。
2 结果与讨论
2.1 催化剂CO-SCR性能测试及分析
2.1.1 催化剂脱硝性能检测
图1所示为催化剂样品在150~400 ℃的脱硝性能曲线,由图1可知不同比例V的掺杂均使样品脱硝率随温度的升高呈上升趋势。当掺V比例为0.05~0.3时样品的脱硝性能呈正向提升,对比发现,在150~400 ℃范围内V0.3-Mn0.8Fe0.2O2样品的脱硝性能较好,300 ℃时V0.3-Mn0.8Fe0.2O2样品脱硝率可达到90.36%,400 ℃时达到94.42%。当提升V掺杂量为0.4时,脱硝率反而有所下降,说明适量的V掺杂对Mn0.8Fe0.2O2催化剂有很大的促进作用。同时由脱硝性能对比可以看出V掺杂对催化剂的改性主要体现在低温脱硝性能的提高。
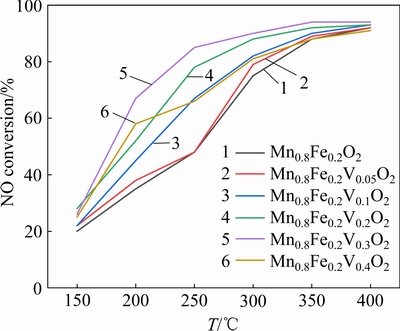
图1 Vx-Mn0.8Fe0.2O2的脱硝率曲线
Fig. 1 Denitrification rate curves of Vx-Mn0.8Fe0.2O2
2.1.2 催化剂抗硫脱硝性能检测
图2(a)所示为Mn0.8Fe0.2O2样品在400 ℃,不同浓度SO2的条件下的脱硝性能曲线,由图可知随着SO2浓度的增大Mn0.8Fe0.2O2样品的脱硝率呈下降趋势。当w(SO2)=200×10-6时样品反应4 h后脱硝率仅为63%。当w(SO2)=600×10-6时样品反应4 h后脱硝率仅为30%,相比于在无SO2气氛下反应的脱硝率降低了60%。反应一段时间后停止通入SO2,样品的脱硝率均有一定的回升,对比发现当SO2浓度较低时停止通入SO2样品的脱硝率能得到有效的恢复;当SO2浓度较高时即使停止通入SO2,样品的脱硝率基本不会有很大的变化。推测是过高的SO2浓度会使样品表面的Mn2O3和Fe2O3硫酸化,生成相应的硫酸盐沉积在催化剂表面导致样品失活。
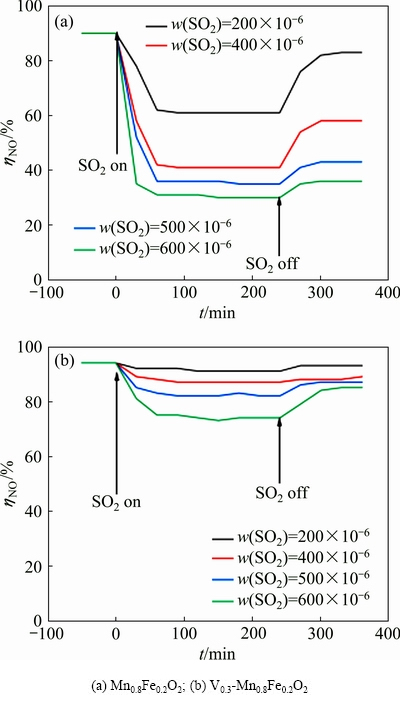
图2 不同SO2浓度下样品的脱硝率曲线
Fig. 2 Denitration rate curve of sample at different SO2 concentration
图2(b)为V0.3-Mn0.8Fe0.2O2样品在400 ℃,不同浓度SO2的条件下的脱硝性能曲线,可以看出通入SO2对样品脱硝率影响较小,当w(SO2)=200×10-6时样品反应4 h后脱硝率为88%,当w(SO2)=600× 10-6时样品反应4 h后脱硝率仍能保持在75%以上,反应一段时间后停止通入SO2,样品的脱硝率均有一定的回升。对比V0.3-Mn0.8Fe0.2O2样品的抗硫性可知掺V后样品的抗硫性能有了极大的提升,较低SO2浓度对样品的脱硝率几乎没有影响,在高浓度SO2气氛下样品脱硝率仍能保持在75%以上。
2.2 XRD表征及分析
图3所示为Mn0.8Fe0.2O2,Vx-Mn0.8Fe0.2O2及Mn2O3标准卡片PDF#41-1442的XRD谱。其中Mn0.8Fe0.2O2催化剂在23.1°、32.9°、38.2°、47.3°、49.3°、55.1°、67.4°处出现衍射峰,分别对应于Mn2O3的(211)、(222)、(400)、(422)、(431)、(440)、(631)晶面[18]。对于Vx-Mn0.8Fe0.2O2催化剂,随着掺V比例的增大,衍射峰强度呈下降的趋势,说明V的掺入降低了催化剂的结晶度。当掺V比例小于0.2时可以看出XRD谱主要呈现的物相为Mn2O3,并未观察到与Fe,V物种相关的峰。以共沉淀法制备的催化剂中Fe,V物质的存在形式一般为氧化物(Fe2O3、VO2、V2O5等)[19-20],可以推断,铁,钒物质以无定形状态存在或者掺入Mn2O3晶格中,导致无法检测到相关物质。随着掺V比例的增加,XRD谱显示在28.1°及29.3°开始出现了V2O5的特征衍射峰。当掺V比例增加到0.4时,催化剂主要物相则表现为V2O5。
图3 Mn0.8Fe0.2O2、Vx-Mn0.8Fe0.2O2的XRD谱
Fig. 3 XRD patterns of Mn0.8Fe0.2O2 and Vx-Mn0.8Fe0.2O2
2.3 SEM表征及分析
图4所示为Mn0.8Fe0.2O2和Vx-Mn0.8Fe0.2O2样品的扫描电子显微镜图片。由图可知,通过共沉淀法所制备的样品为不规则颗粒,颗粒尺寸较小且分散均匀。在对比掺V前后样品的形貌可以看出掺V后样品颗粒尺寸有小幅增大且当掺V量为0.2和0.3时颗粒表面较为粗糙且存在着细小的裂纹(图4(d)、(e))。从脱硝结果可知V0.3-Mn0.8Fe0.2O2催化剂具有最佳的脱硝效率,推测是因为该掺杂量的样品在制备过程中更容易产生晶格缺陷,从而暴露更多的活性位点促进催化反应的进行。图4(g)、(h)分别为Mn0.8Fe0.2O2、V0.3-Mn0.8Fe0.2O2进行抗硫反应4 h后样品的扫描电子显微镜图片,可以看出反应后的Mn0.8Fe0.2O2样品表面覆盖大量的白色产物,根据图6 XPS分析可知白色产物对应着MnSO4的生成。而反应后的V0.3-Mn0.8Fe0.2O2样品表面仅有少量细小颗粒,对应S单质的生成。说明掺V能有效地阻止催化剂的硫酸化。
图5所示为V0.3-Mn0.8Fe0.2O2样品的X射线能谱元素面分布分析(SEM-EDAX)结果。分别为扫描区域Mn、Fe、V、O元素分布图,证实了Mn、Fe和V物质的存在,且各元素在样品中分散均匀。
2.4 N2物理吸附测试
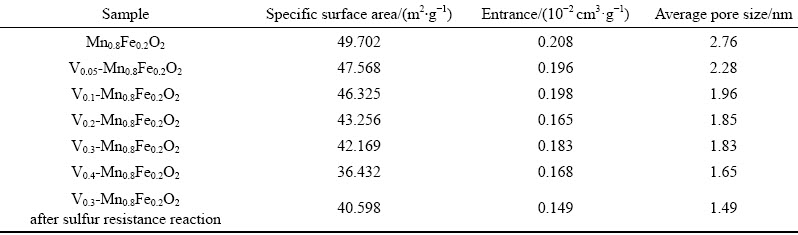
Vx-Mn0.8Fe0.2O2样品的N2物理吸附测试结果见表1。随着V掺杂量的增大,催化剂的比表面积逐渐减小,孔径也呈下降趋势,但是对孔容的影响无明显的规律。根据Vx-Mn0.8Fe0.2O2样品的脱硝率曲线可知,V0.3-Mn0.8Fe0.2O2样品有着最好的脱硝性能,但是其比表面积和孔容孔径都相对较小,由此可知比表面积大小对样品脱硝性能的影响并不能起到决定性作用。V0.3-Mn0.8Fe0.2O2样品抗硫后比表面积、孔容、孔径都有小幅的降低,推测是样品抗硫反应过程中生成的含硫物质附着在样品上所导致。

图4 Mn0.8Fe0.2O2与Vx-Mn0.8Fe0.2O2的SEM像
Fig. 4 SEM images of Mn0.8Fe0.2O2 and Vx-Mn0.8Fe0.2O2

图5 V0.3-Mn0.8Fe0.2O2的SEM像及相应的元素面扫描分布
Fig. 5 SEM image and EDAX element mappings distribution of V0.3-Mn0.8Fe0.2O2
表1 Vx-Mn0.8Fe0.2O2样品的 N2 物理吸附测试
Table 1 N2 physical adsorption test of Vx-Mn0.8Fe0.2O2 sample
2.5 XPS表征及分析
对Mn0.8Fe0.2O2,V0.3-Mn0.8Fe0.2O2抗硫反应前后的样品进行XPS检测,通过计算Mn0.8Fe0.2O2掺V前后和抗硫反应后Mn,V的价态及含量,对比分析掺V后对样品脱硝及抗硫脱硝性能的影响。
图6(a)和(b)分别为Mn0.8Fe0.2O2抗硫反应前后的Mn 2p光谱。图7(a)和(b)分别为V0.3-Mn0.8Fe0.2O2抗硫反应前后的Mn 2p光谱,其中Mn4+线、 Mn3+线、Mn2+线如图所示,反应前金属Mn在样品中主要以Mn3+和Mn4+形式存在,而抗硫反应后由于硫酸盐的生成金属Mn在样品中主要以Mn2+、Mn3+和Mn4+形式存在。Mn 2p3/2轨道出现在641.4 eV处,图6(a)对Mn 2p3/2轨道分峰拟合后可以得到两个峰,分别为641.2 eV(Mn3+)、642.5 eV(Mn4+),图6(b)对Mn 2p3/2轨道分峰拟合后可以得到三个峰,分别为640.1 eV(Mn2+)、641.2 eV(Mn3+)、642.5 eV(Mn4+)[21]。图7(a)和(b)分别为V0.3-Mn0.8Fe0.2O2抗硫反应前后的Mn 2p光谱,同样的图7(a)对Mn 2p3/2轨道分峰拟合后可以得到两个峰,分别为641.2 eV(Mn3+)、642.5 eV(Mn4+),图7(b)对Mn 2p3/2轨道分峰拟合后可以得到三个峰,分别为640.1 eV(Mn2+)、641.2 eV(Mn3+)、642.5 eV(Mn4+)。
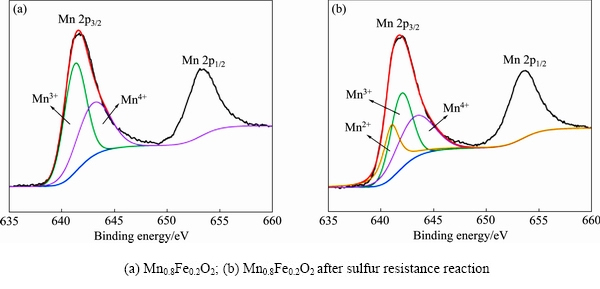
图6 Mn0.8Fe0.2O2的Mn 2p光谱
Fig. 6 Mn 2p XPS spectra of Mn0.8Fe0.2O2
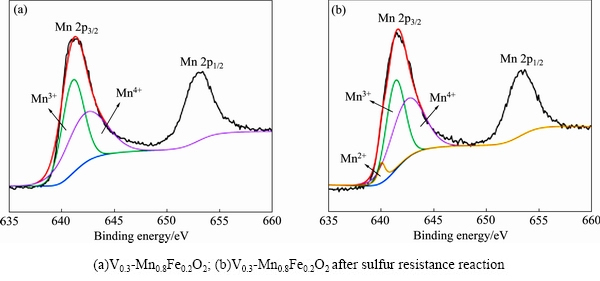
图7 V0.3-Mn0.8Fe0.2O2的Mn 2p光谱
Fig. 7 Mn 2p XPS spectra of V0.3-Mn0.8Fe0.2O2
通过对图6,图7中峰面积计算可以得出Mn0.8Fe0.2O2和Vx-Mn0.8Fe0.2O2抗硫反应前后的不同Mn物种的相对含量,结果如表 2 部分所示。其中抗硫反应前Mn0.8Fe0.2O2,V0.3-Mn0.8Fe0.2O2中锰氧化物表现出Mn3+和 Mn4+价态,多价态使锰氧化物表现出优异的氧化还原性能,表面存在多种类型的不稳定活性氧[22],有利于提高催化性能。对比掺V前后锰氧化物的价态可知,V的加入使得Mn4+的比例增加,表明Mn和V之间存在相互作用,促进了Mn3+向Mn4+的转化。不同MnOx活性遵循以下规 则:MnO2>Mn5O8>Mn2O3>Mn3O4>Mn3O4,因此Mn4+/(Mn4++Mn3++Mn2+)的比值越高则催化剂的脱硝能力越强[23]。通过Mn0.8Fe0.2O2,V0.3-Mn0.8Fe0.2O2脱硝性能的对比也可看出高价态Mn更为活跃,有助于提高催化剂的脱硝性能[24-25]。通过图6(b)和图7(b)可知Mn0.8Fe0.2O2、V0.3-Mn0.8Fe0.2O2抗硫反应后各价态Mn之间存在着这样的关系: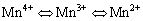 。从表2可以看出Mn0.8Fe0.2O2反应后Mn2+的含量高达27.9%,说明在反应过程中很大一部分锰氧化物活性组分被还原成MnSO4,而V0.3-Mn0.8Fe0.2O2反应后Mn2+的含量仅为4.4%,说明V的加入能有效地抑制硫酸盐的生成。Mn的多种价态中,Mn4+ 的脱硝反应性能最强,生成MnSO4 的同时Mn4+ 减少,故而催化剂性能降低。
。从表2可以看出Mn0.8Fe0.2O2反应后Mn2+的含量高达27.9%,说明在反应过程中很大一部分锰氧化物活性组分被还原成MnSO4,而V0.3-Mn0.8Fe0.2O2反应后Mn2+的含量仅为4.4%,说明V的加入能有效地抑制硫酸盐的生成。Mn的多种价态中,Mn4+ 的脱硝反应性能最强,生成MnSO4 的同时Mn4+ 减少,故而催化剂性能降低。
表2 Mn0.8Fe0.2O2和V0.3-Mn0.8Fe0.2O2 抗硫反应前后Mn元素含量分析
Table 2 Mn0.8Fe0.2O2和V0.3-Mn0.8Fe0.2O2 analysis of Mn before and after sulfur resistance reaction
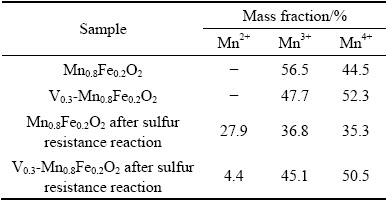
图8(a),(b)分别为V0.3-Mn0.8Fe0.2O2抗硫反应前后的V 2p光谱,图8(a),(b)分峰拟合后出现三个峰,分别为515.7eV(V3+)、516.3eV(V4+)、517.1eV(V5+)[26-27]。通过图 8可以通过峰面积计算V0.3-Mn0.8Fe0.2O2中的不同V物种的相对含量,结果如表 3部分所示。由表3可以看出,抗硫反应后V0.3-Mn0.8Fe0.2O2中V3+、V4+的占比显著减少,V5+含量增多,相关研究表明催化剂中低价钒(V3+、V4+)的比例越高,催化剂脱硝性能越好[28]。这也是V0.3-Mn0.8Fe0.2O2进行抗硫反应后样品的脱硝率有所下降的原因之一。
图9(a),(b)分别为Mn0.8Fe0.2O2和V0.3-Mn0.8Fe0.2O2的O 1s光谱,通过 XPS Peak 软件可以将其拟合为两个峰,与金属离子的氧化还原性质有关,电子结合能较低的峰(528~529 eV)属于晶格氧峰,一般称为Oβ。电子结合能较高的峰(531~532 eV)属于化学吸附氧峰,一般称为Oα。其中晶格氧主要是给催化剂提供氧空位的氧物种,在脱硝反应中主要作为NO的吸附位,对脱硝性能的提高有着重要的作用。从图中可以看出催化剂中主要以Oβ为主,对比Mn0.8Fe0.2O2催化剂中Oβ的含量可以看出,掺V可以在一定程度上提升催化剂中晶格氧的含量。同时V0.3-Mn0.8Fe0.2O2的脱硝性能明显优于Mn0.8Fe0.2O2,这也说明了晶格氧含量的增加有助于提高催化剂的脱硝性能。
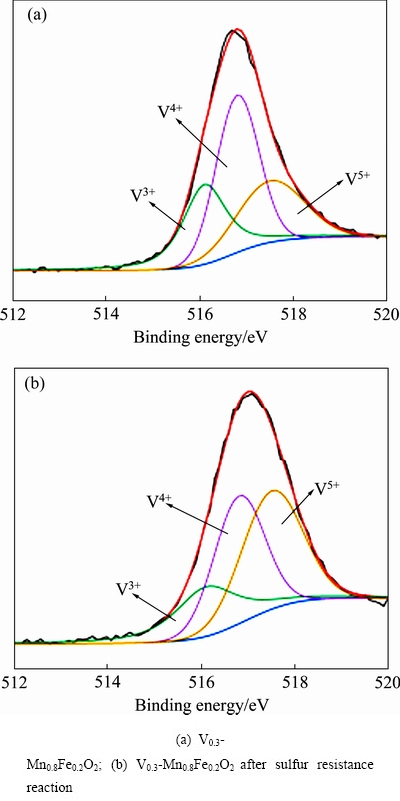
图8 V0.3-Mn0.8Fe0.2O2的V 2p光谱
Fig. 8 V 2p XPS spectra of V0.3-Mn0.8Fe0.2O2
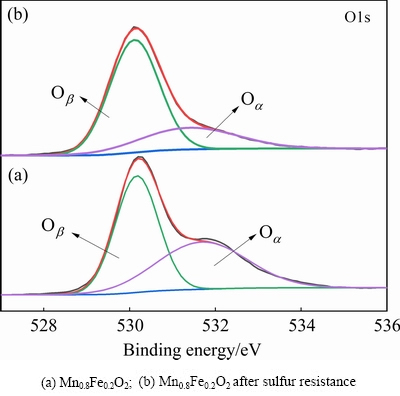
图9 Vx-Mn0.8Fe0.2O2的O 1s光谱
Fig. 9 O 1s XPS spectra of Vx-Mn0.8Fe0.2O2
表3 V0.3-Mn0.8Fe0.2O2 抗硫反应前后V元素含量分析
Table 3 V0.3-Mn0.8Fe0.2O2 analysis of V before and after sulfur resistance reaction
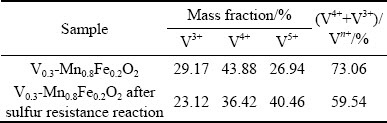
图10(a),(b)分别为Mn0.8Fe0.2O2、V0.3-Mn0.8Fe0.2O2抗硫反应后的S 2p光谱。其中Mn0.8Fe0.2O2抗硫反应后在S 2p轨道168.5 eV出现明显的特征峰,该峰归属于 ,由此可知Mn0.8Fe0.2O2在抗硫反应过程中会生成大量的硫酸盐物质,导致催化剂上硫酸盐的不断沉积和部分活性组分的硫酸化,表面硫酸盐的沉积使孔道发生阻塞,催化剂表面活性位减少,从而脱硝性能显著降低。V0.3-Mn0.8Fe0.2O2抗硫反应后在S 2p轨道164.0 eV、168.5 eV出现明显的特征峰,分别归属于S单质和
,由此可知Mn0.8Fe0.2O2在抗硫反应过程中会生成大量的硫酸盐物质,导致催化剂上硫酸盐的不断沉积和部分活性组分的硫酸化,表面硫酸盐的沉积使孔道发生阻塞,催化剂表面活性位减少,从而脱硝性能显著降低。V0.3-Mn0.8Fe0.2O2抗硫反应后在S 2p轨道164.0 eV、168.5 eV出现明显的特征峰,分别归属于S单质和 ,说明V0.3-Mn0.8Fe0.2O2的作用主要是催化CO还原SO2,其主要化学反应有[29]:
,说明V0.3-Mn0.8Fe0.2O2的作用主要是催化CO还原SO2,其主要化学反应有[29]:
SO2+2CO=2CO2+S (2)
CO+S=COS (3)
2COS+SO2=2CO2+3S (4)
由此可见V0.3-Mn0.8Fe0.2O2主要是通过将SO2还原为价态更低的S单质从而减少了硫酸盐的生成,这也是V0.3-Mn0.8Fe0.2O2在SO2气氛下仍能保持较高脱硝性能的原因。
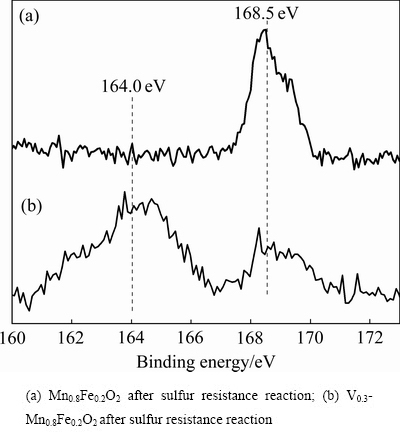
图10 Mn0.8Fe0.2O2、V0.3-Mn0.8Fe0.2O2的S 2p光谱
Fig. 10 S 2p XPS spectra of Mn0.8Fe0.2O2, V0.3-Mn0.8Fe0.2O2
3 结论
在本次的实验中,我们采用共沉淀法制备了不同V含量的Vx-Mn0.8Fe0.2O2复合金属氧化物,通过XRD分析了催化剂物相的组成;通过SEM观察及分析方法研究了不同V含量的Vx-Mn0.8Fe0.2O2复合金属氧化物的组织形貌;通过XPS分析各元素含量对催化剂脱硝性能的影响。研究结果如下:
1) 通过共沉淀法成功制备出Vx-Mn0.8Fe0.2O2催化剂,制备的样品呈纳米级不规则颗粒存在,颗粒尺寸在20~100 nm之间,其主要物相为Mn2O3,铁及钒以高度分散氧化物形式分散于催化剂中。
2) V0.3-Mn0.8Fe0.2O2催化剂脱硝性能最好,在300 ℃和400 ℃时,其脱硝性能分别能达到90.36%和94.42%。V0.3-Mn0.8Fe0.2O2催化剂在400 ℃,CO:NO:SO2为3:1:1的反应条件下反应4 h催化剂的脱硝率仍能保持在80%以上。
3) V0.3-Mn0.8Fe0.2O2催化剂中钒与锰的协同作用有助于活性物质的产生,提高Mn4+的比例。脱硫反应后生成硫酸盐物质,Mn4+,V4+的比例减少导致脱硝率降低。
4) Mn0.8Fe0.2O2催化剂抗硫后主要产物为硫酸盐,V0.3-Mn0.8Fe0.2O2催化剂抗硫后主要产物为S单质,减少了硫酸盐的生成,这也是掺V后样品抗硫性能提升的重要原因。
REFERENCES
[1] PATEL A, SHUKLA P, PAN Guan-ting, et al. Influence of copper loading on mesoporous alumina for catalytic NO reduction in the presence of CO[J]. Journal of Environmental Chemical Engineering, 2017, 5(3): 2350-2361.
[2] LIU T, QIANG J, YAO Y, et al. Research on SCR of NO with CO over the Cu0.1La0.1Ce0.8O mixed-oxide catalysts: Effect of the grinding[J]. Journal of Molecular Catalysis A Chemical, 2016, 430: 43-53.
[3] LAIS F O, ALCINEIA C O, JESUINA C S, et al. Selective catalytic reduction of NOx by CO (CO-SCR) over metal-supported nanoparticles dispersed on porous alumina[J]. Advanced Powder Technology, 2020, 31(1): 464-476.
[4] ZHANG Li, QIN Yi-hong, CHEN Bai-zhen, et al. Catalytic reduction of SO2 by CO over CeO2-TiO2 mixed oxides[J]. Transactions of Nonferrous Metals Society of China, 2016, 26(11): 2960-2965.
[5] 张 丽, 秦毅红, 陈白珍. CO-NOx-SO2体系化学平衡分析[J]. 中南大学学报(自然科学版), 2015, 46(1): 27-33.
[6] LONG Jia-ju, HE Han-bing, LI Zhong-pu, ZHANG Hui. Low-temperature and anti-sulfur catalytic performance of Nix-OMS-2 for NO-CO[J]. 功能材料, 2019, 50(8): 8084-8090.
[7] 何汉兵, 马小鹏, 李忠濮, 等. 钴铁双金属有机骨架及其炭化产物的低温脱硝性能研究[J]. 功能材料, 2018, 49(12): 12001-12006.
[8] ZHANG Li, HUANG Lei, QIN Yi-hong, et al. Structure and denitration performance of carbon-based catalysts prepared from Cu-BTC precursor[J]. Transactions of Nonferrous Metals Society of China, 2018, 28(5): 980-988.
[9] WANG Jian-cheng, CHEN Ying, TANG Lei, et al. One-step hydrothermal synthesis of Cu-SAPO-34/cordierite and its catalytic performance on NOx removal from diesel vehicles[J]. Transactions of Nonferrous Metals Society of China, 2013, 23(11): 3330-3336.
[10] 李立清, 吴绍康, 李海龙, 等. CeO2-TiO2催化剂低温协同控制燃煤 NOx与汞[J]. 中南大学学报(自然科学版), 2016, 47(3): 1049-1057.
[11] DONOVAN A P, BALU S U, PANAGIOTIS G S. TiO2-supported metal oxide catalysts for low-temperature selective catalytic reduction of NO with NH3: I Evaluation and characteirzation of first row transition metals[J]. Journal of Catalysis, 2004, 221(2): 421-431.
[12] 吴碧君, 刘晓勤, 肖 萍, 等. Mn-Fe/TiO2低温NH3选择性还原NO催化性能及其反应机制[J] . 中国电机工程学报, 2007, 27(17): 51-56.
[13] 付国友, 何汉兵, 张 丽, 等. Fe-Mn/ETS-10催化剂制备及其CO-SCR的脱硝性能[J]. 中国有色金属学报, 2020, 30(11): 2616-2626.
FU Guo-you, HE Han-bing, ZHANG Li, et al. Preparation of Fe-Mn/ETS-10 catalyst and its CO-SCR denitrification performance[J]. The Chinese Journal of Nonferrous Metals, 2020, 30(11): 2616-2626.
[14] WU Zhong-biao, JIANG Bo-qiong, LIU Yue. Effect of transition metals addition on the catalyst of manganese/ titania for low-temperature selective catalytic reduction of nitric oxide with ammonia[J]. Applied Catalysis, B. Environmental: An International Journal Devoted to Catalytic Science and Its Applications, 2008, 79(4): 347-355.
[15] 崔 晶, 黄华存, 董文华, 等. 脱硝性能V2O5-WO3- CeO2/TiO2催化剂的制备及其[J]. 化工环保, 2019, 39(2): 178-183.
[16] YANG Wei-wei, LIU Fu-dong, XIE Li-juan, et al. Effect of V2O5 Additive on the SO2 Resistance of a Fe2O3/AC Catalyst for NH3-SCR of NOx at Low Temperatures[J]. Industrial & Engineering Chemistry Research, 2016, 55(10): 2677-2685.
[17] 贾 勇, 张 松, 戴 波, 等. 负载型磷酸氧钒低温脱硝催化剂的制备及其抗硫抗水性能[J]. 环境工程学报, 2019, 13(1): 125-133.
[18] NAJJAR R, AWAD R, ABDELl-GABER A M. PHYSICAL. Properties of Mn2O3 nanoparticles synthesized by co-precipitation method at different pH values[J]. Journal of Superconductivity and Novel Magnetism, 2018, 32(4): 885-892.
[19] XIN Ying, LI Qian, ZHANG Zhao-liang. Zeolitic materials for de NOx selective catalytic reduction[J]. Chem Cat Chem, 2018, 10(1): 29-41.
[20] 孙克勤. 选择性催化还原脱硝的理论及实验研究[D]. 南京理工大学, 2007: 13-19.
[21] KANG M, PARK E D, KIM J M, et al. Manganese oxide catalysts for NOx reduction with NH3 at low temperatures[J]. Applied Catalysis A General, 2007, 327(2): 261-269.
[22] HAN Li-ying, DONG Li-hui, YAO Yan-yan, et al. Preparation and evaluation of copper manganese oxide as a high-efficiency catalyst for CO oxidation and NO reduction by CO[J]. Journal of Physical Chemistry C Nanomaterials & Interfaces, 2017, 121(23): 12757-12770.
[23] KAPTEIJN F, SINGOREDJO L, ANDREINI A, et al. Activity and selectivity of pure manganese oxides in the selective catalytic reduction of nitric oxides with ammonia[J]. Appl Catal B, 1994, 3(2/3): 173-189.
[24] TANG Xing-fu, LI Jun-hua, SUN Liang, et al. Origination of N2O from NO reduction by NH3 over β-MnO2 and α-Mn2O3[J]. Applied Catalysis B: Environmental, 2010, 99(1/2): 156-162.
[25] 杨 超, 刘小青, 黄碧纯, 等. Zr改性MnOx/MWCNTs催化剂的结构特征与低温SCR性能[J]. 物理化学学报, 2014, 30(10): 1895-1902.
[26] SALVI A M, GUASCITO M R, DEBONIS A, et al. Lithium intercalation on amorphous V2O5 thin film, obtained by r.f. deposition, using in situ sample transfer for XPS analysis[J]. Surface & Interface Analysis, 2010, 35(11): 897-905.
[27] EBERHARDT M A, PROCTOR, HOUALLA, et al. Investigation of V oxidation states in reduced V/Al2O3 catalysts by XPS[J]. Journal of Catalysis, 1996, 160(1): 27-34.
[28] ZHU Zhen-ping, LIU Zhen-yu, NIU Hong-xian, et al. Promoting effect of SO2 on activated carbon-supported vanadia catalyst for NO reduction by NH3 at low temperatures[J]. Journal of Catalysis, 1999, 187(1): 21-23.
[29] 方朝君, 闫常峰, 余美玲. 同时脱硫脱硝技术的应用与发展现状[C]// 中国化工学会年会暨石油补充与替代能源开发利用技术论坛. 中国化工学会, 2010: 17-26.
Preparation of Vx-Mn0.8Fe0.2O2 catalyst and its anti-sulfur denitration performance
HE Han-bing1, 2, 3, ZHANG Ye-lin1, ZENG Jing1, ZHANG Li1, ZHENG Ya-jie1, MA Ying4
(1. School of Metallurgy and Environment, Central South University, Changsha 410083, China;
2. National Key Laboratory of Environmental Protection Mining and Metallurgy Resources Utilization and Pollution Control, Wuhan University of Science and Technology, Wuhan 430081, China;
3. Key Laboratory of Metallurgical Emission Reduction & Resources Recycling (Anhui University of Technology), Ministry of Education, Ma’anshan 243002, China;
4. Yongqing Environmental Protection Co., Ltd., Changsha 410001, China)
Abstract: In order to better adapt to the needs of industrial denitration, this paper selected cheap ferrous metals Mn and Fe as the main raw materials of the catalyst, and greatly improved the low temperature denitration performance and sulfur resistance performance of ferromanganese catalyst by doping V. In this paper, Vx-Mn0.8Fe0.2O2 catalyst was prepared by co-precipitation method. X-ray diffraction (XRD), scanning electron microscopy (SEM) and X-ray photoelectron spectroscopy (XPS) were used to investigate the effects of V2O5 supplemental amount on the structure, morphology and anti-sulfur denitration performance of Mn0.8Fe0.2O2 catalyst. The results show that the main phase of Vx-Mn0.8Fe0.2O2 catalyst is Mn2O3, which has good homogeneity and fine particles. V0.3-Mn0.8Fe0.2O2 catalyst has more performance sites and better anti-sulfur denitration performance. The denitration rate can reach 90.36% at 300 ℃, which is about 100 ℃ lower than the temperature when the denitration performance of Mn0.8Fe0.2O2 catalyst reaches 90%. At the same time, under the reaction condition of CO:NO:SO2 is 3:1:1, the denitration rate of the catalyst can still keep above 80%.
Key words: ferromanganese catalyst; V2O5 doping; catalytic denitration; CO-SCR; NO
Foundation item: Project(2017GK4010) supported the Hunan Province’s Scientific Technology Project of Strategic Emerging Industries and Major Achievement Transformation in 2017; Projects (2019JJ40378, 2020JJ4685) supported by the Hunan Province Natural Science Foundation; Project(HB201908) supported by the Open Foundation of State Environmental Protection Key Laboratory of Mineral Metallurgical Resources Utilization and Pollution Control; Project(JKF20-02) supported by the Open Foundation of Key Laboratory of Metallurgical Emission Reduction & Resources Recycling
Received date: 2021-03-16; Accepted date: 2021-08-02
Corresponding author: ZENG Jing; Tel: 15116335400; E-mail: zengjing@csu.edu.cn
(编辑 )
基金项目:湖南省战略性新兴产业科技攻关与重大科技成果转化资助项目(2017GK4010);湖南省自然科学基金资助项目(2019JJ40378,2020JJ4685);国家环境保护矿冶资源利用与污染控制重点实验室开放基金课题资助(HB201908);冶金减排与资源综合利用教育部重点实验室开放基金项目(JKF20-02)
收稿日期:2021-03-16;修订日期:2021-08-02
通信作者:曾 婧,副教授,博士;电话:15116335400;E-mail:zengjing@csu.edu.cn