文章编号:1004-0609(2013)07-2026-07
钴和镍协同萃取分离研究进展
李晓晖,黄松涛,温建康,周桂英
(北京有色金属研究总院 生物冶金国家工程实验室,北京 100088)
摘要:综述1990以来国内外采用协同萃取方法从复杂溶液中分离钴和镍的研究现状。将钴和镍协萃体系分为螯合萃取剂-有机酸体系、有机磷酸类混合体系、吡啶羧酸酯-有机酸类体系和胺类-有机酸类体系4类,分别介绍这些协萃体系对钴、镍及其他金属离子的分离情况及萃取机理,对相同类型的体系进行比较,分析各协萃体系的分离特点,并提出运用协萃体系需要进一步解决的问题。
关键词:钴;镍;协同萃取;分离
中图分类号:TF111.3 文献标志码:A
Research progress of synergistic solvent extraction of cobalt and nickel
LI Xiao-hui, HUANG Song-tao, WEN Jian-kang, ZHOU Gui-ying
(National Engineering Laboratory of Bio-hydrometallurgy,
General Research Institute for Nonferrous Metals, Beijing 100088, China)
Abstract: The synergistic solvent extraction of cobalt and nickel from complex solution at home and abroad was summarized since the 1990s. The system of synergistic extraction is divided into four categories, including chelating extractant and organic acid, organophosphorous class of hybrid, pyridinecarboxylate esters and organic acids, and amines and organic acids. The separation and extraction mechanisms of different extraction systems were introduced, respectively. And the characteristics of synergistic extraction were analyzed by comparing the same synergistic extraction system. Finally, some problems about the synergistic extraction system that should be further studied were proposed.
Key words: cobalt; nickel; synergistic solvent extraction; separation
钴和镍在工业中占据着重要地位,主要应用于航空、航天、电子和电池等领域。随着国民经济的增长,钴和镍的消费量迅速增长,而钴和镍资源日益枯竭,低品位的钴、镍氧化矿和硫化矿逐渐被开采,这种矿石宜采用湿法冶金工艺处理。近年来,低品位矿的湿法冶金技术得到了很大的发展,特别是生物浸出技术和各种组合的溶剂萃取工艺。生物浸出液中成分复杂,钴和镍含量很低,酸度和其他金属离子含量均很高,这种浸出液分离起来比较困难。通常,溶液中与钴和镍共存的金属离子有铁、铜、锌、锰、铝、钙和镁等,在工业实践中,制定钴和镍分离方案时,必须顾及这些金属离子的分离。一般采用化学沉淀法[1]、溶剂萃取法[2]和双水相萃取[3]等方法分离钴和镍,因溶剂萃取法[4]具选择性好、回收率高、流程简单和操作连续化等优点,已成为钴和镍等金属离子分离的主要方法。目前,广泛应用于钴和镍分离的萃取剂有:磷酸类萃取剂(如P204、P507和Cyanex 272等)、胺类萃取剂和螯合萃取剂等。对于复杂浸出液,仅采用单一萃取体系对钴、镍与其他金属离子的分离效果较差。1958年,BROWN等[5]发现了协同效应,采用协萃体系可提高萃取剂的可选性、萃取性以及金属离子的萃取率。之后,广大研究者对此进行了广泛深入的研究,本文作者总结了1990年以来国内外应用协同萃取从复杂溶液中分离钴和镍的研究进展,将钴和镍协萃体系分类并分析和比较其萃取机理。
1 钴、镍协萃体系
根据大量关于钴、镍协萃的文献报道[6],将钴、镍协萃体系分为4种类型:螯合萃取剂-有机酸体系、有机磷酸类-有机磷酸体系、吡啶羧酸酯-有机酸类体系和胺类-有机酸类体系。这里,本文作者对这4种协萃体系的萃取情况以及萃取机理进行详细介绍。
1.1 螯合萃取剂-有机酸体系
1.1.1 有机磷酸类-羟肟体系
螯合羟肟萃取剂与有机磷酸混合有机相对钴和镍表现出很强的协同效应,如LIX 63+P204、LIX 63+P507等体系明显增大了钴和镍的分离系数[7]。CHENG等[8-9]采用LIX 84+Cyanex 272体系从钴、镍溶液中分离出铜、铁和锌,铜、铁和锌与钴、镍的分离系数达到3×105,其中,100% Fe和超过97%(Cu+Zn)(质量分数)进入有机相,共萃取的钴、镍含量低于2.5%,达到了很好的分离效果。TANAKA等[10]采用有机磷酸(P204、P507和Cyanex 272)+羟基肟(LIX 63和LIX 860)协萃体系从Ni-P合金酸性电解液中回收镍,并对各协萃体系分离系数由大到小进行排序如下:P204+LIX 63、P507+LIX 63、Cyanex 272+LIX 63、P204+LIX 860。
以LIX63和有机磷酸协萃体系为例,对有机磷酸类-羟肟体系中镍的萃取机理进行分析[11],如式(1)所示,可以认为是LIX 63置换出镍与有机磷酸(HR)萃合物中的酸或水。镍萃合物中所含的水分子被LIX 63所取代,所形成配合物的亲水性降低,稳定性增加,从而增大了镍的萃取率。
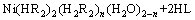

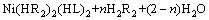 (1)
(1)
对于钴的萃取[11],如式(2)所示,萃合物Co(HR2)2与LIX 63相互作用,配位数由4增加到6,使得钴配合物的结构由原来的四面体转变为八面体,萃合物的稳定性增强,钴的萃取率增加。
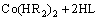

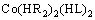 (2)
(2)
1.1.2 磺酸萃取剂-羟肟体系
铁、钴和镍同属第3周期第8族,铁失去3个电子后外层电子构型为3d5,呈半充满结构,而Co2+和Ni2+的外层电子结构分别为3d7和3d8,因此,Fe3+通常会优先与萃取剂形成配合物,并且形成配合物很稳定,反萃取相当困难[12]。然而,采用DNNSA和LIX 63协萃体系分离钴、镍和铁由易到难的顺序为Ni2+、 Fe3+、Co2+,该协同萃取体系改变了铁和镍的萃取顺序,可从含铁和钴的溶液中优先分离镍[13]。
该协萃体系中镍的萃取是由于磺酸盐在非极性有机溶剂中形成反胶束,反胶束可由单一磺酸基组成,也可由磺酸、羟肟(HL)与镍或钴混合组成,并测得镍或钴、羟肟(HL)与磺酸组成(摩尔比)为n(M2+):n(HL):n(DNNSA)=1:3:2。反胶束的形成导致反应物界面浓度增加,催化了萃取过程。该协同萃取还可以在低pH值下进行,由于LIX 63与Ni2+的螯合反应未经历去质子过程[13]。
1.1.3 羧酸萃取剂-羟肟体系
与磷酸类萃取剂相似,螯合萃取剂与羧酸类萃取剂混合后,对钴和镍同样产生正协同效应。JONES等[14]采用Versatic 10+LIX 63体系从含有镍、锰、钙和镁的溶液中分离钴,经一次萃取,钴的萃取率超过96%,共萃取的镍为10%,残余液中Ni2+与Co2+的质量比大于667,钴和镍的分离效果较好,主要由于钴和镍萃取和反萃机理有较大的差异,从而达到了分离的目的[15]。
如前所述,浸出液中有Fe3+存在时对钴和镍的分离影响很大。对于Co2+、Ni2+和Fe3+共存的溶液, FLETT等[16]提出用α-羟基肟和羧酸组成的体系分离出镍,该体系的特点是Ni2+可以在Fe3+之前优先被萃取,存在的问题是镍和钴的分离效果较差,Ni2+和Co2+的分离系数为50,并且在萃取过程中镍的萃取速率很慢,这是在萃取过程中含镍正己烷溶液中月桂酸的界面张力快速下降所致。
除Fe3+之外,浸出液中的其他金属离子,如锌和铜等,也会对钴和镍的分离产生影响。CHENG[17]采用Versatic 10+LIX 63混合有机相来分离钴、镍和锌、铜。萃取过程中发现Ni2+的萃取速率很慢,萃取反应10 min后,Ni2+的萃取率才达到86%。FLETT等[16, 18]在LIX 63+羧酸协萃体系萃镍的研究中也发现了同样的问题。研究认为,这两种协萃体系中镍萃合物表面张力的下降是导致镍萃取速率变慢的主要原因。Versatic 10+LIX 63体系中还存在钴反萃速率很慢的问题,但在混合有机相中加入TBP后,反萃速率大大提高,达到了工业化应用要求。
在钴、镍硫化矿或氧化矿中还含有大量钙、镁和锰等元素,这些元素一般以碳酸盐、硅酸盐等形式存在,在酸浸或生物浸出过程中会随钴和镍一起浸出,所以,钴、镍与锰、钙和镁离子的分离也是一个需要解决的问题。CHENG等[17, 19-20]研究了Versatic 10+4PC、Versatic 10+LIX 63+TBP与LIX 1104+ Versatic 10体系对钴、镍与锰、钙和镁离子的分离。其中,LIX 1104+Versatic 10体系呈现反协同作用。另外两种体系对钴、镍与锰、钙和镁离子的分离均表现为正协同作用,对比分析这两种体系的分离效果(表1)[21]可知,最佳混合有机相为0.5 mol/L Versatic 10+0.45 mol/L LIX 63+1 mol/L TBP体系中镍、钴与锰的分离系数明显大于0.5 mol/L Versatic 10+1.0 mol/L 4PC体系中镍、钴与锰的分离系数。两种协萃体系中钴和镍的萃取率相当,但是Versatic 10+4PC体系有机相中杂质离子的含量明显高于Versatic 10+LIX 63+ TBP体系中杂质离子的含量。Versatic 10+LIX 63+TBP混合有机相中的锰很容易洗涤除去,洗涤后锰含量仅为0.8 mg/L,然而,在Versatic 10+4PC体系中锰很难洗涤除去,而且锰的反萃速率也很慢,主要由于4PC中的杂质催化了Mn2+向Mn3+的氧化。相比较Versatic 10+LIX 63+TBP的萃取分离效果最好,因此对其进行了半连续和全连续实验[22]。
表1 Versatic 10、Versatic 10+4PC与Versatic 10+LIX 63+ TBP协萃体系中分离系数b(Ni-Mn)与b(Co-Mn)值[21]
Table 1 b(Ni-Mn) and b(Co-Mn) values of metals with Versatic 10, Versatic 10+4PC and Versatic 10+LIX 63+TBP[21]

对于羧酸萃取剂-羟肟协萃体系对钴和镍的萃取机理,以Versatic 10+LIX 63协萃体系对钴和镍的萃取为例[17],钴、镍萃合物均为八面体结构,可能形成配合物的形式有Ni(Ox)2(RH)2(H2O)2、Ni(Ox)2(RH)4、CoR2(Ox)2(H2O)2和CoR2(Ox)4等几种,式中:Ox代表螯合萃取剂,RH代表羧酸。体系中钴、镍形成配合物的形式不同,由于协萃体系中镍主要与LIX 63结合,而钴主要与Versatic 10结合,LIX 63和Versatic 10又分别作为另外一种金属离子的协萃剂。
CHENG等[23]对LIX 63+Versatic 10协萃体系以及LIX 63和Versatic 10与有机酸类或吡啶羧酸酯类萃取剂的协萃作用进行了大量的研究工作,并取得了丰硕的研究成果。
1.2 有机磷酸-有机磷酸萃取体系
采用有机磷酸类混合萃取体系分离钴和镍的研究比较多。目前,广泛应用于钴和镍分离的磷酸类萃取剂主要有P204、P507、Cyanex 272和Cyanex 301等。其中,Cyanex 272、Cyanex 301和Cyanex 302对钴和镍的分离效果优于P204和P507的,但是Cyanex 272、Cyanex 301和Cyanex 302的价格比P204、P507的高得多,考虑经济以及萃取性能两方面,不少研究者开展了有机磷酸类混合体系对钴和镍分离效果的研究。
一般在镍电解液中常含有一定量的钴,而钴和镍的分离是镍电解精炼中的技术难题,为了得到高纯镍或高纯钴电解液,需要开发在宽pH范围内分离钴和镍的协萃方法。王胜等[24]采用P507+P204协萃体系分离镍电解液中的钴。该协萃体系萃取钴和镍的pH范围变宽,并且对分离高镍低钴溶液有一定的效果。P507+P204协萃体系不仅应用于钴和镍的分离,而且也能应用于其他金属离子的分离[25]。
锂离子电池在各类电子产品中被广泛使用,随之带来了大量的电池废弃物,一般处理方法是用硫酸将其溶解,再回收其中Co2+、Mn2+和Cu2+等有价金属离子。ZHAO等[26-27]分别采用Cyanex 272+P507混合有机相分离溶液中的Co2+、Mn2+以及其他金属离子。研究表明,Cyanex 272+P507协萃体系对Co2+、Mn2+和Cu2+分离能力大大提高,但与单独萃取体系相比萃取率并不是最高。同样,Cyanex 272+P204体系对钴和锰的分离也显示出很强的协同作用[28],VCyanex 272: VP204=3:2、pH=4.95时,Co2+和Mn2+的最大协萃系数Rmax分别为3.48和4.12。在协萃体系中加入EDTA后,Mn2+和Co2+的分离系数提高了两个数量级,该体系形成配合物的形式为MH3A2L3(M为Co2+或Mn2+)。
DARVISHI等[28]研究了Cyanex 272+Cyanex 302与P204混合体系对钴和镍的分离。研究认为,通过降低P204与Cyanex 272或Cyanex 302的摩尔比可以提高钴和镍的分离能力。
综合分析磷酸类萃取剂与金属离子的萃取机理,得出磷酸类萃取体系与金属离子发生反应的通式为


 (3)
(3)
式中:M2+代表金属离子;R和R′代表磷酸类萃取剂。
以P204+Cyanex 302协萃体系对钴和镍的萃取为例[28],萃取反应式为


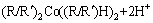 (4)
(4)


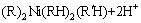 (5)
(5)
P204+Cyanex 302协萃体系萃取钴的化学计量系数为4,萃取镍的化学计量系数为5,P204+Cyanex 272协萃体系对钴和镍萃取化学计量系数均为4。该协萃体系中钴和镍萃取机理与TAIT[29]和PRESTON[30]的研究结果基本一致。TAIT[29]研究发现,用P204单独萃取钴和镍时,萃取反应化学计量系数都为4,分别用Cyanex 272[29]和Cyanex 302[30]单独萃取钴和镍时,萃取反应化学计量数分别为4和6。对比单独萃取与协同萃取反应机理,发现协萃体系中金属离子分离系数的增大,是由于协萃体系中配合物形式发生了变化。
对于酸性浸出液,pH一般小于2;但对于单一萃取体系,一般适合于钴和镍分离的平衡pH范围为3~5,如果在分离钴和镍前先用碱调节浸出液pH至适合钴和镍分离的酸度条件,在整个生产流程中需要消耗大量的酸和碱,增加了中和成本,这就要求有一种新的萃取剂或协萃体系,能够在低pH下将钴和镍直接分离。RAMACHANDRA等[31-32]采用P204+Cynex 471X协同萃取体系分离低pH溶液中的钴、镍以及镍、铬,均达到了很好的分离效果。在分离钴和镍时,平衡时pH值为1.1,钴和镍的分离系数达到12 245,实现了低pH下钴和镍的高效分离;在分离镉和镍时,分离系数达到1 085,远远超过P204单独分离镉和镍时的分离系数(369)。一般认为,金属离子的分离系数达到1 000以上时,金属离子的分离效果较好。此外,也有应用P204+含硫磷酸萃取剂体系分离其他金属离子的报道[33]。
1.3 吡啶羧酸酯-有机酸类体系
吡啶羧酸酯可以作为氮给体与有机酸一起产生协同萃取效应。PRESTON等[34]采用Versatic 10+4-(5-壬基)吡啶混合有机相分离红土镍矿浸出液中镍和钙。该混合有机相对二价金属离子协萃作用由强到弱的顺序如下(括号内数字为pH50值):Cu(3.16)、Ni(4.73)、Zn(4.94)、Co(5.41)、Fe(5.65)、Mn(6.45)、Ca(7.96)、Mg(8.43)。另外,PREEZ等[35]采用Versatic 10和Mintek协萃剂+CLX50从含有钙、镁和锰的溶液中分离钴和镍时,二价金属离子的协萃顺序与Versatic 10+4-(5-壬基)吡啶混合体系相同,只是金属离子分离能力差异较大。以镍和钙的分离为例,Versatic 10+4-(5-壬基)吡啶体系对镍和钙分离的ΔpH50(Ni-Ca)为3.48,Versatic 10+Mintek协萃剂与Versatic 10+CLX50体系中ΔpH50(Ni-Ca)值分别为3.09和2.36,Versatic 10+4-(5-壬基)吡啶体系的分离效果较好。Versatic 10+4-(5-壬基)吡啶协萃体系中ΔpH50(Ni-Ca)的增加主要由于协萃体系中形成配合物的形式发生变化,形成配合物形式变为MA2Lx。而单独羧酸与金属离子(以Ca2+为例)形成配合物的形式为CaA2(HA)4,协萃体系中L替代了HA,明显削弱了HA作为溶剂化配体的能力,使得镍和钙的分离能力提高,式中:HA代表Versatic 10;L代表4-(5-壬基)吡啶。
另外,CHENG等[36-39]采用Versatic 10酸+癸-4-吡啶甲酸酯协萃体系几乎完全将Ni2+、Co2+、Cu2+和Zn2+从含Mn2+、Mg2+和Ca2+的溶液中分离出来,但由于癸-4-吡啶甲酸酯没有得到商业化应用,因此,该协萃体系在镍生产过程中也很难实现工业化应用。
1.4 胺类-有机酸类体系
BOURGET等[40]采用Cyanex 301与Primene JMT/Amberlite LA-2/Alamine 336/Aliquat 336组成协萃体系,来提高Cyanex 301负荷钴和镍萃合物的反萃率。采用Cyanex 301与Primene JMT+Amberlite LA-2+Alamine 336+Aliquat 336组成协萃体系和单独Cyanex 301体系进行萃取和反萃取实验,得到钴和镍萃取率由小到大的顺序为Cyanex 301+Amberlite LA-2、Cyanex 301+Alamine 336、Cyanex 301+Aliquat 336、Cyanex 301+Primene JMT、Cyanex 301。
钴和镍反萃率由小到大的顺序为Cyanex 301、Cyanex 301+Alamine 336~Cyanex 301+Amberlite LA-2、Cyanex 301+Primene JMT、Cyanex 301+Aliquat 336。
各种协萃体系对钴和镍的萃取率均低于单独Cyanex 301萃取钴和镍时的萃取率,但4种协萃体系中负荷钴和镍的反萃率均有所改善。用Cyanex 301单独萃取钴和镍时,钴和镍的萃取率分别为99.2%和100%,反萃率分别为76.1%和3.9%,钴和镍的反萃率不高。综合考虑4种协萃体系中钴和镍的萃取率与反萃率,10% Cyanex 301+5% Aliquat 336体系的协萃性能最优,该体系对钴和镍的萃取率分别为97.7%和99.3%,反萃效果也比较好,钴反萃完全,镍的反萃率也达到52.2%。
对其机理进行分析,认为反萃性能的提高可能与Aliquat 336和Cyanex 301之间的相互作用有关。Aliquat 336和Cyanex 301之间的相互作用会降低Cyanex 301与金属离子形成配合物的机会,可以表示为
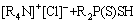

 (6)
(6)
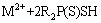

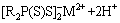 (7)
(7)
式中:[R4N]+[Cl]-和R2P(S)SH分别代表Aliquat 336和Cyanex 301;M2+代表金属离子。
2 钴、镍协萃体系研究现状及存在的问题
很多研究者对采用协萃体系分离金属离子已进行了大量的研究工作,但仍有很多问题急需进一步解决。例如,对于有机磷酸类加羟肟协萃体系,该协萃体系与单一P204萃取体系相比,形成钴和镍的萃合物稳定性大大增强,这就导致钴和镍的反萃取速率变慢,反萃取过程中需要很高浓度的酸才能反萃完全。另外,螯合萃取剂LIX 63在强酸性条件下很容易降解,这一难点始终没有从根本上得到解决,所以该体系仍未实现工业化应用。
采用协萃方法将铁、钴和镍三者分离,这项研究难度很大。三价铁外层电子构型决定了Fe3+在溶液中的活性,它通常优先与萃取剂形成很稳定的配合物[12-13]。DNNSA和LIX 63的混合有机相对铁、镍和钴具有协萃作用[14],但是,DNNSA是一种表面活性物质,容易产生乳化,不易分相。采用α-羟基肟和羧酸组成的体系[12]分离出镍、钴和铁,Ni2+可在Fe3+之前被萃取,但协萃体系中镍的萃取速率很慢。在采用协萃体系分离金属离子时,萃取分相、萃取动力学、反萃和萃取剂降解等问题制约着该体系的工业化应用。
酸性浸出液或生物浸出液此类复杂溶液体系的分离较困难,对分离技术的要求也越来越高,因此,需要开发新的协萃体系,对杂质离子有抑萃作用,能从较高酸度溶液中直接分离钴和镍。
对于协萃体系机理,目前大部分研究工作仍处在宏观测试及分析阶段,没有深入到微观,不能很好地分析金属离子与混合有机体系相互作用的实质过程,对复杂体系中协萃机理以及有机相与金属离子的协萃过程仍不清楚。
3 结语
综述4种类型协萃体系的研究进展,这些协萃体系均能够很好地实现金属离子的分离,从实验结果分析金属离子之间的分离效果良好,并且某些协萃体系(例如:Versatic 10+LIX 63+TBP体系)还经过连续性试验,得到了很好的分离效果。但至今没有实现工业化,主要是一些生产实践方面的因素制约着其应用,例如,生产过程中要求协萃体系萃取分相速度快、不易乳化和易于反萃等。这就要求进一步开发协萃体系的应用。另外,需要开发新的萃取剂或协萃体系以满足于复杂溶液中金属离子的分离,并加强理论研究,了解复杂体系中有机相与金属离子的相互作用过程。
REFERENCES
[1] 刘三平, 王海北, 蒋开喜, 王玉芳. 钴提取分离技术分析与应用[J]. 有色金属, 2004, 56(2): 73-76.
LIU San-ping, WANG Hai-bei, JIANG Kai-xi, WANG Yu-fang. Cobalt separation technologies and their application to scrap treatment[J]. Nonferrous Metals, 2004, 56(2): 73-76.
[2] 诸爱士, 徐 亮, 沈芬芳, 成 忠. 钴与镍的分离技术研究综述[J]. 浙江科技学院学报, 2007, 19(3): 169-174.
ZHU Ai-shi, XU Liang, SHEN Fen-fang, CHENG Zhong. Review of separation technology study of cobalt and nickel[J]. Journal of Zhejiang University of Science and Technology, 2007, 19(3): 169-174.
[3] PAMELA D R, MAIBY C M, LUIS HENRIQUE MENDES D S, MARIA C H D S. Application of aqueous two-phase systems for the development of a new method of cobalt(II), iron(III) and nickel(II) extraction: A green chemistry approach[J]. J Hazard Mater, 2011, 193: 311-318.
[4] ZHANG X J, LI X G, CAO H B, ZHANG Y. Separation of copper, iron (III), zinc and nickel from nitrate solution by solvent extraction using LK-C2[J]. Sep Purif Technol, 2010, 70: 306-313.
[5] BROWN K B, COLEMAN C F, CROUSE D J, BLAKE C A, RYON A D. Solvent extraction processing of uranium and thorium ores[C]//Proceedings of the Second United Nations International Conference on the Peaceful Uses of Atomic Energy. Tennessee, 1958: 473-494.
[6] 马荣骏. 萃取冶金[M]. 北京: 冶金工业出版社, 2009.
MA Rong-jun. Extraction metallurgy[M]. Beijing: Metallurgical Industry Press, 2009.
[7] 张平伟, 朱 屯. 钴镍协同萃取体系[J]. 化工冶金, 1997, 18(3): 282-288.
ZHANG Ping-wei, ZHU Tun. Synergistic systems of solvent extraction of cobalt and nickel[J]. Engineering Chemistry and Metallurgy, 1997, 18(3): 282-288.
[8] CHENG C Y, ZHANG W S, RODRIGUEZ M. Separation of copper, iron and zinc from cobalt and nickel in mineral process liquor by synergistic solvent extraction: Pilot plant operation[C]//Proceedings of ALTA 2007 Nickel/Cobalt. Perth: ALTA Metallurgical Services, 2007: 1-11.
[9] ZHANG W S, CHENG C Y, RODRIGUEZ M, PRANOLO Y. Separation of copper, iron and zinc from cobalt and nickel with mixed CYANEX 272 and LIX 84 extractants[C]//Proceedings of International Solvent Extraction Conference ISEC 2008. Montreal: Canadian Institute of Mining, Metallurgy and Petroleum, 2008: 177-182.
[10] TANAKA M, MARUYAMA M, SATO Y. Solvent extraction recovery of nickel from spent electroless nickel plating baths using mixtures of organophosphorus acids and hydroxyoximes[J]. Solvent Extr Res Dev Japan, 2003, 10: 51-63.
[11] 汪家鼎, 陈家镛. 溶剂萃取手册[M]. 北京: 化工工业出版社, 2001: 123-124.
WANG Jia-ding, CHEN Jia-yong. Solvent extraction manual[M]. Beijing: Chemical Industry Press, 2001: 123-124.
[12] 孙为银. 配位化学[M]. 北京: 化学工业出版社, 2004: 87-88.
SUN Wei-yin. Coordination chemistry[M]. Beijing: Chemical Industry Press, 2004: 87-88.
[13] OTU E O, WESTLAND A D. Solvent extraction with sulphonic acids[J]. Solvent Extr Ion Exch, 1991, 9(5): 875-883.
[14] JONES D, MAYHEW K, MCCOY T, CHENG C Y, BARNARD K R, ZHANG W S. A process to separate cobalt from nickel[C]//Proceedings of ALTA 2010 Nickel/Cobalt/Copper. Melbourne: ALTA Metallurgical Services, 2010: 1-9.
[15] MAYHEW K, MCCOY T, JONES D, BARNARD K R, CHENG C Y, ZHANG W S, ROBINSON D. Kinetic separation of Co from Ni, Mg, Mn and Ca via synergistic solvent extraction[J]. Solvent Extr Ion Exch, 2011, 29(5/6): 755-781.
[16] FLETT D S, WEST D W. Extraction of metal ions by LIX 63/carboxylic acid mixtures[D]//Proceedings of ISEC’71. London: Society of Chemical Industry, 1971: 214-223.
[17] CHENG C Y. Solvent extraction of nickel and cobalt with synergistic systems consisting of carboxylic acid and aliphatic hydroxyoxime[J]. Hydrometallurgy, 2006, 84: 109-117.
[18] FLETT D S, COX M, HEELS J D. Extraction of nickel by α hydroxy oxime/lauric acid mixtures[J]. Society of Chemical Industry, 1974, 74(3): 2560-2575.
[19] CHENG C Y, HOUCHIN M. Solvent extraction process for recovering nickel and cobalt from leach solutions: Australian, PCT/AU01/01161[P]. 2002-02-28.
[20] ZHANG W S, PRANOLO Y, URBANI M, CHENG C Y. Extraction and separation of nickel and cobalt with hydroxamic acids LIX 1104, LIX
1104, LIX 1104SM and the mixture of LIX
1104SM and the mixture of LIX 1104 and Versatic 10[J]. Hydrometallurgy, 2012, 119/120: 67-72.
1104 and Versatic 10[J]. Hydrometallurgy, 2012, 119/120: 67-72.
[21] CHENG C Y, BODDY G, ZHANG W S, GODFREY M, ROBINSON D J , PRANOLO Y, ZHU Z, ZENG L, WANG W. Recovery of nickel and cobalt from laterite leach solutions using direct solvent extraction: Part 1—Selection of a synergistic SX system[J]. Hydrometallurgy, 2010, 104: 45-52.
[22] CHENG C Y, BODDY G, ZHANG W S, GODFREY M, ROBINSON D J, PRANOLO Y, ZHU Z, ZENG L, WANG W. Recovery of nickel and cobalt from laterite leach solutions using direct solvent extraction: Part 2—Semi- and fully-continuous tests[J]. Hydrometallurgy, 2010, 104: 53-60.
[23] CHENG C Y, BARNARD K R, ZHANG W S, ROBINSON D J. Synergistic solvent extraction of nickel and cobalt: A review of recent developments[J]. Solvent Extr Ion Exch, 2011, 29(5/6): 719-754.
[24] 王 胜, 王玉棉, 赵燕春, 郭鹏成. P507-P204协同萃取分离镍钴[J]. 有色金属, 2010, 62(3): 65-68.
WANG Sheng, WANG Yu-mian, ZHAO Chun-yan, GUO Peng-cheng. Extracting separation of cobalt from nickel with synergistic extraction[J]. Nonferrous Metals, 2010, 62(3): 65-68.
[25] NAYAK D, LAHIRI S, DAS N R. Synergistic extraction of neodymium and carrier-free promethium by the mixture of HDEHP and PC88A[J]. J Radioanal Nucl Chem, 1999, 210(2): 555-560.
[26] ZHAO J M, SHEN X Y, DEGN F L, WANG F C, WU Y, LIU H Z. Synergistic extraction and separation of valuable metals from waste cathodic material of lithium ion batteries using Cyanex 272 and PC-88A[J]. Sep Purif Technol, 2011, 78(3): 345-351.
[27] WANG F C, HE F H, ZHAO J M, SUI N, XU L, LIU H Z. Extraction and separation of cobalt(II), copper(II) and manganese(II) by cyanex 272, PC-88A and their mixtures[J]. Sep Purif Technol, 2012, 93: 8-14.
[28] DARVISHI D, HAGHSHENAS D F, KESHAVAR Z A E, SADRNEZHAAD S K, HALALI M. Synergistic effect of Cyanex 272 and Cyanex 302 on separation of cobalt and nickel by D2EHPA[J]. Hydrometallurgy, 2005, 77: 227-238.
[29] TAIT B K. Cobalt-nickel separation: The extraction of cobalt(II) and nickel(II) by Cyanex 301, Cyanex 302 and Cyanex 272[J]. Hydrometallurgy, 1993, 32(3): 365-372.
[30] PRESTON J S. Solvent extraction of cobalt and nickel by organophosphorus acids[J]. Hydrometallurgy, 1982, 9(2): 115-133.
[31] RAMACHANDRA R B, VENKATESWARA R S, KYUNG H P. Solvent extraction separation and recovery of cobalt and nickel from sulphate medium using mixtures of TOPS 99 and TIBPS extractants[J]. Miner Eng, 2009, 22: 500-505.
[32] RAMACHANDRA R B, VENKATESWARA R S, NEELA P D. Selective separation and recovery of divalent Cd and Ni from sulphate solutions with mixtures of TOPS 99 and Cyanex 471X[J]. Sep Purif Technol, 2008, 59(2): 214-220.
[33] 许启初, 张利兴, 杨裕生. 二(2-乙基己基)二硫代磷酸对镅和稀土元素协同萃取的研究[J]. 核技术, 2004, 27(7): 547-550.
XU Qi-chu, ZHANG Li-xing, YANG Yu-sheng. Extraction of Am3+ and rare earths by DEHDTP combined with TOPO, DPPHEN and TOPS[J]. Nuclear Techniques, 2004, 27(7): 547-550.
[34] PRESTON J S, du PREEZ A C. Separation of nickel and calcium by solvent extraction using mixtures of carboxylic acids and alkylpyridines[J]. Hydrometallurgy, 2000, 58: 239-250.
[35] du PREEZ A C, PRESTON J S. Separation of nickel and cobalt from calcium, magnesium and manganese by solvent extraction with synergistic mixtures of carboxylic acids[J]. Journal of the South African Institute of Mining and Metallurgy, 2004, 104(7): 333-338.
[36] CHENG C Y. SX applications for nickel and cobalt: Pros and cons of existing processes and possible future developments[C]//Proceedings of ALTA SX/IX World Summit. Melbourne: ALTA Metallurgical, 2003: 1-27.
[37] CHENG C Y, URBANI M D. Purification of laterite leach solutions by direct solvent extraction[C]// Proceedings of Yazawa International Symposium on Metallurgical and Materials Processing: Principles and Technologies. Warrendale: The Minerals, Metals and Materials Society, 2003: 251-265.
[38] CHENG C Y, URBANI M D, HOUCHIN M. Synergistic solvent extraction and its potential application to nickel and cobalt recovery[C]//Hydrometallurgy 2003—Fifth International Conference in Honour of Professor Ian Ritchie. Warrendale: The Minerals, Metals and Materials Society, 2003: 787-800.
[39] CHENG C Y, URBANI M D, HOUCHIN M. Manganese separation by solvent extraction in nickel laterite processing[C]//Proceedings of International Laterite Nickel Symposium 2004. Warrendale: The Minerals, Metals and Materials Society, 2004: 429-447.
[40] BOURGET C, JAKOVLJEVIC B, NUCCIARONE D. CYANEX 301 binary extractant systems in cobalt/nickel recovery from acidic sulphate solutions[J]. Hydrometallurgy, 2005, 77: 203-218.
301 binary extractant systems in cobalt/nickel recovery from acidic sulphate solutions[J]. Hydrometallurgy, 2005, 77: 203-218.
(编辑 陈卫萍)
基金项目:国家重点基础研究发展计划资助项目(2010CB630906);国家高技术研究发展计划资助项目(2012AA061502)
收稿日期:2012-08-30;修订日期:2013-04-07
通信作者:周桂英,教授级高级工程师,博士;电话:010-82241006;E-mail:zhouguiying2001@163.com