相转移催化法合成4-羟甲基二苯甲酮
唐瑞仁,朱金娟,严子耳,罗一鸣
(中南大学 化学化工学院,湖南 长沙,410083)
摘要: 以4-甲基二苯甲酮为原料,经卤代、相转移催化水解反应合成有机中间体4-羟甲基二苯甲酮,并对其反应的工艺条件进行研究。研究结果表明:N-溴代丁二酰亚胺为较好的卤化剂,生成4-溴甲基二苯甲酮的产率为70.7%;4-溴甲基二苯甲酮以三乙基苄基氯化铵作相转移催化剂在碱性条件下水解,反应5 h后,目标化合物产率为84.4%;初产品用四氢呋喃重结晶后,最终产品纯度可达99%;经元素分析以及红外光谱、质谱和氢核磁共振谱表征,其结构为4-羟甲基二苯甲酮。
关键词: 相转移催化法; 4-羟甲基二苯甲酮; 质谱; 氢核磁共振谱
中图分类号:O625 文献标识码:A 文章编号: 1672-7207(2005)04-0594-05
Synthesis of 4-hrdroxymethylbenzophenone
by phase transfer catalytic method
TANG Rui-ren, ZHU Jin-juan, YAN Zi-er, LUO Yi-ming
(School of Chemistry and Chemical Engineering, Central South University, Changsha 410083, China)
Abstract: An important organic intermediate 4-hydroxymethylbenzophenone was synthesized by halogenation and hydrolyzation with phase transfer catalytic method using 4-methylbenzophenone as raw material and the technological conditions of reactions were investigated as well. The experimental results show that N-Bromosuccinimide(NBS) is a good halogention reagent to give 4-bromomethylbenzophenone undergoing a radical reaction with 4-methylbenzophenone with the yield of about 70.7%; 4-Bromomethylbenzophenone can be hydrolyzed under basic conditions in the presence of phase transfer catalyst triethylbenzylammonium chloride for 5 h to give 4-hydroxymethylbenzophenone with yield of 84.4%. After the crude product is recrystallized from tetrahydrofuran, the final product was obtained with purity above 99%. The structure of the titled compound is determined by infrared spectrum, proton nuclear magnetic resonance, mass spectrum and elemental analysis.
Key words: phase transfer catalytic method; 4-hydroxymethylbenzophenone; mass spectrum; nuclear magnetic resonance
二苯甲酮(BP)为典型的三重态光敏剂,同时又具有光化学活性,其衍生物的吸收光谱容易受环境的影响,可用作光化学探针材料来观察分子聚集时环境对光敏功能基团行为的影响[1]。近年来,二苯甲酮衍生物特别是分子中有活性化学基团的二苯甲酮类化合物作为光化学交联剂,取代常用的含迭氮基、重氮基和二嗪环基等基团的化合物,用于研究核[CM(22] 苷酸、酶和受体蛋白结构 [1-10]。4-羟甲基二苯甲酮是二苯甲酮的4-羟甲基化产物,具有羰基和羟基等活性基团,为一种具有广阔应用前景的二苯甲酮衍生物,其分子中的活性官能团被各种功能基团取代后可以合成一系列的二苯甲酮衍生物。例如,利用4-羟甲基二苯甲酮,可以合成一些新的紫外线吸收剂、光稳定剂、香料的定香剂以及光敏功能性表面活性剂。如J. E. Oatis等[2]利用4-羟甲基二苯甲酮为中间体合成了性能优良的光化学交联剂2-顺丁烯二酰亚胺基乙酸(4-苯甲酰基)苯甲酯。另一方面,在其分子中的活性基团羟基(-OH)上接上某些生物活性基团,也能合成农药方面的生理活性物质。目前,人们对4-羟甲基二苯甲酮的合成研究较少。在此,作者以市售4-甲基二苯甲酮为原料,用N-卤代丁二酰亚胺自由基卤代生成4-卤甲基二苯甲酮[11],研究相转移催化条件下碱性水解合成4-羟甲基二苯甲酮的工艺条件[12-14]。
1 实验部分
1.1 主要仪器和试剂
主要仪器为:XR-01型显微熔点仪(温度计未校正);AVATAR-360-FT型傅里叶红外光谱仪(IR,溴化钾压片);P230型高效液相色谱(HPLC)仪;INOVA-400 MHz型核磁共振谱(NMR)仪(CDCl3作溶剂), HP5988型气相色谱—质谱(GC-MS)联用仪,PE-2400型元素分析仪(EA)。
主要试剂为:4-甲基二苯甲酮,由湖南化工研究院提供;其余试剂均为分析纯试剂。
1.2 反应路线
以4-甲基二苯甲酮为原料合成4-羟甲基二苯甲酮的反应路线如图1所示。
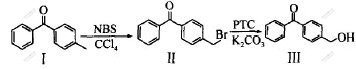
图 1 4-羟甲基二苯甲酮的合成路线
Fig. 1 Synthetic route for 4-hydroxymethylbenzophenone
1.3 4-溴甲基二苯甲酮的合成
将0.15 mol 4-甲基二苯甲酮、0.15 mol NXS (X为Cl, Br, I) 以及2.9 mmol过氧化苯甲酰和300 mL四氯化碳加入1 L圆底烧瓶中,在磁力搅拌器上搅拌,油浴加热回流。用薄层色谱(TLC)监控其反应。反应完毕后,溶液上部有大量白色固体(丁二酰亚胺),将其抽滤并洗涤滤饼,收集滤液蒸干,得黄色固体,用高效液相色谱(HPLC)测定转化率;用CCl4进行重结晶,得白色粉末晶体,熔点为118~120 ℃。
1.4 4-羟甲基二苯甲酮的合成
将0.1 mol 4-溴甲基二苯酮,0.58 mol K2CO3,300 mL H2O和0.002 mol相转移催化剂加入500 mL三口圆底烧瓶中,搅拌加热回流5 h,温度控制在约100 ℃。反应完毕后,将其反应混合物自然冷却,观察到溶液底部有大量咖啡色固体析出。过滤,弃去水相,对收集所得固体进行重结晶,得银白色粉末晶体19.2 g,熔点为98~100 ℃,HPLC显示产物纯度>99%。
2 化合物的结构表征
分离纯化后所得4-羟甲基二苯甲酮的熔点为98~100 ℃,高于文献[2]中的值59~61 ℃(文献[2]报道此化合物是由液相色谱得到的,量少,其中可能含有溶剂,因而熔点偏低)。化合物经HPLC测定,其纯度>99%。元素分析结果表明:由分子式C14H12O2计算,得w(C)=79.24%, w(H)=5.66%;实测值为:w(C)=79.53%, w(H)=5.61%。这表明通过该法所得产品纯度极高。其结构经IR,MS和1H-NMR确定。IR分析结果表明:在波数为3418,1647和1607 cm-1处分别对应νO-H,νC=O和νAr-H振动吸收峰。
2.1 质谱分析
4-溴甲基二苯甲酮的质谱中的质荷比m/z为274的吸收峰是分子离子峰,276的峰是其同位素离子峰,两峰等高,证明分子中有1个溴原子存在。m/z为195的峰是基峰,为丢失溴自由基后所形成的离子,由于异构化形成稳定的 [SX(B-*4]艹[]卓[SX)] 钅翁离子,特别稳定,故此峰最强;m/z为167是m/z为195的离子丢失CO后所形成的离子产生的吸收峰,也比较强。此外,m/z分别为105,89,77,53,41的吸收峰,也证明了二苯甲酮骨架的存在。各主要碎片离子峰的解析结果如表1所示。
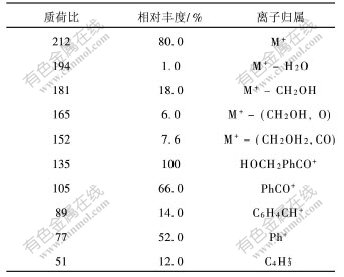
4-羟甲基二苯甲酮的质谱如图2所示。其分子离子峰M+质荷比(m/z)为212。各碎片离子峰的解析结果如表2所示。
表 1 4-溴甲基二苯甲酮的主要质谱峰
Table 1 Characteristic peaks in mass spectrum of 4-bromomethylbenzophenone
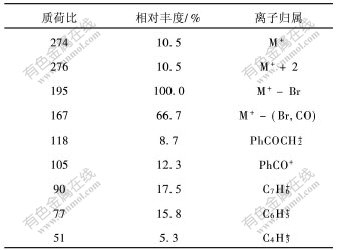
图 2 4-羟甲基二苯甲酮质谱
Fig. 2 Mass spectrum of 4-hydromethylbenzophenone
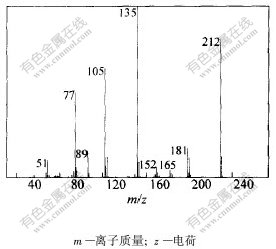
表 2 4-羟甲基二苯甲酮的主要质谱峰
Table 2 Characteristic peaks in mass spectrum of 4-hydromethylbenzophenone
2.2 4-羟甲基二苯甲酮的氢核磁共振谱分析
4-羟甲基二苯甲酮的氢核磁共振谱如图3所示。
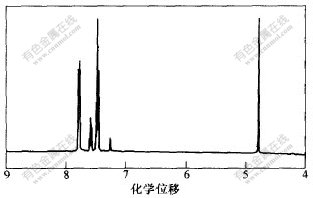
图 3 4-羟甲基二苯甲酮核磁共振氢谱
Fig. 3 1H-NMR spectrum of4-hydromethylbenzophenone
图谱分析结果表明:
a. 化学位移δ=7.772~7.798处存在多重峰,其中4个H为2个苯环中与羰基(C-O)处于邻位的4个H;而δ=7.461~7.499处存在多重峰,4个H,为2个苯环上分别与羰基(C-O)处于间位的4个H。因为羰基(C-O)与苯环的吸电子共轭效应,导致苯环邻位的电子云密度相对较小,屏蔽作用也最小,所以,邻位质子的化学位移在较高处。由于2个苯环的化学环境不同,所以2组邻位氢的吸收峰相互重叠在一起形成复杂的峰;与邻位氢的吸收峰比较相似,间位氢的谱图分裂也很复杂,只是间位氢的电子云密度比邻、对位的要大,屏蔽作用较大,故化学位移相对要小,处在较高场。
b. δ=7.573~7.611的峰(多重峰,1H),为其中1个苯环上与羰基(C-O)处于对位的1个氢吸收峰,谱图裂分也比较复杂。
c. δ=4.793的峰是亚甲基(-CH2-)的吸收峰,因为受羟基的吸电子效应影响,电子云密度降低,屏蔽效应小,化学位移比烷烃中亚甲基的化学位移大。
d. 活性羟基上质子的吸收峰因与溶剂中水分交换而在谱图上显示不出来[15,16]。
综合元素分析、红外光谱、质谱和氢核磁共振谱图等数据的分析结果,确定化合物4-羟甲基二苯甲酮的结构含有2个苯环、1个羰基、1个亚甲基和1个羟基。
3 结果与讨论
3.1 4-甲基二苯甲酮的卤代
卤代试剂有Cl2,Br2和N-卤代酰胺卤化剂,如:N-碘代丁二酰亚胺(NIS),N-溴代丁二酰亚胺(NBS)和N-氯代丁二酰亚胺(NCS)。由于卤素单质毒性大,反应难以控制。这里主要研究用N-卤代酰胺卤化剂对4-甲基二苯甲酮的卤代反应,实验结果如表3所示。
表 3 不同卤代试剂对卤化反应的影响
Table 3 Effect of different NXSs on halogenation reactions
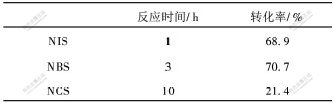
实验结果表明:NIS 反应1 h后达到反应终点,但碘化物价格较贵,同时碘离子的存在使其后处理难度增大,转化率也没有明显增大;NCS反应速度慢且反应达到平衡时转化率很低。而NBS作为上述反应的卤代试剂,反应条件简便,后处理方便,为该反应较理想的自由基卤化试剂。
3.2 4-羟甲基二苯甲酮的合成工艺
4-溴甲基二苯甲酮不溶于水,当用碱水解时,属两相反应,反应难以进行[12],故需寻找合适的溶剂或相转移催化剂,以使反应顺利进行。
3.2.1 溶剂的选择
分别用四氢呋喃(THF),1,4-二氧六环、甲醇和二甲基亚砜(DMSO)作溶剂使化合物Ⅱ(见图1)水解。上述4种溶剂均与水混溶。实验结果表明:用THF或1,4-二氧六环作溶剂时,体系仍为两相反应,即化合物Ⅱ溶于THF或二氧六环后所得的有机相仍不溶于水,反应难以顺利进行;甲醇或二甲基亚砜作溶剂时,反应虽是均相反应,但主要生成副产物;用甲醇作溶剂时,GC-MS显示副产物为4-甲氧甲基二苯甲酮;而用DMSO作溶剂时,副产物即为4-甲醛基二苯甲酮。因此,本实验中没找到合适的溶剂,使反应在均相条件下顺利合成出目标产物。
3.2.2 相转移催化剂的选择
分别使用聚乙二醇-1000(PEG-1000)、十六烷基三甲基溴化铵(HTAB)、OP-10、四丁基溴化铵(TBAB)、氯化二甲基苄基十二烷基铵(DDBA)和苄基三乙基氯化铵(BTEAC)作相转移催化剂,回流5 h进行水解反应。结果表明,聚乙二醇的催化作用不是很好,副产物太多,难以处理,且反应进行不完全;OP-10、氯化十二烷基二甲基苄基铵(DDBA)和十六烷基三甲基溴化铵(HTAB)的催化效果一般;而苄基三乙基氯化铵(BTEBA)对此反应的催化作用效果很好。可见,此水解反应选择苄基三乙基氯化铵作相转移催化剂效果较好。各相转移催化剂的催化效果如表4所示。
表 4 不同相转移催化剂对水解产率的影响
Table 4 Effect of different PTCs on hydrolyzation yield

3.2.3 粗产品的纯化
水解反应完成后,TLC和HPLC显示已无原料,粗产品中有88%左右4-羟甲基二苯甲酮,其他为副产物。分别使用乙酸乙酯、异丙醇和THF作为溶剂对粗产品进行重结晶,发现四氢呋喃重结晶效果最好,重结晶最高产率可达84.4%,说明THF是4-羟甲基二苯甲酮进行重结晶的良好溶剂。产品经IR,1H-NMR,GC-MS和元素分析,确定其成分为4-羟甲基二苯甲酮。
4 结 论
a. NBS为优良的自由基卤代试剂,它与4-甲基二苯甲酮等摩尔反应可生成中间体4-溴甲基二苯甲酮,产率可达70.7%。反应条件简便,后处理简单。
b. 用相转移催化剂碱性水解4-溴甲基二苯甲酮合成了4-羟甲基二苯甲酮。用苄基三乙基氯化铵作相转移催化剂时,反应5 h可使反应达到终点,水解分离产率高达84.4%。粗产品用THF重结晶后,其纯度大于99%。
参考文献:
[1]Bolette L, Denieul M P, Skrydstrup J. Formal total synthesis of the PKC inhibitor, balanol: preparation of the fully protected benzophenone fragment[J]. Tetrahedron, 2002, 58(11):2231-2238.
[2]Oatis J E, Jr Knapp D R. Synthesis and photochemistry of two cleavable heterobifunctional benzophenone protein crosslinkers[J] .Tetrahedron Letters, 1998, 39(13): 1665-1668.
[3]Patil M L, Deshpande V H, Pamlingams H B, et al. Synthetic studies towards the benzophenone precursor for balanol[J]. Tetrahedron, 2004, 60(8): 1869-1873.
[4]Chirico R D, Knipmeyer S E, Steel W V. Heat capacities, enthalpy increments and derived thermodynamic function for benzophenone between the temperatures 5 K and 440 K[J]. J Chem Thermodynamic, 2002, 34(9):1885-1895.
[5]方培基,王尔鉴.光敏功能表面活性剂及稳态光谱性质[J]. 感光科学与光化学, 1988, 8(3): 12-16.
FANG Pei-ji, WANG Er-jian. The photosensitive functional surfactants and their steady spectra[J]. Photographic Science and Photochemistry, 1988, 8(3): 12-16.
[6]Neumann P, Aumueller A. Process for the preparation of 2,4-dihydroxybenzophenone[P]. US 4990680,1991.
[7]Khanum S A, Shiharsha S, Deepak A V. Synthesis and anti-inflammatory activity of benzophenone analogues[J]. Biorganic Chemistry, 2004, 32(1): 211-222.
[8] Nurari S K, Sriharsha S N, Shashikanth S, et al. Synthesis of benzophenone oxime analogues as inhibitor of secretory phospholipase A2 with anti-inflammatory acitivity[J]. Bioorganic Medicinal Chemistry Letters,2004, 14(4):2423-2425.
[9]Yamaji M, Kiyota T, Kimura S, et al. Laser flash photolysis studies on the interaction between triplet benzophenone and naphthalate anions electron transfer or triplet energy transter[J]. Chemistry Physics Letters, 1995,237(5): 419-424.
[10]Koshima H, Matsusaka W, Yu H T. Preparation and photoreaction of organogel based on benzophenone[J]. Photo Chemistry Photobiology A: Chemistry, 2003, 156(1):83-90.
[11]臧阳陵,徐伟箭.4-溴甲基二苯甲酮的合成研究[J].精细化工中间体, 2003, 33(1): 16-17.
ZANG Yang-ling, XU Wei-jian. Studies on synthesis of 4-bromomethylbenzophenone[J]. Fine Chemical Intermediates, 2003, 33(1):16-17.
[12]李金志.相转移催化水解法制备苯甲醇的研究[J].化工矿物与加工.2000,3(12):8-9,12.
LI Jin-zhi. Study on benzene methanol preparation with phase transfer hydrolysis catalytic method[J]. Chemical Engineering Mineral and Machining, 2000, 3(12): 8-9,12.
[13]黄枢,谢如刚,田宝芝,等.有机合成制备手册[M].成都:四川大学出版社,1988.
HUANG Su, XIE Ru-gang, TIAN Bao-zhi, et al. Organic synthesis and preparation handbook[M]. Chengdu: Sichuan University Press, 1988.
[14]王清廉,沈凤嘉.有机化学实验[M].北京:高等教育出版社,1992.
WANG Qing-lian, SHEN Feng-jia. Organic chemistry experiment[M]. Beijing: Higher Education Press, 1992.
[15]丛浦珠.质谱学在天然有机化学中的应用[M].北京:科学出版社,1987.
CONG Pu-zhu. Application of mass spectrum in nature organic chemistry[M]. Beijing: Science Press, 1987.
[16]宁永成. 有机化合物结构鉴定与有机波谱学(第二版)[M].北京:科学出版社,2001.
NING Yong-Cheng. Structural identification of organic compounds and organic spectroscopy(2nd Edition)[M]. Beijing: Science Press, 2001.
收稿日期:2004 -11 -12
基金项目:国家自然科学基金资助项目(200376018)
作者简介:唐瑞仁(1967-),男,湖南邵阳人,副教授,博士,从事有机合成和药物化学的研究
论文联系人: 唐瑞仁,男,副教授,博士;电话:0731-8836961(O); E-mail: trr@mail.csu.edu.cn