用N235-TBP混合体系从硫酸盐溶液中协同萃取除铁
刘 铭1, 周雍茂2
(中南大学 冶金科学与工程学院, 长沙 410083)
摘 要: 研究了采用N235-TBP协同萃取体系从硫酸盐溶液中萃取除铁, 考察了萃取体系、 N235浓度和料液初始pH值对Fe(Ⅲ)萃取的影响以及相比(Vorg/Vaq)、 H2SO4浓度和平衡pH值对Fe(Ⅲ)反萃的影响。 结果表明: N235和TBP对硫酸盐溶液中的Fe(Ⅲ)具有协同萃取效应; 加入TBP能有效地抑制载铁有机相的分层, 提高Fe(Ⅲ)的反萃率; 料液初始pH值及N235浓度对Fe(Ⅲ)的萃取率影响显著, 萃铁曲线的最高点随着N235浓度的增大向低pH值方向移动; 以含30%N235和10%TBP(体积分数)的有机相作萃取剂, 在相比(Vorg/Vaq)为2∶1的条件下, 含铁12.73g/L的合成料液经过3级错流萃取, 萃余液中含铁低于0.15g/L, 铁的总萃取率接近99%; 以0.4mol/L的H2SO4为反萃剂, 控制反萃液平衡pH小于0.8, 铁的单级反萃率大于96%; 含铁7.05g/L的有机相在相比为1∶1时, 经过2级错流反萃, 铁基本上被反萃完全, 贫有机相不经处理可以循环使用。
关键词: 硫酸盐溶液; 协同萃取; 反萃; 除铁; N235; TBP 中图分类号: TF804.2
文献标识码: A
Removal of Fe(Ⅲ) from sulphate solutions by synergistic extraction using N235-TBP mixed solvent systems
LIU Ming, ZHOU Yong-mao
(School of Metallurgical Science and Engineering,Central South University, Changsha 410083, China)
Abstract: The removal of iron (Ⅲ) from sulphate solutions was investigated by solvent extraction using a mixed solvent system consisting of tertiary amine (N235) and tributyl phosphate (TBP). The effect of extraction systems, concentration of N235 and initial pH on the extraction of iron(Ⅲ), as well as the effect of volume ratio of organic to aqueous(Vorg/Vaq), concentration of sulfuric acid and equilibrium pH on the stripping of iron(Ⅲ) in loaded organic phase were studied. The results demonstrate that the N235-TBP system has a synergistic effect on the extraction of iron(Ⅲ); By adding TBP in N235, the demixing of loaded organic phase can be prevented and the stripping ratio of iron (Ⅲ) increases. Initial pH and concentration of N235 have remarkable influences on iron (Ⅲ) extraction, the maximum on the extraction curve moves towards the direction of low pH with increasing concentration of N235. At Vorg∶Vaq of 2∶1, the concentration of iron(Ⅲ) in raffinate is less than 0.15g/L after a three-stage cross-flow extraction with a organic phase consisting of 30%N235 and 10%TBP and a total extraction ratio of nearly 99% is achieved for a feed solution containing 12.73g/L Fe(Ⅲ). Furthermore, the stripping results indicate that with a dilute sulphuric acid (0.4mol/L), iron stripping ratio can reach 96% controlling equillium pH less than 0.8. At Vorg∶Vaq of 1∶1, iron(Ⅲ) in loaded organic phase containing 7.05g/L Fe(Ⅲ) can be easily and completely stripped by a dilute sulphuric acid (0.4mol/L) after a two-stage cross-flow stripping.
Key words: sulphate solutions; synergistic extraction; stripping; iron(Ⅲ) removal; tertiary amine; tributyl phosphate
湿法处理锌、 锰等金属矿物时, 作为杂质元素的铁不同程度地进入溶液, 工业上主要采用沉淀法除去溶液中的铁, 如黄钾铁矾法、 针铁矿法和赤铁矿法等。 但这类方法普遍存在操作繁杂、 有价金属损失大、 以及沉铁渣回收困难且易造成二次污染等问题[1]。 溶剂萃取法除铁具有选择性高、 能耗低和污染少等优点, 国内外冶金工作者已经对该方法进行了广泛的研究[2]。
可用于从溶液中萃取除铁的萃取剂包括胺类[3-6]、 酸性磷(膦)类[7-10]、 羧酸类[11]以及酰胺类[12]等萃取剂, 其中胺类和酸性磷(膦)类是硫酸盐体系中萃取除铁的主要萃取剂。 胺类萃取剂的萃铁能力与其结构有关, 其中伯胺的萃铁能力最强, 仲胺次之, 叔胺最弱, 但叔胺载铁有机相的反萃最容易。 常用的酸性磷(膦)类萃取剂有二(2-乙基己基)磷酸(P204)、 2-乙基己基磷酸单2-乙基己基酯(P507)、 二(2, 4, 4-三甲基戊基)膦酸(Cyanex 272)和磷酸-烷基酯(P538)等, 它们对铁的萃取效果较好, 但选择性较差, 即在萃取铁的同时, 其它有价金属会同时被萃取; 羧酸类萃取剂能有效地从弱酸性溶液中萃取铁, 但它们在水溶液中的溶解损失较大, 不能满足工业生产的要求。 在用上述几类萃取剂从硫酸盐体系萃取除铁时, 都存在一个共同的问题, 即萃入有机相中的Fe(Ⅲ)的反萃十分困难。 例如, 用N1923从硫酸盐溶液中萃取除铁时, 载铁有机相需要用4~5mol/L的H2SO4才能有效地反萃。 为解决这一问题, 一些研究者曾根据载铁有机相中Fe(Ⅱ)容易反萃的特点, 提出了还原反萃、 水解反萃等方法[13, 14], 但由于工艺复杂、 操作条件苛刻, 其工业应用前景黯淡。 近年来, 酰胺类萃取剂由于其优异的萃取性能受到广泛的关注, 但有关酰胺萃取除铁的研究未见详细报道。
据文献[15-17]报道, 采用协同萃取体系, 萃入有机相的铁可以在较低的酸度下被有效地反萃。 如由仲碳伯胺(N1923、 7101)与长链醇(仲辛醇)或中性磷(TBP)组成的协同萃取体系, 在水相初始酸度较高的情况下对铁有较高的萃取率; 同时, 当反萃液的平衡pH值小于1.0时, 萃入有机相的铁就能被有效地反萃。
虽然叔胺协萃体系的萃铁能力不如伯胺或仲胺协萃体系, 但采用叔胺协萃体系时, 载铁有机相中的铁更容易被反萃。 因此, 本文采用N235-TBP协同萃取体系从硫酸盐溶液中萃取除铁, 试图为解决“载铁有机相中铁反萃困难”的问题提供一条切实可行的途径。
1 实验
实验用萃取剂N235(叔胺7301)为工业试剂, 由株洲冶炼厂提供, 经过蒸馏提纯后, 纯度≥98%; 改性剂磷酸三丁酯(TBP)为分析纯试剂; 稀释剂为磺化煤油。 合成料液用分析纯硫酸铁、 硫酸锌和硫酸锰配制, 其中铁、 锌和锰的浓度分别为12.73、 24.01和40.02g/L。 萃取实验有机相的基本组成为30%N235、 10%TBP和60%磺化煤油(体积比)。 反萃实验的有机相含铁7.05g/L, 其余成分与萃取实验的有机相相同。
所有实验均在室温下进行。 按照一定相比将有机相和待萃水相置于分液漏斗中, 用浓硫酸或氢氧化钠调节水相的初始pH值, 振荡5min; 静置分相直至相界面清晰且有机相澄清后, 取萃余液, 用PHS-25C型酸度计测定平衡pH值, 用重铬酸钾容量法分析铁的含量, 通过差减法计算有机相中的铁浓度。 反萃实验的操作步骤同上, 振荡时间为4min。
2 结果与讨论
2.1 N235-TBP体系对铁的协萃效应
考察了不同萃取体系对Fe(Ⅲ)萃取及反萃的影响, 结果如表1所示。 在实验条件下, TBP基本上不萃取硫酸盐溶液中的Fe(Ⅲ), 相应的分配比小于0.01。 而Fe(Ⅲ)在N235-TBP体系中的分配比达5.88, 大于在TBP与N235体系中分配比之和(4.95)。 这说明, 在硫酸盐溶液中N235-TBP对Fe(Ⅲ)具有协同萃取效应。 这种效应是由中性膦类萃取剂中磷酰氧具有较强的给体能力决定的。 通常条件下, N235与水相中的SO2-与HSO04作用生成相应的胺盐; 而这些胺盐在磺化煤油中的溶解度有限, 以致生成第三相。 在有机相中添加TBP可以减少硫酸胺盐的生成, 从而有效地抑制有机相的分层。 实验表明, TBP的添加量达到10%时, 有机相的分层情况得到明显的改善。 更为重要的是, 在相同条件下与简单的N235体系相比, N235-TBP混合体系中Fe(Ⅲ)的反萃率、 铁锌分离系数βFe/Zn及铁锰分离系数βFe/Mn均要高得多。 表1还表明, N235的酸化处理对硫酸盐体系中Fe(Ⅲ)的萃取和反萃影响均很小。
2.2 料液初始pH值对铁萃取的影响
表1 不同萃取体系对Fe(Ⅲ)萃取、反萃及分离的影响
Table 1 Extraction, stripping and separation of iron(Ⅲ) in different systems
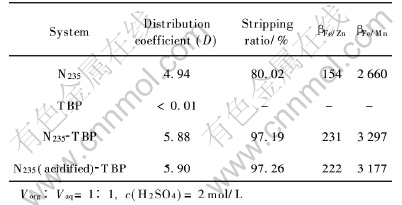
图1显示了不同N235浓度下料液初始pH值对Fe(Ⅲ)萃取率的影响。 由图可知, 在低酸度范围内, Fe(Ⅲ)的萃取率随着料液初始pH值的降低而增大; 而在高酸度范围内, Fe(Ⅲ)的萃取率则随着料液初始pH值的降低而减小, 即萃铁曲线上出现一个最高点。
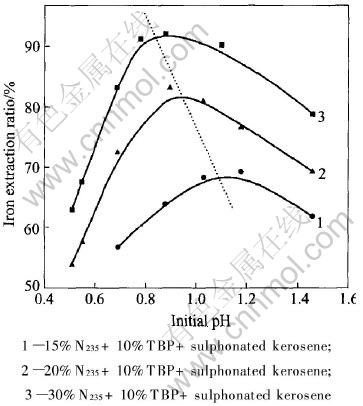
图1 料液初始pH值对协萃铁的影响
Fig.1 Effect of initial pH on synergistic extraction of iron
一般认为, 萃铁曲线的最高点是由于不同酸度下有机相中自由胺分子、 胺的硫酸盐及酸式硫酸盐的比例不同引起的[18]。 叔胺从硫酸盐溶液中萃取Fe(Ⅲ)的总反应可表示为[1]

式中 x为萃合物的聚合度; y为叔胺的分子数; z为萃合物中的羟基数。
由式(1)可知, 溶液中的Fe(Ⅲ)是以羟基铁的形式与胺的硫酸盐形成萃合物后被萃入有机相的。 增大胺的硫酸盐的浓度促使反应(1)向右进行, 有利于Fe(Ⅲ)的萃取。
在低酸度范围内, 有机相中的游离胺分子(R3N)能够与等量的硫酸络合, 即发生如下反应[19]:
2R3N(org)+H2SO4→(R2NH)2SO4(org)(2)
因此, 随着酸度的增加, 游离胺分子减少, 胺的硫酸盐增加, Fe(Ⅲ)的萃取率逐渐升高。 但在高酸度范围内, 胺的硫酸盐进一步与HSO-4结合成酸式硫酸盐, 即:
(R3NH)2SO4(org)+2HSO-4(aq) → 2R3NH·HSO4(org)+SO2-4(aq)(3)
式(3)表明, 由于HSO-4的竞争萃取, 使得胺的硫酸盐量随着酸度增加而减少, 因而Fe(Ⅲ)的萃取率逐渐降低。 由此可见, 在铁萃取率与初始pH值的关系曲线上会出现一个最高点。 图1还表明, 随着N235浓度的增加, 萃铁曲线上的最高点向低pH值方向移动。
2.3 N235浓度对铁萃取的影响
不同料液初始pH值下N235浓度对Fe(Ⅲ)萃取率的影响如图2所示。
由图可知, 不同初始pH值下萃铁曲线均为S型, 即在N235浓度较低的范围Fe(Ⅲ)的萃取率增加缓慢, 然后Fe(Ⅲ)的萃取率迅速增加, 最后在N235浓度较高的范围又趋于平缓。 在相比(O/A)固定的条件下, 增大N235浓度, 相当于增加萃取剂物质的量, 因此有利于Fe(Ⅲ)的萃取, 当N235浓度大于20%后, 有机相趋于饱和, 因此铁的萃取率变化很小。 在萃取实践中, 萃取剂浓度一般不宜超过40%, 否则有机相的黏度急剧上升, 不利于相分离。 综合考虑萃取率和相分离效果两个因素, 萃铁实验中N235的浓度取为30%。
2.4 萃铁等温线
图3和图4所示为用相比方法测定的萃铁等温线。 用McCabe-Thiele图解法, 在相比(O/A)为2∶
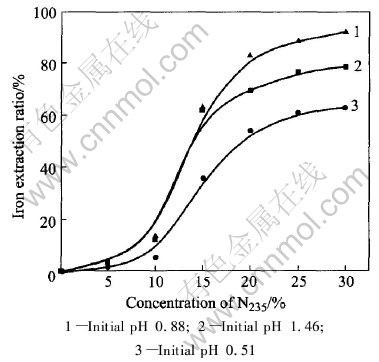
图2 N235浓度对协萃铁的影响
Fig.2 Effects of N235 concentration on synergistic extraction of iron
图3 铁的萃取平衡等温线
Fig.3 Extraction isotherm of iron
1的条件下, 求得逆流萃取的理论级数为2。 在工业生产中, 实际操作的萃取级数往往在理论级数上增加1级, 即3级逆流萃取。 另外, 从图3可知, 在实验条件下, 组成为30%N235+10%TBP+磺化煤油的有机相萃取Fe(Ⅲ)的饱和容量为12.6g/L。 合成料液的萃取实验结果表明, 在相比为2∶1的条件下, 含铁12.73g/L的料液经过3级错流萃取, 萃余液含铁0.15g/L, 铁的总萃取率接近99%, 基本达到除铁目的; 由于料液中铁浓度低时萃取效率明显降低, 因此若要达到深度除铁的目的, 需要增加萃取级数。 由图4可知, 经过4级逆流萃取, 萃余液铁含量可低于0.02g/L。
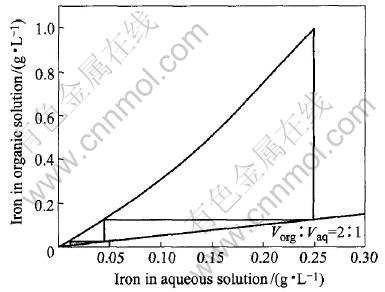
图4 萃取平衡等温线低浓度区域放大图
Fig.4 Enlarged extraction isotherm of iron in low concentration area
2.5 H2SO4浓度对铁反萃的影响
图5所示为载铁有机相中Fe(Ⅲ)的反萃率与H2SO4浓度的关系。 由图可见, 当H2SO4浓度小于0.4mol/L时, 随着H2SO4浓度的增加, Fe(Ⅲ)的反萃率迅速增大, 而相应的平衡pH值则迅速减小; 当采用去离子水作反萃剂时, Fe(Ⅲ)的反萃率仅为17.6%, 平衡pH为2.6; 而用0.4mol/L的H2SO4作反萃剂时, Fe(Ⅲ)的反萃率超过90%, 平衡pH为0.8; 当H2SO4浓度大于0.4mol/L时, 随着H2SO4浓度的增大, Fe(Ⅲ)的反萃率变化趋于平缓, Fe(Ⅲ)的反萃率最高可达到97%, 因此反萃实验中H2SO4的浓度均选为0.4mol/L。
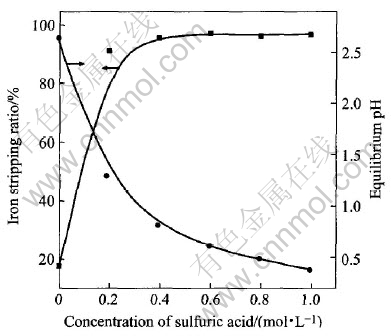
图5 H2SO4浓度对铁反萃的影响
Fig.5 Effect of H2SO4 concentration on iron stripping
一般来说, 载铁有机相反萃非常困难, 通常需要用4~5mol/L的H2SO4为反萃剂, 铁才能被有效地反萃。 而在N235-TBP体系中, 含铁7.05g/L的有机相用0.4mol/L的稀H2SO4就能有效地反萃, 充分说明了叔胺协同体系具有容易反萃的特点。 实际上, 胺类萃取体系的载铁有机相是一个反相胶团体系, 而有机相中生成的反相胶团体积越小越利于反萃, 通常协萃体系有机相中的反相胶团的体积最小, 因而载铁有机相的反萃十分容易[1]。
2.6 相比对铁反萃的影响
相比对铁反萃率的影响如图6所示。 为了保证反萃酸用量相同, 实验是在固定酸铁比的条件下进行的。 随着相比的增大, Fe(Ⅲ)的反萃率有所增加, 但增加的幅度不明显。 这是由于增大相比, 提高了体系的酸度, 使得Fe(Ⅲ)的反萃率升高。 但减小相比对反萃液的处理有利, 因为相比较小时, 反萃液的平衡pH值较高, 在进一步利用反萃液制备铁产品时, 可以减少中和碱的用量, 降低生产成本。
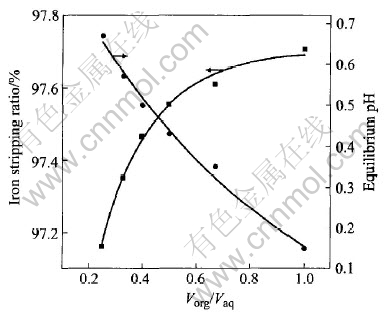
图6 相比对铁反萃的影响
Fig.6 Effect of ratio on iron stripping
2.7 平衡pH值对铁反萃率的影响
图7所示反映了反萃液平衡pH值对Fe(Ⅲ)反萃率的影响。 当平衡pH小于0.8时, Fe(Ⅲ)的反萃率随平衡pH增加下降缓慢, 且均大于96%; 当平衡pH大于0.8时, Fe(Ⅲ)的反萃率随平衡pH的增加迅速下降; 当平衡pH达到2.8时, Fe(Ⅲ)的反萃率只有17.6%。 因此, 只要控制反萃液平衡pH小于0.8, 有机相中的Fe(Ⅲ)就可以有效地被反萃下来。
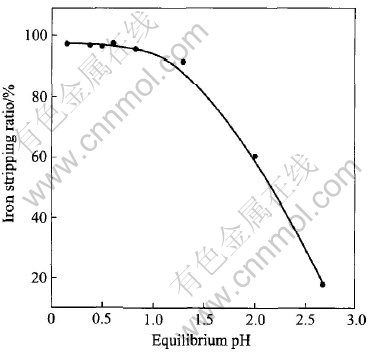
图7 平衡pH值对铁反萃的影响
Fig.7 Effect of equilibrium pH on iron stripping
2.8 反萃等温线与铁的富集
为了使反萃液中Fe(Ⅲ)的浓度达到进一步制备铁产品的要求, 必须对铁进行有效的富集, 因此对载铁有机相的多级逆流反萃进行了研究。 图8所示为在相比为1∶1, H2SO4浓度为0.4mol/L条件下绘制的反萃等温线。 由图可知, 在该条件下经过2级逆流反萃, 反萃液中铁可达到7.5g/L, 此时平衡水相的pH值约为0.8, 而贫有机相中的铁小于0.002g/L, 可不经处理循环使用。 若适当增加反萃剂H2SO4的用量或者增大相比反萃液中的铁可以进一步得到富集。
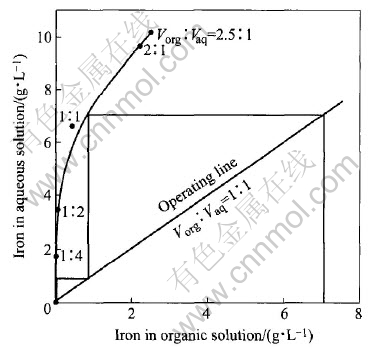
图8 铁的反萃等温线
Fig.8 Stripping isotherm of iron
3 结论
1) N235和TBP对硫酸盐溶液中Fe(Ⅲ)的萃取具有协同效应; 添加TBP作为改性剂, 能够有效抑制载铁有机相的分层, 提高Fe(Ⅲ)的反萃率。
2) 料液初始pH值及N235浓度对Fe(Ⅲ)的萃取率影响显著, 萃铁曲线的最高点随着N235浓度的增加移向低pH方向值移动。
3) 以含30%N235、 10%TBP的有机相作萃取剂, 在相比为2∶1条件下, 含铁12.73g/L的合成料液经过3级错流萃取, 萃余液含铁低于0.15g/L, 铁的总萃取率接近99%。
4) 以0.4mol/L的H2SO4作反萃剂, 控制反萃液平衡pH小于0.8, 铁的单级反萃率大于96%; 在相比为1∶1的条件下, 含铁7.05g/L的有机相经过2级错流反萃, 铁基本上被反萃完全, 贫有机相可以不经处理循环使用。
REFERENCES
[1]陈家墉, 于淑秋, 伍志春. 湿法冶金中铁的分离与利用[M]. 北京: 冶金工业出版社, 1991. 3, 229
CHEN Jia-yong, YU Shu-qiu, WU Zhi-chun. Separation and Utilization of Iron in Hydrometallurgy[M]. Beijing: Metallurgical Industry Press, 1991. 3, 229.
[2]Ismael M R C, Carvalho J M R. Iron recovery from sulphate leach liquors in zinc hydrometallurgy[J]. Minerals Engineering, 2003, 16: 31-39.
[3]周学玺, 杜晓宁, 朱屯. 叔胺萃取分离钴(Ⅱ)、 铁(Ⅱ)[J]. 过程工程学报, 2001, 1(4): 360-364.
ZHOU Xue-xi, DU Xiao-ning, ZHU Tun. Solvent extractive separation of cobalt (Ⅱ) and iron (Ⅱ) with tertiary amine[J]. The Chinese Journal of Process Engineering, 2001, 1(4): 360-364.
[4]周学玺, 汪焕庆, 夏云龙, 等. 用季胺盐萃取分离钴铁锰[J]. 中国有色金属学报, 2000, 10(5): 723-727.
ZHOU Xue-xi, WANG Huan-qing, XIA Yun-long, et al. Solvent extraction separation of cobalt, iron and manganese with quaternary ammonium chloride[J]. The Chinese Journal of Nonferrous Metals, 2000, 10(5): 723-727.
[5]何朝晖, 易文武, 刘一平. 伯胺萃取法生产无铁硫酸铝工艺研究[J]. 无机盐工业, 2001, 33(6): 29-30.
HE Zhao-hui, YI Wen-wu, LIU Yi-ping. Study on manufacturing non-iron aluminium sulfate by primary amine extraction method[J]. Inorganic Chemicals Industry, 2001, 33(6): 29-30.
[6]Saji A, Reddy M L P. Liquid-liquid extraction separation of iron(Ⅲ) from titania wastes using TBP-MIBK mixed solvent system[J]. Hydrometallurgy, 2001, 61: 81-87.
[7]沈纬, 王英, 傅洵. 硫酸铝生产过程中的萃取法除铁[J]. 应用化学, 2002, 19(5): 464-467.
SHEN Wei, WANG Ying, FU Xun. Extraction separation of Fe(Ⅲ) from crude Al2(SO4)3 by extractant P538[J]. Chinese Journal of Applied Chemistry, 2002, 19(5): 464-467.
[8]Asano H, Itabashi H, Kawamoto H. Separation of iron(Ⅲ) by di(2-ethylhexyl) phosphate/ 4-methyl-2-pentanone extraction[J]. Journal of the Iron and Steel Institute of Japan, 2001, 87(9): 623-625.
[9]汤兵, 朱又春, 白雪梅. 溶剂萃取法从镀锌酸洗废液中分离锌、 铁的研究[J]. 矿冶工程, 2003, 23(5): 47-50.
TANG Bing, ZHU You-chun, BAI Xue-mei. Study of separating of zinc from iron in waste sulfuric acid pickle liquor by solvent extraction[J]. Mining and Metallurgical Engineering, 2003, 23(5): 47-50.
[10]Suarez C, Ahumada E, Orellana F. Extraction of iron(Ⅲ) from acidic sulfate solutions with bis(2-ethylhexyl) phosphoric acid in PENRECO 170 ES, a new friendly diluent[J]. Journal of Chemical Technology and Biotechnology, 2002, 77(2): 183-189.
[11]Preston J S. Solvent extraction of metals by carboxylic acids[J]. Hydrometallurgy, 1985, 14: 171-188.
[12]陆国弟, 顾金英, 耿政松. 杯芳烃的配位化学(Ⅻ)——对叔丁基杯芳烃乙酸萃取铁(Ⅲ)的研究[J]. 同济大学学报, 2000, 28(5): 587-592.
LU Guo-di, GU Jin-ying, GENG Zheng-song. Coordination chemistry of callixarene(Ⅻ)—study on extraction of Fe(Ⅲ) using p-tertbutylcalix[n] arene carboxylic acids[J]. Journal of Tongji University, 2000, 28(5): 587-592.
[13]Lupi C, Pilone D. Reductive stripping in vacuum of Fe(Ⅲ) from D2EHPA[J]. Hydrometallurgy, 2000, 57: 201-207.
[14]Verbeken K, Verhaege M, Wettinck E. Separation of iron from a zinc sulphate electrolyte by combined liquid-liquid extraction and electro-reductive stripping[A]. Proceedings of the TMS Fall Extraction and Processing Conference[C]. Warrendale, Pennsylvania: Minerals, Metals & Materials Soc, 2000. 779-788.
[15]Demopoulos G P, Gefvert D L. Iron (Ⅲ) removal from base metals electrolyte solutions by solvent extraction[J]. Hydrometallurgy, 1984, 12: 299-315.
[16]Chen J, Shuqiu Y, Huizhou L, et al. New mixed solvents systems for the extraction and separation of ferric iron in sulphate solutions[J]. Hydrometallurgy, 1992, 30: 401-416.
[17]陈家墉, 于淑秋. 叔胺从硫酸锌溶液中萃取除铁的研究[J]. 有色金属, 1988, 40 (2): 66-72.
CHEN Jia-yong, YU Shu-qiu. Removal of Fe(Ⅲ) from zinc sulfate solutions by extraction with tertiary amines as solvent[J]. Nonferrous Metals, 1988, 40(2): 66-72.
[18]韩泳平. 叔胺从硫酸钾溶液中萃取硫酸机理的研究[J]. 四川化工, 1996(3): 9-11.
HAN Yong-ping. Study on the extraction of sulfuric acid with tertiary amine from potassium bisulfate solution[J]. Chinese Journal of Sichuan Chemical, 1996(3): 9-11.
[19]胡海南. 用叔胺萃取铀分离钍及稀土的研究[J]. 稀有金属与硬质合金, 1996(1): 4-7.
HU Hai-nan. Study of extraction of uranium with tertiary amine for the separation from Th and rare earths[J]. Rare Metals and Cemented Carbides, 1996(1): 4-7.
(编辑龙怀中)
基金项目: 湖南省中青年科技基金资助项目(00JCY2139)
收稿日期: 2005-04-01; 修订日期: 2005-07-04
作者简介: 刘 铭(1979-), 男, 硕士研究生
通讯作者: 周雍茂, 教授, 博士; 电话: 0731-8830872; E-mail: drymzhou@163.com