稀有金属 2014,38(03),464-470 DOI:10.13373/j.cnki.cjrm.2014.03.018
[Bmim]HSO4离子液体强化硫脲浸取银矿物
方夕辉 童雄 钟名清 陈文亮
昆明理工大学国土资源工程学院
江西理工大学资源与环境工程学院
云南省金属矿尾矿资源二次利用工程研究中心
摘 要:
针对硫化银和纯银粉中银的浸出, 在以[Bmim]HSO4离子液体调节pH值, Fe2 (SO4) 3为氧化剂, 硫脲为浸出试剂的浸取体系中, 研究了pH值、浸出时间、硫脲浓度、氧化剂用量、温度、搅拌速度等因素对银浸出率的影响, 并对其强化浸出机制进行了初步探讨。研究结果表明[Bmim]HSO4可强化硫脲浸银, 在[Bmim]HSO4浓度为0.30 mol·L-1 (pH=1.0) , 硫脲浓度0.16 mol·L-1, Fe3+浓度11.25×10-3mol·L-1, 搅拌速度250 r·min-1, 浸出时间24 h, 浸出温度298 K的条件下, 银的浸出率可以达到78.85%, 而以H2SO4调节浸液pH=1时, 银浸出率仅为51.10%。对硫脲稳定性的研究表明, [Bmim]HSO4在银浸出过程中不但起到调节浸液pH值的作用, 也减少了硫脲的氧化分解, 硫脲在[Bmim]HSO4溶液中的剩余浓度比在H2SO4溶液中高12.56%。研究也表明[Bmim]HSO4在银浸出过程中减少了硫化银的二次沉淀。[Bmim]HSO4离子液体作为一种新型浸出溶剂, 创造了一个更加有利于银溶解的溶液环境。
关键词:
1-丁基-3-甲基咪唑硫酸氢盐;离子液体;银;浸出;硫脲;pH调整剂;
中图分类号: TD953
作者简介:方夕辉 (1972-) , 女, 湖南宁乡人, 硕士, 副教授, 研究方向:稀贵金属选冶理论与工艺研究;E-mail:fangxihui@yeah.net;;童雄, 教授;电话:0871-65140955;E-mail:xiongtong2000@yahoo.com;
收稿日期:2013-06-19
基金:国家自然科学基金项目 (51174103, 51104077);江西省科技支撑计划项目 (2011BBG70002-2);江西省教育厅科技计划项目 (GJJ11480) 资助;
Intensification of Silver Leaching Process by [Bmim]HSO4 from
Fang Xihui Tong Xiong Zhong Mingqing Chen Wenliang
Faculty of Land Resource Engineering, Kunming University of Science and Technology
Faculty of Resource and Environmental Engineering, Jiangxi University of Science and Technology
Yunnan Province Engineering Research for Reutilization of Metal Tailing Resources
Abstract:
In order to leach silver from a mixture of silver sulfide and silver powder in the aqueous solvents, [Bmim]HSO4as pH regulator, Fe2 ( SO4) 3 as oxidant, thiourea as lixiviant, the process parameters, such as pH value, leaching time, thiourea concentration, oxidant concentration, temperature, stirring speed, and its intensified mechanism of silver leaching by [Bmim]HSO4were studied. The results showed that the leaching efficiency could reach 78. 85% under the optimal conditions of c ( [Bmim]HSO4) =0.30 mol·L- 1 ( pH =1.0) , c ( thiourea) =0.16 mol·L- 1, c ( Fe3 +) =11.25 ×10- 3mol·L- 1, agitation speed 250 r·min- 1, t ( leaching time) = 24 h, T ( leaching temperature) = 298 K. But the leaching efficiency of silver by H2SO4was only 51. 10% under similar conditions.Experimental investigation on thiourea stability showed that, [Bmim]HSO4not only played the role of pH adjustment infusion, but also reduced oxidative decomposition of thiourea. Thiourea remaining concentration ratio in [Bmim]HSO4solution was 12. 56% higher than that in the H2SO4 solution. And silver sulfide secondary precipitation was inhibited in [Bmim]HSO4aqueous solvents. [Bmim]HSO4, a kind of new leaching solvent, created a solution environment to promote the silver leaching reaction.
Keyword:
1-butyl-3-methylimidazolium hydrogen sulfate; ionic liquid; silver; leaching; thiourea; pH regulator;
Received: 2013-06-19
硫脲浸取金银具有清洁、高效等优点, 成为金银提取领域中备受关注的热点之一, 但传统的酸性硫脲浸银存在以下缺点[1,2]: (1) 硫酸溶液中, 硫脲自身具有较强的还原性, 容易被氧化成二硫甲脒或更高价态的氧化物而被消耗, 造成硫脲的消耗量大; (2) 含硫银矿石浸出时, 浸液中Ag+容易与S2-发生二次沉淀反应, 降低银的浸出率; (3) H2SO4在一定程度上会溶解铜、铅、锌、铁、砷、锑等杂质, 这些杂质不但降低了浸出过程的选择性, 也增大了药剂的消耗量, 进而降低银的浸出率。因此如果能找到一种新的浸取体系, 克服传统酸性硫脲浸银体系的缺点, 将是硫脲浸银技术的一大突破。
离子液体是一种新型绿色溶剂, 具有传统试剂无法比拟的优良性能, 将其应用于矿物浸出具有以下优点: (1) 对不同原料可通过选择不同的阴阳离子调节其溶解能力, 达到选择性溶解的目的[3,4]; (2) 能通过简化浸液中金属的提取过程达到缩短生产流程, 降低操作复杂度及能量消耗的目的, 因为有研究表明大多数金属都能直接从离子液体中电沉积出来[5]。 (3) 可循环使用[6]。因此将离子液体应用于矿物原料中金属的提取, 有望开发成金属的绿色湿法冶金新技术, 同时可解决当前金属提取分离中存在的环境污染严重的问题。
澳大利亚纽卡斯尔大学的Whitehead等[7]曾分别在[Bmim]HSO4离子液体-硫脲体系及传统的硫酸-硫脲体系中浸出某含伴生金银的硫化矿, 结果表明金在[Bmim]HSO4溶液中的浸出率与H2SO4溶液中的浸出率相当, 银的浸出率却比硫酸溶液中高出50%。然而上述研究是针对伴生银矿开展的, 以银作为主要有价金属的矿物原料用[Bmim]HSO4浸出少有相关报道。本文以含银矿物纯银粉和硫化银作为被浸矿物, 对[Bmim]HSO4-硫脲浸取体系的工艺条件以及[Bmim]HSO4强化浸银机制进行了研究。
1 实验
1.1 原料及药剂
由于天然硫化银和自然银矿物极其稀少, 加之矿石中其他成分的存在可能会影响银矿物的溶解过程, 因此本试验以市售的硫化银和银粉为原料进行浸出试验, 二者纯度均为分析纯级。化学分析表明硫化银含Ag 87.23%, S 12.75%, 银粉含Ag 99.99%。
所用试剂[Bmim]HSO4、硫脲 (TU) 、硫酸铁、硫酸均为分析纯。
1.2 试验方法
浸出试验:称取0.5 g银粉和0.5 g硫化银置于500 ml烧杯中, 依次加入去离子水200 ml, 硫脲和硫酸铁, 最后用[Bmim]HSO4或硫酸调节浸液的p H值, 置于磁力搅拌器上搅拌浸出一定时间后过滤, 收集浸液, 测定浸出液中银的浓度, 计算浸出率。
分析方法:银含量测定采用原子吸收光谱进行分析;溶液中硫脲分解率是通过容量法测得溶液中游离硫脲的含量, 再经计算得出。
2 硫脲浸银机制
有氧化剂存在的硫脲溶液中, 银和硫化银的溶解都属于氧化还原反应, 因此银粉和硫化银在硫脲溶液中的浸出反应可看成是电化学腐蚀过程[8]。
在阳极区, Ag2S在酸性硫脲溶液中先溶解出Ag+和S2-, 在氧化剂Fe2 (SO4) 3及溶解氧的作用下, 溶解出的S2-被氧化成硫单质。因此Ag2S浸出的阳极反应式为:
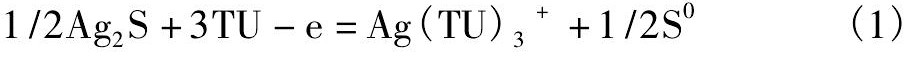
银粉在阳极区的溶解过程为在氧化剂的作用下, 银被氧化成Ag+, 溶于溶液中的Ag+继而与硫脲络合成Ag (TU) 3+, 因此银浸出的阳极反应式为:
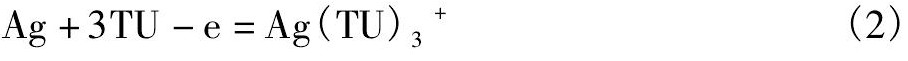
在阴极区, Ag2S与Ag的电化学反应过程相同, 均为溶液中的溶解氧和Fe3+获得电子, 分别被还原成H2O和Fe2+。
因此硫脲浸取银粉和硫化银的原电池反应为:
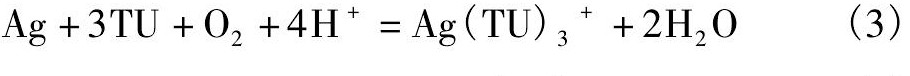

3[Bmim]HSO4离子液体的性质
试验采用的离子液体是1-丁基-3-甲基咪唑硫酸氢盐, 简称为[Bmim]HSO4, 结构式为:
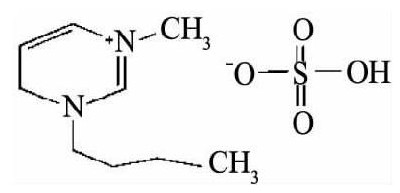
[Bmim]HSO4是由咪唑阳离子和HSO4-阴离子组成的离子液体, 它的阴离子具有硫酸氢盐的特点, 水溶液呈酸性, 因此在浸出体系中[Bmim]HSO4的一个很重要的作用是代替传统酸性硫脲浸出体系中的硫酸或盐酸调浆矿浆p H值[9]。[Bmim]HSO4具有离子液体的许多特点, 与水及绝大多数常用有机溶剂互溶, 对金属氧化物也具有较好的溶解能力[10], 这就为[Bmim]HSO4在矿物原料浸出中的应用提供了可能。
4 结果与讨论
4.1 p H值对银浸出率的影响
p H值是硫脲浸出过程的重要影响因素, Orgul和Kim等[11,12]的研究表明硫脲浸金体系中适宜的酸度对金浸出率影响极大, 只有在酸性介质中硫脲才能保持较高的稳定性。[Bmim]-HSO4离子液体作为浸出体系的p H调整剂, 浓度对溶液的p H值及银浸出率影响很大。因此分别以[Bmim]HSO4和H2SO4调整浸液的p H值, 在温度298 K, 硫脲浓度0.16 mol·L-1, Fe3+浓度11.25×10-3mol·L-1, 搅拌速度为250 r·min-1, 浸出时间18 h的条件下进行了试验, p H值对银浸出率的影响如图1所示。
由图1可知, p H值对两体系溶液中银浸出率大小的影响规律类似。不同的是在相同的p H条件下, [Bmim]HSO4离子液体-硫脲溶液中银的浸出率要比硫酸-硫脲体系中银的浸出率要大得多。当p H=1.0时, 含有离子液体的浸出溶液中, 银的浸出率为78.86%, 相同条件下硫酸作为p H调整剂时, 银的浸出率却只有51.10%。两个浸出体系银浸出效果的差异说明[Bmim]HSO4离子液体在银的浸出过程中不仅起到p H调整剂的作用, 作为一种新的浸出溶剂它可能还在某种程度上促进了银的浸出反应, 创造了一个更利于银溶解的溶液环境。
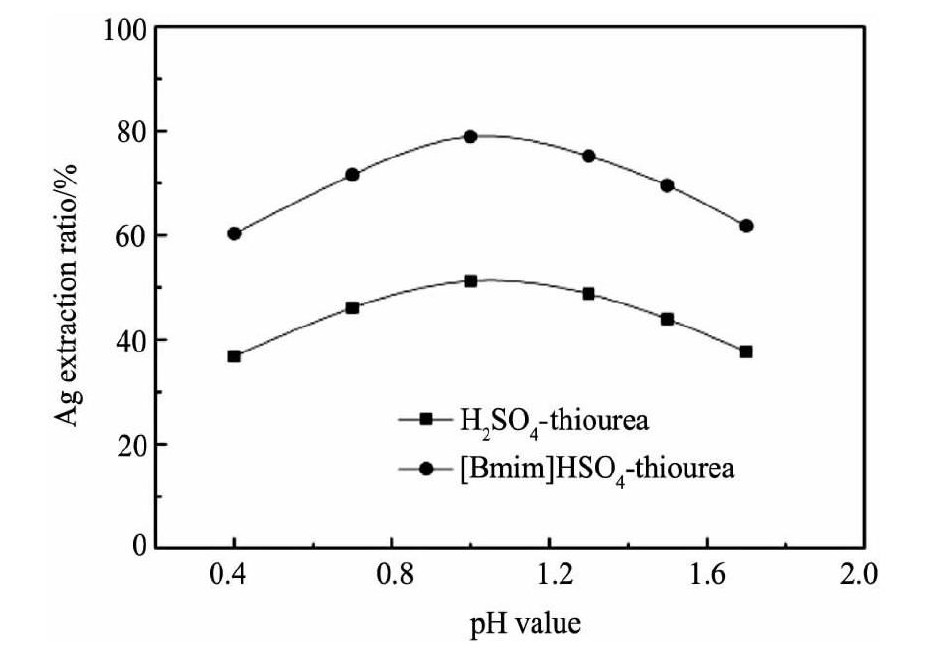
图1 不同p H条件下两体系的浸银效果比较Fig.1Effects of p H values on silver extraction ratio with H2SO4and[Bmim]HSO4
4.2 浸出时间对银浸出率的影响
试验分别对[Bmim]HSO4-硫脲体系、H2SO4-硫脲体系分别进行了浸出时间影响试验。试验中控制温度298 K, 搅拌转速250 r·min-1, 硫脲浓度0.16 mol·L-1, [Bmim]HSO4浓度0.30 mol·L-1 (p H=1.0) , 硫酸调节浸液初始p H=1.0, 试验结果见图2。
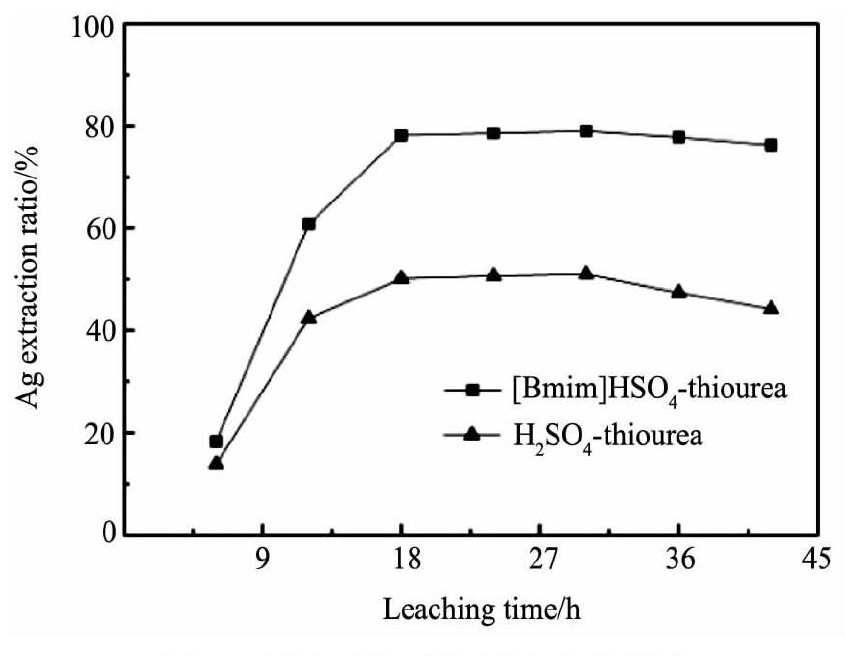
图2 浸出时间对银浸出率的影响Fig.2 Effects of leaching time on silver extraction ratio
由图2中可知: (1) 无论是[Bmim]HSO4-硫脲体系还是H2SO4-硫脲体系, 银的浸出速率都是比较快的, 当浸出时间为18 h时, 银的浸出率已经接近极大值, 而氰化浸银的银浸出率达到极大值时浸出时间一般都在48 h以上[13]; (2) 相同浸出条件下, 银在[Bmim]HSO4-硫脲体系中的浸出率要比H2SO4-硫脲体系中的浸出率要高得多, 浸出时间18 h时, 两体系的浸出率分别约为78.81%和50.93%。
4.3 硫脲浓度对银浸出率的影响
试验考察了298 K, [Bmim]HSO4浓度0.30mol·L-1 (p H=1.0) , 搅拌速度250 r·min-1, Fe3+浓度7.5×10-3mol·L-1, 浸出时间24 h条件下硫脲浓度对银浸出率的影响, 试验结果见图3。
从图3可看出, 硫脲的用量对银浸出率的影响很大, 当硫脲浓度从0.06增大到0.16 mol·L-1时, 银的浸出率几乎呈直线趋势增长, 然而, 当硫脲浓度超过0.16 mol·L-1时, 银浸出率增幅很小, 因此硫脲浓度0.16 mol·L-1较为合适。
4.4 氧化剂Fe2 (SO4) 3用量对银浸出率的影响
由于硫脲自身具有还原性, 在酸性环境中容易被氧化成二硫甲脒, 因此氧化能力太强的氧化剂会导致硫脲氧化使得浸液中硫脲有效浓度降低, 不利于银的浸出, 但如果氧化剂的氧化性过弱, 又不足以氧化Ag及Ag2S以满足浸出反应的要求, 因此本文以氧化能力适中的Fe2 (SO4) 3为氧化剂进行了Fe3+浓度条件试验。试验条件为温度298K, [Bmim]HSO4浓度0.30 mol·L-1 (p H=1.0) , 硫脲浓度0.16 mol·L-1, 搅拌转速250 r·min-1, 浸出时间24 h, 试验结果如图4所示。
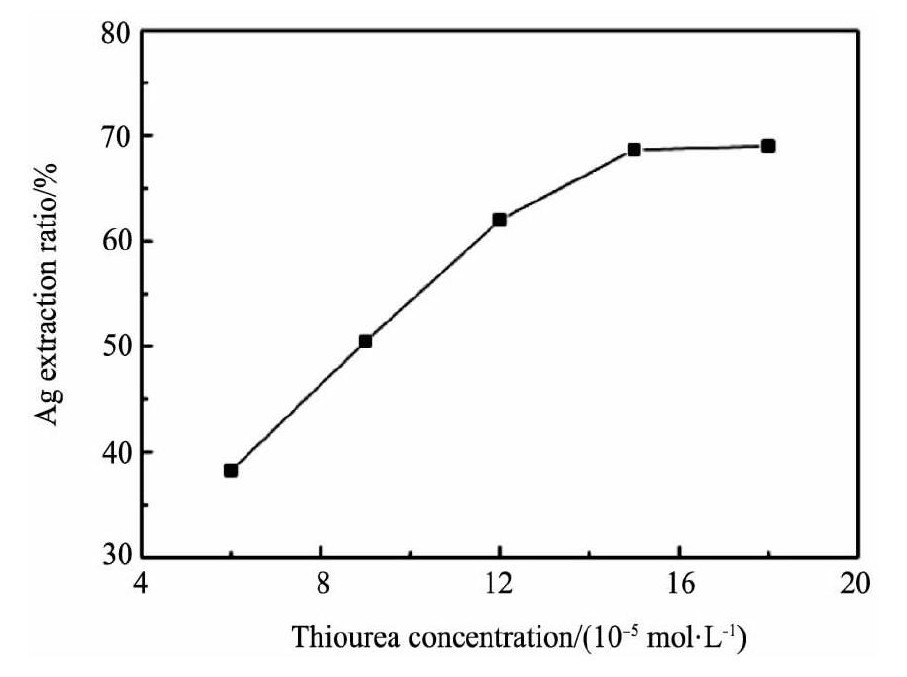
图3 硫脲浓度对银浸出率的影响Fig.3 Effects of thiourea concentration on silver extraction ratio
从图4可看出, 在未添加Fe2 (SO4) 3时, 银浸出率很低, 而当浸液中开始加入硫酸铁时, 银浸出率随铁离子浓度的加大而迅速增大, 这说明Fe2 (SO4) 3对银粉和硫化银的浸出提供了氧化环境。从图中还发现铁离子浓度越大银浸出率越高, 当Fe3+浓度增大至11.25×10-3mol·L-1时, 浸出率到达最大值, 继续增大浓度, 浸出率反而急剧下降。这是因为, 故Fe3+除了能氧化Ag和Ag2S之外, 也能氧化硫脲, 随着铁离子浓度的增大, 硫脲被氧化的程度也会加大。
4.5 温度对银浸出率的影响
试验对不同温度条件下的银浸出率进行了考查, 除浸出温度外, 其他试验条件均与图4相同, 试验结果见图5。
由图5可知, 在浸出反应的前期, 温度越高, 浸出速度越快。12 h后, 银的浸出率从298 K时的61.0%提高到了328 K时的84.71%;温度为328 K时, 银浸出6 h后浸出率就已经达到了44.39%。可见, 升高温度能大幅提高银的浸出速度, 因为高温有助于分子的热运动, 能在一定程度上加大物质的扩散速度和反应速度。虽然反应前期温度的提升对浸出是有利的, 但反应后期随着温度的升高, 浸出率下降的趋势也逐渐明显。当温度分别为318和328 K时, 银的浸出率从12 h的80.38%和84.71%分别降到了24 h的68.58%和66.15%。

图4 Fe3+浓度对银浸出率的影响Fig.4 Effects of Fe3+concentration on silver extraction ratio
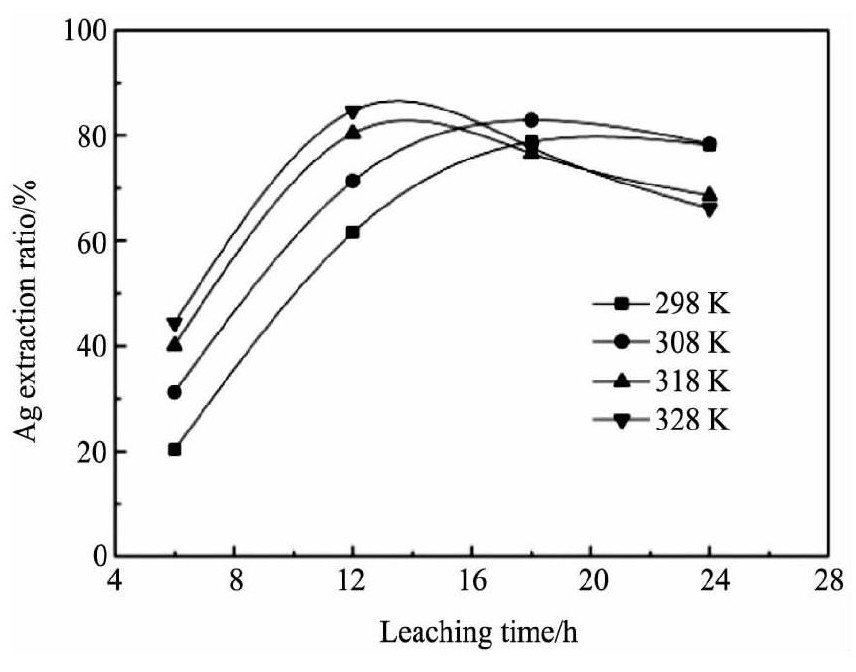
图5 浸出温度对银浸出率的影响Fig.5 Effects of temperature on silver extraction ratio
4.6 搅拌速度对银浸出率的影响
为探索[Bmim]HSO4-硫脲体系中银浸出率受搅拌速度的影响程度, 本试验进行了不同搅拌速度条件下的银浸出试验, 试验条件为温度298 K, [Bmim]HSO4浓度0.30 mol·L-1 (p H=1.0) , 硫脲浓度0.16 mol·L-1, Fe3+浓度11.25×10-3mol·L-1, 试验结果见图6。
由图6可知, 当搅拌速度从0增大到250 r·min-1时, 银浸出率从18.23%升到了78.85%, 提高转速至300 r·min-1, 浸出无明显变化, 进一步再增大, 浸出率却有下降趋势。这是因为一定范围内提高搅拌速度有利于增大溶液中氧气的溶解度及液体的扩散和传质, 但搅拌速度过大会使固相和液相的相对运动速度下降, 则固液两相间的传质速率减小, 浸出率下降。对于该浸出反应, 250 r·min-1是最佳的搅拌速度。
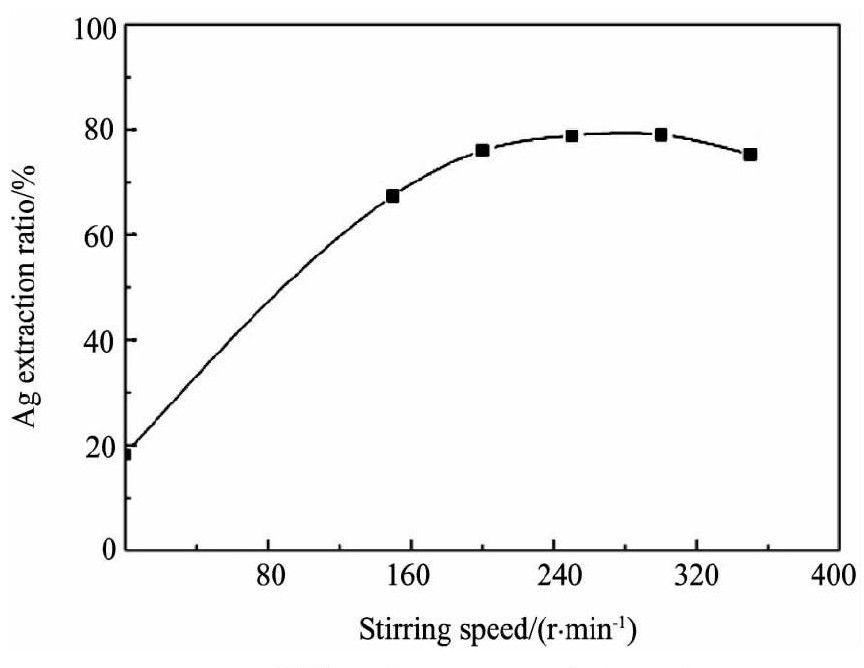
图6 搅拌速度对银浸出率的影响Fig.6 Effects of stirring speed on silver extraction ratio
5[Bmim]HSO4强化硫脲浸银机制分析
为探究[Bmim]HSO4离子液体溶液体系中银浸出率更高的原因, 论文对[Bmim]HSO4-硫脲体系及H2SO4-硫脲体系中的硫脲稳定性, 银二次沉淀程度进行了研究。
5.1 硫脲在[Bmim]HSO4和硫酸体系中的稳定性比较
Whitehead等[7]指出, 酸性硫脲浸取金银浸出率不高的最主要原因就是硫脲的消耗量大, 因为硫脲在酸性条件下具有较强的还原性, 在有氧化剂存在的条件下容易被氧化成二硫甲脒甚至更高价态的含硫产物, 降低了浸液中硫脲的有效浓度。为解决这一问题, 出现了一系列的强化助浸法, 如亚硫酸钠电位调控法[14]、稳定剂添加法、超声波强化法[15]等, 然而它们都因操作难控制或助浸效果不稳定而未得到广泛应用。Whitehead等[16]采用[Bmim]HSO4-硫脲体系浸取某含金银的硫化矿石时, 曾推测[Bmim]HSO4的水溶液作为浸出溶剂时银浸出率比硫酸水溶液中银浸出率好可能是因为硫脲在离子液体溶液中更稳定。为验证这一推断是否正确, 实验对硫酸与[Bmim]HSO4两种不同体系中硫脲浓度分别进行了测定, 考察了硫脲在上述两个体系中的稳定性。
试验过程为在两个烧杯中分别加入200 ml蒸馏水, 分别以[Bmim]HSO4和硫酸调整p H值至1.0, 再分别将要求用量的硫脲和0.02 g硫酸铁加入烧杯中, 待其溶解后置于磁力搅拌器上搅拌, 每隔一定时间取滤液进行硫脲浓度测定, 这两个滤液样品中的硫脲浓度大小分别代表了相同条件下硫脲在[Bmim]HSO4离子液体溶液及硫酸溶液中的氧化分解率。
试验结果如图7所示, 从图中的曲线可看出[Bmim]HSO4离子液体溶液中硫脲的损耗比硫酸溶液中的损耗少, 可见相同条件下硫脲在[Bmim]HSO4离子液体溶液中被铁离子氧化的速度更慢, 故[Bmim]HSO4-硫脲浸银体系中硫脲的稳定性更高, 验证了Whitehead的猜测[16]。
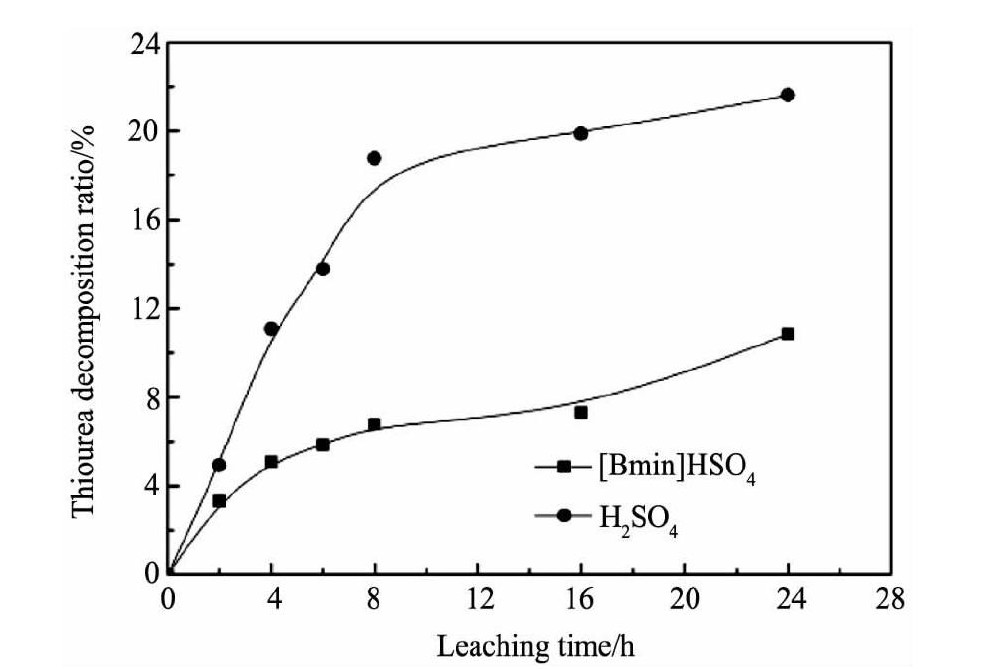
图7[Bmim]HSO4和硫酸体系中硫脲的分解情况Fig.7 Thiourea decomposition ratios between compared[Bmim]HSO4and sulfuric acid solution
5.2 在[Bmim]HSO4和硫酸体系中硫化银的二次沉淀程度比较
图2表明浸出时间过长时, 银的浸出率有下降的趋势, 因为硫化银解离出的S2-可能会与溶液中的Ag (CSN2H4) 3+发生反应, 二次沉淀为硫化银回到固相中[17]。银的二次沉淀现象是否会在[Bmim]HSO4离子液体溶液中得到改善, 试验对[Bmim]HSO4-硫脲和H2SO4-硫脲溶液中Ag2S的二次沉淀程度进行了研究。取试样Ag2S 0.2 g, 温度298 K, p H=1.0 (分别用[Bmim]HSO4和硫酸调节p H) , 硫脲浓度0.16 mol·L-1, Fe3+浓度11.25×10-3mol·L-1, 搅拌速度250 r·min-1的试验条件下进行浸出, 银浸出率与时间的关系见图8。
从图8可看出, 硫化银在[Bmim]HSO4-硫脲体系与H2SO4-硫脲体系中的浸出速率接近, 当浸出时间约20 h时, 银的浸出率达到最大, 继续增加浸出时间, 银的浸出率都开始下降;不同的是H2SO4溶液中银浸出率下降的幅度要比[Bmim]HSO4离子液体溶液中银浸出率下降的幅度大, 从20~48 h, [Bmim]HSO4-硫脲体系中银的浸出率从81.2%降到了76.3%, 而H2SO4-硫脲溶液中银浸出率却从54.3%降到了41.8%, 这表明相对于传统的硫酸-硫脲浸银工艺, [Bmim]HSO4-硫脲体系中银的二次沉淀反应在一定程度上受到了抑制。硫化银在两溶液中浸出率变化差异表明[Bmim]HSO4-硫脲浸银体系优于H2SO4-硫脲浸银体系的另一个原因是[Bmim]HSO4溶液中银和硫脲反应生成的络合物Ag (CSN2H4) 3+更稳定, 二次沉淀反应的进行受到了一定程度的抑制。
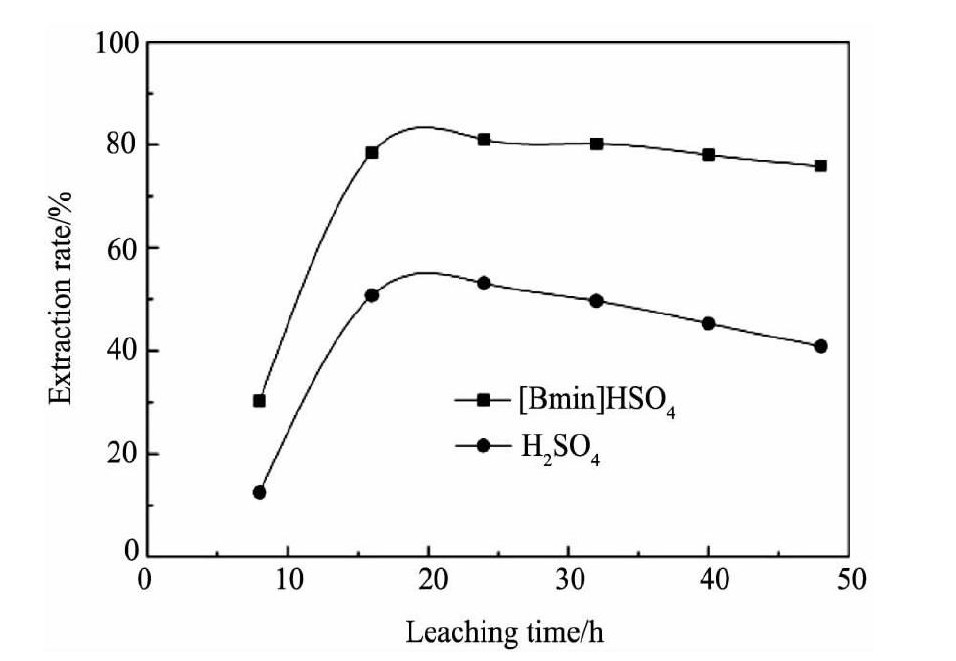
图8 不同浸出时间Ag2S的浸出率变化Fig.8 Leaching solution under[Bmim]HSO4solution and H2SO4solution with different leaching time
硫脲稳定性、银二次沉淀反应程度的比较结果表明银在[Bmim]HSO4溶液中浸出效果更好可能与浸出剂硫脲及浸出产物Ag (CSN2H4) 3+在该环境中较好的稳定性有关, 虽然目前还不能完全明确这些差别产生的原因, 但也为[Bmim]HSO4离子液体在硫脲浸银工艺中的应用提供了一定的理论基础。
6 结论
1.[Bmim]HSO4-硫脲体系浸取银粉和硫化银的试验结果表明, [Bmim]HSO4浓度 (p H值) 、硫脲浓度、Fe3+浓度、温度、浸出时间、搅拌速度对银浸出率均有较大影响, 其最佳工艺条件为[Bmim]HSO4浓度为0.30 mol·L-1 (p H=1) , 硫脲浓度0.16 mol·L-1, Fe3+浓度11.25×10-3mol·L-1, 搅拌速度250 r·min-1, 浸出时间24 h, 浸出温度298 K, 此时银的浸出率可以达到78.85%。而以H2SO4-硫脲体系浸银, 银浸出率仅为47.35%。
2.[Bmim]HSO4强化硫脲浸银机制的初步研究表明, 硫脲在[Bmim]HSO4溶液中的剩余浓度比在H2SO4溶液中高12.56%, 表明硫脲在[Bmim]HSO4溶液中的稳定性更好。对硫化银在[Bmim]HSO4-硫脲体系和H2SO4-硫脲体系的二次沉淀情况进行了测定, 发现[Bmim]HSO4溶液中银和硫脲反应生成的络合物Ag (CSN2H4) 3+更稳定, 其二次沉淀反应的进行受到了一定程度的抑制。
参考文献
[1] He J, Tong X, Cui Y Q.Current situation of silver leaching technology research[J].Yunnan Metallurgy, 2004, 10 (5) :6. (何剑, 童雄, 崔毅琦.银浸出技术的研究现状[J].云南冶金, 2004, 10 (5) :6.)
[2] Bai C Q.Application status and development of non-cyanide gold leaching reagents[J].Express Information of Mining Industry, 2008, 24 (12) :17. (白成庆.非氰浸金试剂的应用现状及发展[J].矿业快报, 2008, 24 (12) :17.)
[3] Branco L C, Rosa J N, Moura Ramos J J, Afonso C A.Preparation and characterization of new room temperature ionic liquids[J].Chemistry-A European Journal, 2002, 8 (16) :3671.
[4] Welton T.Room-temperature ionic liquids.Solvents for synthesis and catalsis[J].Chemical Reviews, 1999, 99 (8) :2071.
[5] Yang P X, An M Z, Liang S M, Guo H F.Electrodeposition of metals in ionic liquids[J].Electroplating&Pollution Control, 2006, 26 (5) :1. (杨培霞, 安茂忠, 粱淑敏, 郭洪飞.离子液体中金属的电沉积[J].电镀与环保, 2006, 26 (5) :1.)
[6] Whitehead Jacqueline A, Geoffrey A Lawrance, Adam McCluskey.‘Green’leaching:recyclable and selective leaching of gold-bearing ore in an ionic liquid[J].Green Chem., 2004, 6 (7) :313.
[7] Whitehead J A, Zhang J, Pereira N, McCluskey A, Lawrance G A.Application of 1-alkyl-3-methyl-imidazolium ionic liquids in the oxidative leaching of sulphidic copper, gold and silver ores[J].Hydrometallurgy, 2007, 88 (1) :109.
[8] Hu Y H, Guo G F, Qiu G Z, Wang D Z.Electrochemical research of gold leaching mechanism with thiourea[J].Gold Science&Technology, 1995, 3 (2) :43. (胡岳华, 郭观发, 邱冠周, 王淀佐.硫脲浸金机理的电化学研究[J].黄金科学技术, 1995, 3 (2) :43.)
[9] Dong T G, Hua Y X, Zhang Q B.Leaching of chalcopyrite with Bronsted acidic ionic liquid at ambient pressure and low temperature[J].Hydrometallurgy, 2009, 99 (1) :33.
[10] Sun H, Li S Q, Chen H, Liu J C, Liu H L.Physical properties of 1-alkyl-3-methylimidazolium hydrosulfate[J].Chemistry Research, 2008, 19 (3) :32. (孙华, 李胜清, 陈浩, 刘俊超, 刘汉兰.1-烷基-3-甲基咪唑硫酸氢盐的物理性状研究[J].化学研究, 2008, 19 (3) :32.)
[11] Orgul S, Atalay U.Reaction chemistry of gold leaching in thiourea solution for a Turkish gold ore[J].Hydrometallurgy, 2002, 67 (1) :71.
[12] Kim Changsok, Zhang T A, Mu W Z, Jong Taerok, Zeng Y, Jiang X L.Thermody namics of gold chlorination leaching process[J].Chinese Journal of Rare Metals, 2012, 36 (1) :129. (金创石, 张廷安, 牟望重, 郑大录, 曾勇, 蒋孝丽.液氯化法浸金过程热力学[J].稀有金属, 2012, 36 (1) :129.)
[13] Chen C K, Lung T N, Wan C C.A study of the leaching of gold and silver by acidothioureation[J].Hydrometallurgy, 1980, 5 (2) :207.
[14] Long H Z.Effect of sulfur dioxide on anodic process of gold electrode in thiourea solution[J].Nonferrous Metals (Mineral Processing Section) , 2002, (5) :33. (龙怀中.硫脲浸金过程中亚硫酸的促进作用[J].有色金属 (选矿部分) , 2002, (5) :33.)
[15] Wang W Z, Han M M.Experimental research on cyanide leaching of an oxidized gold ore[J].Metal Mine, 2013, (1) :80. (王伟之, 韩苗苗.某氧化型金矿石氰化浸出试验[J].金属矿山, 2013, (1) :80.)
[16] Whitehead J A, Zhang J, McCluskey A, Lawrance G A.Comparative leaching of a sulfidic gold ore in ionic liquid and aqueous acid with thiourea and halides using Fe (III) or HSO5-oxidant[J].Hydrometallurgy, 2009, 98 (3) :276.
[17] Li Y W, Wu D D, Zhao G N.The impact of leaching gold of thiourea about time, C (H2SO4) and C (Fe3+) [J].Environmental Science and Management, 2008, 33 (2) :49. (李玉文, 吴德东, 赵光楠.浸出时间、H2SO4和Fe3+浓度对硫脲浸金的影响[J].环境科学与管理, 2008, 33 (2) :49.)