文章编号:1004-0609(2012)07-2075-07
钙热还原二氧化钛的钛粉制备及其中间产物CaTiO3的成因
万贺利1, 2, 3, 4,徐宝强1, 2, 3, 4,戴永年1, 2, 3, 4,杨 斌1, 2, 3, 4,刘大春1, 2, 3, 4
(1. 昆明理工大学 真空冶金国家工程实验室,昆明 650093;
2. 昆明理工大学 云南省复杂有色金属资源清洁利用国家重点实验室,昆明 650093;
3. 昆明理工大学 云南省有色金属真空冶金重点实验室,昆明 650093;
4. 昆明理工大学 冶金与能源工程学院,昆明 650093)
摘 要:通过热力学计算以及XRD、SEM和EDS等测试手段,研究TiO2钙热还原制备钛粉过程中钛酸钙 (CaTiO3)的形成原因。热力学计算表明:当温度高于800 K时,添加剂CaCl2水解产物CaO与TiO2生成CaTiO3的反应以及还原副产物CaO与TiO2生成CaTiO3的反应均满足反应发生的热力学条件。实验研究表明:CaTiO3的生成主要是由添加剂CaCl2水解生成的CaO与TiO2烧结反应所致,CaTiO3的量随着CaCl2添加量的增加而增加,且CaTiO3更容易被还原为金属钛。当CaCl2与TiO2的质量比约为1:4时、在1 273 K下还原时间为6 h时,反应过程中的CaTiO3被完全还原为金属钛粉,该粉末具有不规则外形,颗粒粒径为8~15 μm。经EDS分析,金属钛粉中钛的质量分数达到99.55%。
关键词:钛;二氧化钛;氯化钙;钛酸钙;钙热还原
中图分类号:TF823 文献标志码:A
Preparation of titanium powders by
calciothermic reduction process of titanium dioxide and formation cause of intermediate CaTiO3
WAN He-li1, 2, 3, 4, XU Bao-qiang1, 2, 3, 4, DAI Yong-nian1, 2, 3, 4,YANG Bin1, 2, 3, 4, LIU Da-chun1, 2, 3, 4
(1. National Engineering Laboratory for Vacuum Metallurgy,
Kunming University of Science and Technology, Kunming 650093, China;
2. State Key Laboratory Breeding Base of Complex Nonferrous Metal Resources Clear Utilization in Yunnan Province,
Kunming University of Science and Technology, Kunming 650093, China;
3. Key Laboratory for Nonferrous Metals Vacuum Metallurgy of Yunnan Province,
Kunming University of Science and Technology, Kunming 650093, China;
4. Faculty of Metallurgy and Energy Engineering, Kunming University of Science and Technology, Kunming 650093, China)
Abstract: The formation cause of perovskite calcium titanate (CaTiO3) in calciothermic reduction process of titanium dioxide to prepare the titanium powders was investigated by thermodynamic calculation, XRD, SEM and EDS. Thermodynamic calculations indicate that the reactions of CaO hydrolyzed from the additive of CaCl2 to form CaTiO3 and the reduction by-product of CaO reacted with TiO2 to form CaTiO3 at the temperature beyond 800 K, satisfy the thermodynamic reaction conditions. The experimental results demonstrate that CaO is produced by the hydrolysis of CaCl2, and the large amount of CaTiO3 is generated in the sintering reaction of CaO with TiO2. Furthermore, with increasing the amount of CaCl2, CaTiO3 increases and is easily reduced to titanium. When the mass ratio of CaCl2 to TiO2 is about 1:4, the reduction temperature is 1 273 K and the reduction time is 6 h, CaTiO3 is completely reduced to titanium with irregular shape and particle size of 8-15 μm, and the mass fraction of titanium powder is 99.55% by EDS analysis.
Key words: titanium; titanium dioxide; calcium chloride; perovskite calcium titanate; calciothermic reducation
钛具有密度低、强度高、耐热、无磁和可焊等优点,在军事领域以及石油、化工、冶金和医疗等民用领域得到了广泛的应用,钛及钛合金已成为国民经济建设的一种重要的稀有金属结构材料[1]。现行的金属钛工业生产方法为克劳尔法(Kroll法,又名镁还原法)[2]。该方法存在工艺流程繁琐、生产周期长、能耗高、成本高及环境污染严重等问题,从而限制了钛的生产与应用[3]。目前,金属钛的制备新方法成为研究热点,如二氧化钛的熔盐电解法(FFC)[4-5]、钙热还原法(OS)[6]、导电介入还原法(EMR)[7-8]、机械化学法(MCP)[9]和预成型还原法(PRP)等[10-11]。
日本东京大学OKABE等[11]研究了PRP工艺:将TiO2粉、CaC12、CaO和粘合剂经过搅拌器充分混合,在乙醇和乙醚中加入5%的硝化纤维作为定型物质,混合压制成型。预成型的混合物在还原之前经过 1 073 K烧结除去其中的粘结剂和水分,然后,将烧结块在1 273 K左右温度下连续还原6 h,得到海绵钛,经酸洗和干燥得到钛粉。PRP法工艺简单,热效率高,来自反应器的污染小,可控制产品的微观结构,与电化学法相比,熔盐的使用量大幅度减少。但该反应装置需要焊接密封,且需要加入一定量的海绵钛吸附反应器中的空气,使成本大大的增加。在本文作者的前期研究中,利用PRP原理以颜料级TiO2粉(>98%)为原料、CaC12为添加剂,将物料充分混合后压片,将片状混合物与金属钙一起放入螺纹密封的高纯石墨坩埚中进行还原反应。与PRP工艺相比,反应器内不添加海绵钛,对密闭的反应器采用螺纹密封使得工艺操作更加简便,省去了单独的烧结过程且只用CaC12作为添加剂,在温度1 273 K下还原6 h后制得了钛 粉[12-13]。
早期的研究中,人们认为TiO2被还原过程为TiO2→Ti4O7→ Ti3O5→Ti2O3→TiO→Ti[14]。但目前在许多新方法如SUZUKI等[15]及TAKENAKA和MASTSUO[16]的研究中都已发现中间化合物CaTiO3的存在,这主要是由于加入CaO或者生成副产物CaO,使得反应过程中不可避免地出现了CaTiO3中间化合物,但对CaTiO3的作用与影响均未见详细的研究报道。本文作者在实验过程也发现了CaTiO3的存在,且不同的条件下中间产物CaTiO3的行为差异明显,直接影响钛粉的制备过程。因此,本文作者从热力学分析、添加剂CaC12、反应时间及温度等方面对TiO2钙热还原过程中CaTiO3的行为进行研究,为探讨钙蒸气还原TiO2过程机理奠定基础。
1 实验
1.1 实验原料
实验中使用的TiO2(98.6%)粉为颜料级锐钛型,其杂质含量如表1所列。盐酸和无水CaCl2(>99%,质量分数)均为分析纯(AR);金属钙(Ca含量>98.7%,质量分数)作为还原剂。
表1 原料TiO2的杂质含量
Table 1 Content of impurities in raw material TiO2 (mass fraction)

1.2 实验设备
选择真空炉为反应装置加热,保护其不被氧化,真空炉结构示意图如图1所示。
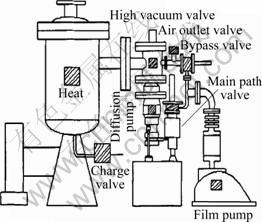
图1 立式真空反应炉示意图
Fig. 1 Schematic diagram of vertical vacuum furnace
1.3 实验步骤
取一定量的TiO2和无水CaCl2,研磨混合均匀后在353~393 K下干燥4 h,将混合物在2 MPa下制成d 20 mm×7 mm片状物块,然后置于自制的多孔不锈钢坩埚中(如图2中4所示),并将金属钙块(m(Ca): m(TiO2)≈2:1)置于下层不锈钢坩埚中(如图2中7所示)。将两不锈钢坩埚按图2放置后放入螺纹密封的高纯石墨坩埚中(如图2中1所示),将石墨坩埚置于真空炉(如图1)内,真空炉内真空度约为20 Pa时开始加热升温,当温度升至1 273 K后保温一定时间,反应结束后冷却至室温,取出块状产物,将产物进行破碎处理,用蒸馏水和稀盐酸(3%~5%,质量分数)反复进行酸洗和过滤,最后,将过滤得到的产物在真空炉中于373 K下干燥6 h后得到钛粉。
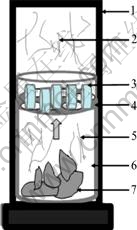
图2 实验反应装置示意图
Fig. 2 Schematic illustration of experimental apparatus: 1—Graphite crucible; 2—Ca vapor; 3—(TiO2+CaCl2) pieces; 4—Stainless crucible A; 5—Ca vapor; 6—Stainless crucible B; 7—Ca
1.4 分析测试
采用Rigaku D/max-3B型X射线衍射仪分析挥发CaCl2后的物相与还原产物的物相,扫描区间为10°~ 90°。采用Philips XL30ESEM-TMP型扫描电子显微镜观察钛粉形貌,用能谱仪(EDAX产PHOENIXTM)分析钛粉中的元素含量。
2 结果与讨论
2.1 CaTiO3的形成分析
图3(a)所示为不添加CaCl2在1 273 K下还原时间6 h时还原产物经酸洗后的XRD谱。可见,还原产物中除存在Ti外还有未被完全还原的TiO和CaTiO3。图3(b)所示为在添加CaCl2(m(CaCl2):m(TiO2)=1:4)后于1 273 K下烧结2 h产物的XRD谱。可以看出,经烧结后也有CaTiO3生成。将烧结产物在1 273 K下还原6 h后产物中的CaTiO3完全消失,最终产物只有CaO和Ti(见图3(c))。

图3 原料烧结产物和还原产物的XRD谱
Fig. 3 XRD patterns of sintered product and reduced product: (a) Reduction product without adding CaCl2; (b) Sintered product with adding CaCl2; (c) Reduction product with adding CaCl2
根据上述实验结果可知,可能导致产物中含有CaTiO3的原因主要有两方面:1) 钙热还原过程中生成中间产物CaTiO3;2) 由于无水CaCl2在物料混合过程中吸水,在加热过程中含有结晶水的CaCl2受热发生水解生成CaO,在高温下CaO与TiO2烧结生成CaTiO3。
据文献[14, 17],TiO2制备金属钛的过程为TiO2→ Ti4O7→Ti3O5→Ti2O3→TiO→Ti,其可能发生的主要反应如下:
TiO2(s)+1/4Ca(g)=1/4Ti4O7(s)+1/4CaO(s) (1)
TiO2(s)+1/5Ca(g)=1/5Ti4O7(s)+1/5CaTiO3(s) (2)
Ti4O7(s)+1/3Ca(g)=4/3Ti3O5(s)+1/3CaO(s) (3)
Ti3O5(s)+1/2Ca(g)=3/2Ti2O3(s)+1/2CaO(s) (4)
Ti2O3(s)+Ca(g)=2TiO(s)+CaO(s) (5)
TiO(s)+Ca(g)=Ti(s)+CaO(s) (6)
CaO(s)+TiO2(s)=CaTiO3(s) (7)
CaTiO3(s)+2Ca(g)=Ti(s)+3CaO(s) (8)
根据热力学手册[18],以TiO2转变成Ti4O7为例,对最终TiO和CaTiO3还原生成Ti进行热力学计算。图4所示为在钙的饱和蒸气压下反应(1)、(2)、(6)~(8)的?GT与T的关系。可以看出,TiO2与钙蒸气反应生成CaO时的?GT大于生成CaTiO3时的?GT,进而说明在TiO2被还原后更容易生成副产物CaTiO3。从反应 (6)和(8)中?GT与T的关系可以看出,钙蒸气还原CaTiO3时的?GT远远小于还原TiO时的?GT,表明在该条件下生成的CaTiO3与钙蒸气充分接触后更容易被还原成金属钛。但图3(a)中未加入任何添加剂时Ca与TiO2反应后,表面形成了致密层,阻碍钙蒸气扩散至料块内部与CaTiO3和TiO充分接触将其还原,如图5(a)所示。因此,图3(a)所示的物相中只有部分TiO2被还原为Ti,而其余被还原成TiO,生成了CaTiO3。
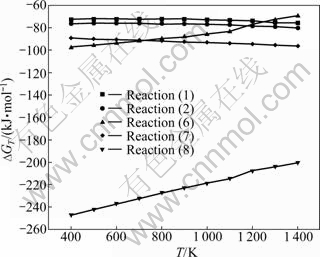
图4 反应 (1)、(2)和(6)~(8)的?GT与T的关系
Fig. 4 Relationship between ?GT and T of reactions (1), (2) and (6)-(8)

图5 不同成分原料还原产物的SEM像(T=1 273 K, t=6 h)
Fig. 5 SEM images of reduction products from raw materials with different compositions (T=1 273 K, t=6 h): (a) m(CaCl2): m(TiO2)=0; (b) m(CaCl2):m(TiO2)=1:4
根据文献[17],当以 CaCl2作为熔盐时,电解中会有中间物质CaTiO3形成。因此,可推测在TiO2钙热还原得到金属钛的过程中添加剂CaCl2的水解产物CaO与TiO2烧结生成CaTiO3。文献[19]表明,MgCl2·H2O发生水解反应生成MgO和HCl,CaCl2吸水后也应有相似的性质,在高温条件下直接发生水解反应。其反应式如下:
CaCl2·2H2O(s)=Ca(OH)2(s)+2HCl(g) (9)
Ca(OH)2(s)=CaO(s)+H2O(g) (10)
通过热力学计算得到反应方程(9)~(10)的?GT与T关系,如图6所示。由图6可知,反应在温度高于800 K时,均有?GT<0,即在800 K以上反应式(9)~(10)都可能进行。生成的CaO与TiO2烧结生成CaTiO3,其反应式为方程式(7),因此,图3(b)中CaCl2与TiO2的混合物在1 273 K下烧结2 h后物相中主要为TiO2和CaTiO3。当添加CaCl2后除部分水解外,CaCl2在反应体系中随着温度上升将有部分挥发,从而在反应块表面形成了许多孔洞,这将增加后续钙蒸气与被还原物的接触界面,有利于充分还原得到金属钛,如图5(b)所示。因此,图3(c)中添加CaCl2后经还原的产物中只有Ti和CaO的物相。
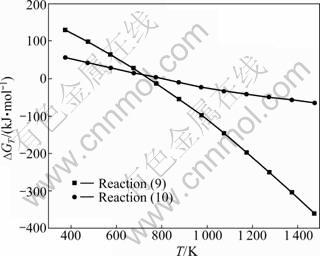
图6 反应(9)~(10)的?GT与T的关系
Fig. 6 Relationship between ?GT and T of reactions (9)-(10)
2.2 不同因素对CaTiO3生成的影响
2.2.1 添加剂CaCl2的影响
分别将不同质量比的CaCl2与TiO2(m(CaCl2): m(TiO2)为1:6, 1:4, 1:2.5, 1:2, 1:1.5, 1:1, 2:1)混合压片后在1 273 K下进行烧结实验,保温时间为2 h,过程中有CaCl2挥发现象。图7所示为在相同条件下添加比例为1:4和1:1.5时烧结后产物的XRD谱。
由反应式(9)~(10)可知,在混合物料的过程中,添加剂CaCl2吸水后变成含结晶水的CaCl2(CaCl2·
2H2O),在高温下水解生成CaO,CaO将与TiO2烧结生成CaTiO3,如反应式(7)所示。图7中的分析结果证实,CaCl2水解后生成的CaO完全与TiO2烧结生成CaTiO3。图7(a)中TiO2的衍射峰强度与图7(b)的基本相同, 然而CaTiO3的衍射峰强度明显弱于图7(b)中的,说明随着CaCl2与TiO2质量比的增大,生成的CaTiO3有增多的趋势。这主要是由于添加剂CaCl2的增加使生成的CaO与TiO2烧结的量也逐渐增多。因此,可以确定CaCl2的添加量是影响CaTiO3生成量的主原因素之一,CaCl2的添加量越多,则CaTiO3的生成量越多。
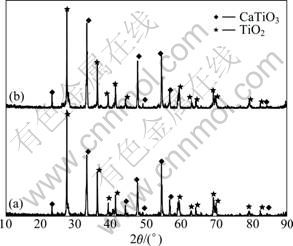
图7 加入不同量的CaCl2烧结后产物的XRD谱(T=1 273 K, t=2 h)
Fig. 7 XRD patterns of sintered products with different amounts of CaCl2 (T=1 273 K, t=2 h): (a) m(CaCl2):m(TiO2)= 1:4; (b) m(CaCl2):m(TiO2)=1:1.5
图8所示为m(CaCl2):m(TiO2)=1:4时在1 273 K烧结2 h后产物的SEM像。从图8(a)可以看出,物料表面及内部存在大量的孔隙且分布较均匀,这主要是因为在1 273 K下,CaCl2大量挥发以及CaCl2·2H2O水解放出气体,有效地增大了气-固还原反应的接触面积。当CaCl2的加入量增大时(如m(CaCl2):m(TiO2)= 1:1.5),从图8(b)中可以看出,基本没有孔结构,这是由于大量的CaCl2会与CaO形成固熔体[20]。当加入大量的CaCl2后,除了有利于形成CaTiO3外,形成的大量固熔体将阻碍钙蒸气向块体内部扩散,抑制气-固还原反应。
2.2.2 反应时间的影响
图9所示为1 273 K、还原时间分别为1、4、6和8 h及m(CaCl2):m(TiO2)=1:4时得到的还原产物的XRD谱。图9(a)和(b)所示分别为反应时间为1和4 h还原产物的XRD谱。可见,产物中除了副产物CaO及部分CaO吸水生成的Ca(OH)2和还原产物金属钛外,还有少量的CaTiO3,说明CaTiO3是TiO2→Ti4O7→ Ti3O5→Ti2O3→TiO→Ti转化过程中的产物,这与前面反应式(1)~(8)的热力学分析结果是一致的。当还原时间较短时,CaTiO3未能完全被钙蒸气进一步还原成金属钛而存在于产物中。
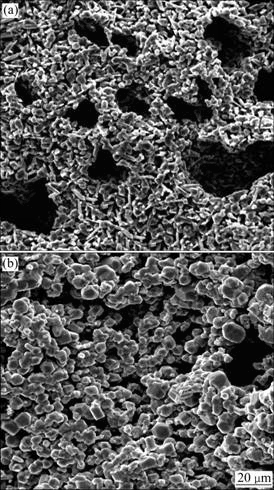
图8 加入不同量的CaCl2烧结后产物的SEM像(T=1 273 K, t=2 h)
Fig. 8 SEM images of sintered products with different amounts of CaCl2 (T=1 273 K, t=2 h): (a) m(CaCl2):m(TiO2)= 1:4; (b) m(CaCl2):m(TiO2)=1:1.5
当反应温度为1 273 K时,反应时间达到6 h后CaTiO3物相消失,表明其完全被还原为金属钛,如图9(c)所示。由此可以说明,在恒定的反应温度下,CaTiO3是一种反应中间物质,最终可以还原为金属钛,这与反应(8)热力学分析得到的结论一致。将反应时间延长至8 h时会有另一种杂质TiC生成,如图 9(d)所示,这是可能由于产物钛(Ti)与石墨反应器(C)接触,在高温状态下生成了杂质TiC。
2.3 钛粉的表征
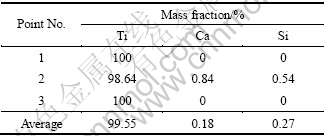
由于在钙热还原TiO2过程中,CaTiO3主要来源于CaCl2水解产物CaO与TiO2烧结反应,这将有助于TiO2被还原成金属钛,但考虑到添加剂CaCl2的挥发作用,因此,要适当控制CaCl2的含量。将m(CaCl2): m(TiO2)=1:4的片状混合物在1 273 K还原6 h,还原产物经酸洗和干燥,得到的最终产物的XRD谱如图10所示。其各衍射峰均与PDF卡片中(65-9622)的衍射峰一致,表明得到的产物为六方晶胞的金属钛粉。对其进行SEM分析,并任取3个不同的点利用EDS对其成分进行表征,结果如图11所示。由图11可以看出,钛粉颗粒具有不规则的外形,颗粒尺寸为8~15 μm。3个点的成分如表2所列,表明钛含量(质量分数)≥99.55%。由于原料为颜料级TiO2,所以,还含有Ca和Mg等元素。
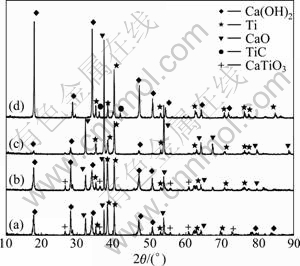
图9 不同还原时间产物的XRD谱
Fig. 9 XRD patterns of reduction products at different reduction times: (a) t=1 h; (b) t=4 h; (c) t=6 h; (d) t=8 h
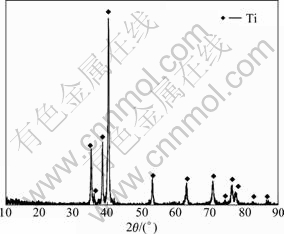
图10 金属钛粉的XRD谱
Fig. 10 XRD pattern of titanium powders
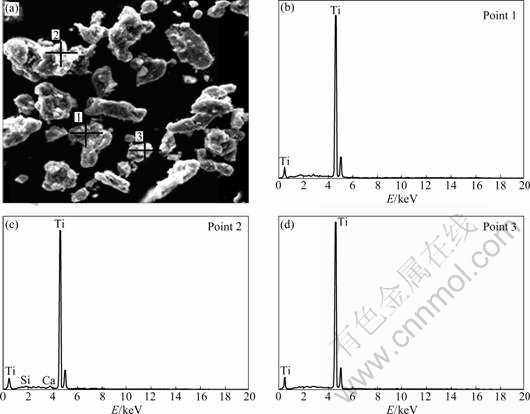
图11 金属钛粉的SEM像和点1, 2和3的EDS分析结果
Fig. 11 SEM image (a) and EDS analysis results ((b)-(d)) of titanium powders at points 1-3
表2 图11(a)中1、2和3的元素组成
Table 2 Element compositions of points 1-3 in Fig. 11(a)
3 结论
1) 热力学分析和实验表明,在钙热还原TiO2制备钛粉的过程中不可避免地产生了CaTiO3,主要是由于在还原过程中生成CaTiO3及在加入添加剂CaCl2后,CaCl2水解生成的CaO在高温下与TiO2烧结生成CaTiO3。
2) 随着CaCl2添加量的增加,生成的CaTiO3增加,且CaCl2挥发造成还原物料多孔,有利于气-固还原反应。但加入过多的CaCl2使反应物料表面熔融,抑制钙蒸气不断向物料内的扩散和迁移。
3) 当CaCl2与TiO2质量比为 1:4、反应温度为 1 273 K、反应时间为6 h时,最终得到单相晶胞为六方晶胞结构的钛粉,该粉末具有不规则外形,颗粒尺寸为8~15 μm,EDS分析其平均纯度达到99.55%。
REFERENCES
[1] 杜继红. 钛提取技术进展[J]. 稀有金属材料与工程, 2008, 37(10): 1872-1875.
DU Ji-hong. Research progress of titanium production technology [J]. Rare Metal Materials and Engineering, 2008, 37(10): 1872-1875.
[2] KROLL W. The production of ductile titanium [J]. Transactions of Electrochemical Society, 1940, 78: 35-47.
[3] 郑海燕, 卢金文, 沈峰满. TiO2直接制备金属钛技术新进展[J]. 过程工程学报, 2009, 9(6): 448-451.
ZHENG Hai-yan, LU Jin-wen, SHEN Feng-man. New technologies on direct production of metallic titanium from TiO2 [J]. The Chinese Journal of Process Engineering, 2009, 9(6): 448-451.
[4] FRAY D J. Electrochemical processing using slags [C]// Proceedings of the 7th International Conference on Molten Slags Fluxes and Salts. South Africa: South Africa Institute of Mining and Metallurgy, 2004: 6-12.
[5] MA Meng, WANG Di-hua, WANG Weng-guang. Extraction of titanium from different titania precursors by the FFC Cambridge process [J]. Journal of Alloys and Compounds, 2006, 420: 37-45.
[6] SUZUKI R O. Calciothermic reduction of TiO2 and in situ electrolysis of CaO in the molten CaCl2 [J]. Journal of Physic and Chemistry of Solids, 2005, 66: 461-465.
[7] OKABE T H, WASEDA Y. Producing titanium through an electronically mediated reaction [J]. Journal of Metals, 1997, 49(6): 28-32.
[8] OKABE T H, SADOWAY D R. Metallothermic reduction as an electronically mediated reaction [J]. Journal of Materials Research, 1998, 13: 3372-3376.
[9] FROES. Reduction of metal oxides through mechanochemical processing: USA, 6152982 [P]. 2000-12-28.
[10] ONO K, RYOSUKE O SUZUKI. A new concept for producing Ti sponge: Calciothermic reduction [J]. JOM, 2002, 54: 56-58.
[11] OKABE T H, TAKASHIOD A, YOSHITA K A MITSU D A. Titanium powder production by perform reduction process (PRP) [J]. Journal of Alloys and Compounds, 2004, 364: 156-163.
[12] 宋建勋, 徐宝强, 杨 斌, 林大志. 镁热还原二氧化钛制取金属钛的实验研究[J]. 轻金属, 2009(12): 43-48.
SONG Jian-xun, XU Bao-qiang, YANG Bin, LIN Da-zhi. Research of producing titanium by magnesiothermic reduction process [J]. Light Metal, 2009(12): 43-48.
[13] XU Bao-qiang, YANG Bin, WAN He-li, SEN Wei, DAI Yong-nian, LIU Da-chun. Preparing titanium powders by calcium vapor reduction process of titanium dioxide [C]// Proceedings of the 140th Annual Meeting & Exhibition. New York: John Wiley and Sons Incorporation, 2011: 501-508.
[14] ALEXANDER D T L, SCHWANDT C, FRAY D J. The electro-deoxidation of dense titanium dioxide precursors in molten calcium chloride giving a new reaction pathway [J]. Electrochimica Acta, 2011, 56: 3286-3295.
[15] SUZUKI R, NAOTO K, KEI-ICHI K Y, DAISUKE Y, SHOGO O. Electrolysis of CaO in the molten CaCl2 for direct reduction of TiO2 [C]// Proceedings of the 12th World Conference on Titanium (Ti-2011). Beijing, 2011: 82.
[16] TAKENAKA T, MASTSUO H. Electrodeposition of Ti in molten salt at high temperature [C]// Proceedings of the 12th World Conference on Titanium (Ti-2011). Beijing, 2011: 61.
[17] 李泽全, 张 娜, 白晨光, 陈小亮, 陶长元. TiO2电极中O2-的形成及迁移过程研究[J]. 稀有金属材料与工程, 2010, 39(3): 473-476.
LI Ze-quan, ZHANG Na, BAI Chen-guang, CHEN Xiao-liang, TAO Chang-yuan. Study on formation and transportation process of O2- in TiO2 electrode [J]. Rare Metal Materials and Engineering, 2010, 39(3): 473-476.
[18] 伊赫桑·巴伦, 程乃良, 牛四通, 徐桂英. 纯物质热化学数据手册[M]. 北京: 科学出版社, 2003: 209-1696.
YIHESANG Balun, CHENG Nai-liang, NIU Si-tong, XU Gui-ying. Thermochemical data of pure substances manual [M]. Beijing: Science Press, 2003: 209-1696.
[19] 周宁波, 肖 华, 陈白珍, 侯朝辉. 铵光卤石热脱水及热分解动力学[J]. 中南大学学报: 自然科学版, 2008, 39(4): 311-314.
ZHOU Ning-bo, XIAO Hua, CHEN Bai-zhen, HOU Zhao-hui. Dehydration and thermal decomposition kinetics on ammonium carnallite in flowing air condition [J]. Journal of Central University: Science and Technology, 2008, 39(4): 311-314.
[20] SUZUKI R O, TERANUMA K, ONO K. Calciothermic reduction of titanium oxide and in-situ electrolysis in molten CaCl2 [J]. Metallurgical and Materials Transactions B, 2003, 34: 287-294.
(编辑 陈卫萍)
基金项目:国家自然科学基金资助项目(51004085);云南省应用基础研究计划项目(2011FB039)
收稿日期:2011-06-05;修订日期:2011-11-04
通信作者:徐宝强, 副教授;电话:0871-5161583; E-mail: kmxbq@126.com