DOI:10.19476/j.ysxb.1004.0609.2017.10.11
生物医用Ta-Zr合金的制备及性能
常 林,刘 珏,杨海林,阮建明
(中南大学 粉末冶金国家重点实验室,长沙 410083)
摘 要:采用粉末冶金方法,应用真空烧结技术对Ta-xZr(x=20, 30, 40, 50, 摩尔分数, %)合金进行研究,制备出力学性能良好的高致密Ta-Zr合金。利用X射线衍射仪(XRD)、扫描电子显微镜(SEM)、X射线能谱仪(EDS)和电子万能试验机对样品的相成分、表面形貌及力学性能进行检测与观察。结果表明:Ta-Zr合金烧结过程中没有第二相形成,有层片状Ta组织析出。抗拉强度在181.0~290.2 MPa范围内变化,弹性模量在16.1~20.9 GPa范围内变化,随Ta含量的增加均呈现出先增大后减小的趋势。其中Ta-30Zr与人体密质骨力学相容性好,有望成为理想的骨替代材料。
关键词:生物材料;Ta-Zr合金;析出相;密质骨;力学性能
文章编号:1004-0609(2017)-10-2046-07 中图分类号:TG146.4 文献标志码:A
生物材料又称生物医用材料,以材料的属性为分类标准可分为金属材料、有机高分子材料、无机非金属材料及其复合材料[1]。生物医用金属材料以其优异的力学性能和抗疲劳能力,是临床应用中使用最广泛的承力植入材料,此类材料在硬组织、软组织、医用口腔材料、关节植入和骨替代材料中均有应用[2]。研究发现医用金属材料在植入过程还需要考虑相容性的问题,其中力学相容性要求植入的材料具有的力学性能与人体组织相适应或相匹配,强度过低导致材料发生断裂失稳,过高会对周围组织产生破坏行为,使材料植入部位难以愈合[3]。
目前,国内外对生物医用Ta系合金的研究大多附属于对Ti-Ta-Nb-Zr(TNTZ)合金的研究中,马秀梅等[4]、SANKAGUCHI等[5]、ZHAO等[6]和吴全兴[7]对不同成分TNTZ合金进行了研究,但弹性模量过高和Ti的低耐磨性问题限制此材料的进一步发展。钽金属由力学性能优异、耐腐蚀性好、抗冲击性强被广泛应用于生物材料[4-7]中。金万军[8]将Ta含量提升到65%(质量分数),成功制备了高钽含量低弹模的Ta系合金。锆金属具有良好的生物相容性,刘方瑜[9]制备了Zr基非晶合金,并验证了Zr系金属细胞毒性较小,生物相容性好;且Zr能与Ta产生共析组织,有效降低材料的弹性模量。
本文作者选用Ta为主要原料,添加适量的Zr以形成析出相,采用粉末冶金方法制备出力学性能与密质骨匹配的Ta-Zr合金,探讨不同Zr含量对结构的影响,并着重研究其微观结构与力学性能之间的关系。
1 实验
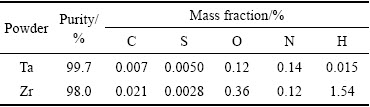
以宁夏东方钽业公司提供的钽粉和南宫市中洲合金材料有限公司提供的锆粉作为原料,其主要成分列于表1。钽粉纯度为99.7%,平均粒度8.45 μm,粒度分布在1.06~35.56 μm之间。锆粉纯度为98.0%,平均粒度11.86 μm,粒度分布在0.78~41.43 μm之间。
表1 钽粉、锆粉主要成分
Table 1 Main compositions of Ta and Zr powders
将Ta、Zr两种金属粉末按摩尔比5:5、6:4、7:3、8:2配制,并在200 r/min的混料机中混料6 h以上,保证粉末混合均匀。将混合好的粉末进行压制,烧结,烧结温度为1300 ℃,保温2 h,烧结过程中气压始终保持在10-2 Pa以下,防止发生氧化。烧结完成的样品冷却后进行超声波清洗以除去表面污物,然后检测其性能。
根据Archimedes法测量烧结体的密度,从而求出材料的相对密度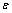 ,其计算公式[10]为
,其计算公式[10]为
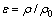 (1)
(1)
式中: 为Archimedes法测定的样品的密度,g/cm3;
为Archimedes法测定的样品的密度,g/cm3;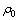 为材料的理论密度,g/cm3。
为材料的理论密度,g/cm3。
通过日本理学 D/max 2550全自动(18 kW)转靶 X 射线衍射仪对材料进行物相分析,采用美国 NOVATM Nano SEM230场发射扫描电镜观察材料表面微观形貌与组织,并用电镜中配备的能谱仪定点半定量分析试样中各区域元素种类与相对含量。用电子万能试验机(CMT4000)测量Ta-Zr合金的抗拉强度,并计算其弹性模量。
2 结果与分析
2.1 XRD结果分析
图1所示为采用粉末冶金法制备Ta-Zr合金的XRD谱。由图1可以看到,Ta-Zr合金XRD谱的背底平滑,峰形尖锐,说明合金结晶程度较高,晶体结构完整。对照标准PDF卡片(PDF#89-4763,PDF#89-3045)可知,样品在2θ为34.68°、36.32°、47.84°和56.94°处附近有4个较为明显的衍射峰,分别对应Zr的(002)、(101)、(102)和(110)晶面;在38.40°和55.38°附近的衍射峰分别对应Ta的(110)和(200)晶面,合金生长没有明显的择优取向,且各个衍射峰的强度与标准谱也相符很好,没有其他杂质峰。图1中由(a)至(d),随着样品中Ta含量增加,Ta峰的高度也明显增加。
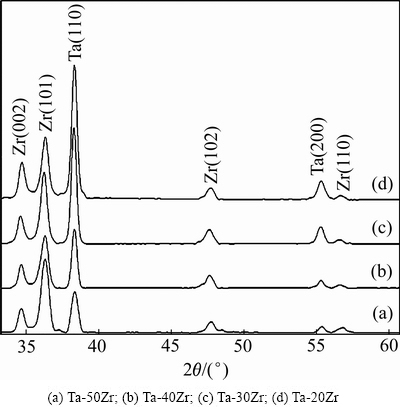
图1 Ta-Zr合金的XRD谱
Fig. 1 XRD patterns of Ta-Zr alloys
2.2 Ta-Zr合金的相图分析
Ta-Zr合金的相图如图2所示,本实验所选取的烧结温度1300 ℃(1573 K)在液相线以下,属于固相烧结。Ta-Zr合金在1060 K附近有一个共析点,说明Ta-Zr合金在冷却过程中会形成共析组织,并且在Ta-95Zr成分下会获得最多的共析组织。根据相图可知,本研究所选取的成分Ta-xZr(x=20, 30, 40, 50 (摩尔分数, %))均在亚共析区,冷却过程中形成体心立方结构的Ta和共析组织,共析组织由体心立方的Ta和密排六方的Zr构成。
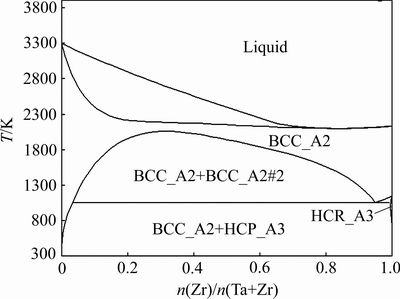
图2 Ta-Zr相图
Fig. 2 Phase diagram of Ta-Zr alloys
2.3 Ta-Zr合金的表面形貌
图3所示为1300 ℃下烧结的不同成分Ta-Zr合金的表面形貌的背散射图像。由图3可以看出,4种成分Ta-Zr合金表面相对平整,存在明暗差异的两种相成分。图4所示为表面不同区域的EDS元素成分分析图,能谱结果显示:偏亮的像主要为Ta,偏暗的像主要为Zr,Ta和Zr的富集区中均含有另一组元的固溶。图3(a)所示为Ta-50Zr的背散射图像,从图3(a)中可看到,大块深灰色Zr区域,其中夹杂着层片状Ta。造成这种现象的原因可能是烧结过程中Ta在Zr中有一定的固溶度,导致冷却过程中温度降低,Ta在Zr中析出,形成图3(a)所示的层片状Ta结构。在图3(b)中同样观察到分布规则的层片状Ta,但由于样品Zr摩尔分数比减少,Zr区域也相应有所减少。在图3(c)中发现了一些黑色孔洞,随着Zr含量的减少,Ta、Zr之间的互扩散变得十分有限,冷却过程中,Zr区域附近没有足够的Ta析出填补空隙,导致形成孔洞。图3(d)中由于Zr的摩尔分数只有20%,Zr中的层片状Ta几乎消失,其中固溶的Ta含量不足以致于无法形成像图3(a)中那样广泛分布的层片状Ta,而只能在靠近边缘处析出少量不规则的Ta结构。
为了进一步探讨Zr中析出的层片状结构的形貌,对析出现象较为明显的Ta-50Zr进行腐蚀观察。图5所示为Ta-50Zr腐蚀后的二次电子的电镜照片,由图5(a)~(d)腐蚀时间依次递增,腐蚀液采用V(HF):V(HNO3):V(H2O)=1:4:5的比例配制。由图5(a)可以看到,Ta-Zr合金内部较为紧密,表面连续且完整,无明显裂纹和孔洞等缺陷;且Ta在Zr中具有一定的固溶度,冷却过程中均匀析出,形成如图5(a)所示条纹状花样。图6所示为腐蚀后表面不同区域的能谱分析结果。由图6可看到,腐蚀后留下的岛屿状平台和Zr被腐蚀后显现出的层片状结构主要成分均为Ta。由于Ta的耐腐蚀性优于Zr,原来Zr富集区中的Zr被腐蚀后层片状Ta被保留了下来,而未被完全腐蚀的Ta富集区留在了样品表面。并且在图5(b)与(c)中可观察到明显的晶界,晶粒尺寸在10~20 μm之间,略大于颗粒尺寸,这与粉末烧结过程中晶粒长大有关。从图5(c)可以清晰地看出,被腐蚀后的Ta-Zr合金,层片状Ta整齐有规律的分布在被腐蚀的原Zr富集区中,厚度均匀且不到1 μm。图5(d)中腐蚀时间较长,Zr富集区已被完全腐蚀,表面留下层片状Ta结构沿晶界断开,且每个晶界中的Ta具有一定的取向性。
2.4 表观密度与相对密度
由式(1)可算出各组样品的表观密度,求出其与理论密度的比值,计算得到相对密度,其结果如表2所示。从表2可以看出,随着Zr组元成分的减少,材料的密度先升后降,相对密度则一直下降。Ta的密度16.654 g/cm3,Zr的密度为6.49 g/cm3,随着Ta摩尔分数的增加,Ta-Zr合金的密度随之上升。Ta的熔点较高,当Ta含量增加时,原子扩散变得不充分,孔隙度提高;当Ta的摩尔分数达到大于70%时,大量的Ta富集区得不到Zr的充分固溶,造成压制过程中形成的显微孔洞无法有效填补,孔洞的存在使合金的相对密度下降,在Ta-20Zr成分中这种现象尤为突出。当相对密度下降对密度改变的程度大于Ta含量升高对密度改变的程度时,密度出现下降的趋势。当Zr含量为30%时,材料表观密度达到最大值11.71 g/cm3。

图3 Ta-Zr合金的表面形貌
Fig. 3 Surface morphologies of Ta-Zr alloys
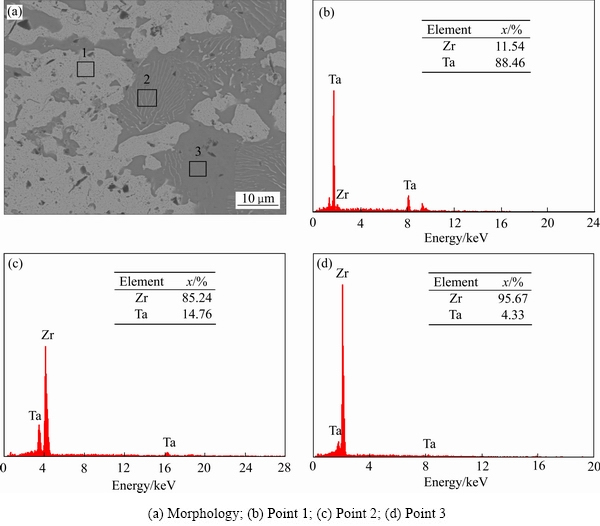
图4 Ta-Zr合金的表面形貌及元素成分分析
Fig. 4 Surface morphology of Ta-Zr alloy and elemental composition analysis

图5 Ta-50Zr合金腐蚀不同时间后的表面形貌
Fig. 5 Surface morphologies of Ta-50Zr alloy after corrosion for different time

图6 Ta-50Zr腐蚀后的表面形貌及元素成分分析
Fig. 6 Surface morphology of Ta-50Zr and elemental composition analysis
表2 各组分Ta-Zr合金的密度与相对密度
Table 2 Density and relative density of Ta-Zr alloys
2.5 力学性能
力学性能是评价骨组织修复材料的一项重要指标,理想的骨替代材料既能诱导成骨细胞生长,又能承受一定的载荷[11]。GEETHA等[12]研究认为密质骨的弹性模量在4.4~28.8 GPa之间不会产生明显的应力屏蔽问题。当植入材料的弹性模量比人骨高出十倍甚至百倍时,在植入骨与人体骨之间会产生局部应力集中,阻碍载荷的传递,这种现象称之为应力屏蔽。应力屏蔽现象严重时导致人体骨产生退化甚至分解[13-16],是骨替代材料中应避免的问题。拉伸强度和弹性模量是检测骨替代材料力学性能的重要指标,也是检测是否会发生应力屏蔽的重要依据。
通过计算得到各组分Ta-Zr合金的弹性模量如表3所列。由表3可知,随着Ta含量的增加,材料的抗拉强度先升后降,在Ta-30Zr时达到最高的290.2 MPa,对应的弹性模量为18.1 GPa。因此,本实验制备的Ta-Zr合金的力学性能符合骨替代材料的基本要求,能够辅助骨细胞的增长[17]。
表3 各组分Ta-Zr合金的力学性能
Table 3 Mechanical properties of Ta-Zr alloys

Ta-Zr合金的弹性模量与纯金属相比较低,可能是由于材料在冷却过程中析出的层片状Ta夹杂在Zr晶体中,界面之间的结合强度有限,在拉伸应力作用下,裂纹在界面结合处优先形成并沿着晶界扩展,使材料发生断裂失稳,导致材料的抗拉强度与弹性模量低于纯金属。人体密质骨的弹性模量为5~30 GPa[18],本研究制备的Ta-Zr合金的弹性模量与人体密质骨相近,符合骨替代材料的要求。当Ta含量从50%升至80%(摩尔分数)时,弹性模量与相对密度呈现出近乎相同的变化趋势。且当Ta含量大于70%(摩尔分数)时,由于材料中层片状析出Ta的减少导致孔洞增多,相对密度下降,弹性模量也相应降低。
图7所示为Ta-30Zr合金拉伸断口形貌,图7中最明显的是长度较长呈放射状的屋脊状撕裂岭(Tear ridge,TR),表面还存在着相互平行的解理阶(Cleavage step,CS),拉伸断口呈现出明显的河流状特征,但河流支流较少,呈现出穿晶断裂的特征,是典型的准解理断裂的断口形貌[19]。准解理断裂是介于解理断裂和韧性断裂之间的一种断裂形式,在应力应变的作用下,在材料不同部位产生解理裂纹源,裂纹先在水平方向进行扩展,当水平方向阻力过大时,沿垂直方向形成撕裂岭。撕裂岭往往伴随着韧窝带的形成,对提高材料的韧性有所帮助。

图7 Ta-30Zr合金拉伸断口形貌
Fig 7 Tensile fracture morphology of Ta-30Zr alloy
3 结论
1) 采用粉末冶金烧结工艺成功制备性能优异,力学相容性高的Ta-Zr生物材料。
2) Ta-Zr合金冷却过程中由于Ta在Zr中固溶度降低而析出,形成明显的层片状结构,高Ta含量会使这种析出组织减少。
3) 在1300 ℃的烧结温度下,Ta-30Zr相对密度较高,抗拉伸性能优异,弹性模量与人体密质骨接近,利于缓解力学性能不匹配所带来的应力屏蔽问题,有望成为理想的骨替代材料。
REFERENCES
[1] 阮建明, 邹俭鹏, 黄伯云. 生物材料学[M]. 北京: 科学出版社, 2004: 2-3.
RUAN Jian-ming, ZOU Jian-peng, HUANG Bai-yun. Biological materials science[M]. Beijing: Science Press, 2004: 2-3.
[2] 于振涛, 麻西群, 余 森, 张明华, 韩建业, 刘春潮. 生物医用钛合金的微纳化加工技术及最新进展[J]. 中国有色金属学报, 2010, 20(S1): s1008-s1012.
YU Zhen-tao, MA Xi-qun, YU Shen, ZHANG Ming-hua, HAN Jian-ye, LIU Chun-chao. Micro and nano machining technology of biomedical titanium alloys and development[J]. The Chinese Journal of Nonferrous Metals, 2010, 20(S1): s1008-s1012.
[3] MENG Q K, LIU Q, GUO S, ZHU Y Q, ZHAO X Q. Effect of thermo-mechanical treatment on mechanical and elastic properties of Ti-36Nb-5Zr alloy[J]. Progress in Natural Science: Materials International, 2015(3): 229-235.
[4] 马秀梅, 孙 威, 杨永建. 生物医用Ti-Nb-(Ta)-Zr合金的微观结构与性能[J]. 中国有色金属学报, 2010, 20(6): 1195-1202.
MA Xiu-mei, SUN Wei, YANG Yong-jian. Microstructures and properties of biomedical Ti-Nb-(Ta)-Zr alloys[J]. The Chinese Journal of Nonferrous Metals, 2010, 20(6): 1195-1202.
[5] SANKAGUCHI N, NIINOMI M, AKAHORI T, TAKADE J, TODA H. Relationships between tensile deformation behavior and microstructure in Ti-Nb-Ta-Zr system alloys[J]. Materials Science and Engineering C, 2005, 25: 363-369.
[6] ZHAO Y K, YAO Y, LIU W X. Fibroblast adhesion and proliferation on a new β type Ti-39Nb-13Ta-4.6Zr alloy for biomedical application[J]. Journal of Materials Science & Technology, 2006(2): 205-210.
[7] 吴全兴. 用氧化钙系铸型铸造的牙科用TNTZ钛合金的力学性能[J]. 钛工业进展, 2012, 29(1): 46.
WU Quan-xing. Mechanical properties of dental TNTZ titanium alloy cast by calcium oxide[J]. Titanium Industry Progress, 2012, 29(1): 46.
[8] 金万军. 生物医用Ti-Ta基合金的形状记忆效应和力学性能的研究[D]. 厦门: 厦门大学, 2009.
JIN Wan-jun, Shape memory effect and mechanical properties of biomedical Ti-Ta based alloys[D]. Xiamen: Xiamen University, 2009.
[9] 刘方瑜. Zr基块体非晶合金的生物相容性[D]. 哈尔滨: 哈尔滨工业大学, 2013.
LIU fang-yu. Biocompatibility of Zr based bulk amorphous alloy[D]. Harbin: Harbin Institute of Technology, 2013.
[10] 杨栋华, 邵慧萍, 郭志猛, 林 涛, 樊联鹏. 凝胶注模工艺制备医用多孔Ti-Co合金的性能[J]. 稀有金属材料与工程, 2011, 40(10): 1822-1826.
YANG Don-ghua, SHAO Hui-ping, GUO Zhi-meng, LIN Tao, FAN Lian-peng. Mechanical properties of porous Ti-Co alloy for medical application by gelcasting[J]. Rare Metal Materials and Engineering, 2011, 40(10): 1822-1826.
[11] REZWAN K, CHEN Q Z, BLAKER J J, ALDO R B. Biodegradable and bioactive porous polymer/inorganic composite scaffold for bone tissue engineering[J]. Biomaterials, 2006, 27(18): 3413-3431.
[12] GEETHA M, SINGH A K, ASOKAMANI R, GOGIA A K. Ti based biomaterials, the ultimate choice for orthopaedic implants: A review[J]. Progress in Materials Science, 2009, 54(3): 397-425.
[13] OH I H, NOMURA N, MASAHASHI N, HANADA S. Mechanical properties of porous titanium compacts prepared by powder sintering[J]. Materials Transactions, 2002, 43(3): 443-446.
[14] MORONI A, CAJA V L, EGGER E L, TRINCHESE L, CHAO E Y S. Histomorphometry of hydroxyapatite coated and uncoated porous titanium bone implants[J]. Biomaterials, 1994, 15: 926-930.
[15] SBERVEGLIERI G, COMINI E, FAGLIA G, ATASHBAR M Z, WLODRARSIK W. Titanium dioxide thin films prepared for alcohol microsensor applications[J]. Sensors and Actuators B, 2000, 66: 139-141.
[16] 奚正平, 汤慧萍, 王建永, 吴引江, 董领峰, 杨保军. 金属多孔材料力学性能的研究[J]. 稀有金属材料与工程, 2007, 36(3): 555-558.
XI Zheng-ping, TANG Hui-ping, WANG Jian-yong, WU yin-jiang, DONG ling-feng, YANG bao-jun. Study on the mechanical properties of porous metals[J]. Rare Metal Materials and Engineering, 2007, 36(3): 555-558.
[17] 谭小兵. 新型生物陶瓷对体外培养成骨细胞影响的初步实验研究[D]. 昆明: 昆明医学院, 2004.
TAN Xiao-bing. Preliminary experimental study on the effect of new type of biological ceramics on osteoblasts cultured in vitro[D]. Kunming: Kunming Medical College, 2004.
[18] 李 婧. 生物医用多孔钛镍(铌)合金的制备与性能研究[D]. 长沙: 中南大学, 2014.
LI Jing. Preparation and properties of biomedical porous titanium nickel(Nb) alloy[D]. Changsha: Central South University, 2014.
[19] 王晓丽. 粉末冶金法制备Nb-Si难熔合金及其组织演变与性能研究[D]. 哈尔滨: 哈尔滨工业大学, 2011.
WANG Xiao-li. Study on microstructure evolution and properties of Nb-Si refractory alloy prepared by powder metallurgy[D]. Harbin: Harbin Institute of Technology, 2011.
Fabrication and mechanical properties of Ta-Zr alloys for biomedical applications
CHANG Lin, LIU Jue, YANG Hai-lin, RUAN Jian-ming
(Skate Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China)
Abstract: Ta-xZr (x=20, 30, 40, 50, mole fraction, %) alloys with good mechanical properties and high density were prepared by powder metallurgy method and vacuum sintering technology. The composition of samples, surface morphologies and mechanical properties were characterized by X-ray diffractometry (XRD), scanning electron microscopy (SEM), X-ray energy dispersive spectroscopy (EDS) and electronic universal testing machine. The results show that lamellar Ta is observed without second phase during the sintering process. The tensile strength and the elastic modulus are observed with the Ta content varying at the range of 181.0-290.2 MPa and 16.1-20.9 GPa, respectively, which increases firstly and then decreases. The Ta-30Zr alloy is potentially useful in the hard tissue implants for the mechanical properties.
Key words: biomaterial; Ta-Zr alloy; precipitated phase; compact bone; mechanical property
Foundation item: Project(51274247) supported by the National Natural Science Foundation of China; Project (2016zzts033) supported by the Fundamental Research Funds for the Central Universities of Central South University, China
Received date: 2016-07-26; Accepted date: 2016-12-27
Corresponding author: RUAN Jian-ming; Tel: +86-731-88836827; E-mail: jianming@mail.csu.edu.cn
(编辑 李艳红)
基金项目:国家自然科学基金资助项目(51274247);中南大学中央高校基本科研业务费专项资金资助(2016zzts033)
收稿日期:2016-07-26;修订日期:2016-12-27
通信作者:阮建明,教授,博士;电话:0731-88836827;E-mail: jianming@mail.csu.edu.cn