“溶钾”真菌原生质体诱变育种与富钾页岩浸矿研究
汤小胖1,陈晔1,曹飞1, 2,孙德四1
(1. 九江学院 化学与环境工程学院,江西 九江,332005;
2. 北京科技大学 土木与环境工程学院,北京,100083)
摘要:以黑曲霉AN和青霉PHT为出发菌株,采用硫酸二乙酯(DES)对其原生质体进行诱变育种与钾矿物浸矿研究。研究结果表明:分别通过体积分数为3.0%和2.5%的DES处理出发菌株AN和PHT的原生质体,致死率分别为75.4%和78.6%,正突变率分别为23.5%和29.0%;获得的2株突变型黑曲霉ANM和青霉PHTM达到生长稳定期的时间分别比对应的出发菌株缩短24 h和36 h,且具有更大的细胞密度与产酸、产蛋白质和多糖的能力;浸出30 d,诱变菌株ANM和PHTM从富钾页岩中释放的K2O质量浓度分别比对应的出发菌株AN与PHT提高34.60%与28.52%,且主要浸矿阶段分别缩短4 d和3 d;混合诱变菌株浸出的K2O的质量浓度比单一诱变菌株ANM与PHTM分别提高13.40%和31.80%,主要浸矿阶段比出发菌株缩短3 d;混合诱变菌株对富钾页岩的破坏作用最为明显;在富钾页岩混合菌浸矿前10 d,没有明显的优势菌种,而浸矿15 d后,黑曲霉在群落中的比例显著上升,并最后取代青霉成为优势菌种。
关键词:“溶钾”真菌;原生质体诱变;硫酸二乙酯;生物浸出;提钾;富钾页岩
中图分类号:TD925.5;Q939.97 文献标志码:A 文章编号:1672-7207(2014)10-3329-10
Breeding of potassium-dissolved Fungi by protoplastmutagenesis and bioleaching potassium-rich shale
TANG Xiaopang1, 2, CHEN Ye1, CAO Fei1, 2, SUN Desi1
(1. School of Chemistry and Environmental Engineering, Jiujiang University, Jiujiang 332005, China;
2. School of Civil and Environmental Engineering, University of Science and Technology Beijing,
Beijing 100083, China)
Abstract: The original strains Aspergillus niger AN and Penicillium heteromorphum PHT were studied by diethylsulfate (DES) induced protoplast mutagenesis and bioleaching of potassium-rich shale. The results show the lethal rates of the original strains AN and PHT are 75.4% and 78.6%, and the positive mutant rates are 23.5% and 29.0% after being treated respectively by DES of 3.0% and 2.5% volume fractions. The two mutants of Aspergillus niger ANM and Penicillium heteromorphum PHTM screened from positive mutant strains reach stationary stages 24 h and 36 h respectively ahead of the corresponding original strains, and have higher cell concentrations and higher ability of producing organic acids and polysaccharides and proteins than those of original strains. After 30 d leaching, K2O concentrations in supernatants of the mutant stains ANM and PHTM are improved by 34.60% and 28.52%. And the mutant strains ANM and PHTM can shorten the main leaching phases of 4 d and 3 d respectively, than those of the two corresponding original strains. After bioleaching for 30 d with the mixture of the two mutant strains ANM and PHTM, the K2O concentration in supernatant is 13.40% and 31.80% higher than those of the two mutant strains PAM and ATM respectively, and the mixture can shorten the main leaching time of 3 d in comparison with the original strains. The SEM and XRD analyses of potassium-rich shale surfaces before and after leaching show that the mixture of PAM and ATM has the greatest corrosion and decomposition ability on shale. There is no obvious dominant culture in fungal community at the early 10 d bioleaching stage, but after 15 d, Aspergillus niger thrives and turns into the dominant culture in replacement of Penicillium heteromorphum.
Key words: potassium-dissolved fungi; diethylsulfate; protoplast mutagenesis; bioleaching; potassium release; potassium-rich shale
可溶性钾素能显著促进农作物生长,也常因其供应不足而对农作物产量与品质产生重要影响。尽管耕层土壤蕴含着丰富的钾资源,但因绝大部分(>90%)是水难溶性的,不能直接被植物吸收利用[1-3]。据统计,我国钾肥生产量只占世界的 0.34%,而消耗量占到世界的 14.7%。可见,我国钾肥供需矛盾非常突出。目前,国内外主要采用高能耗、高污染的的物理化学方法从含钾矿物中提取钾,鲜见有关使用微生物技术提取钾的实验研究或工业应用的相关报道。与传统的湿法冶金工艺相比,生物浸出具有工艺简单、成本低、无污染等优点[4-6],因此,开发环境友好的生物浸出提钾技术对发展生态与经济农业具有十分重要的意义。土壤中的不溶性钾主要赋存于硅酸盐矿物(钾长石、伊利石、云母等)中,目前有关利用微生物风化分解这类硅酸盐矿物的研究报道较多,但研究的主要目的是为了了解微生物在土壤的形成与演化、土壤肥力的形成、植物的矿物营养、矿物的生物淋滤、石质文物的保护、金属的富集与成矿等过程中所起的作用,而较少有人关注采用微生物浸矿技术开发利用储量巨大的钾矿资源的可行性。据已报道的含钾硅酸盐矿物微生物风化的实验结果可知,有较强的矿物风化分解能力且对 K,P,Si和Al 具有一定溶出效果的微生物均为异养菌(主要是细菌及真菌)。细菌中的“钾”细菌(主要指胶质芽孢杆菌(Bacillus mucilaginosus)、环状芽孢杆菌(Bacillus circulans)对硅酸盐矿物的分解能力较强,并能较好地释放其中的有价元素;真菌中的菌根真菌、岩生真菌(研究较多的主要有黑曲霉、青霉菌)等对矿物中的不溶性元素(特别是K)具有较好的溶出作用[7-9]。以上微生物主要被用来制备微生物菌肥。目前,已有大量有关硅酸盐矿物微生物风化机理研究报道,且一致认为“溶钾”微生物分泌的胞外多糖、有机酸及其在分解转化矿物的过程中新合成的蛋白质与矿物钾的转化密切相关。如胞外多糖具有络合功能与较强的黏附作用,可以显著促进细菌(真菌)-矿物聚集体的形成,增大菌体及代谢产物对矿物的风化作用面积[10-11];蛋白质(或酶)与钾矿粉诱导菌体表达载体蛋白有关,而这类蛋白酶是细胞主动运输钾离子时所必需的,“溶钾”细菌或真菌风化矿物过程中会通过相关功能基因组表达实现蛋白质调节,表达量增加的蛋白质点与细胞的信号传导通路、代谢调控改变有关[12];钾矿物风化作用是由菌体产生的有机酸水解和络合双重作用所致;细胞代谢产生的多种代谢物的协同作用对钾的浸出效果明显要高于单一代谢物的作用[13]。此外,微生物与矿物作用机制研究表明,硅酸盐矿物的风化过程包含微生物的直接黏附作用(主要指真菌菌丝生长所产生的机械破坏作用与大分子胞外聚合物的络解作 用)和微生物产生的小分子代谢物溶蚀的间接作用两部分,钾矿物中 K,Fe和Si 的溶出主要受间接作用机制的影响,Al 的溶出主要受直接作用机制的影响[14]。因此,“溶钾”微生物代谢产酸、蛋白质与多糖的能力直接影响其浸矿提钾效率。目前,所有有关钾矿物微生物浸出提钾技术仍处于理论与实验室研究阶段,制约其工业化应用的主要原因有:菌种代谢生长速度缓慢,生物浸矿周期长;不同环境筛选所得菌种产有机酸、胞外多糖与蛋白质的能力存在较大差异;菌种性能不稳定,多次传代培养后浸矿效率会降低。这些缺陷急需在生物浸矿过程中得到解决。微生物诱变育种是一种有效地提高其生长繁殖速度与代谢产物产量的手段。在生物湿法冶金领域,国内外有关浸矿菌种的诱变育种技术主要集中于铜矿、硫铁矿、稀土等重金属与贵金属的生物浸出[15]。但至今很少有关用于浸出钾的“溶钾”细菌与真菌诱变育种方面的报道,更无有关诱变后混合真菌浸出钾矿物及浸矿过程中真菌群落结构变化的相关研究报道。硫酸二乙酯(DES)是一种典型的烷化剂类化学诱变剂,因其对微生物中 DNA 具有较好的致突变性而已广泛应用于微生物药物与食品工业[16-17]。DES 诱变剂具有活泼的烷基化基团,与水反应先形成碳正离子,然后攻击 DNA 碱基中鸟嘌呤的 N-7 位、鸟嘌呤的 N-3 位和腺嘌呤的 N-3 位,导致相应部位的烷基化,破坏微生物的正常生物学功能,从而影响其遗传特性。本文选用2株真菌黑曲霉(Aspergillus niger, A·niger)和青霉(Penicillium heteromorphum, P·heteromorphum)作为出发菌株,采用硫酸二乙酯(DES)对它们的原生质体进行诱变育种,通过对诱变菌株的初筛与复筛及遗传稳定性培养,筛选出2株正突变菌A·niger ANM和P·heteromorphum PHM,并以出发菌株作为对照,采用单一与混合菌种对钾矿物进行浸矿提钾试验研究。通过对比分析诱变前后菌株的产酸、多糖与蛋白质及释钾能力的差异,真菌作用后钾矿物表面结构的变化,以及混合菌浸矿过程中群落结构的动态演替规律,以便为揭示“溶钾”真菌浸出钾矿物的作用过程和机制提供一些有用的 信息。
1 实验
1.1 实验矿样
实验用钾矿物为富钾页岩,购自浙江大学地质标本厂,矿样产地为安徽寿县,呈浅褐色,斑状结构。根据X线衍射分析,其主要矿物组成(质量分数)为:钾长石66.12%;伊利石12.25%;石英8.26%;白云母5.28%;通过原子吸收与分光光度法分析其化学组成,结果如表1所示。
1.2 出发菌株与培养基
试验选用的出发菌株为黑曲霉Aspergillus niger和青霉Penicillium heteromorphu,分别编号为AN与PHT,购买于中国普通微生物菌种保藏管理中心(CGMCC)。
2株出发菌株的孢子产生与菌丝体培养基为PDA培养基[9];原生质体再生培养基为PDA固体培养基;菌株发酵培养基为Czapek’s培养基;钾矿物浸矿液体培养基为去除含钾成分的Czapek’s培养基,其中,蔗糖30.0 g/L,Na2HPO4 1.0 g/L,MgSO4·7H2O 0.5 g/L,FeSO4·7H2O 0.01 g/L, NaCl 0.5 g/L,NaNO3 3.0 g/L。
探索实验表明:AN 菌的最佳生长温度为30 ℃,最佳初始pH为6.8;PHT菌的最适生长温度为28 ℃,最适初始pH为6.5~6.8。在装有90 mL浸矿培养基的250 mL的锥型瓶中,加入粒径≤75 μm的富钾页岩矿样5 g,分别接入孢子浓度为1×107 个/mL的AN与PHT菌,在温度为28~30 ℃、摇床转速为150~200r/min的条件下浸矿培养7 d,浸出液中K2O的质量浓度分别可达到35 mg/L与22 mg/L左右,表明2株出发菌种均具有一定分解富钾页岩的能力,并能释放其中的钾。
1.3 真菌DES诱变
出发菌株原生质体的制备与再生:取-90 ℃保藏的黑曲霉与青霉菌种各1管,接种于PDA斜面培养 基,28 ℃活化培养3~6 d。将生长旺盛的斜面孢子转接于液体PDA培养基中,28 ℃培养 30 h,过滤收集菌丝。将菌丝置于直径为6 cm的培养皿中,添加质量分数为1.5%的溶壁酶和1.5%纤维素酶于温度为30 ℃、转速为50~60 r/min的摇床上进行酶解2 h,制备原生质体。将制备好的原生质体离心(4 000 r/min,5 min)分离,然后用高渗透稳定剂洗涤,获得孢子浓度为107个/mL 的原生质体悬浮液。
1.3.1 硫酸二乙酯(DES)诱变
取已制备好的出发菌株原生质体悬浮液10 mL,分别加入装有90 mL含不同体积分数(1%,1.5%,2%,2.5%,3%,3.5%和4%)的DES的磷酸缓冲溶液的250 mL锥型瓶中,充分混合后,在温度为28~30 ℃、转速为150 r/min条件下处理30 min。然后取各诱变菌液1 mL,加入0.5 mL、质量分数为25%的Na2S2O3溶液终止反应,适当稀释后涂布于固体PDA培养基平板上;同时,设立平行对照组,于28~30 ℃下培养48 h后进行菌落计数,计算致死率,确定最佳诱变剂量并挑取该诱变剂量下的菌落进行初筛与复筛。菌株的正突变率由传代时间、生长稳定期和在发酵培养液中产酸与产胞外多糖与蛋白质的量共同决定。菌株的代谢能力通过装有90 mL发酵培养基的250 mL锥型瓶中进行培养测定,试验条件与1.2节中的相同。在培养过程中,每隔1 d测定发酵液中的pH、多糖与蛋白质浓度;诱变菌株的生长稳定期在以上同样条件下进行培养测定。
1.3.2 正突变菌株的遗传稳定性测定
将筛选出的相对较高代谢活性的正突变菌株在液体发酵培养基中连续传代培养7次,并于第7代测定培养液中的pH、多糖与蛋白质浓度,考察诱变菌株代谢活性的稳定性。
1.4 富钾页岩细菌浸矿实验
在250 mL锥型瓶中装入90 mL的浸矿培养基,接入对数生长期菌液(孢子初始浓度1.1×107个/mL),矿浆质量浓度45 g/L,在30 ℃、初始pH为6.8、转速为150 r/min 条件下连续浸出30 d,定期测定上清液中的K2O的浓度。设计7组试验浸矿体系,在培养基中接种不同菌株,每组做3个平行试验:1)接种菌株 AN;2)接种ANM;3)接种PHT;4)接种PHTM;5)接种AN+PHT(1:1);6)接种ANM+PHTM(1:1);7)对照组CK(不接菌)。
1.5 测试分析方法
浸出上清液中的钾离子采用ICP-AES(仪器型号为JY38S)测定,并以K2O进行计量;发酵液中多糖浓度通过UV-2102紫外可见分光光度计,苯酚-硫酸法测定;发酵液中蛋白质浓度用UV-2102紫外可见分光光度计,考马斯亮蓝G250染色法测定;pH用PHS-3C型pH计(上海雷磁仪器厂)测定;培养液及上清液中的孢子数量在XS-212生物显微镜(南京江南永新光学仪器)下用平板计数法测定;用SEM(TESCAN公司,型号为VEGIILSU)与XRD(日本Rigaku生产的D/Max- 2500型X线衍射仪)观察各真菌浸出前后矿样的表面微观形态及矿物结构变化。
1.6 浸矿过程中混合真菌的群落结构分析
本实验所使用的2株“溶钾”真菌的部分生理生化特征、表形特征存在明显的差异,青霉的直立菌丝的顶端有扫帚状的结构,其上生有成串的孢子,成熟的孢子呈青绿色(图1(b));而黑曲霉的直立菌丝顶端膨大成球状,球状结构的表面呈放射状地生有成串的孢子,成熟的孢子呈黑色(图1(a));在平板或斜面试管上培养生长的黑曲霉菌落颜色为黑色(图1(c)),青霉的菌落颜色为青绿色(图1(d));青霉在 37℃ 以上基本不能生长,而黑曲霉在 90 ℃ 环境中仍可以繁殖生长。因此,富钾页岩浸矿过程中“溶钾”真菌群落的动态演替可通过分析真菌生理生化特征、表形特征来确定,这种方法较 PCR-DGGE 更加简单直接并成本较低。实验选用混合菌连续浸出体系作为研究对象,按照不同时间段从浸出液中取样 1 mL,然后进行梯度稀释并涂布于含固体 PDA 培养基的平板上,静置培养直至长出菌落,随机挑选 50~80个菌落进行分析鉴定。2株菌的生理生化特性与表型形态特征采用文献[8]的常规方法进行。
2 结果与讨论
2.1 出发菌株原生质体的制备
AN与PHT在实验条件下酶解1 h,2株出发菌株的绝大部分菌丝均断裂成小段,形成部分原生质体(图2(a))。酶解2 h,菌丝体全部断裂形成原生质体(图2(b))。因此,选用酶解2 h制备形成的AN与PHT的原生质体进行DES诱变实验。
表1 富钾页岩的主要化学成分及质量分数
Table 1 Main chemical components in rich potassium igneous rock and their relative percentage %


图1 实验用黑曲霉(a)与青霉(b)的孢子形态及斜面试管培养后的黑曲霉(c)与青霉(d)的菌落特征
Fig. 1 Spore morphologies of A·niger (a) and P·heteromorphum (b) and colony characteristics of A·niger (c) and P·heteromorphum (d) after slant tube culturing
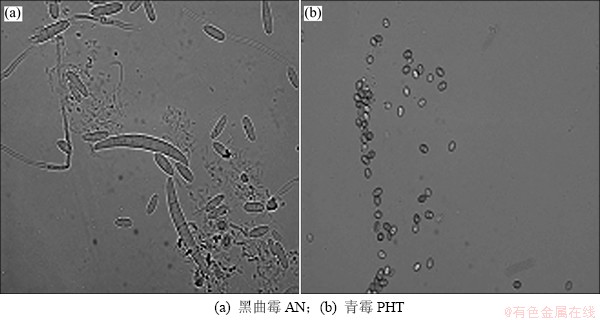
图2 黑曲霉AN与青霉PHT原生质体释放过程
Fig. 2 Protoplast release from A·niger AN and P·heteromorphum PHT
2.2 AN原生质体的DES诱变结果
本实验采用不同剂量的DES对AN进行诱变处理,以诱变菌株在稳定期具有比出发菌株更大的菌体密度与更短的传代时间为正突变指标,所得致死率与正突变率结果如表2所示。从表2可知,当DES的体积分数为1%~3%时,细胞的致死率与正突变率随DES体积分数的增加而增加;当DES体积分数为3%时,细胞致死率为75.4%,正突变率为23.5%,为最佳诱变剂量。从正突变菌株中筛选出传代时间比出发菌株更短且到达生长稳定期时孢子密度更大的变株用于发酵培养及生物浸出探索试验,并经过 7 次传代培养后筛选出1株诱变菌株(编号为ANM),用于富钾页岩生物浸出实验。
AN与ANM的生长曲线如图 3 所示。由图 3 可见:ANM到达生长稳定期的时间为72 h,比AN提前24 h,发酵液中孢子浓度(1011 个/mL)较出发菌株的(109 个/mL)提高近2个数量级。
表2 硫酸二乙酯诱变对黑曲霉AN原生质体的影响
Table 2 Effect of DES-induced mutagenesis on protoplast of A·niger AN

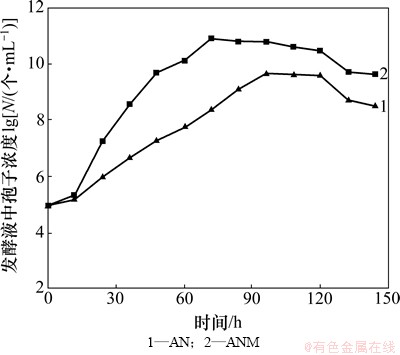
图3 黑曲霉AN诱变前后的生长曲线
Fig. 3 Growth curves of A·niger before and after mutagenesis
2.3 PHT原生质体的DES诱变结果
PHT在不同剂量的DES 处理下的致死率与正突变率如表 3 所示。从表 3可知,PHT的致死率与DES的体积分数成正比。当DES体积分数为 2.5% 时,致死率为 78.6%,正突变率为 29.0%,为最佳诱变剂量。同样以诱变菌株在达到生长稳定期具有比出发菌株更大的孢子密度与更短的传代时间为正突变指标,从中筛选出数株正突变菌株,通过发酵培养与浸矿探索实验,并经7次传代培养,挑选出代谢产酸、产蛋白质与多糖能力最强、释钾效果最好的1株正突变菌株(编号为 PHTM)用于富钾页岩生物浸出实验。
PHT和PHTM的生长曲线如图4所示。由图4可见:PHTM达到生长稳定期的时间为84 h,比PHT的(120 h)提前36 h,发酵液中孢子密度由诱变前的109 个/mL 左右上升到1010 个/mL左右。
表3 硫酸二乙酯诱变对青霉PHT原生质体的影响
Table 3 Effect of DES-induced mutagenesis on protoplast of P·heteromorphum PHT


图4 青霉PHT诱变前后的生长曲线
Fig. 4 Growth curves of P·heteromorphum PHT before and after mutagenesis
2.4 诱变菌株的遗传稳定性测定结果
黑曲霉与青霉原生质体经DES诱变处理后,破坏了其细胞中DNA结构的稳定性,DNA中的突变位点可能处于亚稳定状态,增大了回复突变或抑制基因突变的概率。为保证突变菌株的遗传稳定性,在诱变育种过程中一般需对筛选出的正突变菌株反复传代多次,通过测定其正突变指标来判断其遗传性状稳定性。
在前期钾矿物浸出实验中发现,黑曲霉与青霉等“溶钾”真菌的产酸与产蛋白质及多糖的能力与“溶钾”效率密切正相关。为此,以pH与产胞外聚合物的量为诱变菌株的重要正突变指标,对经过7次传代培养后所挑选出来的诱变菌株ANM、PHTM与出发菌株在各自的最佳生理生化条件下进行培养,定时测定培养体系中的 pH、多糖与蛋白质含量,进一步考察诱变菌株的遗传稳定性,测定结果如图5所示。
从图5可见:ANM和PHTM产酸与产大分子胞外聚合物的能力明显比各自出发菌株的代谢能力强,且达到最大量的发酵时间更短。在含AN,PHT,ANM和PHTM的培养液中,pH分别在第96,144,84和96 h达到各自的最低值,其值分别为 3.5,4.0,2.7和3.1;随着发酵时间的继续延长,各发酵液的酸度均有小幅下降(图5(a));从图5(b)与(c)可见:各实验菌株 AN,PHT,ANM和PHTM分别发酵培养到第96,120,72和96 h时,发酵液中蛋白质与多糖量达到最大值,蛋白质的质量浓度分别为10.25,8.25,15.64和10.21 mg/L,多糖的质量浓度分别为14.25,12.90,21.62和17.25 mg/L。随后,各发酵液中的蛋白质与多糖浓度均会随发酵时间的延长而有较明显的下降,这是因为在发酵后期培养液处于贫营养状态,细胞又会利用自身产生的代谢物来维持其生命活动。以上结果表明:出发菌株原生质体经 DES 诱变后引起了遗传变异,筛选所得到的突变菌株产酸与产胞外聚合物的能力较出发菌株有了较大的提高,其中菌株 ANM 产酸与产胞外聚合物的能力最强。

图5 各菌种发酵液中pH、蛋白质质量浓度与多糖质量浓度
Fig. 5 pH, concentrations of proteins and polysaccharides in fermentation broths of different cultures
2.5 富钾页岩生物浸出释钾实验
以无菌培养液作为对照(CK),采用单一与组合菌种的形式,选用AN和PHT与ANM和PHTM浸出富钾页岩中的钾,结果如图6所示。从图 6可见:在30 d的浸出周期中,浸出液中K2O的质量浓度持续上升,但在不同的浸出体系中,K2O质量浓度的快速上升期存在一定的差异,表明不同生物浸出体系浸出钾的主要阶段略有不同。

图6 不同浸出体系浸出液中K2O质量浓度
Fig. 6 K2O mass concentrations extracted in supernatants of different leaching systems
接种了AN与PHT的浸出体系中,浸出液中K2O的浓度变化规律基本一致,0~15 d为生物浸出钾的主要阶段,K2O的质量浓度从0 mg/L分别快速增加至41.79 mg/L 与31.73 mg/L,15 d后,K2O的质量浓度平缓增加,到第30 d浸出结束时K2O的质量浓度分别为43.32 mg/L与34.03 mg/L。接种了ANM的浸出体系中,0~11 d为生物浸出钾的主要阶段,K2O的质量浓度从0 mg/L快速增加至 55.20 mg/L,随后平缓增加,到第30 d浸出结束时K2O的质量浓度为56.25 mg/L。接种了PHTM的浸出体系中,0~12 d为生物浸出钾的主要阶段,K2O的质量浓度从0 mg/L快速增加至39.76 mg/L,30 d后K2O的质量浓度为40.78 mg/L。接种了AN与PHT(数量比为1:1)的混合菌体系中,生物浸出钾的主要阶段为0~15 d,K2O的质量浓度从0 mg/L快速增加至49.75 mg/L,30 d后K2O的质量浓度为52.55 mg/L。接种了ANM与PHTM(数量比为1:1)的混合菌浸出体系中,生物浸出钾的主要阶段为0~12 d,K2O的质量浓度从0快速增加至62.98 mg/L,30 d后K2O的质量浓度为63.75 mg/L。
从以上试验结果可以看出:AN的浸矿释钾效果要好于PHT。ANM和PHTM对富钾页岩的释钾效率明显比对应的出发菌株要高;浸出结束后,浸出液中K2O的浓度分别提高34.60%和28.52%,且生物浸出钾的主要阶段分别缩短了4 d和3 d。若以钾的溶出速率作为浸矿效率的评判依据,则可以认为各浸出体系中生物浸出钾的主要阶段即可视为今后实际工业应用的生物浸出周期,即实验使用的6种生物浸出体系(AN,PHT,ANM,PHTM,AN+PHT和ANM+PHTM)达到浸出终点的时间分别为15,15,11,12,15和12 d。说明出发菌株经DES诱变后,引起了生物变异,提高了出发菌株对富钾页岩的浸矿效率。结合它们产酸与产胞外聚合物的能力结果(图5),说明代谢能力是影响细菌对矿物溶蚀与分解的关键因素之一。混合菌浸矿释钾效率明显要高于单一菌的浸矿释钾效率。在接种了AN+PHT的混合菌浸出体系中,浸出结束后K2O浓度分别比诱变前单一菌AN和PHT浸出体系的提高了20.48%与65.62%。在接种了ANM+PHTM的混合菌浸出体系中,达到浸出终点的时间比单一出发菌株与混合菌株(AN+PHT)的浸出体系提前了3 d,浸出结束后K2O浓度分别比单一的ANM和PHTM浸出体系提高了13.40%和31.80%;说明黑曲霉和青霉2株菌种在浸矿过程中具有协同效应,可以促进它们各自对矿物的溶蚀能力。
2.6 富钾页岩浸渣表面分析
为考察诱变前后实验菌株对矿样的溶蚀效果,对原矿样(CK)及被不同菌株浸出30 d后的各浸渣样进行电镜扫描观察,结果如图7所示。
从图7可见:未经细菌作用的富钾页岩表面较为光滑平整,晶体结构较为完整(图7(a))。经AN与PHT作用后的富钾页岩浸渣,表面均变得粗糙,凹凸不平,出现大量溶蚀坑与裂缝,但矿物表面结构仍保持为一个整体。与PHT菌相比,AN菌对富钾页岩的溶蚀作用更强,溶蚀的面积更大(图7(b)和(c))。与出发菌株相比,诱变菌株对富钾页岩的溶蚀作用更为显著, PHTM的溶蚀作用与AN基本一致,但明显比PHT强;而ANM作用后的富钾页岩表面结构基本被破坏,分裂成许多细小颗粒,溶蚀坑与裂缝较AN作用后富钾页岩表面的更大、更深与更宽(图7 AN与ANM)。与单一菌对富钾页岩的溶蚀作用相比,诱变后混合菌对富钾页岩的溶蚀作用最强,表面结构被整体破坏,出现了更多更细的颗粒(图7 ANM+PHTM)。

图7 浸出30 d后不同浸出体系中富钾页岩浸渣表面的SEM图像
Fig. 7 SEM images of potassium-rich shale surfaces after 30 d leaching in different leaching systems
为进一步验证诱变前后菌株对矿物结构破坏程度的差异及混合菌在浸矿过程中的协同效应,对含AN、ANM与ANM+PHTM的浸矿体系中的浸渣进行XRD分析,结果如图8所示。从图8可见,与对照样(CK)相比,在有菌的3组浸出体系中,反映富钾页岩中各矿物(钾长石、石英、伊利石、白云母)晶体结构的特征峰均有不同程度的降低或消失;ANM比AN的破 坏作用要强,其中白云母的特征峰基本消失,伊利石的特征峰大部分消失,且出现了水铝石晶体结构的新特征峰;而经ANM+PHTM作用后,XRD图谱中白云母与伊利石的特征峰均基本消失,新生矿物水铝石的特征峰显著增强。

图8 浸出30 d后不同浸出体系中富钾页岩浸渣的XRD图谱
Fig. 8 XRD patterns of potassium-rich shale residues after 30 d leaching in different bioleaching systems
以上分析结果表明:AN与PHT经DES诱变后,显著提高了对富钾页岩的溶蚀能力;在混合菌浸矿过程中,青霉可以协助黑曲霉的浸矿作用,增强其对矿物的破坏程度;在多种矿物同时存在的情况下,细菌对各矿物的破坏作用具有一定的选择性,具层状结构的白云母与伊利石较具架状结构的钾长石更易首先被细菌溶蚀分解,这与本文作者[9]前期研究结果一致;在ANM与ANM+PHTM的作用下,部分原生矿物转化成了新生矿物水铝石,形成次生矿物模块。
2.7 浸出过程中浸出液内生物群落结构的动态演替
分别在AN+PHT与ANM+PHTM混合菌浸矿的第5,10,15,25和30天取浸出液样,稀释涂布平板培养,通过对菌株的分离纯化,随机挑选100个菌落进行生理生化与表型特征鉴别,各样品中二种“溶钾”真菌的比例结果如图9所示。从图9可见:随着浸出时间的延长,诱变前后的黑曲霉在各自的浸出体系中所占比例逐步增加,而青霉的比例逐步下降。在接种了诱变前混合菌浸出体系中,在第5天与第10天的样品中,AN与PHT的比例在1.2:1以内,而当浸出到第15天及以后,AN的比例大幅上升,到第30天浸出结束,浸出液中AN所占百分率为87%, PHT仅占13%。在相同条件下,接种了诱变后混合菌的浸矿体系中,在第5天与第10天的样品中,ANM与PHTM的比例为1.1:1左右,第15天及以后,ANM所占比例显著上升,PHTM的比例显著下降,第30天浸出液样品中,ANM占80.0%,PHTM占20.0%。以上对比结果表明,在浸矿的前10天没有明显的优势菌种,而浸矿15天后,诱变前后的黑曲霉的比例明显上升,并最后取代青霉成为优势菌种。

图9 黑曲霉AN与青霉 PHT诱变前与诱变后在6个样品中所占比例
Fig. 9 Percentages of A·niger AN and P·heteromorphum PHT before and after mutagenesis from six samples
3 结论
1) 硫酸二乙酯(DES)诱变黑曲霉AN与青霉 PHT的最佳体积分数分别为3%和2.5%,致死率分别为75.4%和78.6%,正突变率分别为23.5%和29%。诱变后筛选所得的诱变菌株黑曲霉ANM和青霉PHTM达到生长稳定期的时间分别比对应的出发菌株缩短了24 h和36 h,且有更大的细胞浓度;诱变菌株产酸与产胞外多糖与蛋白质的能力较出发菌株有了较大的提高,其中诱变菌株黑曲霉ANM产酸与产胞外聚合物的能力最强。
2) 诱变菌株黑曲霉ANM和青霉PHTM对富钾页岩的溶蚀分解能力比对应的出发菌株要强。浸出液中K2O的浓度分别比诱变前提高了34.60%和28.52%,且生物浸出的主要阶段分别缩短了4 d和3 d;诱变后黑曲霉ANM和青霉PHTM混合菌株的溶钾效果优于诱变前混合出发菌株、单独出发菌株、单独诱变菌株的溶钾效果,生物浸出的主要阶段比出发菌株的缩短了3 d,浸出液中K2O的浓度分别比单一诱变菌株黑曲霉ANM和青霉PHTM提高了13.40%和31.80%。
3) 在富钾页岩混合菌浸出前10 d,实验菌株黑曲霉与青霉的比例相差不大,没有明显的优势菌种;而浸矿15 d后,黑曲霉在群落中的比例会上升,并最后取代青霉成为优势菌种。
参考文献:
[1] Colpan E, Zengin M,  zbahce A. The effects of potassium on yield and fruit quality components of stick tomato[J]. Hort Environ Biotechnol, 2013, 54(1): 20-28.
zbahce A. The effects of potassium on yield and fruit quality components of stick tomato[J]. Hort Environ Biotechnol, 2013, 54(1): 20-28.
[2] LI Wen-juan, HE Ping, JIN Ji-yun. Effect of potassium on ultrastructure of maize stalk pith and Young root and their relation to stalk rot resistance[J]. Agricultural Sciences in China, 2010, 9(10): 1467-1474.
[3] Bocharnikova E A, Loginov S V, Matychenkov V V, et al. Silicon fertilizer efficiency[J]. Russian Agricultural Sciences, 2010, 36(6): 446-448.
[4] Basak B B, Biswas D R. Influence of potassium solubilizing microorganism (Bacillus mucilaginosus) and waste mica on potassium uptake dynamics by Sudan grass ( Sorghum vulgare Pers) growm under two Alfisols. Plant Soil, 2009, 317: 235-255.
[5] Anjumn F, Shahid F, Akcil A. Biohydrometallurgy techniques of low grade ores: A review on black shale[J]. Hydrometallurgy, 2012, 117/118: 1-12.
[6] Brierly C L. Biohydrometallurgical prospects[J]. Hydro- metallurgy, 2010, 104(3): 216-221.
[7] Dopson M, Lovgren L, Bostrom D. Silicate mineral dissolution in the presence of acidophilic microorganisms: Implications for heap bioleaching[J]. Hydrometallurgy, 2009, 96(4): 325-329.
[8] Hutchens E, Valsami-Jones E, Mceldowney S, et al. The role of heterotrophic bacteria in feldspar dis-solution-An experimental approach[J]. Mineralogical Magazine, 2003, 67: 1157-1170.
[9] 孙德四, 陈晔, 曹飞. 细菌-矿物接触方式对铝土矿降解的影响[J]. 中国矿业大学学报, 2013, 42(1): 122-127.
SUN Desi, CHEN Ye, CAO Fei. Influence of microbe-mineral contact model on decomposition of bauxite[J]. Journal of China University of Mining & Technology, 2013, 42(1): 122-127.
[10] 孙德四, 陈晔, 曹飞. 矿物环境对硅酸盐细菌的铝土矿浸矿脱硅作用的影响[J]. 化工进展, 2012, 21(10): 2341-2348.
SUN De-si, CHEN Ye, CAO Fei. Effects of mineral environments on desilicon from bauxite by silicate bactreia[J]. Chmical Industry and Engineering Progress, 2012, 21(10): 2341-2348.
[11] 胡婕, 郁建平, 连宾. 黑曲霉对含钾矿物的解钾作用及机理分析[J]. 矿物岩石地球化学通报, 2011, 30(3): 277-284.
HU Jie, YU Jianping, LIAN Bin. Capability and mechanism of potassium releasing from potassium-bearing minerals by Aspergillus niger. Bulletin of Mieralogy[J]. Petrology and Geochemistry, 2011, 30(3): 277-284.
[12]  H. Rock weathering by indigenous heterotrophic bacteria of Bacillus spp. at different temperature: a laboratory experiment[J]. Miner Petrol, 2012, 105: 135-144.
H. Rock weathering by indigenous heterotrophic bacteria of Bacillus spp. at different temperature: a laboratory experiment[J]. Miner Petrol, 2012, 105: 135-144.
[13] LIAN Bin, WANG Bo, PAN Men, et al. Microbial release of potassium from K-bearing minerals by themophilic fungus Aspergillus fumigatus[J]. Geochimicaet Cosmochimica Acta, 2008(72): 87-98.
[14] 周跃飞, 王汝成, 陆现彩. 微生物-矿物接触模式影响矿物溶解机制的实验研究[J]. 高校地质学报, 2007, 12/13(4): 658-662.
ZHOU Yuefei, WANG Rucheng, LU Xiancai. Influence of microbe-mineral contact model on mineral dissolution: A primary study on microperthite dissolution by Paenibacillus polymyxa[J]. Geological Journal of China Universities, 2007, 12/13(4): 658-662.
[15] DONG Yingbo, LIN Hai, WANG Han, et al. Effects of ultraviolet irradiation on bacteria mutation and bioleaching of low-grade copper tailings[J]. Minerals Engineering, 2011, 24(8): 870-875.
[16] 陈林, 王明兹, 柯崇榕, 等. 黑曲霉原生质体诱变选育果胶酶高产菌株[J]. 微生物学杂志, 2011, 31(5): 27-30.
CHEN Lin, WANG Mingci, KE Congrong, et al. Breeding of high pectinase producing Aspergillus niger strain by protoplast mutagenesis[J]. Journal of Microbiology, 2011, 31(5): 27-30.
[17] 程明, 崔承彬, 李长伟, 等. 化学诱变技术在微生物育种研究中的应用[J]. 国际药学研究杂志, 2009, 36(12): 412-417.
CHENG Ming, CUI Chengbin, LI Changwei, et al. Chemical mutation technique applied microorganism breeding[J]. Journal of International Pharmaceutical Research, 2009, 36(12): 412- 417.
(编辑 邓履翔)
收稿日期:2013-06-21;修回日期:2013-09-10
基金项目(Foundation item):国家自然科学基金资助项目(51264014, 31360064)(Projects (51264014, 31360064) supported by the National Natural Science Foundation of China)
通信作者:曹飞(1978-),男,江西九江人,副教授,博士研究生,从事微生物浸矿技术研究;电话:15170295286;E-mail: chenyesds@126.com