文章编号:1004-0609(2012)05-1497-06
嗜酸氧化亚铁硫杆菌中锌离子转运基因的鉴定与分析
侯冬梅1,苗 博1,王洋洋1,张云静1,刘代刚1,吴学玲2
(1. 中南大学 资源加工与生物工程学院,长沙 410083;
2. 中南大学 教育部生物冶金重点实验室,长沙 410083)
摘 要:鉴定了Acidithiobacillus ferrooxidans DC (At. ferrooxidans DC)中与锌离子转运相关的4个ATP-binding cassette (ABC) transporter基因,并采用Reverse Transcription quantitative real-time PCR (RT-qPCR)技术分析在不同浓度的锌离子胁迫下这4个ATP-binding cassette (ABC) transporter基因在转录水平上的差异表达情况。然后利用Vector NTI、cluster X、BLAST、ORF Finder等生物信息学软件对各基因做进一步的生物信息学分析。结果表明:在锌离子胁迫下,4个ABC transporter基因(AFE_2435、AFE_2436、AFE_2437、AFE_2438)的表达量均有所上调,说明这4个基因对于锌离子的胁迫具有很强的敏感性。经生物信息学分析可知,基因AFE_2435和AFE_2436编码位于细胞质膜上的透性酶,AFE_2437编码位于细胞质膜上的ATP结合蛋白,AFE_2438编码位于周质空间的锌离子结合蛋白,这4个基因共同组成了一个与锌离子转运有关的ABC转运子。这些结果都表明这4个ABC transporter基因与DC菌中锌离子的转运有着密切的关系。
关键词:嗜酸氧化亚铁硫杆菌;ABC transporter;RT-qPCR;锌离子胁迫;生物信息学分析
中图分类号:Q819 文献标志码:A
Identification and analysis of zinc transport genes in Acidithiobacillus ferrooxidans
HOU Dong-mei1, MIAO Bo1, WANG Yang-yang1, ZHANG Yun-jing1, LIU Dai-gang1, WU Xue-ling2
(1. School of Minerals Processing and Bioengineering, Changsha 410083, China;
2. Key Laboratory of Biometallurgy, Ministry of Education, Central South University, Changsha 410083, China)
Abstract: In this study, four ATP-binding cassette (ABC) transporter genes of Acidithiobacillus ferrooxidans DC (At. ferrooxidans DC) were identified, and differential transcription of these genes during zinc ion stress were investigated by Reverse Transcription quantitative real-time PCR (RT-qPCR). And then, the genes involved in zinc ion transport were analyzed by bioinformatics software. The results show that the expressions of the four ABC transporter genes are increased differently under zinc ion stress, indicating that these genes are sensitive to zinc levels. Bioinformatics analysis shows that the proteins encode by AFE_2435, AFE_2436 are predicted to be permease proteins, whereas the protein encode by AFE_2437 is a putative ATP-bindind protein and AFE_2438 encoded a putative periplasmic cation-binding protein. The four genes together form an ABC transporter for zinc ion transport. These results strongly suggest that the four ABC transporter genes might be directly involved in zinc transport in Acidithiobacillus ferrooxidans DC.
Key words: Acidithiobacillus ferrooxidans; ABC transporter; RT-qPCR; zinc ion stress; bioinformatics analysis
嗜酸氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans)[1]是一种重要的浸矿菌种,在工业上经常被用作还原金、银、铜、铀等重金属[2]。在这些菌种生活的环境中,通常都含有较高浓度的重金属,因此,像大部分的浸矿菌一样,Acidithiobacillus ferrooxidans (At. ferrooxidans)对很多重金属都具有很高的耐受能力[3]。近年来,At. ferrooxidans对重金属的这种高耐受能力越来越引起人们的关注[4]。尽管At. ferrooxidans标准菌ATCC23270的全基因组序列已在2007年被全部测出,但是却很少有基因[5-8]被证明与这种高抗性能的体现有直接关系。
锌对于生物体来说是一种必须的微量元素,许多重要的功能蛋白和酶都需要锌作为其结构或者是辅助因子[9-10]。但是,一旦体内的锌离子浓度过高,将会对呼吸链产生抑制从而对细胞造成毒害作用[11-12]。因此,细胞需要调节其体内的锌离子含量在一个合适的水平。近年来有研究报道At. ferrooxidans 对锌离子具有很高的耐受能力,它可以在30 g/L的锌离子环境中生存[13]。然而,什么机制使At. ferrooxidans具有如此高的抗锌能力,至今仍不清楚。关于锌离子的转运机制,研究较多的是一种存在于大肠杆菌中的依赖于ATPase的ABC转运子—ZnuABC[14-15],它主要负责从外界环境中摄取锌离子。通常来说,这种ABC转运子[14]主要由绑定在周质空间上的锌离子结合蛋白ZnuA、两个透性酶ZnuB以及为此过程提供能量的ATP结合蛋白ZnuC组成。锌离子的这种转运机制在其他的菌种中也普遍存在[16-17],例如:肺炎链球菌(Streptococcus pneumoniae),格氏链球菌(Streptococcus gordonii),肠道沙门氏杆菌(Salmonella enterica)。
2007年CHI等[18]对可能存在于At. ferrooxidans ATCC2327周质空间上的蛋白进行了鉴定,推测AFE_2438所编码的蛋白是一种位于周质空间上的锌离子转运蛋白,它的功能可能类似与ZnuABC中的锌离子绑定蛋白ZnuA。而位于其下游的基因AFE_2437、AFE_2436、AFE_2435与其一起共同组成一个ABC转运子,完成锌离子的转运。尽管如此,至今仍没有任何实验数据证明这4个基因与At. ferrooxidan中的锌离子转运有关。
本文作者以这4个基因(AFE_2435、AFE_2436、AFE_2437、AFE_2438)作为研究对象,利用实时荧光定量PCR技术[19]验证在不同浓度的锌离子刺激下它们在基因转录水平上差异表达情况,并通过生物信息学手段对这4个基因及其编码的蛋白进行结构和功能的预测。
1 实验
1.1 材料
1.1.1 菌种与培养基
At. ferrooxidans DC由中南大学生物冶金教育部重点实验室从取自广西大厂铜矿的酸性矿坑废水中分离得到。
At. ferrooxidans DC生长于9K基础培养基[20],30 ℃,170 r/min 摇床无菌培养。能源物质为单质硫:10 g/L。
1.1.2 其他试剂
DNA提取试剂为EZ-10 spin column genomic DNA isolution kit (BioBasic Inc.),DNA凝胶回收试剂盒为(E.Z.N.A.TM Gel Extraction Kit.Promega),RNA提取试剂为Trizol(Invitrogen),RNA纯化试剂盒为SV Total RNA Isolation System(Promega);RNA反转录试剂为SuperScriptTMⅡ反转录酶(Invitrogen).
1.2 实验方法
1.2.1 菌种收集
前期预实验表明At. ferrooxidans strain DC能够耐受较高浓度的锌离子,但是其生长繁殖情况会受到一定的抑制,本实验中选用1、10和100 mmol/L Zn2+作为锌离子刺激环境。首先将At. ferrooxidans strain DC接种至不含锌离子的标准培养基,培养至对数期时离心收集菌种(4 ℃, 10 min, 12 000 r/min),再将所收集的菌种等量接种于含有0、1、10和100 mmol/L Zn2+的9K培养基中,分别培养24 h后,再次离心收集菌种,马上进行DNA和RNA提取步骤。
1.2.2 DNA提取及ZnuAf基因的克隆测序
细菌基因组提取使用EZ-10 spin column genomic DNA isolution kit。以提取后的DC基因组为模板扩增基因AFE_2435、AFE_2436、AFE_2437、AFE_2438。PCR扩增条件为:预变性:94 ℃,3 min;变性:94 ℃,45 s,退火:60 ℃,45 s,延伸:72 ℃,90 s,共30个循环;延伸:72 ℃,10 min。PCR产物经琼脂糖凝胶电泳检测后切胶,回收,送去上海生物工程公司测序。实验中所用到的引物如表1所列。
1.2.3 RNA提取与cDNA的合成
采用Trizol一步法提取总RNA,用RNA纯化试剂盒(Promega)纯化粗RNA,用NanoDrop微量分光光度计(NanoDrop Technologies)检测RNA的浓度和纯度。取等量的RNA进行反转录,反转录采用Invitrogen 公司 SuperScriptTMⅡ反转录酶和随机引物,以总RNA中mRNA为模板,反转录合成cDNA,反转录后用NanoDrop 微量分光光度计测定每一个cDNA的浓度, 然后将cDNA样品浓度均调至200 mg/L,于-20 ℃冷藏备用。
1.2.4 Real-time qPCR
1.2.4.1 标准样品的制备
分别以目标基因及内参基因为样品, 以cDNA为模板进行普通PCR 扩增,PCR产物经琼脂糖凝胶电泳鉴定。然后将PCR 产物进行10倍梯度稀释, 取10-3~10-7做标准品用于制备标准曲线, 做5个点。普通PCR程序如下:预变性:94 ℃,3 min;变性:94 ℃,30 s,退火:55 ℃,30 s,延伸:72 ℃,30 s, 共35 个循环;最后72 ℃补平5 min。
1.2.4.2 实时定量PCR
Real-time qPCR反应程序如下:预变性:95 ℃,3 min ;变性:95 ℃,30 s, 退火:59 ℃,20 s,延伸 72 ℃,20 s,共40个循环;55~95 ℃,10 s, 每循环一次温度增加0.5 ℃,共80个循环。每组实验设置3个平行,选用16S rRNA为内参基因[5],阴性对照不加任何模板。
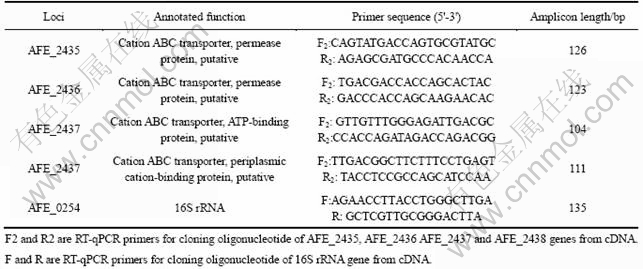
实验结束后,用2-△△Ct法[7, 21]处理数据,即通过与对照组基因表达量的对比计算出每个基因的相对表达量,且每个基因都以16S rRNA作为内参基因进行了校正。实验中所用到的引物如表2所列。
1.2.5 生物信息学分析
用Vector NTI (version 7.1)做一般序列操作。用cluster X 做序列比对。BLAST (http://www. ncbi.nih.gov/blast/Blast.cgi) 做相似性搜索。ORF Finder (http://www.ncbi.nlm.nih.gov/gorf/gorf.html) 寻找基因的开放阅读框。ExPASy Proteomics Server (http: //expasy. org/ cgi- bin/ pi_ tool) 进行蛋白质等电点以及相对分子量的计算。PSORTb v.3.0 (http:// www.psort.org/psortb) 做蛋白亚细胞结构定位。TMHMM Server v.2.0 (http://www.cbs.dtu.dk// servive-s/ TMHMM-2.0/)做蛋白质的跨膜分析。NCBI conserved domains (http://www.ncbi.nlm.nih.gov/Structure/cdd/ wrpsb.cgi) 找寻蛋白的保守区域。
表1 常规PCR引物
Table 1 Primers used in Taq PCR
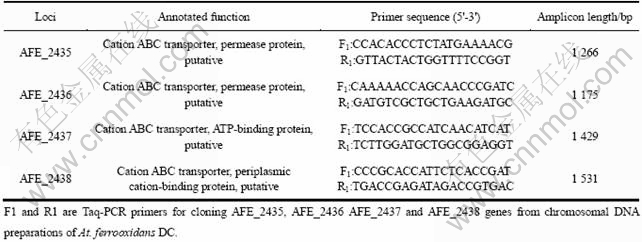
表2 RT-qPCR引物
Table 2 Primers used in RT-qPCR
2 结果
2.1 ZnuAf基因的克隆测序
以At. ferrooxidans DC基因组为模板扩增得到AFE_2435、AFE_2436、 AFE_2437、AFE_2438的基因片段,电泳检测结果如图1所示,扩增产物长度与目标基因长度基本相同,且均无杂带,引物特异性较好。4个基因的测序结果经BLAST进行序列比对,结果与嗜酸氧化亚铁硫杆菌标准菌株ATCC 23270中的这4个基因的序列完全相同。
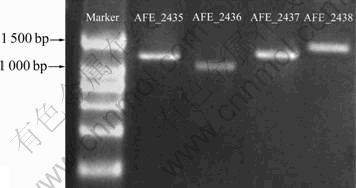
图1 目的基因AFE_2435、AFE_2436、AFE_2437、AFE_2438的PCR产物电泳图
Fig. 1 Electrophoresis analyses of PCR products of AFE_2435, AFE_2436, AFE_2437 and AFE_2438
2.2 不同浓度Zn2+刺激下相关基因的差异表达
实时荧光定量PCR后,溶解曲线峰带单一,没有杂峰出现,说明特异性较好;标准曲线R2值均接近于1,说明Ct值与其起始拷贝数的对数值之间的关系性好; 内参基因16S rRNA在不同环境中的表达量均较为衡定,无显著性差异。经内参基因校正,各基因在转录水平上的相对表达量如图2所示。在不同浓度的锌离子刺激下,4个基因(AFE_2435、AFE_2436、AFE_2437、AFE_2438 ) 的表达量均有所上调,且随着锌离子浓度的增加,各基因上调的倍数也有所增加。AFE_2435和AFE_2436上调最为明显,1 mmol/L Zn2+刺激时,AFE_2435上调了16倍,AFE_2436上调了33倍,而此时AFE_2438仅上调了9倍,AFE_2437仅上调了3倍。当锌离子浓度增加到10 mmol/L时,AFE_2435上调的倍数高达230倍,AFE_2436上调的倍数为270倍,AFE_2438上调的倍数为77倍,虽然此时AFE_2437的表达量也有所增加,但是与其他3个基因相比较,AFE_2437的上调幅度较小,当锌离子浓度为10 mmol/L时仅上调了5倍。当锌离子浓度为100 mmol/L时,4个基因的表达量与未加锌离子刺激的基因表达量相比较,均呈现出明显的上调趋势,AFE_2435上调了442倍, AFE_2436上调了512倍, AFE_2437上调了22倍, AFE_2438上调了321倍。
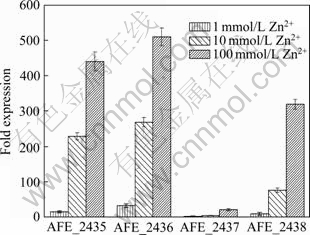
图2 不同锌离子刺激条件下AFE_2435、AFE_2436、AFE_2437、AFE_2438的差异表达
Fig. 2 Differential expressions of genes (AFE_2435, AFE_2436, AFE_2437 and AFE_2438) under different Zn2+ concentrations
2.3 生物信息学分析
本研究对实验中涉及到的4个基因(AFE_2435、AFE_2436、AFE_2437、AFE_2438) 以及其编码的蛋白进行了相关的生物信息学分析。在此将它们所编码的蛋白分别命名为:ZnuB1Af、ZnuB2Af、ZnuCAf和ZnuAAf。通过对4个基因进行开放阅读框的找寻以及等电点和分子量的计算可知:基因AFE_2435的开放阅读框的长810 bp;它所编码的蛋白ZnuB1Af的相对分子质量为28 572.27 Da,等电点为10.1。基因AFE_2436含有一个长为891 bp开放阅读框;它所编码的蛋白ZnuB2Af的相对分子质量为30 704.72 Da,等电点为9.04。基因AFE_2437的开放阅读框长825 bp,ZnuCAf的相对分子质量为29 068.60 Da,等电点为6.66。而基因AFE_2438的开放阅读框的长度为513 bp,其编码的蛋白ZnuAAf的相对分子质量为31 739.21 Da, 等电点为8.51。
为了更进一步了解这4个蛋白所行使的功能,还对ZnuB1Af等4个蛋白进行了亚细胞结构定位、跨膜结构域分析以及保守区域的分析。结果表明:ZnuB1Af与ZnuB2Af均位于质膜上,其中ZnuB1Af 有6次跨膜,ZnuB2Af 有7次跨膜,保守区域分析表明ZnuB1Af与ZnuB2Af含有相同的保守区域cd06550,该保守区域是TM_ABC_iron-siderophores_like super family所特有的; ZnuCAf也位于细胞质膜上,但是它并不存在跨膜结构域,经比对发现ZnuCAf的保守区域与P-loop NTPase surper family家族中的蛋白高度相似,而且ZnuCAf还具有与该家族蛋白相同的保守基序(-LSGGQ);ZnuAAf是4个蛋白中唯一一个位于周质空间上的蛋白,它也不存在跨膜结构域,它的保守区域与TroA-like family中的保守区cd01020高度相似。
3 讨论与分析
本实验中,对At. ferrooxidans DC中4个与锌离子转运相关的基因(AFE_2435、AFE_2436、AFE_2437、AFE_2438)进行了克隆、测序,并应用实时荧光定量PCR(RT-qPCR)[22-24]技术来检测不同浓度锌离子刺激下这4个基因的相对表达量。实验中所选用的内参基因为16S rRNA。虽然近年来有研究认为,在某些情况下以16S rRNA作为内参基因校正基因的相对表达量时可能存在误差[25],但是在本实验中16S rRNA在不同锌离子环境中的表达量均相对稳定,因此可以作为内参基因。RT-qPCR结果表明,对于锌离子的胁迫,这4个基因都具有很强的敏感性,在较低浓度(1 mmol/L) 刺激时, AFE_2435和AFE_2436的反应较大,分别上调了16倍和33倍数;随着锌离子浓度的升高,其它两个基因的表达量也出现了明显的上调趋势,当锌离子刺激浓度达到100 mmol/L时,AFE_2437上调了22倍,AFE_2438上调了321倍,而此时AFE_2435和AFE_2436的上调倍数分别达到了442倍和512倍。此实验数据表明,At. ferrooxidans DC中的这4个基因(AFE_2435, AFE_2436, AFE_2437, AFE_2438) 对于锌离子的胁迫非常敏感。这4个基因可能与其能够耐受较高浓度的锌离子有着密切的关系。
生物信息学的分析结果表明:基因AFE_2435和AFE_2436所编码的蛋白ZnuB1Af与ZnuB2Af与位于质膜上的铁载体蛋白有着相同的保守区域,这个家族中的蛋白通常是作为ABC转运子[26]的一个组件而存在。 ZnuCAf 的保守区域属于P-loop NTPase surper family,该家族中的蛋白含有ATP或者GTP的结合位点,它们与iron-siderophores uptake family拥有共同的祖先,这两个家族中的蛋白都与锌离子、锰离子、铁离子的转运密切相关。ZnuAAf属于TroA-like family,这个家族中的蛋白在ABC转运子转运金属离子的过程中担当金属离子的受体。综上所述,可以推断在At. ferrooxidans DC转运锌离子的过程中,ZnuB1Af、ZnuB2Af、 ZnuCAf、 ZnuAAf共同组成了一个转运Zn2+的ABC转运子,其中ZnuAAf主要负责在周质空间中绑定锌离子,ZnuB1Af和ZnuB2Af作为透性酶负责锌离子向细胞内的运输,ZnuCAf作为ATP结合蛋白为此过程提供能量。
4 结论
1) 首次鉴定了At. ferrooxidans DC中与Zn2+转运相关的4个ATP-binding cassette (ABC) transporter 基因。
2) 在不同浓度锌离子刺激下,At. ferrooxidans DC中的这4个ABC transporter 基因(AFE_2435, AFE_2436, AFE_2437, AFE_2438)的相对表达量均呈上调趋势,说明这4个ABC transporter 基因对于锌离子的胁迫非常敏感。
3) 经生物信息学分析可知基因AFE_2435和AFE_2436所编码的蛋白是位于细胞质膜上的透性酶,基因AFE_2437编码的蛋白也位于细胞质膜上,是一种ATP结合蛋白,而基因AFE_2438编码位于周质空间的锌离子结合蛋白,这4个基因共同组成了一个与锌离子转运有关的ABC转运子。
4) 推断At. ferrooxidans DC中的这4个ABC transporter 基因(AFE_2435、AFE_2436、AFE_2437、AFE_2438)对于其能够耐受较高浓度的锌离子刺激有着密切的关系。
REFERENCES
[1] INGLEDEW W J. Thiobacillus ferrooxidans: The bioenergetics of an acidophilic chemolithotroph[J]. Biochim Biophys Acta, 1982, 683(2): 89-117.
[2] RAWLINGS D E. Characteristics and adaptability of iron- and sulfur-oxidizing microorganisms used for the recovery of metals from minerals and their concentrates[J]. Microbial Cell Factories, 2005, 4: 13.
[3] DOPSON M, BAKER-AUSTIN C, KOPPINEEDI P R, BOND P L. Growth in sulfidic mineral environments: Metal resistance mechanisms in acidophilic microorganisms[J]. Microbiology, 2003, 149: 1959-1970.
[4] RAWLINGS D E, KUSANO T. Molecular genetics of Thiobacillus ferrooxidans[J]. Microbiology and Molecular Biology Reviews, 1994, 58(1): 39-55.
[5] NAVARRO C A, ORELLANA L H, MAURIACA C, JEREZ C A. Transcriptional and functional studies of Acidithiobacillus ferrooxidans genes related to survival in the presence of copper[J]. Applied Environmental Microbiology, 2009, 75: 6102-6109.
[6] LUO Y J, LIU Y D, ZHANG C G, LUO H L, GUAN H, LIAO H H, QIU G Z, LIU X D. Insights into two high homogenous genes involved in copper homeostasis in Acidithiobacillus ferrooxidans[J]. Current Micobiology, 2008, 57: 274-280.
[7] FERRAZ L F C, VERDE L C L, REIS F C, ALEXANDRINOl F, FELI?CIO A P, NOVO M T M, GARCIA O Jr, OTTOBONI L M M. Gene expression modulation by chalcopyrite and bornite in Acidithiobacillus ferrooxidans[J]. Archives of Microbiology, 2010, 192: 513-540.
[8] PAULINO L C, de MELLO M P, OTTOBONI L M M. Differential gene expression in response to copper in Acidithiobacillus ferrooxidans analyzed by RNA arbitrarily primed polymerase chain reaction[J]. Electrophoresis, 2002, 23: 520-527.
[9] VALLEE B L, AULD D S. Zinc coordination, function, and structure of zinc enzymes and other proteins[J]. Biochemistry, 1990, 29(24): 5647-5659.
[10] PATZER S I, HANTKE K. The ZnuABC high-affinity zinc uptake system and its regulator Zur in Escherichia coli[J]. Molecular Microbiology, 1998, 28(6): 1199-1210.
[11] KASAHARA M, ANRAKU Y. Succinate- and NADH oxidase systems of Escherichia coli membrane vesicles: Mechanism of selective inhibition of the systems by zinc ions[J]. The journal of Biochemistry, 1974, 76(5): 967-976.
[12] BEARD S J, HUGHES M N, POOLE R K. Inhibition of the cytochrome bd-terminated NADH oxidase system in Escherichia coli K-12 by divalent metal cations[J]. FEMS Microbiol Letters, 1995, 131(2): 205-210.
[13] CABRERA G, GO?MEZ J M, CANTERO D. Influence of heavy metals on growth and ferrous sulphate oxidation by Acidithiobacillus ferrooxidans in pure and mixed cultures[J]. Process Biochemisty, 2005, 40: 2683-2697.
[14] PATZER S I, HANTKE K. The zinc-responsive regulator Zur and its control of the znu gene cluster encoding the ZnuABC zinc uptake system in Escherichia coli[J]. The journal of Biological Chemistry, 2000, 275: 24321-24332.
[15] GRASS G, WONG M D, ROSEN B P, SMITH R L, RENSING C. ZupT is a Zn(Ⅱ) uptake system in Escherichia coli[J]. Journal of Bacteriology, 2002, 184: 864-866.
[16] NIES D H. Microbial heavy-metal resistance[J]. Applied Microbiology and Biotechnology, 1999, 51: 730-750.
[17] CAMPOY S, JARA M, BUSQUETS N, PE?REZ de ROZAS A M, BADIOLA I, BARBE J. Role of the high-affinity zinc uptake znuABC system in Salmonella enterica serovar typhimurium virulence[J]. Infection and Immunity, 2002, 70: 4721-4725.
[18] CHI A, VALENZUELA L, BEARD S, MACKEY A J, SHABANOWITZ J, HUNT D F, JEREZ C A. Periplasmic proteins of the extremophile Acidithiobacillus ferrooxidans[J]. Molecular and Cellular Proteomics, 2007, 6(12): 2239-2251.
[19] ZAMMINT C M, MUTCH L A, WATLING H R, WATKIN E L J. Evaluation of quantitative real-time polymerase chain reaction for enumeration of biomining microorganisms in culture[J]. Hydrometallurgy, 2008, 94: 185-189.
[20] WU Xue-ling, DING Jian-nan, GAO Jian, LIU Xing-xing, QIU Guan-zhou. Isolation and identification of metal-resistant iron-oxidizing bacteria[J]. Minerals and Metallurgical Processing, 2007, 24: 57-60.
[21] XU Ai-ling, XIA Jin-lan, LIU Ke-ke, LI Li, YU Yang, NIE Zhen-yuan. Real-time PCR analysis of metabolic pathway of PHB in acidiphilium cryptum DX1-1[J]. Journal of Microbiology and Biotechnology, 2010, 20: 71-77.
[22] 刘小荣,张 笠, 王勇平. 实时荧光定量PCR技术的理论研究及其医学应用[J]. 中国组织工程研究与临床康复, 2010, 14(2): 329-332.
LIU Xiao-rong, ZHANG Li, WANG Yong-ping. Theory study and medical application of real-time quantitative polymerase chain reaction[J]. Journal of Clinical Rehabilitative Tissue Engineering Research, 2010, 14(2): 329-332.
[23] 徐小刚, 刘雅婷. 实时荧光定量PCR在植物病害中的应用[J]. 中国农学通报, 2009, 25(7): 52-56.
XU Xiao-gang, LIU Ya-ting. Application of real-time fluorescence quantitative PCR in plant disease[J]. Chinese Agricultural Science Bulletin, 2009, 25(7): 52-56.
[24] SCHMITTGEN T D, ZAKRAJSEK B A, MILLS A G, GORN V, SINGER M J, REED M W. Quantitative reverse transcription-polymerase chain reaction to study mRNA decay: Comparison of endpoint and real-time methods[J]. Analytical Biochemistry, 2000, 285: 194-204.
[25] NIETO P A, COVARRUBIAS P C, JEDLICKIL E, HOLMES D S, QUATRINI R. Selection and evaluation of reference genes for improved interrogation of microbial transcriptomes: Case study with the extremophile Acidithiobacillus ferrooxidans[J]. BMC Molecular Biology, 2009, 10:63. doi:10.1186/1471-2199/10/63.
[26] LOCHER K P. Structure and mechanism of ATP-binding cassette transporters[J]. Philosophical Transaction of the Royal Society, 2009, 364: 239-245.
(编辑 何学锋)
基金项目:国家重点基础研究发展计划资助项目(2010CB630901)
收稿日期:2011-02-17;修订日期:2011-05-09
通信作者:吴学玲,副教授,博士;电话:0731-88836944;传真:0731-88710804;E-mail: xueling0714@yahoo.com.cn