漂浮阳极泥富集金银及回收锑铋工艺
郑雅杰,洪波
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
摘要:采用盐酸浸出漂浮阳极泥富集金银,浸出液经过2次水解分别回收锑铋,考察反应温度、盐酸浓度、液固比和反应时间对盐酸浸出过程中锑铋浸出率的影响,稀释比对锑水解过程中锑水解率的影响以及终点 pH对铋水解过程中铋水解率的影响。研究结果表明:当盐酸浓度为6 mol/L,固液比为1:5,反应温度为80 ℃,反应时间为1 h时,锑、铋浸出率分别可达到99.2%和99.1%;浸出后的漂浮阳极泥与浸出前相比,金、银富集15倍以上。用水按稀释比8:1稀释盐酸浸出液,进行锑的水解,锑水解率为95%,锑的总回收率为94.2%;用氢氧化钠调节锑水解液pH为8,进行铋的水解,铋的水解率为99.5%以上,铋总回收率为90%以上;铋水解液含杂质较低,返回锑的水解稀释盐酸浸出液,水可以循环利用。
关键词:漂浮阳极泥;盐酸浸出;金;银;锑;铋;水解
中图分类号:TF09 文献标志码:A 文章编号:1672-7207(2011)08-2221-06
Enrichment of Au and Ag and recovery of Sb and Bi from floating anode slime
ZHENG Ya-jie, HONG Bo
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Abstract: Floating anode slime was leached by hydrochloric acid to enrich Au and Ag. The leaching solution was used to recover Sb and Bi by twice hydrolysis, respectively. Effects of reaction temperature, concentration of hydrochloric acid, reaction time on leaching rates of Sb and Bi during hydrochloric acid leaching process, effect of dilution ratio on hydrolysis rate of Sb during hydrolysis process of Sb and effect of final pH on hydrolysis rate of Bi during hydrolysis process of Bi were investigated. The experimental results show that the leaching rates of Sb and Bi are 99.2% and 99.1% when hydrochloric acid concentration is 6 mol/L, reaction temperature is 80℃, ratio of solid to liquid is 1:5, reaction time is 1 h. Compared with not-leached floating anode slime, the content of Au and Ag in leached floating anode slime are enriched by more than 15 times. The hydrolysis rate of Sb is 95% after the hydrochloric acid leaching solution is diluted 8 times by water to hydrolyze Sb, and the total recovery rate of Sb is 94.2%. The hydrolysis rate of Bi is 99.5% when the hydrolysate of solution is adjusted to pH=8 by NaOH after hydrolyzing Sb3+, and the total recovery rate of Bi is more than 90%. For its low impurity content, the solution of hydrolyzing Bi3+ is used to dilute hydrochloric acid leaching solution.
Key words: floating anode slime; hydrochloric acid leaching; Au; Ag; Sb; Bi; hydrolysis
铜电解精炼过程中,阳极杂质元素砷、锑、铋相互作用[1],生成微细的絮状物,吸附电解液中的金、银、铜、锡、铅、硒后,生成微细颗粒,悬浮在铜电解液中,形成漂浮阳极泥[2-5]。漂浮阳极泥难以沉降,严重影响了阴极铜的质量。因此,铜电解过程中常采用过滤的方法去除漂浮阳极泥,每10万t阴极铜可产生40~60 t漂浮阳极泥。目前,对漂浮阳极泥的湿法研究报道较少,一般将漂浮阳极泥返回熔炼炉进行火法处理。其主要缺点是漂浮阳极泥中铜含量较低,杂质元素含量高,进入熔炼炉后极易引起熔炼炉中渣量增大,渣含铜增加,造成砷、锑、铋等杂质累积,同时导致金、银损失。当漂浮阳极泥中金、银含量较高时,有些工厂把它作为贵金属冶炼的原料,与阳极泥一起生产贵金属。其主要缺点是由于漂浮阳极泥中砷、锑和铋含量高,处理时脱砷困难,环境污染较大[6-7]。本研究采用湿法工艺处理漂浮阳极泥,整个工艺过程闭路循环,无废弃物排放,而且金和银富集倍数大,锑和铋回收率较高,为漂浮阳极泥的处理开辟了新的方法和思路。
1 实验
1.1 实验原料
漂浮阳极泥原料成分分析结果(质量分数)如表1所示,砷和锑价态及其成分分析结果(质量分数)如表2所示。
表1 漂浮阳极泥成分
Table 1 Composition of floating anode slime %

表2 砷、锑、铋在漂浮阳极泥中的价态
Table 2 Valences of As, Sb, Bi in floating anode slime %

由表1可知,漂浮阳极泥中含锑32.67%、铋9.48%、银0.87%、金0.0173%,其回收价值较高。由表2可知:漂浮阳极泥中的砷主要以As5+存在,铋以Bi3+存在,锑存在形态较复杂,Sb3+与Sb5+的质量比约为1.35:1。在铜电解精练过程中,砷、锑、铋相互作用易产生漂浮阳极泥,形成机理复杂,至今还未有统一的认识。一般认为,漂浮阳极泥中的主要物相为SbAsO4,BiAsO4以及难溶锑酸盐和砷锑酸盐[8]。
1.2 实验步骤及工艺流程
将漂浮阳极泥加入到盐酸溶液中,启动搅拌,在适宜的温度下反应一定时间后过滤得到酸浸液和浸出后的漂浮阳极泥。在酸浸液中加水稀释后进行锑的水解,过滤得到锑水解液和白色固体锑渣。用氢氧化钠调节锑水解液的pH,进行铋的水解,过滤,得到白色固体铋渣,铋水解液含杂质较低,返回锑的水解。其工艺流程图如图1所示。
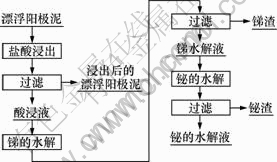
图1 漂浮阳极泥处理工艺流程图
Fig.1 Process of treatment of floating anode slime
1.3 分析方法
Sb3+采用硫酸铈滴定法测定,Sb5+采用硫酸联胺还原-硫酸铈滴定法测定[9]。溶液中As,Bi,Ag和Au等其他元素采用ICP(IRIS Intrepid Ⅱ XSP)分析。固体成分采用X荧光分析仪(PW2424)分析。固体物相采用X线衍射仪(D/max-rA,日本理学)进行分析。
2 结果与讨论
2.1 漂浮阳极泥的盐酸浸出
2.1.1 温度对锑、铋浸出率的影响
实验取漂浮阳极泥 100 g,当盐酸浓度为6 mol/L、固液比为1:5、时间为2 h时,温度对锑和铋浸出率的影响如图2所示。
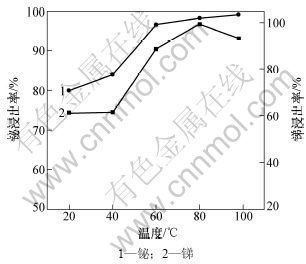
图2 反应温度对锑和铋浸出率的影响
Fig.2 Effects of reaction temperature on leaching rates of Sb and Bi
由图2可知:铋浸出率随着温度的升高而增大,当温度达到80 ℃时后,铋浸出率达到99%以上。铋在漂浮阳极泥中主要以BiAsO4形式存在,盐酸浸出过程中主要反应为:
BiAsO4+3HCl=BiCl3+H3AsO4 (1)
锑浸出率在温度低于40 ℃时,维持在61%左右。漂浮阳极泥中锑的存在形态较复杂,Sb3+占总锑的57%,主要以SbAsO4形式存在,易浸出;Sb5+大多以难溶的锑酸盐、砷锑酸盐形式存在,不易浸出。因此,温度较低时锑的浸出主要以Sb3+为主,其反应为:
SbAsO4+3HCl=SbCl3+H3AsO4 (2)
随着温度的升高,难溶的锑酸盐、砷锑酸盐逐步溶解。当温度达到80 ℃后,锑浸出率达到最大值99.17%;继续升高温度,锑浸出率反而降低。这是因为温度较高时,盐酸挥发较大,反应的盐酸浓度降低,不利于锑的浸出。选择适宜的温度为80 ℃。
2.1.2 盐酸浓度对锑、铋浸出率的影响
上述实验条件不变,当温度为80 ℃时,盐酸浓度对锑、铋浸出率的影响如图3所示。
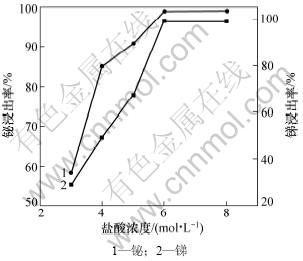
图3 盐酸浓度对锑和铋浸出率的影响
Fig.3 Effects of hydrochloric acid concentration on leaching rates of Sb and Bi
由图3可知:盐酸浓度对锑、铋浸出率的影响很大,浸出率随着盐酸浓度的增加而增大;当盐酸浓度达到6 mol/L后,锑和铋浸出率达到最大,锑浸出率为99.17%、铋浸出率为99.00%,继续增加盐酸的浓度对浸出率影响不大。盐酸浓度对锑和铋浸出率的影响主要表现在氢离子浓度和氯离子浓度上。氢离子浓度高,锑和铋的溶解性大,锑和铋水解可能性小(锑离子极容易水解。在实验中发现:SbCl3即使在3 mol/L的盐酸中放置一段时间,也会出现白色沉淀),浸出率高。氯离子浓度对Sb3+的浸出影响较大,Lin等[10-11]认为:在盐酸浓度较低时,Sb3+主要以SbCl2+,SbCl2+,SbCl30和SbCl4-形式存在,在盐酸浓度较高时,以SbCl4-和SbCl63-形式为主。因此,增大氯离子浓度,可以使Sb3+与Cl-的络合呈现高配位的稳定趋势,使锑的浸出率增大。故选择适宜的盐酸浓度为6 mol/L。
2.1.3 固液比对锑、铋浸出率的影响
上述实验条件不变,当盐酸浓度为6 mol/L时,固液比对锑和铋浸出率的影响如图4所示。
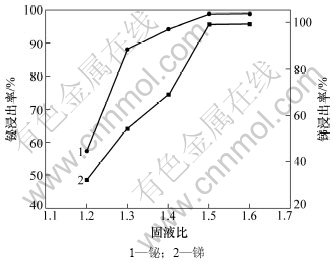
图4 固液比对锑和铋浸出率的影响
Fig.4 Effects of solid to liquid on leaching rates of Sb and Bi
由图4可知:锑和铋的浸出率随固液比的减小而增大;当固液比为1:5时,锑和铋浸出率均大于99%。固液比减小,同等浓度下参与反应的盐酸量增多,提供的氢离子和氯离子也增多,反应后能溶解产物SbCl3和BiCl3的盐酸量增大,反应终点的酸度增加,锑和铋水解减少,浸出率增大。故适宜的固液比为1: 5。
2.1.4 反应时间对锑、铋浸出率的影响
上述实验条件不变,当固液比为1:5时,反应时间对锑、铋浸出率的影响如5所示。
由图5可知,反应时间对锑和铋浸出率的影响不大,当反应时间为1 h时,锑和铋浸出率达到最大。继续延长反应时间,锑和铋浸出率变化不大。选择适宜的反应时间为1 h。
取漂浮阳极泥1 kg,进行放大实验,当盐酸浓度为6 mol/L,固液比为1:5,反应温度为80 ℃,反应时间为1 h时, 锑和铋浸出率均大于99%,浸出液中锑质量浓度为69.5 g/L,铋质量浓度为20.2 g/L,浸出后漂浮阳极泥成分(质量分数)如表3所示,XRD图如图6所示。
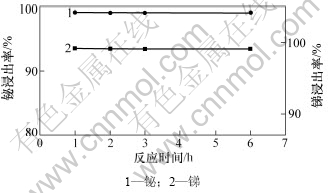
图5 反应时间对锑和铋浸出率的影响
Fig.5 Effects of reaction time on leaching rates of Sb and Bi
表3 浸出后漂浮阳极泥成分
Table 3 Composition of leached floating anode slime %

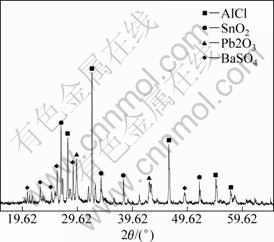
图6 浸出后漂浮阳极泥XRD图
Fig.6 XRD pattern of leached floating anode slime
由表3可知:浸出后漂浮阳极泥中金含量为0.26%,银含量为13.12%,与表1相比,金银富集15倍以上。浸出后的漂浮阳极泥中金、银、砷、锑、铋含量与阳极泥[12]成分相似,可直接提取金和银。漂浮阳极泥中金银主要以单质、硒化物和碲化物存在,盐酸浸出过程中,金、银溶解较少,为防止其损失,浸出后可冷却静置一段时间[13]。由图6可知:浸出后漂浮阳极泥物相较复杂,主要物相为AgCl,SnO2,Pb2O3和BaSO4。
2.2 锑的回收
盐酸浸出液采用水解法回收锑、铋,根据锑、铋的水解pH不同,分2次水解回收。首先进行锑的水解。在水解过程中,水解时间和水解温度对锑的水解率影响不大,稀释比(稀释比为加入水与盐酸浸出液体积比)影响较大。当温度为20 ℃,反应时间为1 h时,稀释比对锑水解率的影响如图7所示,当稀释比为8:1时,所得水解固体产物锑渣成分(质量分数)如表4所示,XRD衍射图如图8所示。
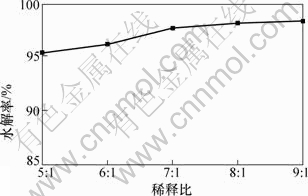
图7 稀释比对锑水解率的影响
Fig.7 Effect of dilution ratio on hydrolysis rate of Sb
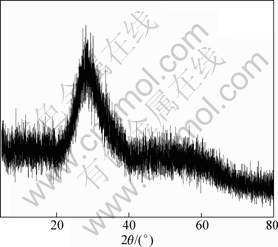
图8 锑渣XRD图
Fig.8 XRD pattern of antimony residue
由图7可知:随着稀释比的增加,锑水解率增大;当稀释比达到8:1时,锑水解率达到95%;继续增加稀释比,锑水解率变化不大。Sb3+与Sb5+混合水解体系较复杂,在Sb3+浓度与Sb5+浓度相差不大时,Sb3+水解反应为[14]:
4SbCl3+5H2O=Sb4O5Cl2↓+10HCl (3)
Sb5+水解生成非晶态锑氧化合物[15],水解过程中,Sb3+的水解产生沉淀会引起Sb5+的水解共沉淀,反过来,Sb5+的水解又会促使Sb3+的水解共沉淀,Sb3+与Sb5+水解同时进行,致使水解固体产物呈现图8所示的非晶态状态。
由表4可知:锑渣中锑含量在50%以上,主要由氯、氧、锑和砷4种元素组成。该锑渣经过洗涤除砷后,可以用来制备纯度较高的氧化锑。
表4 锑渣成分
Table 4 Composition of antimony residue %

漂浮阳极泥经过盐酸浸出及水解,锑的总回收率为94.2%,铋损失率小于10%。锑水解时,由于夹带以及局部水解pH过高,少量的铋会水解进入锑渣中。
2.3 铋的回收
采用氢氧化钠调节锑水解液的pH,使溶液达到铋水解的pH,进行水解回收铋。铋水解过程中,水解时间和水解温度对铋的水解率影响不大,终点pH对铋的水解率影响较大。当温度为20 ℃,反应时间为1 h时,终点pH对铋水解率的影响如图9所示。
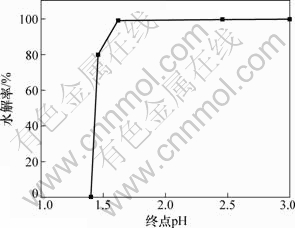
图9 终点pH对铋水解率的影响
Fig.9 Effect of final pH on hydrolysis rate of Bi
由图9可知,随着终点pH的增加,铋水解率增大。铋水解过程中,开始水解pH约为1.46,其反应为[16]:
BiCl3+H2O=BiOCl↓+2HCl (4)
反应进行后,溶液pH逐步降至1.3左右,此时,铋的水解率为80%。继续增加溶液pH,水解进一步发生,当pH=2左右时,铋水解率大于99.5%。
为了便于铋水解液的循环利用,选择铋水解的终点pH为8。取锑水解液1 L,当温度为20 ℃,反应时间为1 h,终点pH为8时,铋水解所得固体产物铋渣成分(质量分数)如表5所示,滤液成分(质量浓度)如表6所示,固体XRD图如图10所示。
漂浮阳极泥经过盐酸浸出,水解回收锑和水解回收铋,铋的总回收率大于90%。由图10可知:铋渣主要物相为氯氧铋。由表5可知:铋渣中含铋52.47%,铋含量较高,可以作为制备氧化铋的原料。由表6可知,铋水解液中含砷256 mg/L,其他杂质均较低,可以返回锑的水解过程稀释盐酸浸出液。铋水解液中的砷含量远小于盐酸浸出液中的砷含量,实验发现没有对锑的水解过程造成影响,大部分可以循环利用。
表5 铋渣成分
Table 5 Composition of bismuth residue %

表6 铋水解液成分
Table 6 Composition of bismuth hydrolysate mg/L

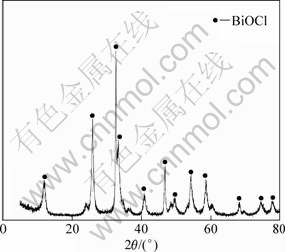
图10 铋渣XRD图
Fig.10 XRD pattern of bismuth residue
3 结论
(1) 漂浮阳极泥盐酸浸出的适宜条件为:盐酸浓度6 mol/L,固液比1:5,反应温度80 ℃,反应时间 1 h。在此条件下,锑浸出率和铋浸出率分别为99.2%和99.1%。
(2) 水解回收锑的适宜条件为:温度20 ℃,反应时间1 h,稀释比8:1。在此条件下,锑水解率为95%。水解回收铋的适宜条件为:温度20 ℃,反应时间1 h,终点pH为8。在此条件下,铋水解率大于99.5%,铋水解液含杂质较低,可以循环利用。
(3) 该工艺可得含金0.26%、银13.12%的富集后的漂浮阳极泥,金和银富集15倍以上;可得含锑50.41%的锑渣,锑总回收率为94.2%;可得含铋52.47%的铋渣,铋总回收率大于90%;整个工艺过程适应性较强,无废弃物排放。
参考文献:
[1] 肖发新, 郑雅杰, 简洪生, 等. 砷、锑和铋对铜电沉积及阳极氧化机理的影响[J]. 中南大学学报: 自然科学版, 2009, 40(3): 575-580.
XIAO Fa-xin, ZHENG Ya-jie, JIAN Hong-sheng, et al. Influence of As, Sb and Bi on electrodepositing and anode oxidation mechanism of copper[J]. Journal of Central South University: Science and Technology, 2009, 40(3): 575-580.
[2] Petkova E N. Mechanisms of floating slime formation and its removal with the help of sulphur dioxide during the electrorefining of anode copper[J]. Hydrometallurgy, 1997, 46(3): 277-286.
[3] Petkova E N. Microscopic examination of copper electrorefining slimes[J]. Hydrometallurgy, 1990, 24(3): 351-359.
[4] 许并社, 李明照. 铜冶炼工艺[M]. 北京: 化学工业出版社, 2007: 200-205.
XU Bing-she, LI Ming-zhao. Copper smelting process[M]. Beijing: Chemical Industry Press, 2007: 200-205.
[5] 彭容秋. 铜冶金[M]. 长沙: 中南大学出版社, 2004: 226-229.
PENG Rong-qiu. Copper metallurgy[M]. Changsha: Central South University Press, 2004: 226-229.
[6] Fernández M A, Segarra M, Espiell F. Selective leaching of arsenic and antimony contained in the anode slimes from copper refining[J]. Hydrometallurgy, 1996, 41(23): 255-267.
[7] 蔡练兵, 刘维, 柴立元. 高砷铅阳极泥预脱砷研究[J]. 矿冶工程, 2007, 12(6): 44-47.
CAI Lian-bing, LIU Wei, CHAI Li-yuan. Study on pre-treatment process of arsenic removal for arsenic-rich lead anode slime[J]. Mining and Metallurgical Engineering, 2007, 12(6): 44-47.
[8] WANG Xue-wen, CHEN Qi-yuan, YIN Zhou-lan, et al. Identification of arsenate antimonides in copper anode slimes[J]. Hydrometallurgy, 2006, 84(3/4): 211-217.
[9] 陈进中, 曹华珍, 郑国渠, 等. 高锑低银类铅阳极泥制备五氯化锑新工艺[J]. 中国有色金属学报, 2008, 18(11): 2094-2099.
CHEN Jin-zhong, CAO Hua-zhen, ZHENG Guo-qu, et al. Novel technology for preparation of SbCl5 from lead anode slime with high antimony and low silver content[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(11): 2094-2099.
[10] Lin H K. Extraction of antimony by a copper chloride extractant[J]. Hydrometallurgy, 2004, 73(3/4): 283-291.
[11] Oelkers E H, Sherman D M, Ragnarsdottir K V, et al. An EXAFS spectroscopic study of aqueous antimony(III) chloride complexation at temperatures from 25 to 250 ℃[J].Chemical Geology, 1998, 151(1/4): 21-27.
[12] 郑雅杰, 孙召明, 汪蓓, 等. 阳极泥预处理及回收稀散金属的方法: 中国, 200810032000.0[P]. 2009-01-07.
ZHENG Ya-jie, SUN Zhao-ming, WANG Bei, et al. Method of pretreatment of anode slime and recovery of rare metal: China, 200810032000.0[P]. 2009-01-07.
[13] 傅崇说, 王庆祥, 郑蒂基. 关于氯化物溶液中铅、银结晶分离的理论分析[J]. 中南矿冶学院学报, 1981, 12(4): 6-9.
FU Chong-shuo, WANG Qing-xiang, ZHENG Di-ji. A theoretical analysis on the crystallization separation of lead and silver in chloride solution[J]. Journal of Central South University of Technology, 1981, 12(4): 6-9.
[14] 赵天丛. 锑[M]. 北京: 冶金工业出版社. 1987: 290-296.
ZHAO Tian-cong. Antimony[M]. Beijing: Metallurgical Industry Press, 1987: 290-296.
[15] 郑国渠, 支波, 陈进中. 五氯化锑的水解过程[J]. 中国有色金属学报, 2006, 16(9): 1628-1633.
ZHENG Guo-qu , ZHI Bo, CHEN Jin-zhong. Hydrolysis of antimony pentachloride[J]. The Chinese Journal of Nonferrous Metals, 2006, 16(9):1628-1633.
[16] 王云燕, 彭文杰, 舒余德, 等. Bi (Ⅲ)-X(Cl-, NO3-)-H2O 体系热力学平衡研究[J]. 中南工业大学学报: 自然科学版, 2001, 32(3): 139-141.
WANG Yun-yan, PENG Wen-jie, SHU Yu-de, et al. Thermodynamic equilibrium study of Bi(Ⅲ)-X(Cl-, NO3-)-H2O system[J]. Journal of Central South University of Technology: Natural Science, 2001, 32(3): 139-141.
(编辑 赵俊)
收稿日期:2010-08-25;修回日期:2010-12-02
基金项目:广东省教育部产学研重大项目(2008A090300016)
通信作者:郑雅杰(1959-),男,湖南常德人,教授,从事湿法冶金、水污染控制、资源综合利用研究;电话:0731-88836285:E-mail:zzyyjj01@yahoo.com.cn